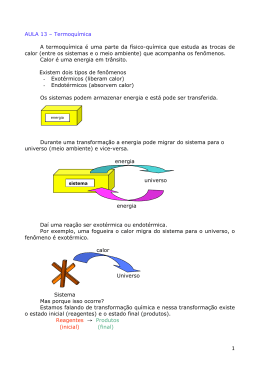
A ciência dos fogos de artifício ● É energia armazenada nas substâncias (reagentes ou produtos),ou seja, a soma da energia química e da energia térmica. ● Esta é usualmente representada pela letra H Externa - Exemplos da aplicação da entalpia É a diferença entre as entalpias dos produtos e dos reagentes corresponde à variação de entalpia. (∆H). A variação é sempre medida pela fórmula: ∆H = Hp - Hr ● Hp = entalpia dos produtos; ● Hr = entalpia dos reagentes. Considere as seguintes entalpias de formação em kl/mol: AL2O3 (S)= -1670; MgO(S)= -604. Com essas informações, pode-se calcular a variação da entalpia da reação representada por : 3MgO (S) + 2 Al (s) → 3Mg (S) +Al2O3(S) Seu valor é igual a: a) – 1066kj b) – 142 kj c) +142kj d) +1066kj e) + 2274 KJ A hidrogenação total do acetileno (C2H2) produz etano (C2H6). Essa reação pode ser representada por: C2H2 (G) + 2H2(G) → C2H6 (G) ∆H=? Calcule a variação da entapia (∆H) dos participantes presentes da reação de hidrogenação. Dados: H C2H2 (G)= +227KJ/MOL ; H2 (g) = zero ; HC2H6 (G)= -84,5KL/MOL ● Reação exotérmica ∆H < 0 H2 (G) + ½ O2 (G) → H2O (l) ∆H = -68,3 kcal O sinal negativo do valor de ∆H indica que a reação é exotérmica ( calor liberado) ● Reação exotérmica ∆H > 0 N2(g) +O2 (g) → 2NO(G) ∆H = +43kcal (calor absovido) O sinal positivo do valor de ∆H indica que a reação é endotérmica ( calor absorvido) Considere a equação a seguir: 2 H2 (g) + O2 (g) → 2 H2O (l) ΔH = –572 kJ É correto afirmar que a reação é: a) exotérmica, liberando 286 kJ por mol de oxigênio consumido. b) exotérmica, liberando 572 kJ para dois mols de água produzida. c) endotérmica, consumindo 572 kJ para dois mols de água produzida. d) endotérmica, liberando 572 kJ para dois mols de oxigênio consumido. e) endotérmica, consumindo 286 kJ por mol de água produzida ● Decomposição da sacarose A entalpia dos produtos (Hf) é maior que a entalpia dos reagentes (Hr) HR > Hp ∆H >0 ● Combustão do etanol A entalpia dos produtos (Hf) é menor que a entalpia dos reagentes (Hr) HR < Hp ∆H <0 Considere a equação a seguir: 2 H2 (g) + O2 (g) → 2 H2O (l) ΔH = –572 kJ É correto afirmar que a reação é: a) exotérmica, liberando 286 kJ por mol de oxigênio consumido. b) exotérmica, liberando 572 kJ para dois mols de água produzida. c) endotérmica, consumindo 572 kJ para dois mols de água produzida. d) endotérmica, liberando 572 kJ para dois mols de oxigênio consumido. e) endotérmica, consumindo 286 kJ por mol de água produzida Energias alternativas 1) Observe as seguintes equações termoquímicas: I. C(s)+H2O(g) → CO(g)+H2(g)................... ΔH = 31,4 kcal II. CO(g)+ ½ O2(g) → CO2(g)..................... ΔH= - 67,6 kcal III. H2(g)+ ½ O2(g) → H2O(g)..................... ΔH = - 57,8 kcal De acordo com a variação de entalpia, podemos afirmar: a) I é endotérmica, II e III exotérmicas. b) I e III são endotérmicas, II exotérmica. c) II e III são endotérmicas, I exotérmica. d) I e II são endotérmicas, III exotérmica. e) II é endotérmica e I e III exotérmicas. 2) Analise as afirmativas abaixo: I. Entalpia (H) pode ser conceituada como a energia global de um sistema. II. Uma reação exotérmica apresenta H positivo. III. O calor de reação de um processo químico será dado por H. a) somente I é correta b) somente II é correta c) somente III é correta d) as afirmativas I e II são corretas e) as afirmativas I e III são corretas (UFSM 2002) Cerca de 80% da energia consumida no mundo deriva da queima de petróleo, carvão ou gás natural, que são fontes energéticas não renováveis e irão se esgotar a médio ou longo prazo. Uma das alternativas, para resolver o problema, é o uso da biomassa, matéria orgânica que, quando fermenta, produz o biogás, cujo principal componente é o metano. A queima do metano se dá pela equação CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) → H = - 888 kJ/mol Em relação a essa equação, analise as afirmativas a seguir e assinale verdadeira (V) ou falsa (F) em cada uma delas. ( ) A reação de combustão do metano é exotérmica. ( ) A entalpia dos reagentes é menor que a entalpia dos produtos. ( ) A variação de entalpia, nesse caso, indica que a quantidade de calor absorvida é de 888 kJ/mol. A sequência correta é a) V - F - F b) V - F - V c) F - V - F d) F - V - V e) V - V – F
Baixar