Universidade Federal de Ouro Preto
Programa de Pós-Graduação Engenharia Ambiental
Mestrado em Engenharia Ambiental
PROÁGUA
Gustavo de Sousa Leite
“CARACTERIZAÇÃO, POR ESPECTROMETRIA DE MASSAS, DOS
MICROPOLUENTES PRESENTES NO ESGOTO BRUTO E NOS
EFLUENTES DE UM SISTEMA DE TRATAMENTO COMBINADO
ANAERÓBIO-AERÓBIO.”
Dissertação apresentada ao Programa de Pósgraduação em Engenharia Ambiental (Pro-água), da
Universidade Federal de Ouro Preto, como requisito
parcial à obtenção do título de Mestre.
Área de concentração: Saneamento Ambiental
Linha
de
pesquisa:
Técnicas
avançadas
de
cromatografia acoplada à espectrometria de massa.
Orientador: Dr. Robson José de Cássia Franco Afonso
Co-orientador: Dr. Sérgio Francisco de Aquino
Ouro Preto
Instituto de Ciências Exatas e Biológicas
Universidade Federal de Ouro Preto
2008
ii
Agradecimentos
Agradeço a Deus, pela oportunidade da realização desse trabalho, e por toda a força
concedida nos momentos difíceis.
Agradeço à minha mãe Margarida, meu pai Rogério, meu irmão Bruno e minha namorada
Débora, as pessoas mais especiais de minha vida, que sempre apoiaram e estimularam meu
desenvolvimento como pessoa e como profissional. Exemplos de pessoas justas,
batalhadoras e de espírito de aprimoramento incansável.
A meus orientadores, Dr. Robson José de Cássia Franco Afonso e Dr. Sérgio Francisco de
Aquino, os quais me proporcionaram ensinamentos de inestimável valor, enriquecendo
minha formação acadêmica e profissional.
A todos os professores da UFOP, por ensinar, durante a graduação e mestrado, as ciências
fundamentais, indispensáveis à minha atuação profissional.
À querida República Xeque-Mate, minha eterna segunda casa, e meus irmãos
xequemateanos, pela eterna amizade, convívio, companheirismo.
A meus amigos de Belo Horizonte, companheiros de longas datas, que com suas amizades
eternas, contribuíram para que esse caminho fosse menos árduo.
Aos companheiros do laboratório: Davi, Aniel, Fernanda e aos alunos de iniciação
científica Miriany, Emanuel e Thaísa, pela amizade, ajuda e conhecimentos
intercambiados.
À fundação Gorceix, pela bolsa de estudos concedida.
iii
Sumário
Resumo..................................................................................................................................xi
Abstract................................................................................................................................xii
1.
Introdução........................................................................................................................1
2.
Revisão biliográfica. .......................................................................................................5
2.1.
Tratamento biológico de esgotos...............................................................................5
2.1.1. Processos aeróbios de degradação de matéria orgânica...................................6
2.1.2. Processos anaeróbios de degradação de matéria orgânica...............................7
2.2.
Sistemas de tratamento combinado anaeróbio-aeróbio...........................................10
2.3. Impacto ambiental causado por micropoluentes no sistema de esgoto doméstico....13
2.3.1.
Produtos de limpeza e higiene pessoal...........................................................15
2.3.2.
Fármacos........................................................................................................22
2.4. Monitoramento de micropoluentes em sistemas de tratamento de esgotos................24
2.4.1.
Produtos de limpeza e higiene pessoal............................................................24
2.4.2.
Fármacos.........................................................................................................26
2.5. Fatores que influenciam a remoção de micropoluentes pelos sistemas de
tratamento.................................................................................................................46
2.5.1.
Hidrofobicidade e hidrofilicidade...................................................................46
2.5.2.
Estrutura química dos micropoluentes............................................................47
2.5.3. População microbiana.....................................................................................48
2.5.4.
Idade do lodo...................................................................................................48
2.5.5.
Valor de pH.....................................................................................................49
2.5.6.
Temperatura do sistema...................................................................................49
2.6.
Técnicas de preparo de amostras e análise de micropoluentes...............................49
2.6.1.
Técnicas de extração......................................................................................51
2.6.2.
Técnicas de separação cromatográfica e detecção por espectrometria de
massas...........................................................................................................52
3.
Materiais e métodos.......................................................................................................56
3.1.
O sistema de tratamento UASB/FBP.......................................................................56
3.1.1.
Reator UASB................................................................................................... 56
3.1.2.
Filtro biológico percolador............................................................................. 56
3.2.
Amostragem............................................................................................................57
iv
3.3. Preparo das amostras e extração dos analitos..........................................................59
3.4. Reagentes, consumíveis e equipamento instrumental.............................................60
3.4.1.
Metodologia analítica: aquisição dos espectros totais (fingerprint)................63
3.4.2.
Metodologia analítica: detecção de compostos específicos............................65
3.5.
4.
Tratamento quimiométrico de dados.......................................................................65
Resultados e discussão................................................................................................. 68
4.1.
Análise de similariedade entre as amostras: scores................................................. 68
4.2.
Elucidação estrutural de micropoluentes no esgoto doméstico................................71
4.2.1. Íons deprotonados de m/z =-311,1768;-325,1923;-339,1999 e -297,1509......73
4.2.2.
Íon deprotonado de m/z = -279,2350...............................................................76
4.2.3.
Íon deprotonado de m/z = -281,2493...............................................................78
4.2.4.
Íon deprotonado de m/z = -212,0733...............................................................79
4.2.5.
Íon deprotonado de m/z = -248,9611...............................................................81
4.2.6.
Íon deprotonado de m/z = -199,1728...............................................................82
4.3.
Monitoramento dos compostos elucidados no sistema UASB-FBP........................85
4.3.1. Alquilbenzeno sulfonados lineares (LAS) .......................................................85
4.3.2.
Demais compostos destacados pela PCA no modo negativo de ionização......86
4.3.3.
Compostos destacados pela PCA no modo de ionização positivo...................88
4.4. Compostos-alvo encontrados durante o tratamento biológico de esgotos sanitários.90
4.4.1.
Dibutilftalato..……………………………….............................................….91
4.4.2.
Bisfenol A……………..……..……….......................................….….........…94
4.4.3.
Nonilfenol……………………..…..……….............................…..........……..96
4.4.4.
Bezafibrato…………….……….…………..........................…….............…..99
4.5.
5.
Análise Crítica........................................................................................................101
Conclusões...................................................................................................................104
6. Sugestões para trabalhos futuros.................................................................................106
7.
Referências bibliográficas...........................................................................................107
v
Lista de Figuras
Figura 2.1 - Diagrama simplificado da degradação aeróbica de carboidratos. Fonte: Von
Sperling, 2005........................................................................................................................7
Figura 2.2 - Fluxograma representativo da degradação da matéria orgânica complexa
(proteínas, carboidratos e lipídeos). Fonte: Aquino e Chernicharo, 2005a............................9
Figura 2.3 - Esquema de um reator UASB. Fonte: Chernicharo, 2007...............................11
Figura 2.4 - (a) Corte transversal em um FBPs e (b) escoamento dos esgotos e disposição
do biofilme no meio suporte. Fonte: Chernicharo, 2001......................................................12
Figura 2.5 - (a) Escória de alto-forno; (b) Donwflow Hanging Sponge; (c) Bloco crossflow 45° e (d) Pedra britada. Fonte: Tavares, 2008..............................................................13
Figura 2.6 - Estrutura química generalizada dos LAS.........................................................16
Figura 2.7 - Etapas do processo de degradação aeróbica do C12-LAS. Fonte: Schöberl
(1989)...................................................................................................................................18
Figura 2.8 - Mecanismo proposto para a degradação dos APEOn. Fonte: Langford et al.,
2005......................................................................................................................................19
Figura 2.9 - Estrutura química do CA5P1EC. Fonte: Hoai et al., 2004..............................20
Figura 2.10 - Formação de dioxinas a partir do triclosan, e a semelhança estrutural entre o
bifenilol e os PCBs. Fonte: Agüera et al., 2005...................................................................22
Figura 2.11 - Principais rotas de fármacos no meio ambiente. Fonte: Billa e Dezzoti,
2003......................................................................................................................................23
Figura 3.1 - Reatores que compõem a ETE experimental em estudo. (a) Reator UASB e
(b) FBPs. Fonte: Tavares, 2008............................................................................................57
Figura 3.2 - Filtro biológico percolador, dividido em quatro compartimentos, preenchidos
com diferentes meios suportes para crescimento microbiano. Fonte: Tavares, 2008..........57
Figura 3.3 - Fluxograma esquemático do sistema UASB/FBP utilizado como aparato
experimental. Fonte: Almeida, 2007a..................................................................................58
Figura 3.4 - Fluxograma das etapas de preparo das amostras, anterior à análise no HPLCMS-IT-TOF...........................................................................................................................60
Figura 3.5 - Montagem utilizada no processo de extração em fase sólida dos
micropoluentes das amostras de esgoto................................................................................60
Figura 3.6 - Pré-coluna cromatográfica diretamente acoplada à fonte de ionização por
electronspray (ESI)...............................................................................................................61
vi
Figura 3.7 - Esquema simplificado do equipamento HPLC-MS-IT-TOF. Adaptado de
Shimadzu Corporation, 2007...............................................................................................62
Figura 3.8 - Cromatógrafo líquido acoplado aos espectrômetros Ion-Trap e Time-of-Flight
(HPLC-MS-IT-TOF).............................................................................................................64
Figura 3.9 - Representação matricial da operação realizada no cálculo de componentes
principais. Fonte: Souza, 2008.............................................................................................66
Figura 4.1 - Primeira e segunda componentes principais da matriz de Scores do modo de
ionização negativo................................................................................................................69
Figura 4.2 - Primeira e segunda componentes principais da matriz de Scores do modo de
ionização positivo.................................................................................................................70
Figura 4.3 - Relação entre a primeira e a segunda componentes principais da matriz
Loadings dos íons gerados nos modo negativo....................................................................72
Figura 4.4 - Relação entre a primeira e a segunda componentes principais da matriz
Loadings dos íons gerados nos modo positivo.....................................................................72
Figura 4.5 - Espectros de massas dos íons moleculares deprotonados do modo MS1 (a)
m/z=-311,1768; (b) m/z=-325,1923; (c) m/z=-339,1999; (d) m/z=-297,1509; e (e) espectro
de massas do modo MS2, comum às quatro substâncias.....................................................74
Figura 4.6 - Fragmentações provenientes dos íons investigados........................................75
Figura 4.7 - Cromatograma específico dos íons de m/z=311,1768; 325,1923; 339,1999 e
297,1509...............................................................................................................................75
Figura 4.8 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-279,2350;
(b) espectro de massas dos fragmentos gerados por colisão induzida.................................77
Figura 4.9 - Fragmentação proposta para o íon m/z=-279,2350.........................................77
Figura 4.10 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-281,2493;
(b) espectro de massas dos fragmentos gerados por colisão induzida.................................78
Figura 4.11 - Fragmentações propostas obtidas nos experimentos MS2 provenientes do íon
m/z= -281,2493....................................................................................................................79
Figura 4.12 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-212,0733;
(b) espectro de massas dos fragmentos gerados por colisão induzida.................................80
Figura 4.13 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-248,9611;
(b) espectro de massas dos fragmentos gerados por colisão induzida.................................81
Figura 4.14 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-199,1728;
(b) espectro de massas dos fragmentos gerados por colisão induzida.................................82
vii
Figura 4.15 - Dados sobre as substâncias elucidadas..........................................................84
Figura 4.16 - Comportamento dos LAS durante o tratamento estudado..............................85
Figura 4.17- Perfis de monitoramento dos ácidos graxos láurico, linoléico e oléico, de um
ftalato e um composto não identificado, presentes no esgoto doméstico.............................87
Figura 4.18 - Perfis de monitoramento de íons positivos de estruturas não elucidadas
214,0954; 231,1290; 236,0793 e 251,1327, presentes no esgoto doméstico.......................88
Figura 4.19 - Perfis de monitoramento de íons positivos de estruturas não elucidadas
279,1611; 301,1421; 304,3084; 341,0800, presentes no esgoto doméstico.........................89
Figura 4.20 - Perfis de monitoramento de íons positivos de estruturas não elucidadas
399,2561; 413,2709; 421,2469 e 659,1751, presentes no esgoto doméstico.......................89
Figura 4.21 - Estruturas moleculares dos compostos-alvo..................................................91
Figura 4.22 - (a) cromatograma e (b) espectro de massas do dibutilftalato, modo MS1,
mostrando o íon molecular do poluente (m/z=277,1494)....................................................92
Figura 4.23 - Perfil da concentração do dibutilftalato relativa à do padrão interno, em
diferentes pontos da ETE, onde: A- esgoto bruto (entrada do UASB); B- saída do
UASB/entrada do FBP; C1- saída do FBP (conduíte); C2- saída do FBP (pedra britada)...93
Figura 4.24-(a)cromatograma e (b) espectro de massas do íon molecular do bisfenol A..95
Figura 4.25 - Perfil de degradação do bisfenol A no sistema de tratamento de efluentes
estudado. A- esgoto bruto (entrada do UASB); B- saída do UASB/entrada do FBP; C1saída do FBP (conduíte); C2- saída do FBP (pedra britada)................................................95
Figura 4.26 - Metabolismo microbiano aeróbio dos alquilfenóis etoxilados. Fonte: Ahel et
al., 1994................................................................................................................................97
Figura 4.27 - (a) cromatograma e (b) espectro de massas do nonilfenol............................98
Figura 4.28 - Perfil do comportamento do nonilfenol no sistema experimental UASB-FBP,
onde: A- esgoto bruto (entrada do UASB); B- saída do UASB/entrada do FBP; C1- saída
do FBP (conduíte); C2- saída do FBP (pedra britada).........................................................98
Figura 4.29 - (a) cromatograma e (b) espectro de massas correspondentes ao
bezafibrato..........................................................................................................................100
Figura 4.30 - Comportamento do bezafibrato ao longo do sistema de tratamento de
efluentes sanitários em estudo............................................................................................100
viii
Lista de Tabelas
Tabela 2.1 - Remoção de substâncias presentes em produtos de limpeza e higiene pessoal
por diferentes sistemas de tratamento..................................................................................33
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de
efluentes, reportada na literatura..........................................................................................35
Tabela 2.3 - Número de substâncias extraídas por cada método, nos trabalhos
revisados...............................................................................................................................52
Tabela 2.4 - Utilização de técnicas analíticas para alguns micropoluentes mais
freqüentemente encontrados por estudos sobre sistemas de tratamento de esgoto
doméstico..............................................................................................................................54
Tabela 3.1 - Dados das amostragens a e fases operacionais do sistema de tratamento de
efluentes em estudo..............................................................................................................59
Tabela 3.2 - Substâncias-alvo analisadas no modo MS2 do espectrômetro de massas, e seus
íons moleculares, no modo de ionização negativo...............................................................65
Tabela 4.1 - Valores das componentes principais para os íons que se destacaram na análise
de PCA.................................................................................................................................73
Tabela 4.2 - Resultados gerados pelo programa Formula Predictor, na busca por fórmulas
correspondentes aos íons 311,1768; 325,1923; 339,1999 e 297,1509.................................76
Tabela 4.3 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 279,2350...................................................................................78
Tabela 4.4 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 281,2493...................................................................................79
Tabela 4.5 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 212,0733...................................................................................81
Tabela 4.6 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 248,9611...................................................................................82
Tabela 4.7 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 199,1728...................................................................................83
Tabela 4.8 - Compostos-alvo selecionados para o estudo de comportamento de degradação
na ETE..................................................................................................................................91
ix
Lista de Notações
APCI - Atmospheric pressure chemical ionization
APPI - Atmospheric pressure photo ionization
BPA - Bisfenol A
CePTS - Centro de Pesquisa e Treinamento em Saneamento
COV - Carga orgânica volumétrica
DBE - Double bond equivalency
DBO - Demanda bioquímica de oxigênio
DBP - Dibutilftalato
DQO - Demanda química de oxigênio
ETE - Estação de tratamento de efluentes
GC-EI-MS - Gas chromatograph-electron ionization-mass spectrometer
GC-MS - Gas chromatograph-mass spectrometer
GC-NCI-MS - Gas chromatograph-negative chemical ionization-mass spectrometer
HPLC-MS-IT-TOF - High performance liquid chromatograph-mass spectrometer ion
trap-time of flight
GC-MS-IT-TOF - Gas chromatograph- mass spectrometer ion trap time of flight
LAS - Linear alkylbenzene sulfonate
LLE - Liquid-liquid extraction
MBR - Membrane bioreactor
mDa - Milidaltons
MRM - Monitoring reaction mode
PCA - Principal Component Analysis
TAS - Taxa de aplicação superficial
Q-TOF-MS - Quadrupole-time-of-flight mass spectrometer
SIM - Single ion monitoring
SPE - Solid phase extraction
TDH - Tempo de detenção hidráulico
UASB - Upflow anaerobic sludge blanket
UPLC - Ultra-performance liquid chromatography
US-EPA - United States Environmental Protection Agency
x
Resumo
Substâncias provenientes de fármacos, produtos de limpeza e de higiene pessoal, após
utilizadas, atingem o sistema de coleta sanitário e chegam às estações de tratamento onde
são, muitas vezes, apenas parcialmente degradadas. Poucos trabalhos são encontrados na
literatura nacional sobre a presença de microcontaminantes orgânicos em esgoto sanitário e
sua remoção durante o tratamento biológico de efluentes domésticos. Sendo assim, o
presente
estudo
desenvolveu
uma
metodologia
analítica
para
identificação
e
monitoramento dos microcontaminantes presentes no esgoto bruto e nos efluentes de um
sistema simplificado de tratamento, que combina reator de leito de lodo anaeróbio de fluxo
ascendente (UASB) seguido de pós-tratamento aeróbio em filtro biológico percolador
(FBP). Amostras de quatro pontos do sistema de tratamento foram coletadas e, após o
preparo por SPE, foram analisadas por cromatográfica líquida acoplada à espectrometria de
massas. A análise quimiométrica destacou nove compostos nas amostras, sete das quais
tiveram suas estruturas elucidadas e seu comportamento durante o tratamento, estudado
(C10-LAS, C11-LAS, C12-LAS, C13-LAS, ácido oléico, ácido linoléico e ácido láurico). Em
seguida, outra metodologia é aplicada na busca por substâncias específicas (nonilfenol,
bezafibrato, bisfenol A e dibutilftalato), provenientes de produtos de uso rotineiro nos lares
e grandes centros urbanos. O perfil comportamental desses microcontaminantes ao longo
do tratamento demonstra que a eficiência de remoção do reator anaeróbio é, no geral,
baixa, mas foi eficaz na remoção dos ácidos linoléico e oléico. O FBP foi capaz de
degradar com grande eficiência outros micropoluentes, como o bisfenol A. Percebe-se
também que alguns compostos, como o ácido láurico, são recalcitrantes, não havendo
remoção significativa dos mesmos. O comportamento do nonilfenol demonstra, além da
ineficácia do sistema em remover o poluente, uma possível síntese do poluente no reator
aeróbio.
Palavras-chave: esgoto sanitário, espectrometria de massas, HPLC-MS-IT-TOF,
microcontaminantes orgânicos, cromatografia líquida, fármacos, produtos de limpeza e
higiene pessoal.
xi
Abstract
Pharmaceuticals and personal care products arrive at wastewater treatment plants after
disposal, where aren’t completely degraded. There are only a few Brazilian studies which
look for those organic micropolutants on the domestic sewage, as well as their removal in
effluent treatment systems. This work developed an analytical methodology in order to
identify micropolutants in raw domestic sewage and in a simplified biological effluent
treatment plant samples, which enclose both anaerobic bioreactor (UASB) and aerobic
bioreactor filter. Samples from four points of the treatment were collected and, after SPE
preparation, analyzed in a high performance liquid chromatograph coupled mass
spectrometer (fullscan mode). Chemometrics analysis draw attention to nine compounds,
seven of which had their structures elucidated and their behavior through de treatment
were studied (C10-LAS, C11-LAS, C12-LAS, C13-LAS, oleic acid, linoleic acid and lauric
acid). In other way, another strategy were applied in order to search for specific substances
(nonylphenol, bezafibrate, bisphenol A and dibutylphtalate), which are present in many
daily products. The profile of those substances in the sewage treatment plant shows that, in
general, the anaerobic reactor removal efficiency is low, but capable to remove almost
completely oleic and linoleic acids of the effluent. The aerobic bioreactor was capable to
degrade with high efficiency some organic pollutants such bisphenol A. It was perceptible
that some micropolutants, such as lauric acid, aren’t removed at all, and others, such as
nonylphenol may be synthesized over the treatment process.
Keywords:
domestic
sewage,
mass
spectrometry,
HPLC-MS-IT-TOF,
organic
micropolutants, liquid chromatography, pharmaceuticals, personal care products.
xii
1. Introdução
Atualmente, com o avanço da tecnologia nas mais diversas áreas do conhecimento humano
e com o aumento da variedade de produtos e substâncias desenvolvidos para a melhoria do
bem estar das populações e com o crescimento dos centros urbanos, é notável que a
quantidade e variedade de novas substâncias poluidoras lançadas nos corpos receptores
tenha crescido enormemente. Daughton e Ternes (1999) enfatizam que a identificação e
investigação prematuras do potencial poluidor, antes que chegue a níveis críticos, é
fundamental para a proteção do meio-ambiente e da saúde humana.
Pesquisadores do mundo todo têm observado que alguns contaminantes presentes nos
esgotos sanitários em concentrações da ordem de microgramas por litro (μg/L) ou
nanogramas por litro (ng/L) exercem efeitos tóxicos sobre animais silvestres e têm o
potencial de afetar adversamente a saúde humana. Esses contaminantes, definidos
usualmente
como
micropoluentes
(ou
microcontaminantes),
alusão
à
reduzida
concentração em que se encontram no ambiente, apresentam grande diversidade de
natureza química, e provém das mais variadas fontes, tais como fármacos de uso humano
(Lee et al., 2005; Radjenovic et al., 2007, Vasskog et al., 2006) ou animal (Daughton e
Ternes, 1999) e produtos de limpeza e de higiene pessoal (Agüera et al., 2003; Carballa et
al. 2004; Carballa et al., 2005), os quais são introduzidos no meio ambiente via esgoto
doméstico, seja ele tratado ou não.
Os produtos de limpeza, como detergentes, sabões e desinfetantes, contêm em suas
formulações, centenas de diferentes substâncias, como agentes tensoativos, fragrâncias e
microbicidas. Os surfactantes são substâncias presentes, principalmente, nas formulações
de detergentes e sabões. A degradação incompleta dessas substâncias gera metabólitos
passíveis de interferir no funcionamento normal do sistema endócrino de animais (Nimrod
e Benson, 1996; Beck et al., 2005). Problemas, já relatados pela literatura, causados pela
presença dessas substâncias no meio ambiente incluem o aumento do câncer de mama na
população feminina, anormalidades na formação do sistema reprodutivo humano e várias
expressões de desordens na vida selvagem, como hermafroditismo, feminização e
diminuição da fertilidade (Farré et al., 2007). Esse efeito também é perceptível quando
outros grupos de poluentes orgânicos, como estrógenos (Luckachko, 1999; Laganà et al.,
1
2004), estrógenos sintéticos (Reis et al., 2006), pesticidas e plastificantes, estão presentes
no ambiente (Farré et al., 2007).
É grande também a preocupação com a presença de fármacos no meio ambiente. Essas
drogas após manufaturadas, descartadas ou administradas e excretadas, chegam às estações
de tratamento de esgoto e, muitas delas passam incólumes pelo sistema de tratamento (Bila
e Dezotti, 2003). Como substâncias biologicamente ativas, a presença das mesmas no
ambiente aquático significa um grande risco para a saúde humana, vegetal e animal (Lee et
al., 2005, Farré et al., 2007). Como os estudos nesse campo são recentes, ainda são
desconhecidos os efeitos que a presença destes compostos na água pode causar em
humanos e organismos aquáticos, mas é prudente que a água potável não deva conter
quantidades significativas desses compostos (Kimura et al., 2004).
Outro grupo de substâncias que são alvo de discussão são os produtos de higiene pessoal
de uso diário. Cremes para a pele e rosto, perfumes, bloqueadores solar, dentifrícios e
diversos outros cosméticos, contêm, em suas formulações, várias substâncias químicas que
estão presentes no ambiente (principalmente nos esgotos tratados, mas também em águas
superficiais) em quantidades significativas. Fragrâncias, desinfetantes, fungicidas e
essências, dentre tantas outras, apresentam características bioativas e, quando descartadas
no sistema coletor de esgoto doméstico, são transportadas às estações de tratamento de
efluente. Durante o tratamento, vários deles não são mineralizados (degradação completa a
gás carbônico e água), não são degradados ou sofrem degradação parcial e, por isso, sua
presença é detectada em corpos d’água receptores.
Embora alguns estudos já relatarem, a mais de 20 anos, a ocorrência no meio ambiente de
fármacos, produtos de limpeza e higiene pessoal e outras substâncias classificadas como
perturbadores endócrinos, apenas nos últimos 10 anos é que começaram a ser
intensificadas as pesquisas nesta área, principalmente nos países europeus e EUA. No
Brasil, estudos sobre o tema ‘micropoluentes’ em águas e efluentes ainda são incipientes, e
a revisão da literatura mostra que há pouquíssimos trabalhos nacionais publicados
abordando a presença de tais contaminantes em efluentes sanitários, em águas superficiais
e subterrâneas, bem como seu destino durante os tratamentos de água e esgotos. Efluentes
de estações de tratamento de esgoto podem conter uma variedade de compostos orgânicos
2
que foram introduzidos por atividades antropogênicas. Uma vez que o efluente tratado é,
muitas vezes, despejado em mananciais de água potável, a poluição desta com
microcontaminantes orgânicos é de grande preocupação mundial (Kimura et al., 2004).
A utilização de sistemas combinados de tratamento, que empregam reatores anaeróbios
seguidos de reatores aeróbios, pode conferir grande viabilidade econômica aos sistemas de
tratamento de esgotos. Tal combinação se apresenta como uma opção bastante promissora
no Brasil, tanto do ponto de vista econômico, quanto do ponto de vista técnico e de
atendimento à legislação ambiental. Em particular, a combinação de reatores UASB com
pós-tratamento aeróbio tem encontrado elevada aplicabilidade no Brasil, tendo em vista,
principalmente, a sua simplicidade e baixo custo operacional (Von Sperling, 2005).
Projetos de pesquisa apoiados pelo PROSAB (FINEP/CNPq/Caixa) ao longo dos últimos
anos contribuíram para o avanço desta tecnologia e sua disseminação destes sistemas de
tratamento de esgotos no estado de Minas Gerais e no Brasil.
Durante as últimas três décadas, o impacto da poluição química nos corpos d’água foi
focado quase exclusivamente em macropoluentes (Agüera et al., 2003), o que ocorreu
devido aos impactos diretos causados por eles: como a eutrofização de ambientes lênticos
ou problemas imediatos de saúde pública. De fato, os sistemas de tratamento combinado
são, na maioria das vezes, eficientes na remoção dos macro-poluentes, dos quais se
destacam a matéria orgânica biodegradável (DBO), nutrientes (nitrogênio e fósforo) e
organismos patogênicos (vírus, cistos e ovos de helmintos). Entretanto, pouco se sabe
sobre a eficiência de tais sistemas na remoção de microcontamintes orgânicos.
A remoção de compostos químicos advindos de fármacos, produtos de limpeza e de
higiene pessoal em sistemas simplificados de tratamento de esgotos é altamente desejável,
uma vez que tais sistemas têm grande potencial de serem difundidos, principalmente nas
pequenas comunidades, com pouco aporte de recursos financeiros. A remoção de
microcontaminantes no tratamento de esgotos melhoraria a qualidade ambiental e
diminuiria ainda a pressão sobre as estações de tratamento de água, que muitas vezes
captam água contaminada com tais poluentes.
3
Pelo exposto, o presente trabalho tem como principal objetivo desenvolver técnicas
analíticas que permitam o monitoramento de micropoluentes orgânicos em esgoto sanitário
bruto e nos efluentes de um reator UASB, seguido de pós-tratamento aeróbio com filtros
biológicos percoladores (FBP), sistema de tratamento este de grande aplicabilidade às
condições geográficas e socioeconômicas do Brasil. Essa pesquisa foi dividida em duas
partes principais: a primeira focaliza o monitoramento do esgoto como um todo, durante
dez meses, e, através do tratamento quimiométrico de dados em conjunto com a
interpretação de espectros de massa, identificar os poluentes majoritários presentes no
esgoto, e discutir como ocorre a remoção deles durante o tratamento. A segunda parte trata
de identificar, usando cromatografia acoplada à espectrometria de massas, poluentes
especificados (compostos-alvo) e monitorar o comportamento deles ao longo do sistema de
tratamento.
4
2. Revisão Bibliográfica
Esse capítulo trata, primeiramente, da importância do tratamento de esgotos e dos
fundamentos do tratamento biológico aeróbio e anaeróbio. Depois é apresentado um
sistema combinado (anaeróbio-aeróbio) de tratamento bastante utilizado no país, que
consiste de reator de leito de lodo anaeróbio de fluxo ascendente (UASB) seguido de filtro
biológico percolador (FBP). Em seguida apresenta-se uma revisão da literatura sobre
trabalhos que fizeram uma caracterização mais aprofundada, os quais buscam compostos
específicos nos esgotos sanitários, muitas vezes por técnicas cromatográficas acopladas à
espectrometria de massas. Estes trabalhos mostram a atual preocupação com os
mecanismos de degradação e destino final dessas substâncias. A revisão busca a melhor
compreensão dos mecanismos de degradação ou remoção desses compostos quando
submetidos ao tratamento de efluentes, para uma avaliação mais realista da eficácia dos
sistemas. Finalmente são apresentados os fatores que influenciam na degradação dos
poluentes, que podem ser divididos em dois grupos distintos: as características intrínsecas
das substâncias, diretamente relacionadas com suas estruturas químicas, e os parâmetros
operacionais das ETEs.
2.1. Tratamento Biológico de Esgotos
A presença de poluentes no meio ambiente aquático pode trazer efeitos nocivos ao meio
ambiente e ao homem, muitos deles ainda não completamente elucidados (Bruchet et al.,
2002). Na maioria dos países, incluindo o Brasil, as águas superficiais são uma importante
fonte de captação pelas estações de tratamento, as quais abastecem os centros urbanos.
Assim, é de grande importância a minimização da poluição das águas naturais pelos
efluentes domésticos. Para isso, os efluentes deveriam ser captados e levados às estações
de tratamento de esgotos municipais, que utilizam diversas tecnologias para a minimização
da poluição ambiental gerada pelas populações das cidades.
Para o tratamento biológico de águas residuárias, variados processos estão, hoje,
disponíveis, e que podem ser classificados em dois grandes grupos, relacionados com a
presença ou ausência de oxigênio durante a degradação biológica. Ambos funcionam
através do mesmo mecanismo básico: microorganismos utilizando os poluentes do efluente
em suas reações bioquímicas para gerar energia e crescimento celular. A diferença entre
eles está na condição ambiental imposta em cada um. Sob condições aeróbias, os
5
compostos orgânicos são oxidados a dióxido de carbono e água, tendo como aceptor final
de elétrons, o oxigênio molecular livre. Na ausência de oxigênio molecular (condição
anaeróbia), o ambiente se torna redutor, e aceptores de elétrons alternativos são requeridos.
Os sistemas aeróbios são mais eficientes na mineralização de compostos aromáticos; já os
anaeróbios, de grupos alifáticos de cadeia curta (Aquino, 2004).
Os poluentes presentes nos esgotos são usados pelos microorganismos como fonte de
energia (doadores de elétrons) ou ainda como aceptores de elétrons (Ex. SO42-,
pentaclorofenol, azo-corantes), que os metabolizam e utilizam a energia liberada nesse
processo para suas reações bioquímicas de manutenção e reprodução celular. Como
subprodutos da degradação aeróbia, produzem dióxido de carbono e água, e sob condição
anaeróbia, metano, hidrogênio e dióxido de carbono, gases esses que são liberados na fase
líquida do tratamento (Von Sperling, 2005; Chernicharo, 2007).
Os reatores biológicos, de maneira geral são ambientes que favorecem as melhores
condições para o crescimento dos microorganismos degradadores de matéria orgânica, em
termos de pH, temperatura, nutrientes, presença ou ausência de oxigênio, contato da
biomassa com o substrato, entre outros. É notado que nos reatores anaeróbios a produção
de biomassa é inferior quando comparada aos reatores aeróbios. Isso é explicado pela
quantidade de energia liberada por unidade de biomassa em cada um dos processos.
Enquanto o anaeróbio libera menos energia, o que implica em menor crescimento da
biomassa, o aeróbio libera mais, fazendo com que a multiplicação dos microorganismos
também seja superior (Chernicharo, 2007).
2.1.1. Processos Aeróbios de Degradação de Matéria Orgânica
Os processos aeróbios são caracterizados pela degradação dos poluentes orgânicos na
presença de oxigênio, conforme exemplificado pela equação abaixo:
C6H12O6 + O2 CO2 + H2O + Energia
Nesse tipo de metabolismo, a matéria orgânica poluidora funciona como fonte de carbono
e de energia (doador de elétrons), e o oxigênio é o aceptor final de elétrons, que pode ser
introduzido no sistema de maneira natural, muitas vezes caracterizando uma degradação
6
mais lenta; ou de forma artificial, o que aumenta a concentração de oxigênio disponível
para as bactérias degradadoras, acelerando a remoção dos poluentes. Em relação à
degradação anaeróbia, os processos aeróbios apresentam as seguintes vantagens (Von
Sperling, 2005):
alta taxa crescimento microbiano;
maior estabilidade operacional;
maior eficiência na degradação de poluentes;
remoção NH4+.
Já as desvantagens são (Von Sperling, 2005):
maior geração de lodo a ser tratado, que pode acumular metais pesados ou compostos
orgânicos;
maior consumo de energia, para forçar a introdução artificial de oxigênio nos sistemas.
O fluxograma apresentado na Figura 2.1 ilustra este tipo de degradação biológica para
carboidratos, como exemplo:
Matéria orgânica complexa
Carboidratos
Liberação de enzimas
Compostos de baixo peso molecular
Açúcares (ex. glicose)
Catabolismo e respiração
CO2 e H2O
Figura 2.1 - Diagrama simplificado da degradação aeróbica de carboidratos. Fonte: Von
Sperling, 2005.
2.1.2. Processos Anaeróbios de Degradação de Matéria Orgânica
São sistemas de tratamento de efluentes caracterizados pela degradação seqüencial dos
poluentes, na ausência de oxigênio molecular, por um consórcio de microorganismos
interdependentes, que utilizam a matéria orgânica como fonte de carbono e energia. Esses
processos levam à produção de, principalmente, metano (CH4) e gás carbônico (CO2), de
acordo com a equação simplificada:
7
C6H12O6 3CO2 + 3CH4 + Energia
Quando comparados aos sistemas aeróbios, os anaeróbios mostram as seguintes vantagens
(Von Sperling, 2005):
menor geração de lodo;
menor consumo energético;
produção de metano, o qual pode ser aproveitado como fonte alternativa de energia
E também as seguintes desvantagens (Von Sperling, 2005):
menor taxa crescimento microbiano;
menor estabilidade operacional;
menor eficiência de remoção de matéria orgânica, necessitando, geralmente, de uma
etapa de pós-tratamento;
não remove NH4+;
maior sensibilidade a substâncias tóxicas;
Produção de H2S, o que causa mau odor na periferia de estação de tratamento, bem como
a corrosão de estruturas metálicas da ETE.
A degradação anaeróbia requer três grupos principais de microrganismos: fermentativos,
acetogênicos e metanogênicos, que coexistem na maioria dos ecossistemas anaeróbios.
Esse processo é descrito no fluxograma mostrado pela Figura 2.2:
8
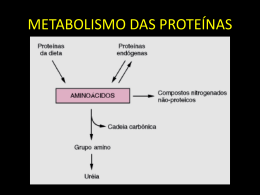
Matéria Orgânica Complexa
Carboidratos
Proteínas
I
Lipídios
HIDRÓLISE
Amino-ácidos, pequenos
sacarídeos
Ácidos graxos, álcoois
-OXIDAÇÃO
FERMENTAÇÃO
Produtos Intermediários:
propionato, (iso) butirato, (iso)
valerato
II
ACETOGÊNESE
Hidrogênio
Dióxido de carbono
Acetato
HOMOACETOGENESE
III
METANOGÊNESE
ACETOCLÁSTICA
METANOGÊNESE
HIDROGENOTRÓFICA
Metano
Dióxido de carbono
Figura 2.2 - Fluxograma representativo da degradação da matéria orgânica complexa
(proteínas, carboidratos e lipídeos). Fonte: Aquino e Chernicharo, 2005a.
A matéria orgânica complexa é degradada por enzimas produzidas pelas bactérias
fermentativas, como celulase, amilase e proteases, em moléculas menores e solúveis. Esses
produtos são, então, fermentados, em um primeiro passo, a ácidos graxos de cadeia curta e
gases hidrogênio e dióxido de carbono. Os ácidos graxos maiores que acetato são
metabolizados a acetato, por bactérias acetogênicas. Por sua vez, H2 e CO2 são convertidos
a acetato pela homoacetogenese ou a CH4 e CO2, pela metanogenese hidrogenotrófica. O
acetato é convertido a metano e dióxido de carbono através da metanogenese acetoclástica,
reação que produz a maior parte do metano gerado nos biorreatores anaeróbios (Aquino et
al., 2005b).
Apesar de existirem diversas vantagens do tratamento anaeróbio quando comparado ao
aeróbio, um dos aspectos que limitam a aplicação da tecnologia anaeróbica é o fato que a
concentração da DQO efluente é geralmente muito alta para atender a legislação ambiental
9
em vigor. Sendo assim, é comum a adoção de sistema de pós-tratamento, com a finalidade
de remover a matéria orgânica residual, o que aumenta o custo final do tratamento.
2.2. Sistemas de tratamento Combinado Anaeróbio-Aeróbio
Os processos de tratamento combinados são caracterizados por unirem ambas as
tecnologias anaeróbias e aeróbias para o tratamento de águas residuárias. Hunter et al.
(1986) sugerem que o mecanismo mais eficiente para a mineralização da matéria orgânica
envolve a alternância entre processos oxidativos (aeróbios) e redutores (anaeróbios). De
fato, ao combiná-las, percebe-se certa redução dos custos de implementação do projeto,
menor quantidade de energia gasto e menor quantidade de resíduo produzido (lodo a ser
disposto). De acordo com Chernicharo (2007), um sistema combinado bastante difundido
no Brasil é o que emprega reator de leito de lodo anaeróbio de fluxo ascendente (UASB)
seguido de pós-tratamento aeróbio com filtros biológicos percoladores (FBP).
O sistema anaeróbio do tipo reator UASB caracteriza-se por apresentar uma zona de
digestão, localizada na parte inferior, onde existe uma manta de lodo que é responsável
pela digestão anaeróbia e uma parte superior, ou zona de sedimentação (Figura 2.3).
Inúmeras vantagens são associadas aos reatores UASB e justificam sua difusão,
especialmente em regiões de clima quente, dentre as quais se destacam a pequena área
requerida para a construção, a simplicidade e baixo custo operacional e de projeto,
consumo energético e produção de lodo inferior a outros sistemas (Chernicharo, 1997).
Von Sperling (2005) destaca ainda que a maior eficiência de remoção de DBO em reatores
UASB (de 60% a 75%) em relação aos decantadores primários (20% a 35%) empregados
em estações de tratamento de esgotos convencionais representa uma grande vantagem na
aplicação dessas unidades.
10
Figura 2.3 - Esquema de um reator UASB. Fonte: Chernicharo, 2007.
Grande parte da matéria orgânica do esgoto bruto é removida no sistema UASB, mas os
efluentes dessas unidades anaeróbias freqüentemente não atendem aos padrões de
lançamento de efluentes no meio ambiente, necessitando, portanto de um sistema de póstratamento. Um exemplo pode ser notado no trabalho de Almeida (2007b), que estudou a
remoção da DQO efluente de reatores UASB em um sistema de pós-tratamento com filtro
biológico percolador (FBP) sob várias condições operacionais. Em todas elas, a DQO
manteve-se em concentração em torno de 150mg/L, valor antigamente considerado
elevado e inadequado ao lançamento, mas que atende ao padrão de lançamento atual
(180mg/L, de acordo com a COPAM-2008). Outro exemplo a ser destacado são os
alquilbenzeno sulfonados de cadeia linear (LAS do acrônimo inglês), que são surfactantes
de ampla utilização doméstica e industrial, que não são removidos por mecanismos
anaeróbios, com seu efluente apresentando alta concentração desses compostos (4,2 a
7,3mg/L) (Tavares, 2008).
Uma opção para reator pós-UASB é o filtro biológico percolador (FBP), um reator aeróbio
empregado no tratamento de esgotos domésticos e industriais. O princípio de
funcionamento de tal reator é a conversão dos poluentes do esgoto por meio de uma
11
biomassa aderida em um meio suporte, os quais são, geralmente, materiais plásticos ou
brita. O esgoto é aplicado sob o meio suporte, proporcionando nele, o crescimento de uma
diversificada matriz microbiológica, composta por bactérias facultativas, aeróbias,
anaeróbias, fungos, algas e protozoários (Tavares, 2008). A aeração no filtro é feita de
maneira natural através de aberturas (escotilhas) na lateral do filtro. À medida que o esgoto
escoa pelo meio suporte, os poluentes ali presentes são oxidados pelos microorganismos,
promovendo a sua estabilização. A Figura 2.4 ilustra o sistema.
(a)
(b)
Figura 2.4 - (a) Corte transversal em um FBPs e (b) escoamento dos esgotos e disposição
do biofilme no meio suporte. Fonte: Chernicharo, 2007.
O meio de suporte empregado no filtro é fator determinante para sua eficiência. Os
materiais usados como meio suporte apresentam como características a elevada área
superficial por unidade de volume, baixo custo, elevada durabilidade e porosidade. Desde a
década de 60, o material mais difundido para ser empregado como meio de suporte é a
pedra britada e a escória de alto forno. Contudo após 1960 um esforço direcionado no
desenvolvimento de materiais que otimizariam as características dos meios de suporte
resultou no surgimento de materiais plásticos, principalmente os anéis plásticos
12
randômicos e blocos cross-flow (Tchobanoglous et al., 2003). A Figura 2.5 ilustra diversos
meios de suporte utilizados nos filtros biológicos percoladores.
A
B
C
DB
Figura 2.5 - (a) Escória de alto-forno; (b) Donwflow Hanging Sponge; (c) Bloco crossflow 45° e (d) Pedra britada. Fonte: Tavares (2008).
2.3.Impacto Ambiental Causado por Micropoluentes no Sistema de Esgoto Doméstico
O esgoto doméstico é constituído principalmente por matéria orgânica biodegradável
originária de alimentos (proteínas, carboidratos e lipídeos) – que representa de 60% a 80%
da DQO total do esgoto bruto. Os detergentes e sabões também são importantes e estão
presentes em concentrações que variam de 7 a 12 mg/L de LAS, representando de 4 a 6%
da DQO filtrada do esgoto. Contudo o esgoto contém ainda uma diversidade de outros
contaminantes orgânicos, presentes em menores concentrações, como resíduos de fármacos
excretados, e ingredientes provenientes de produtos de limpeza e de higiene pessoal.
A caracterização desses micropoluentes, é um assunto de interesse em todo o mundo, e
mobiliza vários grupos de pesquisa a se empenharem em identificar e quantificar essas
substâncias. Nas últimas décadas, a análise de poluentes ambientais esteve focada apenas
nos contaminantes majoritários, ou seja, substâncias amplamente conhecidas por suas
características de persistência no meio ambiente, bioacumulação e toxicidade e que são
definidas pela Agência de Proteção Ambiental dos Estados Unidos (US-EPA) como POP’s
- poluentes orgânicos persistentes. Recentemente, os micropoluentes têm ganhado a
13
atenção da comunidade científica, pelos prejuízos que causam ou podem causar ao bem
estar do homem e ao meio ambiente (Ghiselli, 2006).
Uma vez que a remoção desses micropoluentes não é completa nos sistemas de tratamento,
eles atingem os corpos receptores, acarretando diversos problemas ambientais. Além da
contaminação dos recursos hídricos, microorganismos patógenos, como bactérias, podem
adquirir resistência a fármacos –principalmente antibióticos– com os quais entram em
contato no meio ambiente, através de alterações e adaptações de seu material genético.
Quando utilizado para a eliminação do patógeno em um organismo, a eficiência do
medicamento será reduzida. Outro grupo de substâncias que merece atenção especial são
os estrogênios: substâncias que apresentam potencial de afetar adversamente o sistema
reprodutivo de organismos aquáticos, como por exemplo, a feminização de peixes machos
que habitam rios contaminados com efluentes de ETEs (Billa e Dezotti, 2003; Moreira,
2008). Outras substâncias atraem a atenção pela similaridade de sua estrutura química com
a de substâncias reconhecidamente perigosas, ou pela possibilidade da conversão delas em
compostos tóxicos. O triclosan, agente microbicida presente em xampus, dentifrícios e
outros itens de higiene pessoal, é um policlorofenoxifenol, de estrutura semelhante a
dioxinas e dibenzofuranos, que é associado a efeitos tóxicos em algas e é apontado por
alguns pesquisadores como precursor da formação de várias dioxinas no meio ambiente
(Agüera et al., 2003, Kanetoshi et al., 1988).
A preocupação com microcontaminantes presentes no esgoto doméstico, provenientes das
mais diversas fontes, têm crescido bastante, tendo em vista o número de trabalhos
publicados em todo o mundo, sobre o assunto. A comunidade científica atual tem se
inclinado, cada vez mais, para o desenvolvimento de métodos analíticos suficientemente
sensíveis, com limites de detecção na ordem de μg/L e ng/L, que permitam o
monitoramento da presença desses contaminantes em amostras de águas e efluentes. Os
efeitos que essas substâncias, e tantas outras em potencial, podem causar no meio ambiente
ainda é um assunto controverso, que necessita de estudos mais detalhados. Com o
desenvolvimento e aprimoramento de técnicas analíticas mais sensíveis e especificas, estão
sendo dados grandes passos para a melhor compreensão destas substâncias e seus impactos
ao meio ambiente.
14
Nessa seção é mostrado como substâncias antropogênicas, sintetizadas com o objetivo
geral de melhorar a qualidade de vida, atingem o meio ambiente, principalmente o meio
aquático, e os efeitos nocivos que a presença deles causa ou pode causar para a sociedade e
o meio ambiente.
2.3.1. Produtos de Limpeza e Higiene Pessoal
Produtos de limpeza, como detergentes, sabões e desinfetantes, contêm em suas
formulações, centenas de diferentes substâncias, como agentes tensoativos, fragrâncias e
microbicidas. Ao serem usados, chegam à rede coletora de esgotos, pela qual atingem as
ETEs. Os mecanismos de degradação que aí ocorrem não são, em geral, eficientes na
mineralização desses compostos, o que resulta na presença deles, bem como seus produtos
de degradação, nos corpos receptores. No Brasil e em outros países em desenvolvimento,
ainda há o agravante da emissão de esgotos domésticos e industriais em águas superficiais
sem qualquer tratamento.
Recentemente, a classe de micropoluentes comumente chamados de perturbadores
endócrinos, disruptores endócrinos ou ainda agentes hormonalmente ativos, tem ganhado a
atenção da comunidade científica, pelos prejuízos que causam ou podem causar para o bem
estar do homem e do meio ambiente (Ghiselli, 2006). No caso do esgoto doméstico, as
principais fontes desses micropoluentes são os fármacos e produtos da degradação de
alguns ingredientes de produtos de limpeza. Como exemplo, os tensoativos alquilfenóis
etoxilados (APEOs), presentes em vários produtos de limpeza de uso doméstico, sofrem
biodegradação nas ETEs ou no meio aquático, dando origem a compostos como o 4nonilfenol e o 4-octilfenol, os quais apresentam estruturas químicas características capazes
de interferir nos sistemas endócrinos de alguns animais (ex. peixes e anfíbios) (Moreira,
2008).
Dos constituintes de produtos de limpeza os mais importantes são os agentes tensoativos
ou surfactantes. Tais compostos apresentam uma parte hidrofílica e outra hidrofóbica,
conferindo, de forma simultânea, afinidade por gorduras e pela água. Essa classe de
compostos orgânicos é, em todo mundo, uma das mais sintetizadas, e está presente em
vários produtos rotineiramente usados nos lares, como detergentes, sabões e afins. Na
indústria, os tensoativos são empregados no processamento de têxteis, mineração, flotação,
15
produção de petróleo, tintas e plásticos, processamento do couro e na agricultura (González
et al., 2004). Também são amplamente empregados em produtos com funções higiênicas
de cunho doméstico (Tavares, 2008). Os surfactantes sintéticos podem ser classificados em
aniônicos, catiônicos, não-iônicos, de acordo com a carga suportada pela estrutura
hidrofílica. No entanto, no âmbito ambiental, os mais importantes são os aniônicos e os
não-iônicos.
Um grupo de surfactante aniônico, os alquilbenzeno-sulfonados de cadeia linear (LAS),
merece atenção especial. Essas substâncias estão presentes em amostras de água e solo,
uma vez que são os surfactantes aniônicos mais amplamente utilizados - 41% do total de
surfactantes aniônicos produzidos no mundo são LAS. (Gonzáles, 2004; Tavares, 2008).
Em todo o mundo, o consumo de LAS passa das 3,0 milhões de toneladas anuais, das quais
apenas para a América do Sul, se destinaram cerca de 9% desse montante (Tavares, 2008).
A utilização do LAS em uma extensa gama de formulações está ligada às seguintes
características: grande poder limpante; excelente solubilidade, mesmo em baixas
temperaturas; elevado poder espumante; boa biodegradabilidade e baixo custo. Além de o
LAS ser o principal ingrediente de formulações de detergentes e produtos de limpeza
comerciais, ele também pode ser utilizado, em menor escala, na indústria como agente
umectante (indústria têxtil); emulsificante (defensivos agrícolas, fluidos lubrificantes); e
coletores (flotação de minerais) (Sánchez-Martinéz et al., 2005).
O LAS pode ser definido como uma mistura de diferentes homólogos contendo de 10 a 13
carbonos em sua cadeia alquílica, os quais apresentam percentual de distribuição típico em
formulações comerciais de 12,5%, 30%, 33,5% e 24% respectivamente para os homólogos
de 10, 11, 12 e 13 carbonos (Tavares, 2008). A Figura 2.6 mostra a fórmula estrutural geral
dos LAS.
H3C
n(H2C)
H
C
(CH2)n'
CH3
7≤ n+n’ ≤11
0≤ n,n’≤ 11
SO3-
Figura 2.6 - Estrutura química generalizada dos LAS.
16
A remoção desse surfactante se inicia na rede coletora de esgotos, por ação metabólica dos
microorganismos ativos no esgoto, adsorção em sólidos e precipitação, na forma de sais de
cálcio. Cerca de 50% a 60% do LAS consumido nos domicílios pode ser degradado ainda
na rede coletora, dependendo de sua extensão, tempo de residência e atividade dos
microorganismos presentes. A digestão anaeróbia, principal mecanismo para o tratamento
do lodo gerado em sistemas biológicos, não degrada eficientemente os LAS. Sendo assim, o
lodo é uma importante fonte de contaminação ambiental por LAS, permanecendo estes,
intactos no meio ambiente durante vários anos, quando tratados apenas anaerobiamente
(Berna et al., 1988).
Em condições aeróbias, a degradação dos LAS atinge eficiências da ordem de 90%. A
degradação primária dos LAS ocorre a partir da substituição do grupo metila das
extremidades da cadeia carbônica em um grupo carboxila (ω-oxidação). O composto
gerado nesta etapa é um intermediário denominado sulfofenilcarboxilato. Esta molécula é
oxidada de forma a promover o encurtamento da cadeia alquílica (β-oxidação), de maneira
que o estágio final da degradação (biodegradação última) se procede com a dessulfonação
e rompimento do anel aromático (Tavares, 2008). Os produtos finais serão oxidados a
substâncias inorgânicas (Schöberl, 1989). A Figura 2.7 ilustra o mecanismo de degradação
do C12-LAS.
17
Figura 2.7 - Etapas do processo de degradação aeróbica do C12-LAS. Fonte: Schöberl,
1989.
Outro importante grupo de surfactantes são os alquilfenóis polietoxilados (APEOn).
Encaixam-se, na classe dos surfactantes não-iônicos, e são amplamente utilizados em
vários produtos de utilização comercial e industrial, como detergentes, emulsificantes,
agentes dispersantes e solubilizantes (Chen et al., 2005). Essas substâncias interferem no
funcionamento normal do sistema endócrino de seres humanos e animais. Conforme
salienta Beck et al., (2005), mesmo em baixas concentrações, da ordem de nanogramas por
18
litro, alguns subprodutos da degradação de surfactantes podem promover a
hermafroditização de peixes e anfíbios, além de diminuição da capacidade de reprodução e
potencial indução de câncer de próstata e mama em seres humanos (Nimrod e Benson,
1996).
Apesar de os APEOn serem biodegradáveis, os efluentes das estações de tratamento de
esgoto ainda são a principal fonte de contaminação ambiental pelos APEOn, uma vez que
sua degradação é parcial e incompleta nos tempos de detenção hidráulica usualmente
praticados (Langford et al., 2005). Na estação de tratamento de esgotos a remoção desses
compostos surfactantes pode acontecer pela degradação, mas principalmente pela adsorção
ao lodo. A Figura 2.8 apresenta um mecanismo proposto para a degradação desses
surfactantes.
Figura 2.8 - Mecanismo proposto para a degradação dos APEOn. Fonte: Langford et al.,
2005.
Dentro do sistema de tratamento biológico, em condições aeróbias, ocorre a diminuição da
cadeia polietoxilada por oxidação biológica dos APEOn, uma vez que esses grupos
19
apresentam mais carbonos disponíveis do que os grupos alquila, se tornando, então
importantes fontes nutricionais para as bactérias. Sendo assim, a degradação desses
compostos ocorre em duas etapas: a inicial diminuição da cadeia polietoxilada, o que
resulta em intermediários recalcitrantes, como os alquilfenóis mono e dietoxilados,
alquilfenóis mono e dicarboxilados e alquilfenóis (Eljertsson et al., 1999), e uma etapa
final, que resulta na completa mineralização das substâncias. Essa última etapa ocorre
lentamente, devido à presença do anel benzênico e do grupo alquila, à baixa solubilidade
em água e à necessidade de enzimas ou população microbiana específicas (Langford et al.,
2005).
Destaillats et al. (2000) apud Chen et al. (2005) explicam que é possível degradar os
APEOn no ambiente aquático, com o uso de radiações de freqüência na faixa de 20 kHz a
1000 kHz, o que levaria ao rompimento da cadeia etoxilada (EO), bem como do anel
aromático. Radicais H e OH, gerados pela dissociação térmica de bolhas, reagem com os
surfactantes-alvo, degradando-os. Entretanto tal técnica requer equipamentos sofisticados e
de alto custo, bem como procedimentos operacionais complexos, inviabilizando esse tipo
de tratamento (Ying et al., 2002).
Os produtos carboxilados de degradação dos alquilfenóis polietoxilados (CAPECs), que
contém de cinco a oito átomos de carbono no grupo alquila, são metabólitos presentes em
grande concentração no ambiente aquático, uma vez que se mostram persistentes aos
tratamentos. Segundo Ding et al., (1998) e Corcia et al., (1998) tais compostos
permanecem por até cinco meses após sua geração (degradação dos nonilfenóis
polietoxilados) e contabilizam entre 60% e 63% do total de produtos de degradação
presentes em corpos receptores de descarte de estações de tratamento de efluentes. Da
classe dos CAPECs, são mais comuns os carboxialquilfenóis mono e dietoxicarboxilados
(respectivamente CAP1ECs e CAP2ECs). A Figura 2.9 ilustra a estrutura do ácido 4-(4’carboxi-2’-metil-2’-butil) fenoxiacético, de cinco átomos de carbono no grupo alquila
(CA5P1EC).
Figura 2.9 - Estrutura química do CA5P1EC. Fonte: Hoai et al., 2004.
20
Produtos de higiene pessoal de uso diário, como sabonetes, perfumes, dentifrícios e
cosméticos, contêm, em suas formulações, diversas substâncias químicas. Fragrâncias,
desinfetantes, fungicidas e essências, dentre tantas outras, apresentam características
bioativas e, quando descartadas no sistema coletor de esgoto doméstico, são transportadas
às estações de tratamento de efluente. Durante o tratamento, vários deles não são
mineralizados, ou sofrem degradação parcial e são eliminados em corpos receptores,
fazendo com que estejam presentes no ambiente, ainda que em baixas concentrações.
O triclosan (2,4,4’-tricloro-2’-hidroxidifenil éter) é um composto muito usado como agente
antimicrobiano na fabricação de dentifrícios, xampus, sabonetes e cosméticos.
Estruturalmente, se agrupa na classe dos policlorofenoxifenóis, apresentando estrutura
similar (Figura 2.10) às dibenzo-p-dioxinas policloradas (PCDDs) e dibenzofuranos
policlorados (PCDFs), compostos reconhecidos por apresentarem toxicidade. Segundo
Kanetoshi et al. (1988), o triclosan pode ser considerado um dos precursores de PCDDs, e
Orvos et al. (2002) se referem a esse composto como tóxico para algas.
Outro antimicrobiano de aplicação diversificada é o bifenilol, usado na confecção de
desinfetantes, fungicidas, preservativos, e intermediário para a fabricação de corantes.
Segundo Agüera et al. (2003), o triclosan e o bifenilol podem sofrer ação da radiação ou
calor, e serem conseqüentemente convertidos em dioxinas e bisfenóis policlorados
hidroxilados (OH-PCBs), substâncias que apresentam alto grau de toxicidade. A Figura
2.10 apresenta uma proposição de reação de síntese de compostos tóxicos a partir do
triclosan, mostrando a semelhança estrutural entre o bifenilol e os OH-PCBs:
21
Cl
Cl
Cl
O
HO
O
Triclosan
Cl
O
Cl
/h
Cl
O
Cl
O
Cl
Cl
O
Cl
Cl
O
Cl
Dioxinas
OH
OH
n(Cl)
Bif enilol
(Cl)n
PCBs
Figura 2.10 - Formação de dioxinas a partir do triclosan, e a semelhança estrutural entre o
bifenilol e os PCBs. (Fonte: Agüera et al., 2005).
2.3.2. Fármacos
A preocupação com a presença de fármacos no meio ambiente tem se tornado cada vez
maior. Várias classes de drogas, receitadas ou não pelos profissionais da área de saúde,
incluindo antiinflamatórios, antiepilépticos, ß-bloqueadores e antibióticos são despejados
nos sistemas de tratamento de esgotos dos centros urbanos, via excreção humana, via
processos de manufatura da indústria farmacêutica e também via disposição de produtos
não usados ou com o prazo de validade expirado (Petrovic et al., 2006). A degradação
desses fármacos é, muitas vezes, incompleta e ineficiente, e os efluentes são lançados nos
corpos receptores, contaminando o meio ambiente aquático.
Como exemplos de drogas comumente encontradas no meio-ambiente podem ser citados o
diclofenaco, fluoxetina e claritromicina, usados como analgésico, antidepressivo e
antibiótico, respectivamente. A presença dessas substâncias causa sérios impactos no
ambiente natural e nos organismos em que nele vivem. Como essas drogas são substâncias
biologicamente ativas, a presença dos mesmos no ambiente aquático significa um grande
22
risco para a saúde humana, vegetal e animal (Lee et al., 2005). A Figura 2.11 mostra as
principais maneiras pelas quais fármacos podem contaminar o meio ambiente, desde sua
produção/aplicação até a estação de tratamento de água.
Figura 2.11 - Principais rotas de fármacos no meio ambiente. Fonte: Billa e Dezzoti, 2003.
Vasskog et al. (2006) mostram dados do consumo de antidepressivos, drogas que se
apresentam em concentrações cada vez maiores nos sistemas de tratamento. Na Noruega, o
consumo dessas substâncias aumentou em 320% na última década, crescimento esse que
também é percebido em toda a Europa. Juntamente com o aumento na utilização dessas
drogas, aumentou também o interesse em métodos analíticos focados na análise delas,
principalmente em amostras biológicas como sangue, urina e cabelos.
Apesar dos efeitos à saúde provocados pelo consumo de fármacos via ingestão de água
potável contaminada ainda não estarem completamente elucidados, o princípio da
precaução estabelece que tais substâncias devam estar ausentes da água distribuída para a
população (Kimura et al., 2004). A exposição de seres a contraceptivos lançados em
corpos receptores gera anomalias e deterioração em seus sistemas reprodutivos, até mesmo
a feminização de peixes machos (Damstra et al., 2002). Folmar et al. (2000) relatam que,
23
dependendo do tempo e dose que foram expostos, essas substâncias promovem câncer de
mama, testículo e próstata, ovários policísticos, redução da fertilidade masculina e
alterações na produção de ovos.
Jørgensen et al. (2000) relatam que a presença dos antibióticos no meio ambiente promove
a resistência bacteriana às próprias drogas, principalmente quando expostas a baixas
concentrações e durante tempo prolongado. Diversos estudos foram conduzidos e
constataram o desenvolvimento de colônias bacterianas resistentes a antibióticos em
hospitais (Kolár et al., 2001), águas de subsolo (Mckeon et al., 1995) e sedimentos
marinhos (Wu, 1995).
2.4. Monitoramento de Micropoluentes em Sistemas de Tratamento de Esgotos
O que se pretende nessa seção é apresentar estudos realizados por diferentes grupos de
pesquisa relacionados ao monitoramento de microcontaminantes em sistemas de
tratamento de esgoto sanitário. A maioria desses estudos não apresenta dados fundamentais
a respeito das condições operacionais das plantas de tratamento de esgoto, o que dificulta
uma análise crítica sobre as eficiências de remoção dos micropoluentes. Quando citadas,
tais condições de operação foram incluídas nessa revisão.
Todos os estudos aqui revisados mostram a crescente preocupação internacional com os
níveis de micropoluentes, bem como o efeito prejudicial causado pela presença deles no
meio ambiente. Com isso, pode ser percebida a importância de diferentes técnicas
cromatográficas acopladas à espectrometria de massas para o rastreamento dessas
substâncias em águas residuárias domésticas e outros compartimentos ambientais.
Entretanto, essas técnicas devem ser aprimoradas e adaptadas, para que os micropoluentes
já conhecidos possam ser detectados, cada vez mais, em menores concentrações, bem
como auxiliar na elucidação de diversas outras substâncias desconhecidas, que possam
apresentar algum potencial poluidor.
2.4.1. Produtos de Limpeza e Higiene Pessoal
González et al. (2004), por meio de técnicas de extração e cromatografia, puderam
constatar a presença de surfactantes e compostos hormonalmente ativos em alta
concentração, em águas residuárias brutas e tratadas de diversas estações de tratamento de
24
esgoto, e em sedimentos e águas marinhas, na região da Catalunha, nordeste da Espanha,
onde existem, além da contribuição do esgoto doméstico, várias indústrias responsáveis
pelos despejos de surfactantes, como indústrias têxteis e curtumes. Os compostos
estudados foram: alquil benzeno sulfonados de cadeia linear (LAS), dietanol amidas de
cocos (CDEAs), nonilfenóis etoxilatos, nonilfenóis carboxilados (NPECs), e seus produtos
de degradação, quer sejam, 4-nonilfenol (NP) e 4-octilfenol (OP). A pesquisa utilizou
cartuchos de extração em fase sólida para o isolamento e concentração das substâncias,
bem como a técnica de HPLC-MS, a qual, para a detecção de LAS, NPECs, NP e OP foi
realizada sob condições de ionização negativa, enquanto que para a detecção de
nonilfenóis polietoxilados (NPEOs), sob condições de ionização positiva. Os resultados
mostraram que no esgoto bruto, as concentrações de NPEOs variaram na faixa de 60 a 190
μg/L, ao passo que nos efluentes, essa concentração reduziu-se para a faixa de 2,8μg/L a
6,6μg/L, o que corresponde à uma eliminação primária de, aproximadamente, 95%. O NP
foi encontrado, no esgoto bruto, em concentrações que variaram de 0,2μg/L a 18μg/L,
sendo que no efluente tratado a concentração média foi de 5μg/L. A eliminação de LAS e
CDEAs variou de acordo com a estação de tratamento estudada. Em uma das ETEs, que
contava com tratamento secundário biológico, o nível de remoção superou os 85%, ao
passo que foi de apenas 56% (para CDEAs) a 30% (para LAS) em estações de tratamento
de efluentes que contavam apenas com o tratamento primário (decantação).
LEE et al. (2005), utilizaram extração em fase sólida seguida por GC-MS na busca de
vários micropoluentes em afluentes e efluentes de estações de tratamento de esgoto do
Canadá. Nas estações monitoradas o NP estava presente no afluente na faixa de 2,7μg/L a
25μg/L, ao passo que no efluente a faixa de concentração era de 0,32μg/L a 3,21μg/L.
Outros poluentes encontrados foram o octilfenol (OP), o bisfenol A (BPA) e o triclosan
(TCS), presentes nos afluentes em concentrações médias de 3,08μg/L, 1,28μg/L e
1,35μg/L, respectivamente, bem como no efluente, em concentrações médias iguais à
0,06μg/L, 0,18μg/L e 0,14μg/L, respectivamente. Lee et al. (2005) também detectaram o npropil parabeno, em concentrações médias de 0,73μg/L e 0,01μg/L, nos afluente e efluente,
respectivamente. Essa substância, que faz parte da formulação de cosméticos e
conservantes, apresenta atividade estrogênica, e é suspeita de causar câncer de mama.
25
Um desinfetante comumente utilizado em hospitais, lavanderias e usinas de processamento
de alimentos, o 2-fenilfenol, também foi detectado por LEE et al. (2005), nas amostras de
afluente (concentração média de 2,58μg/L) e efluente (concentração média igual a 0,05
μg/L).
Agüera et al. (2003) desenvolveram métodos cromatográficos para a identificação e
quantificação de triclosan e bifenilol em águas residuárias municipais, lodos de sistemas de
tratamento e sedimentos marinhos. Esses compostos são anti-sépticos, caracterizados pela
elevada toxicidade a bactérias, usados na agricultura, indústria e nos lares. Os compostosalvo das amostras foram concentrados por extração em fase sólida e analisados por HPLCMS, equipado com um analisador Ion Trap e ionização no modo negativo. Além disso, os
autores usaram um GC-MS em dois diferentes modos de operação: ionização por elétron
(GC-EI-MS) e ionização química negativa (GC-NCI-MS), a qual usava metano como gás
reagente. Ambas técnicas puderam detectar os poluentes em níveis de ppb (μg/L), e que a
técnica de GC-NCI-MS mostrou-se mais eficiente para a quantificação do triclosan, uma
vez que foi possível detectá-lo em níveis de ppt (ng/L). Foi determinada a presença de
triclosan na faixa de 0,8 a 37,8 μg/L nas águas residuárias estudadas, ao passo que não foi
percebida a presença de bifenilol nas amostras estudadas.
O comportamento dos almíscares sintéticos galaxolida e tonalida, substâncias utilizadas na
fabricação de perfumes como fragrâncias e fixadores, foi avaliado em diferentes sistemas
de tratamento por Carballa et al. (2004, 2005 e 2007). Testes de remoção por coagulaçãofloculação mostraram eficiência entre 50% e 70%, e por flotação, de 35% a 60%. Os
compostos foram monitorados em uma estação de tratamento de efluentes, onde já nos
tratamentos primários (coagulação-floculação e flotação), foram removidos com eficiência
na faixa de 30% a 50%, respectivamente. A eficiência de remoção total desses compostos
chegou a 90%, após passarem por um reator de digestão anaeróbia.
2.4.2. Fármacos
Lee et al. (2005) analisaram os fármacos, ibuprofeno, ácido salicílico, gemfibrozil,
naproxeno, cetoprofeno, diclofenaco e indometacina, por GC-MS, em sistema de
tratamento de esgotos do Canadá. As amostras eram derivatizadas pela reação com ácido
pentafluoropropionil, após passarem pelo processo de extração em fase sólida. Estas
26
substâncias foram consistentemente detectadas por GC-MS nos afluentes e efluentes
amostrados, em concentrações que variaram de 3 a 7μg/L.
Kimura et al. (2004) examinaram, em diversos reatores aeróbio de membrana submersa
(MBR), operados em escala piloto, seis fármacos, dentre eles o ibuprofeno e o diclofenaco,
substâncias usadas no combate à febre e no alivio de dores. A detecção foi feita por
GC/MS após os compostos serem extraídos em cartuchos em fase sólida e derivatizados
com brometo de pentafluorobenzila. Os autores concluíram que o ibuprofeno foi
facilmente removido no reator aeróbio de membranas uma vez que a concentração do
mesmo foi reduzida de várias centenas de ng/L a aproximadamente 10ng/L, em um tempo
de detenção hidráulica (TDH) de nove horas, aproximadamente. Esses dados mostram que
o ibuprofeno está presente em grandes concentrações, mas que é prontamente
biodegradável, ao passo que o diclofenaco foi de mais difícil degradação. Resultados
semelhantes, que atestam a persistência do diclofenaco em outros sistemas de tratamento
biológicos de águas residuárias, foram relatados por Buser et al., (1998a) e por Zwiener et
al., (2000).
Outro estudo realizado no mesmo tipo de reator biológico foi o de Radjenovic et al.
(2007), que compararam a eficiência de dois reatores aeróbios diferentes na remoção de
diversos fármacos. Os autores estudaram um reator aeróbio de membrana submersa
(MBR), em escala de laboratório, e um sistema de lodos ativados (CAS) da estação de
tratamento Rubi, localizada na região da Catalunha, Espanha. A referida estação, que
recebe efluentes domésticos, industriais e hospitalares, conta com tratamento preliminar
(desarenador e gradeamento), primário (decantação) e secundário (biológico). As amostras
coletadas do sistema real e de bancada foram concentradas pelo processo de extração em
fase sólida e analisadas por HPLC-MS, o qual contava com um espectrômetro de massas
do tipo triplo quadrupolo, equipado com interface do tipo electronspray, sendo a análise
realizada nos modos de ionização positivo e negativo. Os resultados revelaram a presença
de 22 dos 31 fármacos pesquisados no afluente da estação. Os fármacos encontrados em
maior concentração (faixa de μg/L) foram os analgésicos e antiinflamatórios (naproxeno,
ibuprofeno, cetoprofeno, diclofenaco, e acetaminofeno), os reguladores de lipídeos
(gemfibrozil e bezafibrato), o β-bloqueador atenolol, e o diurético hidroclorotiazida. Os
autores concluíram que o MBR, no geral, degrada os fármacos detectados com maior
27
eficiência, e que algumas dessas substâncias, como a carbazepina, passaram incólumes por
ambos os sistemas de tratamento.
Petrovic et al. (2006) desenvolveram uma técnica de cromatografia líquida de ultraperformance (UPLC) acoplada à detectores de espectrometria de massas (quadrupole e
time-of-flight - Q-TOF-MS), os quais possibilitaram a varredura e confirmação de vinte e
nove padrões de fármacos de diversas classes, como analgésicos e antiinflamatórios,
drogas psiquiátricas e agentes anti-úlceras, em efluentes de estações de tratamento de
esgotos. A análise de amostras reais de estações de tratamento de esgoto pela metodologia
desenvolvida encontrou resíduos de fármacos, como diclofenaco (0,25µg/L no afluente e
0,32µg/L no efluente), acetaminofeno (5,4 µg/L no afluente e 2,1 µg/L no efluente) e
cetoprofeno (0,23 µg/L no afluente e 0,20 µg/L no efluente), dentre outros.
Huerta-Fontela et al. (2007) também utilizaram cromatografia líquida de ultra performance
(UPLC-MS-MS) para a análise simultânea de quinze drogas estimulantes em águas, dentre
elas cocaína, compostos relacionados à anfetamina, LSD, nicotina e cafeína. A análise de
amostras reais, coletadas em diversas estações de tratamento de efluentes situadas no
nordeste da Espanha, revelou a presença, tanto nos afluentes quanto nos efluentes, de
cocaína e seus metabólitos, MDMA (“ecstasy”), e anfetamina. A cocaína, juntamente com
seu metabólito benzoilegonina, foi encontrada em 85% das amostras de afluentes e em
69% de efluentes. Outras drogas controladas, como o MDMA, foram encontradas em 30%
dos afluentes e 23% dos efluentes, e os resultados mostraram que a eficiência de remoção
do MDMA foi de apenas 15%. As substâncias não-controladas (nicotina, cafeína, e seus
respectivos metabólitos) foram encontradas em todas as amostras, e os autores salientam
que essas drogas são um importante problema ambiental nos centros urbanos.
Vasskog et al. (2006) utilizaram extrações em fase sólida (cartucho de estireno e
divinilbenzeno) e líquido-líquido (pentano), seguidas de HPLC-MS (triplo quadrupolo,
modo MRM, ionização por electronspray), e encontraram cinco drogas antidepressivas
(citalopram, paroxetina, sertralina, fluvoxamina e fluoxetina) em concentrações que
variaram de 0,5ng/L a 612ng/L, durante o monitoramento de uma estação de tratamento de
efluentes em Tromsø, Noruega. A eficiência de remoção das drogas foi, em média, igual a
49%.
28
Bruchet et al. (2002) identificaram mais de 240 diferentes substâncias presentes em águas
residuárias brutas e já tratadas. Dentre elas, foram encontradas, através de GC-MS, drogas
como a nicotina e cafeína, ftalatos (empregados como plastificantes) e etinil estradiol
(hormônio sintético presente em contraceptivos). A planta estudada conta com os seguintes
tratamentos: gradeamento e caixa de areia, decantamento primário, lodos ativados e
clarificação final. Os autores relatam que no geral, a estação apresenta boa eficiência de
remoção dos micropoluentes e, somado ao efeito de diluição do corpo receptor, não é
observado o efeito deteriorativo ambiental. Destacam-se as eficiências de remoção do
hormônio 17β-estradiol (70%), da cafeína (99,5%) e estrona (60%). Por outro lado, alguns
compostos, como a nicotina, não foram removidos.
Segura et al. (2007) utilizaram a técnica de HPLC-MS-MS (triplo quadrupolo) para a
quantificação de seis antiinflamatórios (sulfametoxazol (SMX), trimetoprim (TRI),
ciprofloxacina (CIP), levofloxacina (LEV), azitromicina (AZI) e claritromicina (CLA)) nos
afluentes e efluentes da estação de tratamento de esgotos de Montreal, Canadá, a qual trata
o efluente doméstico correspondente a uma população de 1,8 milhões de habitantes. A
estação, a maior planta de tratamento primário da América do Norte, conta com
gradeamento, coagulação e sedimentação dos sólidos suspensos. Os autores fizeram as
etapas de concentração das amostras e clean-up pela técnica de extração em fase sólida
seguida de análise em HPLC-MS pela técnica de electronspray em modo positivo. O
resultado das análises mostrou a presença de todos os compostos-alvo, tanto no afluente
como no efluente da estação de tratamento, com destaque para a CLA, a qual apresentou
uma concentração no efluente igual a 263ng/L (remoção de apenas 42,1%). Em relação aos
outros compostos, os que apresentaram maior remoção foram a CIP (66,6%) e a LEV
(60,0%) e o SMX (52,9%). Os demais compostos apresentam remoção inferior a 50%.
Yang et al. (2006) utilizaram um espectrômetro de massas do tipo ion trap (IT) com
ionização por electronspray (ESI) em modo positivo para quantificar em amostras de
esgoto os antibióticos anidroeritromicina (ETM) e tilosina (TLS). A amostragem foi feita
nas estações de tratamento de esgotos de Drake (DWRF) e de Mulberry (MWRF), ambas
localizadas nos Estados Unidos. A primeira trata aproximadamente 50.000 m3/d enquanto
a segunda trata 9.600 m3/d de esgoto sanitário e industrial. Em ambas estão presentes as
etapas de pré-tratamento e clarificações primária, intermediária e secundária (processo de
29
lodos ativos). O sistema DWRF apresenta o processo de cloração, enquanto que no sistema
MWRF, o processo de desinfecção dos esgotos tratados é feito por radiação ultravioleta.
As amostras foram concentradas por extração em fase sólida e os resultados mostraram a
presença de ETM e TLS nos afluentes e efluentes de ambas as estações, com exceção da
tilosina, a qual não foi detectada no efluente da estação MWRF. Considerando as
concentrações médias, a remoção de ETM e TLS no sistema de lodos ativados foi de 66%
e 72% para os sistemas ETM e TLS, respectivamente. Considerando-se o pós-tratamento
por oxidação, observou-se que os processos de cloração e de radiação ultravioleta
apresentaram eficiências de remoção semelhantes, de 50 a 56%.
Um trabalho realizado em dez estações de tratamento de esgoto do Rio de Janeiro (Stumpf
et al., 1999) demonstra a detecção de reguladores de lipídeos, antiinflamatórios e
metabólitos de fármacos nos esgotos brutos e tratados. Alguns dos fármacos estudados
foram os ácidos acetilsalicílico, clorifíbrico e fenofíbrico; e os antiinflamatórios
ibuprofeno, diclofenaco, cetoprofeno, naproxeno, indometacina e cetoprofeno. As análises
das amostras foram feitas por GC-MS, após as etapas de extração em fase sólida (cartuchos
C-18) e derivatização. Os resultados mostraram que a eficiência de remoção para
compostos individuais variou de 12% a 90%, e que as concentrações das drogas nos
efluentes variaram de 0,1 µg/L a 1 µg/L.
A eficiência de remoção de alguns fármacos presentes em lodo de sistemas de tratamento
anaeróbio foi avaliado por Carballa et al. (2007). Os autores estudaram a influência da
temperatura e do tempo de detenção do lodo, para os seguintes compostos: carbamazepina
(anti-epiléptico); ibuprofeno, naproxeno e diclofenaco (antiinflamatórios); sulfametoxazol
e roxitromicina (antibióticos); iopromida (meio de contraste para raios-x); e estrona, 17βestradiol e 17α-etinilestradiol (estrógenos). A pesquisa mostrou que o tratamento anaeróbio
apresentou elevada eficiência na remoção de antibióticos, estrógenos e do antiinflamatório
naproxeno. A eficiência de remoção dos demais antiinflamatórios e do meio de contraste
situou-se na faixa de 20% a 60%, ao passo que o anti-epiléptico carbamazepina não foi
removido durante o tratamento. Os autores verificaram ainda que, de forma geral, a
remoção dos compostos não foi afetada pela temperatura ou pela idade do lodo no reator
anaeróbio.
30
O processo de degradação desses mesmos compostos foi analisado por Carballa et al.
(2004) ao longo de um sistema de tratamento na região da Galícia (noroeste da Espanha).
O tratamento primário removeu parcialmente o 17β-estradiol (eficiência de 20%),
enquanto que o tratamento aeróbio (lodos ativados) promoveu uma importante remoção de
todos os compostos (entre 35% e 75%), com a exceção da iopromida. A concentração de
estrona aumentou ao longo do tratamento, por causa da oxidação parcial do 17β-estradiol
nos tanques de aeração. Carballa et al. (2005) também avaliaram a eficiência na remoção
de alguns fármacos pelos processos de coagulação-sedimentação e flotação. A eficiência
de remoção do diclofenaco (composto altamente lipofílico) se mostrou próxima a 60% nos
ensaios de coagulação-sedimentação, e independente da temperatura do sistema, da dose
ou do tipo de coagulante usado. Entretanto a remoção dos compostos hidrofílicos
(diazepan e naproxeno) foi maior que 75% e se mostrou dependente desses parâmetros. A
carbamazepina (composto neutro, que combate a epilepsia) e ibuprofeno (antiinflamatório
de características ácidas) não foram removidos em quaisquer condições. Os ensaios de
flotação mostraram remoção de diazepan próximas a 50%, de diclofenaco na faixa de 20%
a 45%, e com menor eficiência, a remoção de carbamazepina (20% a 35%), ibuprofeno
(10% a 25%) e naproxeno (10% a 30%). As maiores eficiências de remoção dos compostos
estudados foram obtidas na temperatura de 25°C, e a remoção de compostos neutros se
mostrou maior em amostras com alto teor de lipídeos.
Ternes (1998) investigou a ocorrência de resíduos de drogas (antiepilépticos, betabloqueadores e outras usadas em tratamentos psiquiátricos) em estações de tratamento de
esgotos da Alemanha. Foram coletadas amostras de 49 estações de tratamento de esgoto,
todas as quais contavam com os seguintes tratamentos: clarificação primária, aeração com
adição de cloreto ferroso e clarificação secundária. Os dados mostram que a média de
remoção das drogas superou os 60% mas que a remoção incompleta nos sistemas de
tratamento, fez com que 80% das drogas fossem detectadas em pelo menos um efluente
das 49 ETEs estudadas. As concentrações dos fármacos nos efluentes chegaram a 6,3μg/L
(carbamazepina). O mesmo estudo verificou hormônio femininos como o 17-β estradiol
(E2) e estrona (E1), encontrados nos afluentes em concentrações médias iguais a
0,009μg/L e 0,016μg/L, respectivamente. As concentrações médias do estradiol e da
estrona encontradas no efluente foram, respectivamente, iguais a 0,002μg/L e 0,005μg/L.
31
A análise de artigos, publicados por vários grupos de pesquisa em todo o mundo,
possibilitou a compilação das Tabelas 2.1 e 2.2. Nelas, encontram-se as concentrações de
uma variedade de micropoluentes citados, nos afluente e efluente de sistemas de
tratamento de esgoto, bem como a eficiência do tratamento na remoção dos mesmos.
Conforme mostram as tabelas supracitadas, a maioria dos estudos não detalha os sistemas
de tratamento ou as condições operacionais utilizados, o que dificulta a sistematização das
informações, bem como uma análise crítica da eficiência em certo tipo de sistema em
degradar determinado composto.
A maior parte dos compostos relatados são oriundos de fármacos, destacando, pela alta
concentração em esgoto bruto, o ibuprofeno (17,8μg/L), o acetaminofeno (18,0μg/L) e a
cafeína (23,1μg/L), esta última presente também em bebidas como refrigerantes, café e
chás. Dos contaminantes oriundos de produtos de limpeza destacam-se os LAS, os APEOs
e os NPECs que estão presentes nos esgotos brutos em concentrações de 96ng/L a 453μg/L
para o LAS, 1,68 μg/L a 14,6μg/L para os APEOs, e 84,12μg/L para os NPECs.
32
Tabela 2.1 - Remoção de substâncias presentes em produtos de limpeza e higiene pessoal por diferentes sistemas de tratamento.
Substâncias Utilizadas em
Produtos de Limpeza e
Higiêne Pessoal
Concentração
Concentração Média
Média no Afluente
no Efluente da ETE
da ETE
% Remoção
Tipo de Tratamento
Referências
2-hidroximetoxibenzofenona
(protetor solar)
1,6μg/L
<0,1μg/L
>93%%
Lodos ativados
Bruchet et al., 2002
Triclosan
(agente microbiano)
17,95(2)
10,73(2)
40,20%
Digestão aeróbia
Agüera et al., 2003
Bifenilol
(agente microbiano)
Não detectado
Não detectado
Não disponível
Digestão aeróbia
Agüera et al., 2003
TCC
(agente microbiano)
12±15ng/L
84±110ng/L
0%
Não disponível
Sapkota et al., 2006(1)
DCC
(agente microbiano)
0,4±0,7ng/L
1,2±1,8ng/L
0%
Não disponível
Sapkota et al., 2006(1)
TetraCC
(agente microbiano)
Não detectado
Não detectado
Não disponível
Não disponível
Sapkota et al., 2006(1)
Galaxolida
(fragrância)
Não disponível
Não disponível
30% a 50%
Tratamento primário
Carballa et al., 2005
Tonalida
(fragrância)
Não disponível
Não disponível
30% a 50%
Tratamento primário
Carballa et al., 2005
CDEA
(dietanolamida de coco)
40,18μg/L
13,04μg/L
67,54%
Primário e/ou
secundário(3)
Gonzáles et al. , 2004
1-Amostras coletadas de nove diferentes estações de tratamento;
2-Valor correspondente à média das concentrações de triclosan, nos meses de abril a julho de 2002;
3 - Seis diferentes ETEs, das quais uma conta apenas com tratamento físico-químico e as outras, possuem tratamento biológico secundário;
4 - Valores médios, correspondentes a oito diferentes estações de tratamento.
33
Tabela 2.1 - Remoção de substâncias presentes em produtos de limpeza e higiene pessoal por diferentes sistemas de tratamento (continuação).
Substâncias Utilizadas em
Produtos de Limpeza e
Higiêne Pessoal
LAS
Nonilfenol
NPEC
NPEO
Octilfenol
Bisfenol A
Concentração
Concentração Média
Média no Afluente no Efluente da ETE
da ETE
Não disponível
96ng/mL
% Remoção
Tipo de Tratamento
Referências
Não disponível
Não disponível
Sánchez-Martinez et al., 2005
453,2μg/L
144,8μg/L
68,05%
Prim.e/ou secund.(3)
Gonzáles et al. , 2004
6950μg/L
126μg/L
98,2%
Lodos ativados
Bruchet et al., 2002
(3)
1,68μg/L
0,65μg/L
61,31%
Prim.e/ou secund.
Gonzáles et al. , 2004
14,6μg/L(4)
0,70μg/L(4)
95,21%
Não disponível
Lee et al., 2005
84,12μg/L
37,73μg/L
55,15%
Prim.e/ou secund.(3)
Gonzáles et al. , 2004
27,3μg/L
9,96μg/L
63,52%
Prim.e/ou secund.(3)
Gonzáles et al. , 2004
1,02μg/L
1,06μg/L
0,00%
Prim.e/ou secund.(3)
Gonzáles et al. , 2004
3,8μg/L(4)
0,06μg/L(4)
98,42%
Não disponível
Lee et al., 2005
1,28μg/L(4)
0,18μg/L(4)
85,94%
Não disponível
Lee et al., 2005
3,0mg/L
1,5mg/L
50%
Não disponível
Dorn et al., 1987
Não disponível
4 μg/L
Não disponível
Não disponível
Teurneau, 2004
1-Amostras coletadas de nove diferentes estações de tratamento;
2-Valor correspondente à média das concentrações de triclosan, nos meses de abril a julho de 2002;
3 - Seis diferentes ETEs, das quais uma conta apenas com tratamento físico-químico e as outras, possuem tratamento biológico secundário;
4 - Valores médios, correspondentes a oito diferentes estações de tratamento.
34
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura.
Fármacos
e Drogas
17αetinilestradiol
17β-estradiol
Concentração Média no
Afluente da ETE
0,005μg/L
Concentração Média no
Efluente da ETE
Não disponível
% Remoção
Tipo de Tratamento
Referências
Não disponível
Não disponível
Ternes et al., 1999
Não disponível
0,001μg/L
Não disponível
Não disponível
Ternes et al., 1999
Não disponível
0,009μg/L
Não disponível
Não disponível
Ternes et al., 1999
<0,5ng/L a 10ng/L
<0,2ng/L a 2,2ng/L
70,4%
Não disponível
Johnson et al., 2000
Não disponível
0,2ng/L a 7ng/L
Não disponível
Não disponível
Desbrow et al., 1998
Não disponível
0,3ng/L a 1,7ng/L
Não disponível
Não disponível
Baronti et al., 2000
4,5ng/L
0,015μg/L
2ng/L
Não disponível
55,6%
Não disponível
Não disponível
Não disponível
Larsson et al., 1999
Ternes et al., 1999
Não disponível
0,06μg/L
Não disponível
Não disponível
Ternes et al., 1999
0,021μg/L
Não disponível
Não disponível
Não disponível
Ternes et al., 1999
<0,5ng/L a 17ng/L
<0,5ng/L a 7,0ng/L
54,5%
Não disponível
Johnson et al., 2000
Não disponível
2,7ng/L a 48ng/L
Não disponível
Não disponível
Desbrow et al., 1998
1,1ng/L
0,5ng/L
54,5%
Não disponível
Larsson et al., 1999
0,010μg/L
0,003μg/L
70,0%
Lodos ativados
Bruchet et al., 2002
35
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Concentração Média no
Afluente da ETE
Concentração Média no
Efluente da ETE
% Remoção
Tipo de Tratamento
Referências
3,4metilenedioximetamfetamina ("ecstasy")
0,049μg/L
0,041μg/L
16,3%
Não disponível
Huerta-Fontela et al.,
2007
3,4metilenedioxietamfeta
mina (MDEA)
0,028μg/L
Menor que limite de
quantificação
100,0%
Não disponível
Huerta-Fontela et al.,
2007
18,0μg/L
0,07μg/L / 0,29μg/L
99,6% / 98,4%
MBR / lodos ativados
Radjenovic et al.,
2007
<0,05μg/L a 19,5μg/L
(5,4μg/L)
<0,05μg/L a 6,2μg/L
(2,1μg/L)
61,1%
Não Disponível
190g/dia
36,1g/dia
81%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
35ng/L
20ng/L / 05ng/L / 28ng/L
42,9% / 85,7% /
20%
HMBR / CMBR / lodos
ativados
Kimura et al., 2004
0,11μg/L
0,03μg/L / 0,08μg/L
71,8% / 27,7%
MBR / lodos ativados
Radjenovic et al.,
2007
1,00μg/L
0,85μg/L / 0,66μg/L
15% / 34%
filtro biológico/lodos ativados
70g/dia
34,3g/dia
51%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Acetaminofeno
Ácido acetilsalicílico
Ácido Clorifíbrico
Petrovic et al., 2006
Ternes, 1998
Stumpf et al., 1999
Ternes, 1998
36
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Ácido
Fenofíbrico
Concentração Média no
Afluente da ETE
0,40μg/L
Concentração Média no
Efluente da ETE
0,38μg/L / 0,22μg/L
60g/dia
% Remoção
Tipo de Tratamento
Referências
06% / 45%
filtro biológico / lodos
ativados
Stumpf et al., 1999
21,6g/dia
64%
Ternes, 1998
70ng/L
10ng/L / 20ng/L / 40ng/L
85,7% / 71,4% /
42,9%
Clarificação primária,
aeração com adição
de cloreto ferroso
e clarificação secundária
HMBR / CMBR / lodos
ativados
25,0ng/L
6,86μg/L
6,3ng/L / 17,65ng/L
0,14μg/L
74,8% / 29,4%
98%
MBR / lodos ativados
Não disponível
Radjenovic et al., 2007
Lee et al., 2005
0,015μg/L
100,0%
Não disponível
1,50μg/L
Menor que o limite de
quantificação
0,52μg/L / >1,35μg/L
65,5% / <10%
MBR / lodos ativados
Huerta-Fontela et al.,
2007
Radjenovic et al., 2007
<0,05μg/L a 1,00μg/L
(0,23μg/L)
<0,05μg/L a 1,20μg/L
(0,28μg/L)
0%
Não disponível
Petrovic et al., 2006
<0,07μg/L a 0,45μg/L
(0,16μg/L)
<0,07μg/L a 0,30μg/L
(0,14μg/L)
12,5%
Não disponível
Petrovic et al., 2006
135ng/L
80,0ng/L
40,7%
Segura et al., 2007
0,810μg/L
0,216μg/L
73,3%
Gradeamento, coagulação e
sedimentação
Não disponível
Ácido
Mefenâmico
Ácido Salicílico
Amfetamina
Atenolol
Kimura et al., 2004
Azitromicina
Benzoilegonina
Huerta-Fontela et al.,
2007
37
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Concentração Média no
Afluente da ETE
21,6g/dia
Concentração Média no
Efluente da ETE
0,91g/dia / 11.15g/dia
% Remoção
Tipo de Tratamento
Referências
95,8% / 48,4%
MBR / lodos ativados
Radjenovic et al., 2007
1,2μg/L
0,88μg/L / 0,6μg/L
27,0% / 50,0%
filtro biológico/lodos ativados
Stumpf et al., 1999
310g/dia
52,7g/dia
83%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Ternes, 1998
70,1μg/L
0,3μg/L
99,5%
gradeamento e caixa de
areia, decantamento
primário, lodos ativados e
clarificação final
Bruchet et al., 2002
23,134μg/L
4,356μg/L
81,2%
Não disponível
230ng/L
300ng/L / 250ng/L
0,0% / 0,0%
MBR / lodos ativados
Huerta-Fontela et al.,
2007
Radjenovic et al., 2007
<0,10μg/L a 0,95μg/L
(0,40μg/L)
<0,10μg/L a 0,60μg/L
(0,36μg/L)
10%
Não Disponível
Petrovic et al., 2006
120g/dia
111,6g/dia
7%
Ternes, 1998
0,041μg/L
0,019μg/L
53,7%
clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Não disponível
Bezafibrato
Cafeína
Carbamazepina
Cetamina
Huerta-Fontela et al.,
2007
38
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Concentração Média no
Afluente da ETE
0,08μg/L
Concentração Média no
Efluente da ETE
0,05μg/L
320ng/L
10ng/L / 20ng/L / 290ng/L
1,8μg/L
0,15μg/L / 0,87μg/L
0,15μg/L a 0,96μg/L
(0,23μg/L)
0,20μg/L a 0,75μg/L
(0,20μg/L)
0,59μg/L
0,31μg/L / 0,18μg/L
Ciprofloxacina
315ng/L
Citalopram
% Remoção
Tipo de Tratamento
38%
não disponível
96,9% / 93,8% / 9,38% HMBR / CMBR / lodos ativado
Referências
Lee et al., 2005
Kimura et al., 2004
91,9% / 51,5%
MBR / lodos ativados
13,0%
não disponível
47,5% / 69,5%
filtro biológico/lodos ativados
105ng/L
66,6%
gradeamento, coagulação e
sedimentação
Segura et al., 2007
256,7ng/L
151,1ng/L
41,1%
não disponível
Vasskog et al., 2006
Claritromicina
475ng/L
275ng/L
42,1%
gradeamento, coagulação e
sedimentação
Segura et al., 2007
Cocaína
0,079μg/L
0,017μg/L
78,5%
não disponível
Huerta-Fontela et al., 2007
Diazepam
Não disponível
0,033μg/L
Não disponível
não disponível
Ternes et al., 2001
Cetoprofeno
Radjenovic et al., 2007
Petrovic et al., 2006
Stumpf et al., 1999
39
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Diclofenaco
Concentração Média no
Afluente da ETE
0,17μg/L
Concentração Média no
Efluente da ETE
0,11μg/L
50ng/L
% Remoção
Tipo de Tratamento
Referências
35%
Não disponível
Lee et al., 2005
40ng/L / 40ng/L / 70ng/L
20% / 20% / 0%
HMBR / CMBR / lodos
ativados
Kimura et al., 2004
2,8μg/L
0,35μg/L / 1,4μg/L
87,4% / 50,1%
MBR / lodos ativados
Radjenovic et al., 2007
<0,05μg/L a 0,50μg/L
(0,25μg/L)
<0,05μg/L a 0,50μg/L
(0,32μg/L)
0%
Não disponível
Petrovic et al., 2006
0,80μg/L
0,73μg/L / 0,20μg/L
09% / 75%
Filtro biológico/lodos ativados
Stumpf et al., 1999
Não disponível
200ng/L a 370ng/L
Não disponível
Não disponível
Buser et al., 1998
100g/dia
31g/dia
69%
Ternes, 1998
150ng/L
49,1ng/L / 114ng/L
67,3% / 23,8%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
MBR / lodos ativados
Radjenovic et al., 2007
<0,10μg/L a 0,25μg/L
(0,13μg/L)
<0,10μg/L a 0,28μg/L
(0,15μg/L)
0%
Não Disponível
Petrovic et al., 2006
0,09μg/L a 0,35μg/L
(0,22μg/L)
0,04μg/L a 0,12μg/L
(0,08μg/L)
63,6%
Cloração ou UV
Yang et al., 2006
Não disponível
Não disponível
2,5μg/L
2ng/L a 4ng/L
Não disponível
Não disponível
Não disponível
Não disponível
Hirsch et al., 1999
Xiao et al., 2001
24ng/L a 188ng/L
0,43ng/L a 18ng/L
91,3%
Não disponível
Baronti et al., 2000
Eritromicina
Estriol
40
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Estrona
Etinil estradiol
Concentração Média no
Afluente da ETE
0,04μg/L
Concentração Média no
Efluente da ETE
Não disponível
% Remoção
Tipo de Tratamento
Referências
Não disponível
Não disponível
Ternes et al., 1999
0,027μg/L
0,009μg/L
66,7%
Não disponível
Ternes et al., 1999
Não disponível
0,003μg/L
Não disponível
Não disponível
Ternes et al., 1999
<0,5ng/L a 38ng/L
<0,5ng/L a 54ng/L
0%
Não disponível
Johnson et al., 2000
20ng/L a 132ng/L
2,5ng/L a 82,1ng/L
62,65%
Não disponível
Baronti et al., 2000
Não disponível
6,4ng/L a 29ng/L
Não disponível
Não disponível
Xiao et al., 2001
5,8ng/L
0,5ng/L
91,4%
Não disponível
Larsson et al., 1999
0,020μg/L
0,0025μg/L
0,008μg/L
0,0014μg/L
60%
44%
Lodos ativados
Lodos ativados
Bruchet et al., 2002
Bruchet et al., 2002
10g/dia
6,7g/dia
33,0%
Ternes, 1998
1,37ng/L
0,83ng/L
39,4%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Não disponível
Vasskog et al., 2006
2,23ng/L
0,26ng/L
88,3%
Não disponível
Vasskog et al., 2006
Fenazona
Fluoxetina
Fluvoxamina
41
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Gemfibrozil
Glibenclamida
Hidroclorotiazida
Concentração Média no
Afluente da ETE
0,26μg/L
Concentração Média no
Efluente da ETE
0,19μg/L
3,8μg/L
% Remoção
Tipo de Tratamento
Referências
27,0%
Não disponível
Lee et al., 2005
0,4μg/L / 2,3μg/L
89,6% / 38,8%
MBR / lodos ativados
Radjenovic et al., 2007
0,37μg/L
0,31μg/L / 0,2μg/L
16,0% / 46,0%
filtro biológico/lodos ativados
Stumpf et al., 1999
50g/dia
15,5g/dia
69%
Ternes, 1998
58,0ng/L
30,6ng/L / 32,2ng/L
47,3% / 44,5%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
MBR / lodos ativados
Radjenovic et al., 2007
6,50μg/L
2,19μg/L / 1,54μg/L
66,3% / 76,3%
MBR / lodos ativados
Radjenovic et al., 2007
6,77μg/L
0,310μg/L
95%
Não disponível
Lee et al., 2005
0,50μg/L
0,01μg/L / 0,01μg/L /
0,01μg/L
98% / 98% / 98%
HMBR / CMBR / lodos
ativados
Kimura et al., 2004
0,04μg/L / 3,12μg/L
99,8% / 82,5%
MBR / lodos ativados
Radjenovic et al., 2007
<0,15μg/L a 1,05μg/L
(0,27μg/L)
50%
Não Disponível
Petrovic et al., 2006
0,30μg/L / 0,10μg/L
22% / 75%
17,8μg/L
Ibuprofeno
<0,15μg/L a 1,20μg/L
(0,54μg/L)
filtro biológico/lodos ativados
0,38μg/L
0,002μg/L a 0,081μg/L
250g/dia
Stumpf et al., 1999
Não disponível
1,000μg/L a 3,300μg/L
25,0g/dia
97,7%
90%
Buser et al., 1999
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Ternes, 1998
42
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Concentração Média no
Afluente da ETE
0,28μg/L
Concentração Média no
Efluente da ETE
0,18μg/L
0,11μg/L
% Remoção
Tipo de Tratamento
Referências
36%
Não disponível
Lee et al., 2005
0,06μg/L / 0,08μg/L
46,6% / 23,4%
MBR / lodos ativados
Radjenovic et al., 2007
1,00μg/L
0,27μg/L / 0,17μg/L
71% / 83%
filtro biológico/lodos ativados
Stumpf et al., 1999
15g/dia
3,75g/dia
75%
Ternes, 1998
1,6μg/L
0,37μg/L
76,9%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Não disponível
Ternes et al., 2000
4,3μg/L
0,66μg/L
84,7%
Não disponível
Ternes et al., 2000
7,5μg/L
0,75μg/L
90,0%
Não disponível
Ternes et al., 2000
100ng/L
40ng/L
60,0%
Segura et al., 2007
0,30μg/L
0,12μg/L / >27μg/L
58,7% / <10%
Gradeamento, coagulação e
sedimentação
MBR / lodos ativados
Metoprolol
380g/dia
64,6g/dia
83%
Mevastatina
<0,15μg/L a 1,25μg/L
(0,55μg/L)
<0,15μg/L a 0,85μg/L
(0,35μg/L)
36,4%
Indometacina
Iomeprol
Iopamidol
Iopromida
Levofloxacina
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Não Disponível
Radjenovic et al., 2007
Ternes, 1998
Petrovic et al., 2006
43
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Concentração Média no
Afluente da ETE
2,76μg/L
Concentração Média no
Efluente da ETE
0,82μg/L
150ng/L
% Remoção
Tipo de Tratamento
Referências
70%
Não disponível
Lee et al., 2005
0,00ng/L / 20,0ng/L /
50,0ng/L
100% / 86,6% / 66,7%
HMBR / CMBR / lodos
ativados
Kimura et al., 2004
0,51μg/L / 0,13μg/L
15% / 78%
filtro biológico/lodos ativados
0,08μg/L / 1,76μg/L
99,3% / 85,1%
MBR / lodos ativados
Radjenovic et al., 2007
49,5g/dia
66%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Ternes, 1998
0,1μg/L
0,1μg/L
0%
Lodos ativados
Bruchet et al., 2002
13,1μg/L
2,67μg/L
79,6%
Não disponível
0,45μg/L
0,03 μg/L / 0,34 μg/L
94,0% / 23,8%
MBR / lodos ativados
Huerta-Fontela et al.,
2007
Radjenovic et al., 2007
14,24μg/L
5,932μg/L
58,3%
Não disponível
5,30ng/L
0,93ng/L
82,4%
Não disponível
Huerta-Fontela et al.,
2007
Vasskog et al., 2006
39,0ng/L
230ng/L
4,02μg/L / 3,67μg/L
21,2ng/L / 87,9ng/L
89,7% / 90,6%
90,8% / 61,8%
MBR / lodos ativados
MBR / lodos ativados
Radjenovic et al., 2007
Radjenovic et al., 2007
Stumpf et al., 1999
0,60μg/L
Naproxeno
11,8μg/L
75g/dia
Nicotina
Ofloxacina
Paraxantina
Paroxetina
Pravastatina
44
Tabela 2.2 - Remoção de fármacos e drogas por diferentes sistemas de tratamento de efluentes, reportada na literatura (continuação).
Fármacos
e Drogas
Concentração Média no
Afluente da ETE
Concentração Média no
Efluente da ETE
% Remoção
<0,10μg/L a 0,38μg/L
(0,12μg/L)
<0,10μg/L a 0,52μg/L
(0,14μg/L)
0%
520g/dia
20,8g/dia
63,0ng/L
22,3ng/L / 26,9ng/L
<0,05μg/L a 0,85μg/L
(0,50μg/L)
Ranitidina
Sertralina
Propanolol
Propifenazona
Sulfametoxazol
Tilosina
Tipo de Tratamento
Referências
Não disponível
Petrovic et al., 2006
96%
Clarificação primária, aeração
com adição de cloreto ferroso
e clarificação secundária
Ternes, 1998
64,6% / 42,7%
MBR / lodos ativados
Radjenovic et al., 2007
<0,05μg/L a 0,45μg/L
(0,20μg/L)
60%
Não Disponível
Petrovic et al., 2006
0,30μg/L
0,02μg/L / 0,17μg/L
95% / 42,4%
MBR / lodos ativados
Radjenovic et al., 2007
2,1ng/L
1,5ng/L
28,6%
Não disponível
Vasskog et al., 2006
450ng/L
178ng/L / 200ng/L
MBR / lodos ativados
Radjenovic et al., 2007
<0,15μg/L a 0,96μg/L
(0,45μg/L)
<0,15μg/L a 0,80μg/L
(0,40μg/L)
Não Disponível
Petrovic et al., 2006
120ng/L
Gradeamento, coagulação e
sedimentação
Segura et al., 2007
255ng/L
Não disponível
300ng/L a 1500 ng/L
Não disponível
Hartig et al., 1998
Não disponível
0,06μg/L a 0,18μg/L
(0,12μg/L)
0,4μg/L
não detectado a 0,06μg/L
(0,03μg/L)
Não disponível
Desinfecção por
cloração ou UV
Hirsch et al., 1999
60,5% / 55,6%
11,1%
52,9%
Não disponível
Não disponível
75,0%
Yang et al., 2006
45
2.5. Fatores que Influenciam a Remoção de Micropoluentes Pelos Sistemas de
Tratamento
A remoção dos micropoluentes das águas residuárias durante o tratamento se dá por
mecanismos abióticos (como adsorção, volatilização) e/ou bióticos (Cirja et al., 2008). A
contribuição desses fatores está intrinsecamente relacionada às propriedades físicoquímicas do poluente e dos parâmetros de operação da estação de tratamento, sendo então
aspectos de grande relevância para a mineralização ou a remoção física desses compostos.
A literatura mostra que a adsorção e a biodegradação são os dois mais importantes
processos, e estão diretamente correlacionados à disponibilidade dos substratos aos
microorganismos degradadores de matéria orgânica (Clara et al., 2004; Joss et al., 2005).
A degradação abiótica é o grupo de processos de remoção em que os microorganismos não
estão envolvidos, como volatilização, oxidação por substâncias inorgânicas (como
oxigênio e cloro gasosos, e os íons Fe3+ e SO42-) e hidrólise química. Tais processos se
demonstraram menos eficientes quando comparados à biodegradação (Soares et al., 2006).
As principais características intrínsecas dos micropoluentes que afetam sua remoção nas
estações de tratamento são listadas abaixo.
2.5.1. Hidrofobicidade e Hidrofilicidade
Muitos dos micropoluentes encontrados no esgoto apresentam características hidrofóbicas,
que é a característica principal ao se considerar a adsorção pelo lodo dos sistemas de
tratamento biológico (Garcia et al., 2002). Assim, após serem adsorvidos, os
micropoluentes são removidos no processo de retirada de excesso de lodo dos sistemas
biológicos (Cirja et al., 2008). A adsorção de substâncias orgânicas pode ser estimada
usando valores de Kow (coeficiente de partição octanol-água), que reflete o equilíbrio de um
soluto nas fases orgânica (hidrofóbica, no caso o lodo), e aquosa (hidrofílica): quanto
maior for essa constante para determinado composto, maior o potencial de ele ser
encontrado adsorvido.
Carballa et al. (2004) estudou a remoção de alguns fármacos que apresentam
características hidrofóbicas (ex: diazepan, diclofenaco), e concluiu que ela se dá
principalmente pela adsorção desses compostos no lodo presente no biorreator. A
46
eficiência de remoção variou entre 40% e 60%. A adsorção ainda é mais evidente em um
tratamento primário que objetivava a remoção de gorduras, onde as propriedades
hidrofóbicas dos micropoluentes levaram à remoção de até 50%.
Em um estudo posterior (Carballa et al., 2005), foram comparadas as eficiências de
remoção de compostos apolares (galaxolida e tonalida) com as de fármacos de
características mais polares (diclofenaco, ibuprofeno, diazepan e carbamazepina). Foi
concluído que a alta adsorção dos compostos mais apolares levou a uma remoção até de
70%, ao passo que não foi observada qualquer diminuição de concentração dos compostos
mais polares (carbamazepina e ibuprofeno).
2.5.2. Estrutura Química dos Micropoluentes
A estrutura química e a composição elementar de um composto influenciam grandemente
suas taxas de remoção durante o tratamento (Cirja et al., 2008).
É notável que estruturas complexas, presentes, por exemplo, em alguns fármacos
(cetoprofeno e naproxeno), apresentem baixas eficiências de remoção, sobretudo em
sistemas de tratamento convencionais (Kimura et al., 2005). A presença de anéis
aromáticos nas estruturas dessas substâncias as torna recalcitrantes ao tratamento,
principalmente aqueles que empregam metabolismo anaeróbio. Assim também acontece
com moléculas que contêm átomos de cloro (diclofenaco, ácido clorifíbrico) (Kimura et
al., 2005) ou grupos nitro ligados a anéis aromáticos (Andreozzi et al., 2006).
No geral, a estrutura química de um poluente é um bom indício sobre sua degradabilidade
ou persistência no meio ambiente. Um composto simples, como por exemplo, uma cadeia
alquílica curta, é passível de ter uma boa remoção por um sistema de tratamento. Por outro
lado, compostos mais complexos ou que contenham grupos tóxicos (halogênios, por
exemplo) persistem em solução ou adsorvidos no lodo, seja como derivados ou metabólitos
incompletamente degradados (Cirja et al., 2008), que podem apresentar até mesmo maior
risco ambiental do que o poluente do qual foram sintetizados. Como exemplo, os LAS que
apresentam longas cadeias alquídicas são preferencialmente encontrados adsorvidos no
lodo, enquanto os homólogos menores desse surfactante aniônico se posicionam em maior
concentração no efluente (Terzic et al., 2005).
47
2.5.3. População Microbiana
A natureza da população microbiana é uma importante variável na remoção dos compostos
orgânicos nos sistemas de tratamento. Bactérias heterotróficas (Rhodococcus erythropolis)
foram isoladas do lodo ativado de sistemas de tratamento por Yoshimoto et al. (2004) que
concluíram que essa espécie é capaz de degradar rapidamente altas concentrações
(100mg/L) de estrógenos naturais e sintéticos. O gênero Novosphingobium é conhecido por
incluir várias espécies capazes de assimilar compostos resistentes à biodegradação (Koh et
al., 2008). As espécies Rhodococcus equi e Rhodococcus zopfi foram pesquisadas por
Yabuuchi et al. (1990), que mostraram rápida degradação do estrógeno etinil estradiol
(estradiol a 100mg/L para 1/100 de atividade específica, em 24 horas).
Koh et al. (2008) enfatizam que a cultura de cepas conhecidas por degradarem poluentes
recalcitrantes e a introdução delas em sistemas de tratamento de efluentes pode reduzir a
emissão dessas substâncias no meio ambiente. Conhecendo a diversidade microbiana e
melhorando a atividade degradadora, pode-se chegar à completa mineralização de uma
gama de poluentes que ainda são despejados via ETEs. No entanto, ainda são necessários
estudos que visam os mecanismos de degradação e identificação de metabólitos, visando
estabelecer novos processos e características do tratamento a serem aplicados nas ETEs.
2.5.4. Idade do Lodo
Vários estudos atestam a importância da idade do lodo suficientemente alta para a remoção
dos micropoluentes das águas residuárias (Terzic et al., 2005; Ivashechkin et al., 2004,
Kloepfer et al., 2004), bem como para o crescimento e diversificação da comunidade
microbiana. O aumento da idade acarreta a diminuição de lodo que necessita ser retirado
do sistema; logo uma maior quantidade de micropoluentes de baixa polaridade permanece
para degradação, o que aumenta a eficiência da planta de tratamento (Byrns, 2001). Além
disso, em idades de lodo avançadas, a possibilidade de mutação genética e adaptação dos
microorganismos são maiores, fatores importantes para a assimilação, e conseqüente
degradação, de compostos orgânicos persistentes pelos microorganismos.
Outro aspecto importante é quando se tem a idade do lodo avançada é que
microorganismos mais específicos em remover compostos de difícil degradação podem se
desenvolver adaptar melhor (Koh et al., 2008).
48
2.5.5. Valor de pH
O potencial hidrogeniônico do meio a ser tratado interfere na eficiência, uma vez que
influencia o metabolismo dos microorganismos (pH ótimo para as atividades enzimáticas
microbianas), bem como a solubilidade dos micropoluentes. Dependendo dos valores de
pKa (log da constante de acidez Ka) e das estruturas, os poluentes podem existir em
diferentes estados de protonação no meio aquático, o que influencia na solubilização dos
mesmos. Valores baixos de pH ocasionam boas taxas de remoção de micropoluentes de
caráter ácido, uma vez que favorece a protonação e, conseqüentemente, a adsorção no lodo
(Cirja et al., 2008).
2.5.6. Temperatura do Sistema
A variação climática e temperatura ambiente afeta na remoção dos poluentes pelas ETEs.
O aumento da temperatura acelera a atividade e crescimento microbiano, bem como
diminuiu o tempo para o equilíbrio químico na adsorção pelo lodo ser estabelecido (Ten
Hulscher e Cornelissen, 1996 apud Cirja et al., 2008). O estudo de Lapara et al. (2001)
demonstrou também que altas temperaturas é um fator que pressiona o desenvolvimento
seletivo da comunidade bacteriana, aumentando, portanto, a biodegradação dos poluentes.
Nakada et al. (2006) observaram que a diferença na remoção de estradiol em diferentes
estações do ano no Japão chega a 17% (70% de remoção no inverno, contra 87% no
verão). Ternes et al. (1998) observaram que a remoção de estradiol em uma estação de
tratamento de efluentes da Alemanha (média de 2ºC durante o período de amostragem) é
de 64%, enquanto no Brasil (média de 20º durante a amostragem) a remoção desse
estrógeno chega a 99,9%. Koh et al. (2008) observam que a variação na temperatura pode
ter efeitos significantes na remoção de poluentes dos efluentes, e estudos mais
aprofundados são necessários para discriminar a influência da variação de temperatura, de
outros fatores, como a atividade microbiana por exemplo.
2.6. Técnicas de Preparo de Amostras e Análise de Micropoluentes
Recentemente, a comunidade científica se alertou para os problemas decorrentes da
presença de poluentes de origem antropogênica no meio ambiente. Assim, houve grande
crescimento no desenvolvimento de novas técnicas analíticas e protocolos para a extração,
identificação e quantificação dos mesmos em amostras ambientais (Barceló, 2007). O
49
desenvolvimento de técnicas inovadoras de extração e concentração dos compostos, que
substituem a tradicional extração líquido – líquido (LLE), combinadas à análise em
equipamentos de alta resolução, como os cromatógrafos gasosos acoplados à
espectrômetros de massas (GC-MS), têm fortemente contribuído para o rastreamento de
poluentes no meio-ambiente, em concentrações na faixa de μg/L. Segundo Barceló (2007),
a dificuldade da determinação multicomponente de contaminantes orgânicos ambientais é
dificultada pelo maior número de compostos a serem monitorados, e a demanda por
equipamentos de grande sensibilidade. A cromatografia fornece uma ferramenta única para
análises desse tipo, uma vez que as matrizes são extremamente complexas e contêm muitas
classes diferentes de compostos em quantidades variadas. As maiores dificuldades
encontradas nesses trabalhos são a separação entre as matrizes e contaminantes de
interesse, o alcance de baixos limites de detecção e a identificação dos micropoluentes
desconhecidos.
Tradicionalmente, a utilização de equipamentos GC-MS nessa área é preferencial e
rotineira desde os anos setenta (Barceló, 2007). Nos últimos vinte anos, a ciência da
química analítica ambiental se tornou mais exigente, procurando por quantidades cada vez
menores de uma crescente gama de novas substâncias emergentes, incluindo substâncias
termo-instáveis, incapazes de serem analisadas em cromatógrafos gasosos. Então surgiu,
no campo da análise ambiental, a necessidade de técnicas que fundiam a cromatografia
líquida à espectrometria de massas (LC-MS), que foi aplicada, inicialmente a regiões
altamente contaminadas, uma vez que os instrumentos apresentavam altos limites de
detecção ou quantificação. Essas novas capacidades analíticas ampliaram a área do
conhecimento ambiental, bem como descentralizaram as preocupações dos cientistas,
focados apenas no pequeno conjunto dos macropoluentes, voltando a pesquisa, também,
para os micropoluentes.
Cabe destacar que o início de qualquer procedimento analítico de contaminantes
ambientais envolve etapas de purificação e concentração das amostras, as quais visam a
diminuição de interferências das matrizes, bem como a detecção mais eficaz dos
compostos de interesse pelos equipamentos analíticos utilizados.
50
2.6.1. Técnicas de Extração
As técnicas de extração e concentração de micropoluentes podem ser agrupadas em dois
grupos principais, extração líquido-líquido e extração em fase sólida (SPE). Na extração
líquido-líquido, determinado volume de amostra aquosa (ex. 500 mL) é colocado em
contato com alíquotas de solvente imiscível em água (ex. 3 alíquotas de 50 ml de acetato
de etila) em um funil de extração e agitada por determinado tempo. Após o tempo de
agitação a mistura heterogênea é deixada em repouso e a fase orgânica recuperada. Por sua
vez, a extração em fase sólida consiste em passar certo volume de amostra (ex. 500 mL)
através de um cartucho que contém uma substância adsorvente com capacidade de remover
da fase aquosa o composto de interesse. Existem diversos tipos de adsorvente, os quais se
diferenciam pela polaridade e, conseqüentemente, pelas substâncias que se ligam ao meio
suporte que os constitui. Após a passagem da amostra aquosa, utiliza-se então um solvente
orgânico (ou combinação de vários, em diferentes proporções) para eluir (ou dessorver) o
contaminante de interesse do cartucho de extração.
A Tabela 2.3 mostra que aproximadamente 67% dos artigos revisados para a elaboração
desse trabalho utilizaram a extração em fase sólida (SPE) associadas a procedimentos de
clean-up. De fato, tal técnica é consolidada no preparo de amostras ambientais, pela sua
alta eficiência de recuperação, facilidade de operação e uso de pequenos volumes de
solventes orgânicos.
51
Tabela 2.3 - Número de substâncias extraídas por cada método, nos trabalhos revisados.
Número de Substâncias
% de Utilização
Técnica de Extração
1
Extraídas e Detectadas
da Técnica
Extração líquido-líquido (LLE)
19
12,1
Extração em fase sólida (SPE)
106
67,5
Outras2
32
20,4
Total
157
100
1-Número que engloba o número de vezes que os analitos aparecem na totalidade dos artigos revisados.
2-Dentre outras técnicas de extração encontram-se a extração assistida por ultra-som, micro extração em fase
sólida, headspace estático e extração por purge-and-trap.
Após a extração e concentração, os extratos orgânicos são então analisados, geralmente,
em cromatógrafos a gás ou de fase líquida acoplados a espectrômetros de massas. A
característica química do microcontaminante definirá qual das técnicas será apropriada
para sua análise.
2.6.2. Técnicas de Separação Cromatográfica e Detecção por Espectrometria de
Massas
Das diversas técnicas analíticas existentes para a determinação de fármacos, produtos de
limpeza e de higiene pessoal, destacam-se àquelas que empregam cromatógrafos de fase
líquida ou de fase gasosa acoplados a detectores de massas, os quais oferecem seletividade,
sensibilidade e robustez para as análises ambientais.
A técnica de cromatografia gasosa é utilizada na análise de substâncias termoestáveis e
voláteis ou passíveis de derivatização (que consiste na reação da amostra com um reagente
específico, resultando em um derivado de maior volatilidade). No cromatógrafo a gás, a
fase móvel é um gás que arrasta a mistura de micropoluentes através da coluna
cromatográfica onde a separação dos compostos é feita com base no ponto de ebulição e na
diferença das afinidades dos analitos com a fase estacionária da coluna.
Por sua vez, o cromatógrafo de fase líquida é usado na separação de analitos menos
voláteis, ou que podem ou não sofrer degradação quando submetidos a altas temperaturas.
Solventes líquidos (fase móvel) transportam os analitos através de uma coluna
cromatográfica, onde ocorre a separação pelas diferenças das afinidades dos analitos entre
52
a fase estacionária, que caracteriza a coluna, e a fase móvel. Em ambas as técnicas, após a
separação na coluna cromatográfica, os compostos são detectados separadamente e
quantificados, em detector específico.
Dentre os detectores para a cromatografia destaca-se o espectrômetro de massas. A
espectrometria de massas é, de fato, uma poderosa técnica analítica, que se encaixa em
pesquisas de substâncias orgânicas de qualquer natureza, desde pequenas moléculas, como
metano e ácidos de cadeia curta, a enormes proteínas. Existem diversos analisadores de
massa, que são basicamente sistemas capazes de separar, com base nas relações entre a
massa e a carga (m/z) dos contaminantes, os íons formados pelos analitos durante uma
etapa de ionização.
Os espectros de massas geram informações úteis sobre a massa molecular e a estrutura dos
analitos, podendo ajudar na elucidação de compostos desconhecidos. A sensibilidade da
técnica, a formação de aglomerados (ou adducts) com íons de tampões, amostra e fase
móvel, e as fragmentações geradas dependerão da fonte de ionização das amostras, que
variam de acordo com o modelo do equipamento utilizado. Em sistemas de cromatografia
de fase gasosa os sistemas espectrometria de massas mais usados são ionização por
elétrons (EI) e ionização química (CI). Os sistemas de ionização mais difundidos em
cromatografia de fase líquida são a ionização por elétron spray (ESI) e a ionização química
à pressão atmosférica (APCI), as quais são escolhidas de acordo com as propriedades
físico-químicas dos analitos, principalmente polaridade e acidez, sobre ionização positiva
ou negativa (Barceló, 2007). O uso de sistemas de fragmentações consecutivas dos íons
formados (MS/MS) é importante em casos onde alguns compostos sofrem co-eluição. Logo
as fragmentações de íons gerados nesses equipamentos ajudam na identificação inequívoca
dos compostos. A Tabela 2.4 apresenta as técnicas de detecção utilizadas nas pesquisas dos
micropoluentes encontrados com maior freqüência nos trabalhos revisados.
53
Tabela 2.4 - Utilização de técnicas analíticas para alguns micropoluentes mais
freqüentemente encontrados por estudos sobre sistemas de tratamento de esgoto doméstico
(% em relação ao total de artigos revisados).
CLASSE
Fármaco
Produto de limpeza
Produto de higiene pessoal
MICROPOLUENTE
MÉTODO DE DETECÇÃO E
QUANTIFICAÇÃO (%)
GC-MS
LC-MS
Ácido Clorifíbrico
Cetoprofeno
Diclofenaco
Eritromicina
Gemfibrozil
75
50
66,7
0
75
25
50
33,3
100
25
Ibuprofeno
Indometacina
Naproxeno
Nonilfenol
LAS
Bactericidas
Bifenilol
Fragrâncias
Corantes
66,7
75
80
50
0
85
0
100
100
33,3
25
20
50
100
15
100
0
0
A partir da análise dos dados apresentados na Tabela 2.4, percebe-se que a técnica de GCMS é preferencial na análise de micropoluentes em águas residuárias, em relação à LC-MS.
A técnica de cromatografia gasosa acoplada à espectrometria de massas esbarra em
algumas limitações, como a necessidade de os compostos estudados serem voláteis, ou
passíveis de reações de derivatização, o que impede que substâncias de maior massa molar
sejam analisadas. A técnica de LC-MS é muito mais abrangente, uma vez que possibilita a
análise de compostos não-voláteis e de massa molar maior, mas se depara com um número
maior de variáveis para sua operação. Algumas delas são as energias de ionização e do gás
de colisão, tempos de acumulação iônica, rígido controle de temperatura para a
dessolvatação da amostra, fluxo bem definido para o gás de secagem da amostra, posição
entre a agulha de ionização e o orifício de entrada da amostra, entre outros. Essas
dificuldades geram a necessidade de técnicos com maior grau de especialização para
operar esse tipo de equipamento de análise instrumental.
Bobeldijk et al. (2001) cita que a cromatografia gasosa acoplada à espectrometria de
massas é amplamente utilizada nas pesquisas de micropoluentes apolares desconhecidos. A
identificação é, então, realizada pela comparação dos espectros de massas da amostra com
54
bibliotecas ou pela interpretação de padrões de fragmentação. Já para compostos semipolares e polares, são utilizados cromatógrafos líquidos acoplados a espectrômetros de
massas em série (tandem LC-MS/MS), mas a inexistência de bibliotecas de massas para
essa técnica dificulta a elucidação dos compostos desconhecidos.
55
3. Materiais e Métodos
3.1. O Sistema de Tratamento UASB/FBP
A área de estudo está localizada na Estação de Tratamento de Esgotos Arrudas da cidade
de Belo Horizonte, Minas Gerais, onde se situa o Centro de Pesquisa e Treinamento em
Saneamento (CePTS) da UFMG. O sistema de tratamento de esgotos investigado consiste
de um reator de leito de lodo anaeróbio de fluxo ascendente (UASB), seguido de um reator
aeróbio do tipo filtro biológico percolador (FBP), como unidade de pós-tratamento, ambos
dimensionados para o tratamento de esgotos de uma população correspondente a 500
habitantes. Os esgotos afluentes ao sistema são provenientes do tratamento preliminar da
ETE Arrudas, composto por unidades de gradeamento e desarenação.
3.1.1. Reator UASB
O reator UASB (Figura 3.1a), construído em escala piloto, possui dimensões de 4,5m de
altura e diâmetro de 2,50m, com um volume útil de 22,1m³. Durante o projeto, tal reator foi
operado nas seguintes condições: vazão de 2,88m³/h, tempo de detenção hidráulica de
aproximadamente 7 horas, velocidade ascensional de 0,65m/h e carga orgânica volumétrica
de 1,74 kgDQO/m³.d (Almeida et al., 2007a).
3.1.2. Filtro Biológico Percolador
Os efluentes do reator UASB eram encaminhados para um filtro biológico percolador
(Figura 3.1b), dividido em quatro compartimentos, cada qual preenchido com um diferente
material suporte (Figura 3.2): aparas de conduíte corrugado (diâmetro de 1”), pedra
britada, anéis plásticos e o sistema Downflow Hanging Sponge (DHS). Nessa pesquisa, foi
avaliada apenas a degradação do esgoto que percola por dois deles: o revestido com pedra
britada e o com aparas de conduíte corrugado, ambos dispostos aleatoriamente em seus
devidos compartimentos.
As dimensões do FBP são: diâmetro igual a 2,10m e altura, 2,50m. Cada compartimento
apresenta, então, 0,86m² de área e volume correspondente a 2,16 m³. O efluente do reator
UASB era despejado no FBP através de um braço rotativo motorizado, e o efluente de cada
compartimento do filtro era lançado em decantadores secundário para a retenção de
biomassa que escapa do FBP (Almeida et al., 2007a).
56
(a) Reator UASB
(b) Filtro Biológico Percolador e
Decantadores
Figura 3.1 - Reatores que compõem a ETE experimental em estudo. (a) Reator UASB e
(b) FBPs. Fonte: Tavares, 2008.
Figura 3.2 - Filtro biológico percolador, dividido em quatro compartimentos, preenchidos
com diferentes meios suportes para crescimento microbiano. Um braço giratório despeja o
efluente do reator UASB a ser tratado. Fonte: Tavares, 2008.
3.2. Amostragem
Um litro de amostra foi coletado de cada um dos pontos de amostragem, de maneira
pontual, mensalmente, no período de fevereiro de 2007 a janeiro de 2008, exceto no mês
de junho de 2007. A Figura 3.3 ilustra o sistema de tratamento de efluentes e os pontos de
57
coleta de amostras. Bombas peristálticas acopladas diretamente aos pontos de amostragem
coletavam amostras de esgoto bruto (ponto A), efluente do reator UASB (ponto B) e os
efluentes dos compartimentos do FBP preenchidos com as aparas de conduíte (ponto C1) e
com a pedra britada (ponto C2). As amostras foram armazenadas em frascos de
polipropileno e congeladas a -20°C, a fim de preservá-las até o momento da filtração e
extração.
O filtro biológico percolador operou, durante as campanhas de amostragem, com duas
diferentes taxas de aplicação superficial, a fim de atender os parâmetros necessários para o
estudo de Almeida (2007b). Nos períodos de fevereiro a maio de 2007, e novembro de
2007 a fevereiro de 2008, a taxa de aplicação superficial foi igual a 10m3/m2.d, enquanto
no período de julho a outubro de 2008, 15m3/m2.d. A Tabela 3.1 mostra a data de coleta
das amostras e as condições operacionais de cada um dos reatores biológicos.
Ponto de amostragem do
efluente do reator UASB (B)
Ponto de
amostragem do
esgoto bruto (A)
Ponto de amostragem do
efluente final (C1 e C2) – após
decantador
Tratamento
preliminar
Reator
UASB
Filtro
biológico
percolador
Figura 3.3 - Fluxograma esquemático do sistema UASB/FBP utilizado como aparato
experimental. Fonte: Almeida, 2007a.
58
Tabela 3.1 - Dados das amostragens a e fases operacionais do sistema de tratamento de
efluentes em estudo.
Campanha da Coleta Data da Coleta TAS (m3/m2.d) COV (KgDBO/m3.d)
1
28/2/2007
10
0,24
2
12/3/2007
10
0,24
3
9/4/2007
10
0,24
4
21/5/2007
10
0,24
5
23/7/2007
15
0,4
6
13/8/2007
15
0,4
7
15/10/2007
15
0,4
8
19/11/2007
10
0,24
9
10/12/2007
10
0,24
10
14/1/2008
10
0,24
11
18/2/2008
10
0,24
3.3. Preparo das Amostras e Extração dos Analitos
Após serem descongeladas, as amostras foram filtradas em membrana de fibra de vidro
(diâmetro de poros igual a 0,45μm), a fim de remover todo o material particulado
proveniente da estação de tratamento, evitando, assim, entupimentos nas tubulações do
equipamento de análise por partículas.
Volumes iguais a 300 mL de cada amostra passaram em cartuchos de extração em fase
sólida do tipo C18 (3mL, 500mg), utilizando um manifold e bomba de vácuo, em fluxo de
5mL/min. Em seguida, os compostos foram eluídos dos cartuchos com duas diferentes
soluções: 3mL da solução A (n-hexano:diclorometano-1:4) e 5mL da solução B
(metanol:diclorometano-9:1). Os eluatos foram secados com nitrogênio gasoso, e a amostra
foi reconstituída com metanol, para o volume de 1,0mL. Em 200μL dessa solução, foram
adicionados 100μL de uma solução de fenolftaleína (1mg/L, padrão interno) e a mistura foi
diluída em metanol, para o volume final de 1,0mL. O fluxograma dos procedimentos de
59
pré-tratamento e extração das amostras é mostrado na Figura 3.4, e a Figura 3.5 ilustra o
aparato utilizado na extração em fase sólida.
300mL de amostra
Filtração em membrana 0,45μm
Extração SPE (C-18)
Eluição com 3mL de A +5 mL de B
Secagem (N2)
Reconstituição com metanol
Adição de padrão interno e diluição
Figura 3.4 - Fluxograma das etapas de preparo das amostras, anterior à análise no HPLCMS-IT-TOF.
Figura 3.5 - Montagem utilizada no processo de extração em fase sólida dos
micropoluentes das amostras de esgoto.
3.4. Reagentes, Consumíveis e Equipamento Instrumental
Água ultra-pura foi adquirida através de um sistema de troca iônica (TKA
Wasseraufbereitungssysteme, Alemanha). Metanol grau HPLC (Vetec, Rio de Janeiro,
Brasil) foi usado como modificador de polaridade da fase móvel e para a eluição dos
60
compostos adsorvidos nos cartuchos de extração em fase sólida. Na eluição, também foram
utilizados n-hexano grau HPCL (Vetec) e diclorometano grau HPLC (Vetec).
Para a extração e clean-up das amostras, foram usados um manifold (Phenomenex),
cartuchos C18-E (Strata, Phenomenex), e para a separação cromatográfica, foi utilizada
uma pré-coluna C18 (4,0cm x 3,0mm x 3,2µm, Phenomenex). A secagem dos cartuchos e
das amostras foi realizada com nitrogênio (White Martins - Praxair).
Para a análise dos compostos, utilizou-se um cromatógrafo líquido de alta performance
acoplado a um espectrômetro de massas híbrido (HPLC-MS-IT-TOF), o qual consome
nitrogênio líquido (White Martins – Praxair) como gás de nebulização e secagem, e
argônio (99,9999% de pureza, White Martins - Praxair) para a colisão induzida e
diminuição da energia cinética dos íons.
O cromatógrafo líquido de alta performance consiste em um sistema Prominence, equipado
com bombas binárias, modelo LC-20AD (Shimadzu Corp., Quioto, Japão) e um
amostrador automático modelo SIL 20AC (Shimadzu Corp). O volume de amostra injetado
foi de cinco microlitros, e o fluxo da fase móvel igual a 0,2mL min-1. As fases móveis
utilizadas foram (A) água e (B) metanol, adotando-se o seguinte gradiente: de 0% de B a
80% de B em 5 minutos; 80% de B isocrático- por 7 minutos; de 80% de B a 100% de B
em 10 minutos; 100% de B por 8 minutos. No lugar de uma coluna cromatográfica
convencional, utilizou-se apenas uma pré-coluna C-18 (Phenomenex), ligada diretamente à
interface do equipamento, para a separação dos analitos analisados (Figura 3.6).
Figura 3.6 - Pré-coluna cromatográfica diretamente acoplada à fonte de ionização por
electronspray (ESI).
61
A interface entre o HPLC e o espectrômetro de massas consiste em uma fonte de ionização
por electronspray (modo negativo: -3,5 kV; modo positivo: +2,5kV); fluxo de gás
nebulizador- N2- igual a 1,5L/min; pressão do gás de secagem - N2 - igual a 100 kPa e
temperatura do CDL igual a 200°C). O tempo de acumulação iônica no octapolo foi
definido como 10ms. Os espectros MS e MS/MS foram adquiridos simultaneamente nos
modos negativo e positivo de ionização, na faixa de 90 m/z a 1000 m/z, para o modo
fullscan, e experimentos MS2 com colisão induzida por argônio, para a obtenção de
fragmentações, foram feitos subseqüentemente. Para a busca de compostos previamente
especificados (compostos-alvo) e elucidação estrutural, foi utilizado o modo MS2 (sem
colisão induzida por argônio), com a faixa de m/z otimizada para cada um dos íons
monitorados, o que aumenta a sensibilidade instrumental, necessária nesse caso, uma vez
que os compostos-alvo estão presentes em pouca quantidade nas amostras.
Para a aquisição de dados do espectrômetro de massas, foi utilizado o programa de
computador LabSolutions/LCMS Real Time Analisys (versão 3.41, Shimadzu Corporation).
As predições das fórmulas moleculares foram realizadas usando-se o programa Formula
Predictor (versão 1.12, Shimadzu Corporation) e os cálculos para as massas exatas foram
realizados com o programa Accurate Mass Calculator (versão 1.12, Shimadzu
Corporation). A análise de componentes principais foi realizada usando os programas
Multivariate Analysis (versão 1.3), Minitab (versão 14.13, Minitab Inc.) e Microsoft Excel
(versão 11.0, Microsoft Corporation).
Fluxo
Interface ESI
Bomba A
Fase móvel A
Misturador
Pré-coluna
LCMS-IT-TOF
Bomba B
Injetor Automático
Fluxo
Fase móvel B
Figura 3.7 - Esquema simplificado do equipamento HPLC-MS-IT-TOF. Adaptado de
Shimadzu Corporation, 2007.
62
O modo MS2 do espectrômetro de massas pode ser utilizado de duas formas diferentes,
com relação à colisão induzida por argônio (CID). Quando é feita uma análise com esse
parâmetro desligado, a câmara do Ion Trap não é preenchida com argônio. Nesse modo, o
operador seleciona o íon molecular (ou íons moleculares) de interesse, o qual é, por rádiofreqüência, separado dos demais nesse analisador de massa e é então lançado ao Time-ofFlight para medição de seu tempo de vôo e subseqüente detecção. Tal estratégia é
conhecida como “seleção do íon precursor”. Por outro lado, em experimentos MS2 com a
colisão por argônio habilitada, o íon selecionado é separado da mesma forma como
explicado anteriormente. Entretanto, antes da extração para o Time of Flight, um fluxo
pulsante de argônio altamente energético é bombardeado no Ion Trap, com o intuito de
conduzir colisões no íon precursor, que se fragmenta caracteristicamente, de acordo com
sua estrutura molecular específica. Os fragmentos são usados, então, pelos analistas na
tentativa da elucidação da fórmula molecular de um composto desconhecido, ou como
método de confirmação estrutural, dentre outras aplicações.
3.4.1. Metodologia Analítica: Aquisição dos Espectros Totais (fingerprint)
Os experimentos foram executados com a faixa de obtenção dos espectros de 90m/z a
1000m/z, simultaneamente nos modos negativo e positivo de ionização. Os espectros das
amostras
foram
obtidos
em
modo
contínuo
e
processados
pelo
programa
LabSolutions/LCMS Real Time Analisys. As massas das moléculas protonadas (modo
positivo) e desprotonadas (modo negativo) foram determinadas e utilizadas como dado de
entrada no programa Formula Predictor, como base para o cálculo de todas as
composições elementares dos micropoluentes desconhecidos. Os parâmetros configurados
para os cálculos foram C: 0 a 50, H: 0 a 100, N: 0 a 20, O: 0 a 20, F: 0 a 20 e P: 0 a 3. O
parâmetro ligações duplas equivalentes (DBE), que informa sobre a aromaticidade e
insaturações das estruturas, foi configurado como -0,5 a 50 (valores padrão).
Como é grande a quantidade de substâncias presentes nos extratos de amostras de esgoto
domestico, uma análise de componentes principais dos espectros foi realizada utilizando os
softwares Multivariate Analysis e Minitab. Apenas as relações massa/carga que obtiveram
o valor da primeira componente principal (PC1-principal component 1) maior ou igual a
0,05 foram selecionados para a interpretação dos espectros e tentativa de elucidação da
63
fórmula molecular e estrutural. A Figura 3.8 mostra o cromatógrafo líquido acoplado a
espectrômetros de massas utilizados para essa pesquisa.
Figura 3.8 - Cromatógrafo líquido acoplado aos espectrômetros Ion-Trap e Time-of-Flight
(HPLC-MS-IT-TOF).
Para os íons de estruturas desconhecidas, o programa Formula Predictor realizou o cálculo
das percentagens de isótopos teóricos para todas as possíveis composições elementares, e
as comparou com as obtidas experimentalmente. Para diminuir ainda mais a quantidade de
fórmulas possíveis para tais compostos e se chegar mais facilmente a uma conclusão da
fórmula molecular exata, foram feitos experimentos MS2 e os fragmentos obtidos foram
levados em consideração pelo programa para o cálculo. O erro aceitável entre os valores de
m/z teóricos e experimentais para todos os compostos foi fixado como 50mDa.
De posse de algumas fórmulas possíveis para cada uma das massas, a composição
elementar foi pesquisada em bancos de dados, como Merck Index e NIST, a fim de se
chegar a uma fórmula molecular ou estrutura química plausível para cada um dos íons.
Alguns compostos não puderam ser identificados com precisão, mas detalhes das possíveis
estruturas foram obtidos e são citados.
64
3.4.2. Metodologia Analítica: Detecção de Compostos Específicos
Os compostos bezafibrato, bisfenol A, dibutilftalato e nonilfenol foram selecionados para
uma análise semi-quantitativa, calculando-se as concentrações relativas a um padrão
interno (fenolftaleína) e, assim, acompanhar a degradação que ocorre no sistema de
tratamento de efluentes domésticos UASB-FBP. Para isso, foram executados experimentos
em um cromatógrafo líquido de alta performance acoplado a um espectrômetro de massas
híbrido (LC-MS-IT-TOF), no modo MS2, os quais focalizaram a análise apenas nos íons
correspondentes aos compostos pré-selecionados. Foram realizados experimentos MS2
com o parâmetro de fragmentação habilitado, mas os resultados se mostraram
insatisfatórios, provavelmente pela baixa concentração dos poluentes nas amostras. A
Tabela 3.2 mostra as relações m/z utilizadas para cada um dos compostos.
SUBSTÂNCIA
RELAÇÕES m/z UTILIZADAS
NO MODO MS2
Nonilfenol
219,1731
Dibutilftalato
277,1494
Bezafibrato
360,1063
Bisfenol A
227,1060
2
Tabela 3.2 - Substâncias-alvo analisadas no modo MS do espectrômetro de massas, e seus
íons moleculares, no modo de ionização negativo.
3.5. Tratamento Quimiométrico de Dados
As técnicas de estatística convencionais, muitas vezes não são suficientes para fornecer as
informações necessárias sobre um conjunto de amostras, principalmente quando existe um
número grande de informações, como é o caso dos espectros de massas. Ao se comparar
espectros fullscan de diversas amostras, obtém-se um número muito grande de dados
(nesse estudo, a compilação dos dados obtidos na análise de todas as amostras gerou uma
matriz composta por 40 colunas e 586 linhas), o que dificulta a percepção de conclusões.
Usando técnicas estatísticas avançadas, denominadas métodos quimiométricos, é possível
comparar essas amostras, de forma a se chegar a conclusões sobre o comportamento de
uma amostra, ou um grupo de amostras, em relação às outras. O tratamento quimiométrico
dos dados reduz o número de variáveis e, então, a matriz original é utilizada na construção
65
de gráficos de duas ou três dimensões, mais simples de serem analisados, através dos quais
se obtém conclusões em relação à similaridade amostral.
No presente trabalho, o método quimiométrico utilizado foi a Análise por Componentes
Principais (PCA), técnica exploratória, uma vez que as conclusões sobre as amostras são
tiradas de dados coletados (no caso, espectros fingerprint coletados pelo espectrômetro de
massas). A Análise por Componentes Principais consiste em reorganizar os dados
provenientes das amostras em um sistema de eixos conveniente e simplificado para a
análise dos dados. As n-variáveis originais geram “n-componentes principais”, vetores que
as representam e são obtidos em ordem decrescente de máxima variância. Isso quer dizer
que a primeira componente principal detém mais informações estatísticas do que a segunda
componente principal, que por sua vez, traz consigo mais informação estatística do que a
terceira componente principal, e assim por diante.
Geralmente, o que é feito é tomar para a análise de dados apenas a primeira e a segunda
componentes principais, as quais, muitas vezes, detêm mais de 90% das informações
estatísticas, reduzindo o número de variáveis e simplificando, assim, a análise. O gráfico
que se obtém plotando a primeira componente principal e a segunda componente principal
fornece, estatisticamente, uma janela privilegiada estatisticamente para a observação dos
pontos no espaço n-dimensional (Souza, 2008). Na PCA, a matriz original é convertida em
um produto de duas matrizes: a matriz de Scores, associada à relação existente entre as
amostras, e a matriz de Loadings, associada à relação existente entre as variáveis (Neto e
Moita, 1998). Na forma matricial, representa-se a Equação 1:
X= S*LT
(Equação 1)
sendo X a matriz original, S a matriz dos Scores e LT a matriz dos Loadings transposta,
como ilustrado na Figura 3.9.
Figura 3.9 - Representação matricial da operação realizada no cálculo de componentes
principais. Fonte: Souza, 2008.
66
Onde “a”, representado em linhas, são as amostras na matriz S de Scores e “v”,
representado em colunas, são as variáveis da matriz L de Loadings. “CP” são as
componentes principais.
Em síntese, tem-se:
o gráfico de Scores fornece uma relação entre as amostras;
o gráfico de Loadings fornece uma relação entre as variáveis;
na maioria dos casos, duas a três componentes principais representam mais de 90% das
informações estatísticas e torna a análise simplificada.
Nesse estudo, a análise de componentes principais foi, em um primeiro momento, usada
para julgar a importância das variáveis originais escolhidas (Loadings-relações m/z)
quando suas duas primeiras componentes principais são combinadas linearmente,
destacando os íons mais relevantes do ponto de vista estatístico. Posteriormente, a matriz
dos Scores foi calculada e analisada, de forma a agrupar as amostras com características
espectrométricas semelhantes e perceber como se agrupam de acordo com o ponto
amostral do sistema de tratamento de efluentes em que foram coletadas.
67
4. Resultados e Discussão
4.1. Análise de Similariedade Entre as Amostras: Scores
A análise de componentes principais, através da matriz de Scores, fornece informações
sobre a semelhança entre as amostras, no que diz respeito às suas composições químicas.
As Figuras 4.1 e 4.2 ilustram gráficos plotados pela primeira componente principal versus
a segunda componente principal da matriz de Scores, respectivamente dos modos negativo
e positivo de ionização.
A matriz de Scores do modo negativo (Figura 4.1) mostra que as amostras referentes ao
efluente do filtro biológico percolador (C1 e C2) se agrupam, indicando que, durante todo
o período de amostragem, a composição do efluente final permaneceu praticamente
constante. Além disso, é possível concluir que não houve qualquer diferença significativa
provocada pelos diferentes meios de suporte no FBP As amostras coletadas nos pontos A
(esgoto bruto) e B (efluente do reator UASB) não se agruparam uniformemente no gráfico,
o que demonstra que a composição química dessas amostras não é uniforme, apresentando
variações significativas entre elas. A matriz de Scores do modo positivo (Figura 4.2) não
revelou qualquer agrupamento aparente entre as amostras, relacionado ao ponto do sistema
de tratamento em que foram coletadas.
68
Amostras (S cores) - Modo de Ionização N egativo
14
Pontos
de
Cole ta
A
B
A - Novembro 2007
B - J aneiro 2008
12
C1
C2
PC1 (71,99%)
10
B - A bril 2007
A - Outubro B2007
- Novembro 2007
B - Dez embro 2007
A - J aneiro 2008
8
B - A gos to 2007
B - M aio 2007
A - A gos to 2007
B - Outubro 2007
6
A - Dez embro 2007
C 1- Novembro
A - J2007
ulho 2007
A- A
A -bril
2007
M aio
2007
B - Fevereiro 2007
A - Fevereiro 2007
C 2- Novembro 2007
4
B - M arço 2007
B - J ulho 2007
gos2007
to 2007
CC2-2-MAaio
C 1- Outubro
C 2-2007
J ulho 2007 C 1- M aio 2007
2
1CA2Fevereiro
A bril
2007
2007
C 2- Outubro 2007
CC11bril
2007
C
J ulho
2007
C 1-C
M arço
2007
C 1- Dez embro
2007
embro
2Fevereiro
2007
AC-2M Dez
arço
2007 2007
2- 2008
M arç
o 2007
C 1-CJ2aneiro
JCaneiro
2008
C 1- A gos to 2007
0
-5,0
-2,5
0,0
2,5
PC2 (12,85%)
5,0
7,5
Figura 4.1 - Primeira e segunda componentes principais da matriz de Scores do modo de ionização negativo.
69
Amostras (S cores) - Modo de Ionização Positivo
12
C 1- Novembro 2007
P o nto s
de
C o leta
A
B
C1
C2
A - Novembro 2007
C 2- Novembro 2007
B - Novembro 2007
10
A - Outubro 2007
B - Outubro 2007
C 2- Outubro 2007
C 1- J aneiro 2008
PC1 (58,46%)
B - J aneiro 2008
B - Dez embro 2007
8
C 1- Outubro 2007
A - Dez embro 2007
A - A gos to 2007
C 1- Dez embro 2007
6
C 2- J aneiro 2008
B - A gos to 2007
C 2- Dez embro 2007
A - J aneiro 2008
4
C 2- A gos to 2007
A - A bril 2007 A - M aio 2007
B - A bril 2007 A - J ulho 2007
C 1CC2007
2AM1bril
2arço
B -Fevereiro
MCA
aio
2007
C2007
A2007
bril2007
2007
B - Fevereiro
2007
2-- M
aio
2007
arço
C 2- J A
ulho
2007
-MFevereiro
2007
-M
1-2007
arço
2007
CB22007
1M2007
aio
2007
BFevereiro
-arço
JCCulho
CC12007
1- JAulho
gos to
2007
2
-2,0
-1,5
-1,0
PC2 (10,48%)
-0,5
Figura 4.2 - Primeira e segunda componentes principais da matriz de Scores do modo de ionização positivo.
70
4.2. Elucidação Estrutural de Micropoluentes no Esgoto Doméstico
A análise fullscan nos modos negativo e positivo das amostras de esgoto revela um grande
número de substâncias químicas, comprovando a complexidade dessa matriz ambiental.
Uma vez que a identificação de todos os poluentes presentes é demasiadamente complexa,
esse trabalho se limitou ao estudo das substâncias que se destacam dentre as demais nas
amostras, ou seja, aquelas que durante a análise espectrométrica, geraram melhores
respostas instrumentais. Assim, após adquiridos os espectros de cada amostra, o tratamento
quimiométrico dos dados foi realizado, como uma ferramenta fundamental para a seleção
dos poluentes mais determinantes na distinção das amostras. Através do resultado da
análise de PCA, foram considerados como relevantes para a identificação os íons com
valor da primeira componente principal maior ou igual a 0,05.
As relações bidimensionais entre os valores das primeira e segunda componentes
principais, dos íons do modo negativo são mostradas na Figura 4.3 e do positivo na Figura
4.4 (Loadings). Nelas podem ser notados densos agrupamentos de pontos, que representam
as relações m/z semelhantes em todas as amostras. Os íons que se encontram destacados
dos demais são os mais relevantes, logo, são os alvos da tentativa de elucidação estrutural.
De posse das relações m/z desses íons, foram realizados experimentos MS2, a fim de obter
fragmentações que auxiliariam o programa computacional a calcular as possíveis estruturas
do poluente. A Tabela 4.1 relaciona esses íons com seus respectivos valores de
componentes principais calculadas na análise quimiométrica de dados.
Relações m/z (Loadings) - Modo Negativo de Ionização
0,7
311,17
0,6
PC1 (71,99%)
0,5
325,19
339,20
0,4
297,15
0,3
0,2
279,23
281,25
248,96
0,1
0,0
-0,6
-0,4
317,08
112,99 298,16
226,98
299,26
313,17
297,16
318,09
280,24
253,22
327,18
283,27
353,21
282,25
255,23
277,22
299,15
239,07
265,15
341,19
375,29
341,20
635,17
327,19
311,46
309,17
325,49
309,16
273,09
277,21
397,23
297,26
367,23
391,29
297,46
213,08
331,10
353,06
327,17
313,16
635,18
155,00
183,01
284,27
421,23
389,27
227,20
174,98
295,22
200,17
307,20
323,19
311,52
300,26
353,20
256,24
278,22
279,14
254,22
283,26
281,12
339,51
563,51
384,94
559,48
441,25
381,24
295,23
339,36
475,35
636,18
355,18
250,15
241,22
228,95
399,35
325,35
325,55
325,73
311,70
312,18
325,34
337,20
311,32
311,33
329,24
323,18
311,47
341,18
281,53
279,51
279,18
277,13
274,09
269,24
269,25
267,21
258,03
281,40
279,38
278,24
279,13
277,91
278,13
278,19
278,21
277,19
274,10
274,90
275,07
275,10
276,89
277,08
277,09
277,11
270,22
271,23
272,08
272,09
269,08
269,10
269,11
269,21
266,15
267,11
267,12
267,13
267,15
267,18
267,19
258,04
258,54
259,03
259,04
259,10
259,96
260,10
261,06
261,07
261,10
263,08
263,09
263,10
257,17
257,18
255,07
255,18
252,20
252,91
252,92
251,19
283,15
283,07
283,08
283,10
283,11
283,12
282,07
282,11
282,12
282,13
281,26
281,13
280,25
279,25
279,20
279,22
279,15
277,20
273,10
283,14
254,90
251,20
283,13
297,27
249,96
564,51
560,48
544,97
485,28
441,26
411,11
637,19
696,49
339,37
299,57
299,25
298,15
297,47
242,08
243,20
241,19
239,18
223,07
197,96
186,98
194,99
520,91
537,49
513,31
477,35
469,29
439,81
431,07
431,08
425,26
423,15
417,32
409,26
392,29
389,28
389,30
379,83
377,20
378,20
368,23
365,23
356,08
355,20
354,21
296,94
295,24
294,98
293,19
285,24
637,18
340,21
341,15
341,16
300,14
299,16
299,19
298,26
299,12
299,13
299,14
297,67
297,31
297,28
251,16
251,17
251,18
250,14
249,06
249,07
249,16
249,17
248,08
241,21
241,05
241,06
241,07
241,18
239,19
239,20
239,17
236,92
239,06
233,03
233,15
235,04
235,05
235,17
227,98
226,99
225,19
223,17
225,17
214,94
215,01
215,02
215,35
215,68
216,01
219,17
220,15
221,07
221,08
221,09
214,92
213,19
213,51
214,02
213,09
213,10
213,16
212,99
213,00
213,01
213,02
213,07
210,97
211,06
212,07
205,04
205,05
207,01
207,04
208,97
208,98
199,30
199,41
199,42
199,46
199,59
197,97
198,04
197,03
197,15
183,02
183,12
177,07
177,08
178,07
163,06
164,02
168,08
169,06
169,07
170,07
171,14
174,92
174,94
123,01
109,00
576,13
576,63
517,30
494,97
503,07
476,35
450,80
454,21
456,82
463,33
464,33
437,19
437,20
437,21
437,22
431,05
431,06
425,25
421,33
422,23
417,33
417,58
418,09
418,33
421,20
421,22
417,08
409,97
400,35
399,18
394,98
397,22
389,31
390,12
390,82
390,83
383,16
381,22
381,23
378,84
376,30
376,22
371,17
373,28
375,20
368,24
369,17
367,10
367,20
367,21
367,22
356,18
356,86
357,16
357,17
365,18
356,07
355,17
354,22
354,06
296,14
296,15
296,23
296,24
295,16
293,20
293,21
294,19
290,14
291,08
291,10
291,16
293,10
286,95
287,07
287,08
287,16
288,12
289,09
289,10
285,09
285,10
339,52
339,57
297,29
297,30
241,20
240,07
222,08
213,18
381,25
376,29
295,15
295,13
293,18
289,12
236,91
214,93
214,07
369,18
355,19
355,06
225,18
209,09
295,14
311,31
309,28
335,23
333,22
333,09
330,24
329,27
329,23
328,18
318,97
315,25
313,22
345,22
343,97
313,15
311,27
310,18
307,16
307,18
307,19
301,25
308,87
309,15
337,21
338,19
336,33
337,18
337,19
334,01
335,17
335,18
335,19
335,22
333,13
333,14
333,15
332,07
331,11
332,01
330,25
330,29
329,12
329,13
328,14
328,15
327,14
327,15
327,16
324,18
324,19
324,22
324,23
319,19
319,20
319,22
319,23
319,86
320,14
320,19
320,22
321,15
321,16
321,18
321,19
321,20
322,16
323,02
323,17
319,09
318,19
317,24
317,38
317,44
317,61
316,13
316,87
314,88
315,12
315,13
314,14
314,15
345,28
346,29
349,15
349,17
351,17
351,18
351,21
344,98
342,58
343,14
343,15
343,16
343,17
343,18
342,14
342,15
342,16
342,18
341,17
313,12
313,13
313,14
310,15
310,16
303,10
303,11
303,14
303,23
304,16
305,14
305,16
305,21
306,15
307,14
307,15
301,09
301,10
301,16
301,23
300,15
300,20
308,06
308,07
308,13
308,14
308,15
329,28
329,29
319,10
319,11
314,16
342,19
325,48
332,03
328,17
323,22
323,20
329,26
323,21
329,25
-0,2
0,0
PC2 (12,85%)
212,08
199,17
0,2
0,4
Figura 4.3 - Relação entre a primeira e a segunda componentes principais da matriz
Loadings dos íons gerados nos modo negativo.
Relações m/z (Loadings) - Modo Positivo de Ionização
0,7
236.07
0,6
PC1 (58,46%)
0,5
0,4
301.14
0,3
341.08
659.17
399.25
0,2
214.09
231.12
279.16
413.27
251.13
237.08
421.24
302.15
660.17
288.29
273.16
304.30
273.17
381.30
335.22
393.21
579.30
280.16
381.73
401.26
403.74
458.33
481.27
379.28
272.26
327.23
432.28
437.24
331.21
337.70
476.31
535.40
342.08
386.33
400.26
325.21
353.27
316.32
349.18
284.33
601.44
557.41
379.25
388.26 310.20
343.30
170.10
447.77
268.11
362.20
357.23
491.37
238.07
389.25
305.16
401.73
338.22
677.37
349.19
359.72
537.88
564.36
513.38
550.63
301.15
581.91
623.45
445.29
320.10
515.87
559.89
352.25
340.18
315.69
423.27
520.33
425.75
344.23
579.93
603.92
601.94
232.12
297.06
406.28
332.33
335.21
321.24
505.31
215.10
267.16
259.15
564.82
542.81
633.34
428.24
268.10
359.71
379.72
391.28
384.21
493.85
377.23
699.38
382.22
414.28
304.27
420.33 300.19 408.31 425.29
279.12
279.13
289.29
293.17
406.22
579.42
569.32
677.87
463.30
483.32
357.24
423.75
360.20
347.21
315.16
205.09
182.10
535.90
425.76
355.10
562.35
546.39
318.17
467.30
233.12
306.26
414.27
437.20
625.93
557.91
623.95
437.22
608.85
608.39
590.42
384.31
275.16
300.20
404.24
339.24
661.18
667.48
655.35
480.34
323.25
357.71
423.28
645.97
467.31
469.35
647.95
520.34
520.80
540.34
324.22
351.20
261.13
507.33
634.45
255.15
426.28
551.64
246.17
421.25
437.23
302.14
525.30
240.11
611.33
584.36
589.32
699.88
443.28
586.84
306.27
392.31
525.29
274.17
277.20
293.18
289.15
291.16
404.23
401.74
337.23
329.19
363.19
473.34
371.18
502.36
655.36
667.98
465.29
678.47
477.31
502.35
316.20
426.25
471.84
431.33
645.47
355.22
511.34
648.44
560.38
324.21
516.34
633.84
249.13
518.32
353.23
316.19
565.34
357.72
423.76
505.32
360.21
380.28
448.26
388.25
445.76
445.30
304.26
443.27
433.25
281.10
491.83
489.32
379.24
604.41
580.30
375.26
246.16
415.26
494.32
313.20
579.43
582.40
606.38
630.86
587.34
487.31
446.27
415.25
551.36
309.17
721.39
246.15
438.25
379.73
448.27
436.31
313.17
421.28
229.14
233.14
224.13
301.13
288.27
295.22
291.18
295.23
402.24
401.27
404.22
401.75
405.24
328.23
326.38
336.22
329.20
327.21
329.18
3
333.16
27.20
660.18
482.32
669.96
655.86
498.79
474.31
371.17
365.19
689.49
465.28
497.01
496.68
502.01
482.00
496.32
478.32
655.85
362.70
657.37
461.30
482.28
460.80
371.19
368.32
319.22
317.20
429.31
326.22
565.33
469.36
513.39
472.29
469.79
163.03
265.14
423.74
467.77
354.27
342.09
645.46
357.20
357.21
518.33
516.33
472.33
317.19
252.13
357.19
357.70
469.80
432.27
319.23
318.08
562.36
560.37
540.35
652.42
472.30
358.20
538.36
513.87
361.21
317.17
567.31
358.21
345.22
252.05
514.34
350.19
470.28
516.30
305.30
279.17
441.30
377.25
521.31
450.35
218.13
609.35
435.24
385.27
422.24
305.15
303.16
385.20385.19
492.31
246.12
586.83
379.71
307.18
223.10
606.39
582.39
437.21
382.30
305.26
247.16
247.14
626.43
602.43
558.41
450.36
394.30
584.38
307.19
611.83
245.10
384.71
375.24
721.90
595.38
380.23
419.26
524.36
609.36
489.31
307.17
521.32
433.28
438.79
312.21
385.30
439.27
409.31
387.33
277.15
276.15
299.15
297.24
299.16
296.16
300.21
294.20
288.28
289.16
299.47
296.17
288.25
399.75
404.21
402.23
403.23
403.24
406.73
402.26
407.29
329.22
333.18
335.70
335.69
333.34
333.19
333.12
330.26
336.17
335.20
333.17
338.20
337.20
333.13
331.22
338.21
336.21
337.18
336.24
335.71
465.27
363.28
463.31
477.30
459.32
496.31
476.77
461.31
458.32
503.32
474.29
689.99
375.23
477.29
671.45
670.46
373.11
459.30
498.33
483.65
495.34
474.30
679.48
495.32
465.81
464.31
653.39
459.31
503.33
458.82
85.32
482.81
370.33
344.28
470.30
545.30
516.29
515.27
514.35
505.33
339.27
567.30
174.56
563.36
559.30
254.17
424.28
351.19
432.25
426.24
358.22
325.20
562.85
560.32
543.31
252.04
249.14
516.32
347.22
538.34
538.35
531.32
361.22
359.21
326.25
320.11
565.32
560.36
185.12
541.04
265.13
261.17
258.28
249.15
424.25
355.09
353.26
513.89
513.86
509.31
506.32
504.01
345.20
345.21
432.29
432.26
429.30
321.21
559.90
254.09
468.39
424.26
357.17
355.23
271.15
269.11
518.34
511.68
344.26
343.13
426.26
646.46
178.13
171.10
549.41
546.37
541.34
263.14
423.26
469.81
542.35
340.68
652.87
359.20
466.30
269.12
508.34
568.39
510.34
506.33
533.34
547.38
205.08
543.32
545.31
254.10
427.29
215.09
549.36
468.29
429.27
469.33
535.39
511.33
5
467.78
538.31
347.18
04.83
560.33
472.28
424.29
469.78
316.30
318.18
316.31
317.32
317.33
316.18
318.67
513.37
315.17
523.61
303.19
552.64
522.61
449.36
524.61
436.33
447.33
301.58
387.26
396.10
419.29
417.32
523.28
421.78
385.17
743.41
626.42
584.86
444.30
442.31
382.29
382.21
382.19
380.22
306.28
237.07
417.26
613.35
604.40
589.82
557.42
526.34
526.03
524.37
491.82
449.82
392.30
385.28
385.23
375.25
311.21
311.22
307.21
287.07
282.28
240.23
419.28
447.29
304.16
691.97
628.40
624.45
584.37
557.92
555.37
494.31
450.27
438.21
438.23
391.24
389.23
385.26
377.74
377.24
313.21
287.17
285.34
280.13
245.09
433.27
448.25
445.77
445.75
692.47
628.41
606.87
580.41
487.30
443.78
441.29
395.23
307.20
305.31
245.13
419.27
447.34
623.46
579.44
526.35
495.03
437.71
422.25
285.33
281.16
303.15
743.91
696.44
628.39
490.31
488.33
552.37
523.29
421.77
447.31
631.37
381.21
766.53
491.36
494.29
529.35
582.35
6
722.49
436.81
4
580.31
04.37
450.26
17.27
613.34
394.22
422.29
416.77
491.80
441.28
391.27
445.78
384.20
311.19
235.15
233.11
235.16
233.13
277.17
277.14
277.12
277.16
273.27
279.11
277.13
275.15
274.16
272.11
278.15
273.28
272.10
278.21
299.25
299.10
298.14
295.19
295.12
294.22
293.16
301.05
300.28
300.29
299.14
298.06
297.12
296.21
296.18
296.19
295.18
294.19
294.17
291.17
291.15
300.30
300.70
299.26
299.17
299.13
299.07
299.09
297.23
297.18
296.20
295.20
294.18
293.15
292.19
292.16
290.16
289.17
299.24
299.06
289.30
289.28
297.17
299.53
299.71
299.34
404.72
397.28
407.24
406.74
399.22
399.76
399.77
405.23
401.25
399.24
396.32
402.25
407.21
407.22
406.75
398.24
397.42
397.30
397.26
397.18
401.17
402.73
402.74
402.75
401.76
408.26
408.27
407.20
405.25
404.73
404.71
400.23
403.22
407.25
407.23
399.73
404.74
397.24
403.27
579.41
575.33
579.29
579.17
576.39
571.43
570.45
579.28
577.40
575.37
573.91
573.40
572.43
571.42
570.38
570.36
569.34
569.35
569.02
579.16
578.67
578.39
577.37
577.38
576.38
575.36
574.41
574.39
574.10
573.39
571.69
571.37
570.67
570.37
570.06
569.33
578.42
578.38
575.38
575.87
574.40
574.13
573.93
573.35
571.95
572.38
572.40
571.40
570.34
570.05
573.38
570.33
338.24
338.07
332.21
339.21
339.22
337.22
336.20
334.17
332.20
327.39
339.23
338.69
337.17
335.18
335.19
333.11
330.22
329.21
328.21
338.57
338.34
336.19
335.72
333.20
332.30
332.31
339.20
337.19
333.10
330.25
332.32
367.29
464.36
457.34
483.33
455.31
479.26
370.32
369.30
365.28
373.21
461.29
460.30
459.35
453.27
501.37
501.27
499.28
498.65
482.82
480.33
476.30
363.23
656.36
683.44
373.12
465.79
454.30
501.28
500.35
500.33
499.96
499.31
498.32
497.31
484.38
479.27
477.28
368.28
367.27
367.20
366.24
365.20
363.26
363.27
678.44
674.89
672.41
670.45
668.48
661.17
373.19
371.23
464.37
464.33
464.30
463.29
460.29
459.33
457.24
457.25
456.31
455.29
454.29
503.30
501.29
501.26
500.32
499.30
498.66
498.31
497.32
497.33
497.12
496.33
485.31
485.29
484.35
484.32
483.34
482.34
482.39
482.31
481.28
480.84
480.64
474.32
371.14
371.10
370.31
369.28
369.21
369.17
369.18
369.19
368.25
368.26
367.26
367.19
366.26
366.27
366.23
366.19
365.27
365.21
363.29
364.19
364.20
363.21
689.50
684.45
678.48
678.43
675.39
674.88
672.92
672.44
672.45
670.96
668.47
663.36
659.48
656.66
656.38
656.16
653.42
373.23
373.24
372.19
372.20
371.22
371.20
463.83
463.84
462.30
461.28
461.24
457.31
457.26
457.23
456.30
455.30
454.76
454.63
503.31
503.02
501.61
500.37
500.01
499.32
499.29
498.80
497.62
496.60
495.65
495.31
485.30
484.93
484.33
483.98
483.99
483.64
483.30
483.31
482.65
482.66
482.30
480.97
480.66
479.29
479.30
478.98
479.25
478.31
476.76
476.32
475.32
475.30
475.27
370.15
369.24
675.40
659.47
657.40
658.41
658.43
656.42
656.37
461.35
462.29
459.29
457.33
453.28
503.01
502.34
501.30
500.63
500.31
499.33
499.61
499.00
497.27
495.67
495.61
484.31
483.37
483.35
480.67
365.18
455.27
456.32
502.85
500.36
497.29
479.28
366.29
373.22
463.82
453.25
462.34
369.31
480.83
3
63.24
517.36
639.43
536.62
324.23
195.08
355.24
271.16
504.33
653.37
647.35
471.27
428.77
269.13
512.41
510.33
507.32
341.25
652.88
650.40
635.46
538.32
537.62
472.80
430.29
324.20
322.25
320.23
317.18
561.38
263.15
253.14
468.28
424.75
271.14
518.83
513.84
510.32
510.00
509.59
349.22
349.20
348.23
347.20
344.27
340.19
339.61
648.39
634.43
539.34
539.35
539.36
536.39
532.36
531.34
472.34
431.29
429.28
428.25
426.73
426.22
426.23
360.70
360.18
323.24
323.19
322.22
318.30
314.24
562.86
561.36
560.35
211.05
207.10
158.55
548.37
545.32
540.70
540.36
540.33
255.13
255.14
253.15
252.14
265.10
264.19
250.18
468.98
468.27
466.29
425.35
425.24
357.22
355.72
354.09
352.23
271.11
268.24
521.29
519.35
519.33
517.37
517.33
514.97
514.64
513.85
513.40
512.99
512.42
512.33
511.67
510.03
509.70
509.29
508.61
508.32
508.33
507.86
507.87
506.01
505.35
351.21
351.99
350.24
350.30
350.20
346.23
345.17
344.24
344.22
343.20
343.16
343.12
341.24
650.42
648.94
647.94
645.48
643.52
641.51
640.44
637.47
633.35
539.67
538.85
536.38
533.35
533.36
529.48
529.65
472.31
470.76
470.29
470.26
431.28
430.27
429.29
429.21
427.81
427.82
427.26
426.72
361.23
360.33
360.19
359.99
359.22
357.26
323.20
322.23
321.14
320.09
316.21
568.67
567.80
567.81
567.34
566.38
216.09
191.08
183.10
181.05
149.02
564.83
563.37
563.10
562.37
561.39
560.86
560.88
549.37
546.38
545.79
545.33
545.34
543.99
543.33
542.34
541.36
540.85
540.86
540.83
267.17
261.14
260.16
254.16
249.12
468.78
468.30
467.64
465.96
424.36
357.13
356.12
356.13
355.00
353.22
352.24
271.10
269.07
269.10
519.37
519.07
519.32
518.84
517.93
517.94
516.85
516.80
516.81
515.86
515.35
515.31
515.32
514.36
514.37
513.65
513.00
513.01
512.39
512.02
511.83
512.00
511.35
510.02
509.71
509.32
508.36
508.07
507.34
506.36
506.34
506.31
505.36
505.34
505.01
504.40
503.34
350.23
349.21
349.16
348.28
348.21
347.19
346.22
345.18
343.21
343.15
341.35
341.26
341.23
340.17
653.38
653.35
653.36
651.43
650.93
650.43
650.90
649.43
648.40
646.47
646.96
644.51
641.37
640.42
639.95
639.41
637.97
636.43
634.44
634.41
633.85
633.37
632.43
539.69
539.05
539.06
539.17
538.84
538.37
538.33
537.68
537.36
537.33
536.89
535.91
534.34
534.35
531.57
530.96
530.38
530.39
530.34
530.07
473.33
473.31
472.76
472.77
471.85
471.30
471.28
470.61
470.37
470.31
470.27
470.25
432.32
430.28
430.26
430.24
429.20
428.26
427.24
362.21
362.22
360.68
360.69
359.27
359.19
358.19
357.73
326.27
325.22
324.19
323.26
324.17
323.18
322.21
321.19
321.12
321.04
319.21
314.23
568.38
568.36
567.83
567.35
567.32
567.03
565.35
565.36
564.59
564.64
564.35
563.38
562.87
561.37
560.81
559.38
211.06
202.18
198.18
198.19
195.07
191.09
185.11
181.06
175.07
163.12
158.03
149.03
549.92
550.37
548.41
547.39
546.88
544.37
544.33
544.35
543.34
542.61
542.33
541.62
541.35
540.84
540.02
265.11
265.12
265.09
261.16
260.17
257.14
255.16
255.12
254.18
250.17
249.08
249.09
249.10
423.25
469.37
469.21
468.41
468.37
467.79
467.76
467.66
467.27
466.31
425.31
425.32
425.33
425.25
424.27
424.24
423.77
423.78
357.18
356.99
354.99
354.26
354.23
353.99
354.08
353.24
353.25
353.21
352.21
352.22
268.12
268.21
517.34
517.32
517.20
516.36
514.63
514.33
513.88
510.64
509.82
508.65
508.03
505.38
505.89
504.84
504.34
504.35
503.35
519.34
512.35
511.81
343.36
343.29
343.11
341.27
650.92
650.41
648.95
642.06
643.42
640.43
639.94
637.44
637.46
631.89
537.35
536.36
536.37
533.84
530.35
530.36
529.90
473.29
470.77
470.78
470.94
471.19
430.30
428.75
426.27
359.16
326.26
325.19
323.17
321.13
315.68
314.65
568.89
569.01
568.40
565.87
566.37
560.85
560.34
559.33
558.91
558.99
216.11
195.09
187.07
191.07
549.40
548.40
547.36
547.37
545.64
544.66
543.36
543.64
543.01
542.67
259.14
252.12
249.11
355.11
469.34
467.99
353.20
648.42
532.35
529.88
471.31
509.85
509.33
539.33
535.85
428.74
256.16
511.82
530.37
473.32
472.79
550.39
548.85
250.20
355.21
517.22
639.42
635.45
538.82
536.35
531.33
560.82
544.36
323.16
512.34
325.26
321.17
325.18
652.41
539.18
171.14
513.81
343.14
555.51
631.43
603.32
394.35
313.22
604.36
557.43
451.31
422.27
395.26
310.23
247.15
416.26
445.31
815.71
721.89
558.42
556.49
551.37
526.31526.30
521.30
489.79
485.35
450.24
443.29
422.26
391.16
287.15
285.14
283.26
281.14
235.14
447.32
447.22
447.23
446.76
446.26
445.32
303.18
815.21
783.58
765.42
712.01
711.51
700.39
611.35
605.43
604.89
602.44
596.39
593.44
591.43
590.41
589.34
585.36
583.37
582.87
557.18
529.32
528.42
527.48
525.31
524.67
521.33
494.80
493.86
493.30
492.81
491.87
487.33
451.23
451.24
450.78
449.83
444.08
443.79
440.35
439.28
438.24
394.21
392.29
383.31
382.71
378.26
378.27
376.32
314.15
308.19
307.22
304.29
239.11
219.11
217.11
417.25
416.78
415.23
415.24
415.19
410.32
448.24
447.30
446.25
301.24
733.52
727.46
723.51
722.46
721.40
701.39
697.41
694.43
691.37
628.91
628.89
627.43
626.92
623.96
624.44
621.41
621.42
619.53
619.33
617.50
616.47
615.48
614.39
609.37
609.34
607.39
607.40
606.89
605.39
604.38
604.39
599.39
597.34
595.92
595.39
593.42
592.40
591.49
588.40
587.36
584.88
584.89
583.39
583.36
582.37
582.38
580.32
580.37
580.38
580.17
558.40
557.54
557.40
556.44
555.67
554.35
554.02
552.35
552.36
551.90
551.01
529.36
527.68
527.66
527.39
527.40
526.43
524.70
524.35
523.00
523.01
522.81
522.34
522.35
492.32
488.31
488.32
487.82
485.85
485.34
451.36
451.27
450.34
444.61
442.32
441.81
441.32
421.76
393.20
391.21
390.24
389.24
387.23
386.26
386.24
386.20
385.29
378.17
378.18
311.20
310.22
310.19
309.18
309.19
309.20
309.15
305.27
304.28
287.08
285.16
283.13
283.14
281.15
281.09
280.17
280.12
247.13
245.12
245.08
241.11
241.12
239.13
227.09
227.10
227.11
226.12
225.11
226.10
224.14
223.11
603.41
409.29
408.32
384.29
383.30
383.19
382.23
380.24
379.74
435.23
434.25
420.29
417.31
415.22
415.20
433.26
433.24
413.26
413.22
411.29
447.21
445.79
445.74
445.35
303.17
303.07
302.25
816.21
810.56
734.02
732.84
716.44
714.48
713.98
713.99
711.50
696.90
697.39
694.93
692.42
690.49
690.00
629.39
629.40
629.41
627.71
627.42
627.39
626.93
626.91
626.39
626.40
625.94
625.42
624.95
620.41
619.52
619.35
618.42
618.43
617.93
617.94
617.41
617.42
615.96
615.46
615.43
614.47
613.36
613.38
613.03
612.71
612.41
612.35
611.36
611.34
610.41
609.89
609.39
608.38
606.90
606.88
606.40
606.37
605.42
604.90
604.91
604.85
603.66
603.38
602.94
600.46
600.40
599.69
599.40
598.40
598.38
598.04
597.39
596.68
596.42
596.40
596.38
593.94
593.43
593.40
591.44
590.90
591.39
590.37
590.38
590.39
589.83
589.84
589.81
588.39
587.35
586.62
586.38
586.39
585.64
585.37
585.38
585.06
585.07
583.69
583.19
582.88
582.89
582.85
582.83
582.36
581.39
581.32
580.92
580.42
580.43
558.66
557.02
556.43
556.36
556.37
556.01
555.70
554.67
554.38
554.36
554.05
553.73
553.80
553.32
553.34
552.65
552.38
552.39
552.10
551.10
550.84
529.34
528.34
528.35
528.00
528.01
527.98
527.34
526.69
526.67
526.41
525.32
525.03
525.00
524.87
523.79
523.30
523.31
523.32
523.06
521.34
495.16
494.82
494.78
493.65
493.32
492.29
492.27
491.84
490.32
490.29
489.80
489.78
489.34
488.59
487.81
487.32
486.93
486.35
486.32
486.33
485.86
485.62
452.96
452.28
452.29
452.30
451.35
451.26
450.79
450.37
450.25
449.24
449.26
445.12
444.31
444.28
444.29
442.34
441.79
440.41
440.33
439.31
439.26
438.37
421.26
409.21
395.30
394.29
392.16
392.14
392.11
392.12
391.25
391.20
390.25
390.23
389.26
387.27
386.25
385.18
384.22
379.19
378.25
377.75
377.22
376.33
376.31
375.77
313.69
313.19
312.24
310.21
309.16
309.14
308.18
306.16
305.17
287.16
286.19
286.16
286.17
285.57
285.15
283.15
283.16
282.21
282.18
281.26
282.11
281.12
279.44
246.13
246.14
243.17
242.13
239.12
237.18
227.07
225.06
221.13
220.16
220.17
219.12
217.12
383.29
383.20
383.21
383.23
382.69
382.70
382.20
381.26
381.20
380.34
380.72
380.25
379.75
436.30
435.25
433.20
432.33
421.23
418.32
416.27
414.30
414.31
413.96
413.20
411.28
410.33
410.73
410.29
410.30
447.78
446.28
446.29
304.15
303.05
738.45
740.47
722.50
701.40
699.39
692.97
690.50
631.38
631.40
627.40
625.34
619.41
615.98
616.43
616.45
615.44
615.45
614.41
614.42
612.40
611.86
611.05
607.41
600.02
598.07
593.95
593.39
590.40
589.37
588.36
586.35
583.38
581.35
580.93
558.38
557.03
556.04
555.71
555.06
555.36
554.66
554.06
554.01
553.35
553.36
553.29
552.13
550.40
528.37
527.99
527.95
526.99
526.66
526.42
524.99
524.66
523.83
523.33
495.02
494.30
493.31
491.85
490.30
489.82
490.28
486.34
452.97
452.65
450.77
450.75
450.33
449.27
449.28
448.73
442.30
441.77
440.30
440.31
439.25
409.19
395.29
391.78
391.17
391.18
388.72
387.24
386.27
386.22
384.24
378.28
377.73
375.76
313.70
311.16
307.25
283.27
281.17
281.18
243.18
239.10
232.11
433.29
420.28
416.25
411.27
554.37
443.80
441.80
487.83
582.84
579.91
382.72
314.17
308.20
410.31
583.20
450.76
390.27
283.17
282.17
435.26
414.79
626.38
591.42
558.39
524.86
485.84
451.28
305.28
526.84
7
527.33
495.15
489.81
395.22
43.40
434.31
492.30
278.24
278.12
278.13
278.18
278.19
278.20
277.18
277.19
276.16
277.11
276.14
272.12
272.13
272.14
272.15
272.16
272.17
272.25
300.17
300.18
298.16
298.63
298.64
298.13
297.19
297.22
297.13
297.15
297.16
296.22
296.23
296.24
296.13
296.15
295.21
295.13
295.14
295.15
295.16
295.17
294.86
294.21
293.19
293.24
293.64
293.65
293.66
294.16
292.20
292.21
292.23
293.13
293.14
292.18
292.13
292.14
290.17
290.18
291.14
290.14
290.15
289.20
289.13
288.22
288.24
406.21
401.28
401.70
401.71
401.72
401.18
401.23
401.24
400.27
400.68
401.15
400.25
399.74
399.63
399.68
399.71
398.27
398.28
398.29
398.30
398.31
398.42
399.15
397.68
398.19
398.21
398.23
397.31
397.29
397.27
397.25
397.19
397.20
397.21
397.22
397.11
396.30
396.31
403.72
403.21
402.19
402.22
408.29
408.30
407.69
408.15
408.18
408.19
408.22
408.24
408.25
407.19
406.68
406.69
406.72
406.23
406.24
406.25
405.26
405.27
405.69
406.18
406.19
405.21
405.22
404.25
404.26
404.27
404.69
404.70
579.31
579.18
579.27
578.88
578.92
578.40
578.41
578.43
578.60
577.41
577.42
577.62
577.85
577.86
577.88
577.93
577.94
578.09
577.39
576.41
576.61
576.63
576.83
577.15
575.60
575.61
575.85
575.88
576.11
576.12
576.37
575.34
575.35
574.61
574.62
574.67
574.87
574.88
574.92
574.99
575.30
574.36
574.37
574.38
574.00
573.65
573.66
573.67
573.90
572.64
572.69
572.87
572.88
572.89
572.93
573.00
573.11
573.12
573.37
571.70
571.92
571.93
571.94
571.98
572.00
572.02
572.03
572.36
572.37
572.39
572.41
571.38
571.41
570.68
570.87
570.89
570.96
570.99
571.08
571.34
571.36
570.39
570.40
570.41
569.36
569.64
569.66
569.88
569.89
569.04
569.07
338.70
339.19
338.58
338.67
338.68
338.35
338.36
337.69
337.21
336.25
336.26
336.27
336.28
336.30
336.18
336.16
335.68
334.20
334.22
334.23
334.27
335.12
335.13
335.16
335.17
333.71
334.11
334.12
334.13
334.14
334.15
334.16
333.21
333.22
333.23
332.22
332.23
332.25
332.27
332.28
332.09
331.10
330.23
330.24
330.10
330.13
330.14
330.19
330.20
330.21
328.24
329.08
329.11
328.22
328.18
328.19
327.24
327.22
326.70
326.71
327.14
327.16
327.19
460.33
483.36
371.13
370.74
369.39
370.11
370.13
370.14
370.16
370.20
370.26
370.27
370.28
370.29
370.30
369.22
369.23
369.20
368.72
368.27
368.19
368.22
368.24
367.28
367.21
367.22
367.23
367.24
367.18
366.28
366.25
366.20
366.21
366.22
365.29
366.15
366.16
366.18
365.22
364.21
364.22
364.23
364.26
363.25
363.22
363.20
363.18
362.23
362.30
684.48
686.09
686.43
686.44
687.20
687.50
688.00
688.51
683.97
684.44
680.45
680.49
681.48
681.49
681.50
682.00
682.50
683.43
678.95
678.46
678.38
678.39
678.41
678.42
677.39
675.43
675.89
677.36
674.90
672.94
672.95
673.19
673.42
673.43
673.49
672.91
672.42
671.46
671.75
671.42
671.43
671.44
670.95
668.97
668.98
667.99
665.44
665.45
665.46
665.48
661.19
661.45
661.96
662.44
662.45
662.46
660.48
659.98
659.99
659.44
659.45
659.46
657.38
658.45
658.46
658.47
658.48
656.67
656.73
656.74
656.95
657.06
657.07
657.16
656.40
656.43
656.65
656.17
656.15
655.38
655.39
653.88
654.37
654.44
655.09
655.10
374.19
374.22
374.23
374.24
375.19
375.21
375.22
373.20
373.13
373.14
373.15
373.16
373.17
373.18
372.21
372.22
372.23
372.24
372.34
372.17
371.21
465.80
465.53
465.68
465.78
464.63
464.64
464.81
464.32
464.04
464.29
463.32
463.33
462.35
462.31
462.32
462.33
461.32
461.34
461.36
461.78
461.80
461.87
462.25
462.26
461.25
461.27
461.23
460.34
460.31
459.62
459.79
460.28
459.34
459.28
458.81
457.58
457.59
457.81
458.30
457.32
457.29
456.33
456.34
455.58
455.92
455.93
455.96
456.25
456.28
456.29
455.28
454.77
454.96
454.75
454.33
454.34
454.52
453.29
453.30
454.25
454.27
454.28
453.26
502.86
502.37
502.32
501.82
501.94
501.95
501.31
501.32
501.33
501.34
501.35
501.36
500.38
500.64
500.85
501.02
501.24
500.34
499.98
500.00
499.34
499.36
499.37
499.53
499.62
499.79
498.98
499.01
499.02
499.17
499.20
499.23
499.24
499.26
498.34
498.37
498.38
498.53
498.57
498.63
497.64
497.65
498.30
497.60
497.61
497.30
497.13
497.28
497.02
497.03
497.11
496.81
496.83
496.84
496.67
495.68
495.69
495.82
496.01
496.02
495.35
495.58
495.62
495.33
495.30
484.80
484.34
483.83
483.89
483.95
483.96
483.97
482.83
482.97
482.64
482.29
481.30
481.31
481.81
480.98
480.99
481.00
481.26
480.85
480.68
480.82
480.63
479.31
479.63
478.33
478.34
478.38
478.84
477.32
477.52
477.78
478.27
478.29
478.30
473.35
473.36
473.82
473.83
477.00
477.27
476.33
476.54
476.65
476.71
476.72
476.74
476.75
475.34
475.36
475.55
475.96
476.29
475.31
475.29
474.80
475.04
531.83
424.35
270.13
270.14
270.15
270.16
270.18
270.19
268.14
268.22
518.05
518.09
517.84
517.86
517.35
517.28
517.30
517.31
516.91
516.97
516.82
516.83
516.84
516.62
516.63
516.75
515.88
515.90
516.26
515.36
515.64
515.33
515.34
515.29
514.98
514.65
514.69
514.82
514.83
514.38
513.93
514.27
514.29
513.63
513.04
513.23
513.24
513.36
512.80
510.35
510.67
510.81
510.82
511.02
511.31
511.32
509.99
509.81
509.83
509.68
509.55
508.62
508.66
508.96
509.01
508.35
507.36
507.37
506.83
507.08
506.35
506.02
505.37
505.86
505.90
504.70
504.36
504.32
503.36
503.65
520.81
520.82
520.87
521.04
521.06
520.35
520.36
520.37
520.67
520.78
520.79
519.58
519.94
519.98
520.04
519.36
519.05
518.35
518.82
516.31
512.40
512.36
512.37
512.38
512.31
512.01
511.69
511.80
351.18
350.21
350.22
349.23
350.18
349.17
348.72
348.24
348.25
348.22
348.18
348.20
346.24
346.70
346.18
346.19
346.20
346.21
345.19
344.31
344.33
343.34
343.35
343.37
344.20
343.22
343.26
343.18
343.19
342.22
342.23
342.24
342.25
342.26
342.35
343.10
341.64
341.28
341.34
341.21
341.22
340.21
340.22
340.23
340.24
340.25
340.11
340.12
340.13
340.15
340.16
339.34
339.60
358.15
357.25
652.47
651.46
651.47
651.41
649.44
649.39
648.93
648.43
648.41
647.39
647.44
647.56
646.97
645.96
645.45
643.70
643.71
644.04
644.41
644.43
644.46
644.48
642.40
642.41
642.42
642.71
642.72
643.43
641.43
640.45
640.73
641.07
640.16
639.44
638.43
638.46
638.92
638.98
636.45
636.46
636.47
636.91
636.95
636.96
636.97
637.42
637.43
636.17
634.91
634.92
634.93
635.42
634.42
633.86
633.88
634.36
634.37
634.38
633.38
632.44
632.70
632.06
632.14
632.15
632.39
539.68
539.37
539.38
539.19
539.20
539.21
539.22
539.32
538.87
538.83
538.38
538.71
538.81
538.02
538.03
538.04
537.87
537.37
537.38
537.39
536.90
537.06
537.30
536.80
536.88
536.40
536.17
536.31
536.33
536.34
535.87
534.36
534.37
534.38
534.39
533.37
533.72
533.81
533.82
533.83
534.04
534.05
534.31
534.33
532.38
532.57
532.72
532.81
532.84
533.07
533.08
533.33
531.84
531.85
531.86
532.06
532.32
532.33
531.64
531.69
531.35
531.31
530.58
530.59
530.62
530.86
530.95
530.08
530.15
530.33
529.89
529.93
529.97
530.00
529.87
473.17
473.22
473.23
473.30
472.78
472.60
472.32
471.86
472.27
471.32
471.33
471.83
471.29
470.93
470.60
470.33
470.34
469.82
469.85
469.86
469.88
432.30
432.31
431.30
431.31
431.32
430.31
431.20
431.21
431.26
430.25
429.32
429.33
429.70
429.71
430.21
429.22
429.26
429.19
428.27
428.28
428.29
428.31
428.73
427.88
428.21
427.30
427.31
427.33
427.34
427.71
427.27
427.25
426.74
426.75
427.21
427.22
426.29
426.31
426.58
361.32
361.33
361.99
360.71
361.18
361.19
361.20
360.22
360.25
360.31
360.32
359.23
358.26
358.69
359.17
326.23
326.24
326.15
325.23
324.27
324.28
324.18
323.21
323.22
323.23
323.15
322.24
322.12
322.13
322.14
322.15
322.18
322.19
321.22
321.23
321.18
321.15
321.05
321.10
321.11
320.22
319.24
319.25
318.19
318.22
318.16
316.33
316.98
316.99
317.16
316.22
316.25
316.26
316.27
316.09
316.10
316.11
315.18
315.15
314.21
568.64
568.37
567.85
567.87
567.88
568.07
567.82
567.39
567.66
567.74
567.33
566.39
566.40
566.41
566.87
566.88
565.37
565.39
565.40
565.59
565.62
565.83
565.86
565.88
566.10
566.34
566.35
566.36
564.88
565.10
565.31
564.37
564.38
564.39
564.40
563.39
563.40
563.60
563.85
563.86
564.31
564.32
564.33
564.34
563.07
562.38
562.61
561.74
561.87
561.88
562.11
562.12
560.89
561.35
560.39
560.63
560.65
559.92
559.39
559.60
559.34
559.35
559.36
558.92
558.93
558.95
559.00
559.02
559.15
216.10
214.25
211.08
211.55
211.56
211.60
212.13
212.14
213.11
213.14
213.15
208.11
209.11
209.12
206.09
206.10
203.08
203.09
204.09
204.10
204.11
198.99
200.11
201.09
201.10
202.11
195.58
196.08
196.09
196.10
196.11
196.12
196.13
197.11
191.59
192.11
192.13
192.14
193.10
193.11
193.12
194.10
194.11
194.12
194.14
194.58
195.04
195.05
195.06
189.10
183.09
181.07
181.08
178.56
179.06
179.07
179.14
180.08
177.05
177.06
177.07
177.08
175.06
164.09
165.06
166.57
167.08
167.56
163.04
163.05
163.06
149.04
100.11
104.05
550.38
549.42
549.90
549.91
549.38
549.39
548.86
548.89
548.90
548.39
547.40
548.36
547.06
546.40
546.86
546.87
545.81
545.83
545.86
545.97
545.98
546.36
545.37
545.62
545.63
544.39
544.70
544.87
544.88
544.99
544.06
544.07
543.35
543.39
543.57
543.82
543.83
543.88
542.82
542.88
543.00
542.65
542.66
542.68
542.80
542.38
542.39
542.60
541.63
541.64
541.68
542.28
542.30
542.32
541.33
540.71
540.69
540.04
540.07
539.71
539.85
265.15
265.18
265.19
265.60
266.11
266.12
266.13
266.14
266.15
266.19
266.20
267.14
267.15
264.20
262.12
262.13
262.14
262.15
263.13
261.15
260.18
260.21
261.10
259.28
260.13
260.14
260.15
259.12
259.13
257.16
257.18
257.26
258.10
258.11
258.22
258.27
256.17
256.26
256.30
257.11
257.12
257.13
256.13
256.14
254.19
254.21
254.22
255.11
254.13
253.16
253.20
253.22
254.08
252.15
253.12
253.13
252.06
252.07
252.08
252.11
251.17
251.18
251.19
250.19
249.58
249.59
250.12
250.13
250.16
248.14
425.34
425.30
425.26
425.28
425.22
425.23
424.74
424.33
424.22
357.14
357.15
357.16
357.00
357.01
357.12
356.19
356.20
356.21
356.23
356.24
356.27
355.98
355.99
356.07
356.08
356.09
356.10
356.11
355.69
355.71
354.59
354.98
354.24
354.25
354.13
354.16
354.22
353.98
469.75
469.24
468.96
468.97
468.77
468.40
468.38
468.31
468.32
467.80
467.97
467.98
467.67
467.63
467.28
467.29
466.37
466.54
466.55
466.63
466.80
465.97
466.00
352.99
352.19
352.20
445.34
302.12
441.27
447.79
447.80
447.81
447.88
448.22
448.23
447.35
447.74
447.75
447.25
447.26
447.27
446.30
446.34
446.35
446.37
446.74
446.08
446.09
446.14
446.15
446.16
446.17
446.22
445.73
445.33
304.17
304.18
304.22
304.23
304.24
304.25
304.11
303.10
302.26
302.19
302.22
302.13
302.09
302.11
301.16
301.17
301.19
816.22
854.59
811.56
784.58
785.45
787.44
787.94
809.45
809.95
810.55
767.53
767.54
782.48
765.92
766.49
766.50
766.52
744.41
755.53
756.03
760.46
760.47
760.97
762.94
762.95
735.99
736.00
736.44
736.46
736.49
738.46
738.95
738.96
740.93
741.41
741.43
734.01
723.52
725.52
726.03
722.51
722.47
722.48
722.40
722.41
722.42
722.43
716.94
718.91
718.92
719.42
714.49
714.82
715.43
714.31
712.50
712.51
712.00
701.41
701.42
702.50
703.51
704.01
704.50
709.51
700.40
700.42
700.76
700.96
701.09
699.89
700.38
697.40
695.43
694.45
694.50
692.98
693.41
692.43
692.46
692.41
691.38
690.48
631.87
631.39
631.41
630.87
629.45
629.46
629.68
629.92
629.96
630.14
630.37
630.41
630.42
630.46
630.65
630.66
628.92
629.06
628.90
628.88
628.05
628.07
628.09
628.38
627.41
627.22
627.32
627.33
627.34
627.36
626.44
626.67
626.10
625.70
625.72
625.15
624.46
624.94
621.44
621.90
622.15
622.40
622.41
622.42
622.43
622.44
622.45
623.14
620.42
620.43
620.65
621.40
619.63
619.83
619.36
619.37
619.38
619.39
619.40
618.64
618.89
619.14
619.32
618.12
618.14
618.40
617.90
617.43
616.88
617.14
617.15
617.38
617.40
615.97
616.01
616.04
616.41
616.44
616.46
615.64
615.74
614.48
614.68
614.69
614.90
614.92
615.03
615.11
615.40
615.41
614.40
614.43
614.44
614.45
613.39
613.70
613.71
614.17
614.37
612.92
612.42
612.36
612.37
612.38
612.39
611.84
611.89
612.12
612.33
612.34
611.38
611.67
611.75
610.43
609.90
609.93
610.16
610.18
610.36
610.37
609.63
609.86
609.87
609.38
608.86
608.40
608.43
608.44
608.63
608.64
608.84
607.43
607.44
607.64
607.89
607.90
607.91
607.92
607.94
608.34
608.35
608.36
608.37
607.13
607.14
606.65
606.66
605.68
605.89
606.13
605.41
604.92
605.11
605.37
604.67
604.15
604.16
603.65
603.36
603.00
603.03
603.16
602.68
602.69
602.70
602.93
601.95
602.17
602.39
602.41
601.45
601.67
601.72
601.93
600.47
600.67
600.89
600.94
601.05
601.06
601.42
601.43
600.41
600.42
600.43
600.44
600.45
599.73
599.98
600.39
599.67
598.41
598.42
598.43
598.44
598.67
598.68
598.69
599.04
599.38
598.39
597.61
597.63
597.76
597.82
597.85
597.87
597.90
598.03
597.35
597.37
597.38
596.69
596.88
596.91
596.92
597.06
596.66
596.41
596.13
596.14
596.16
595.40
595.43
595.63
594.40
594.41
594.42
594.43
594.44
594.67
594.88
594.89
595.12
595.13
593.65
593.90
593.93
593.41
592.41
592.42
592.43
592.88
592.90
592.91
592.92
593.13
591.90
592.16
591.41
590.43
589.87
589.89
590.01
589.35
589.36
589.62
589.67
589.33
588.41
588.42
588.64
588.66
588.68
588.90
589.31
587.37
587.38
587.39
587.41
587.42
587.55
587.56
587.59
587.60
587.84
587.85
587.86
587.88
587.89
587.91
588.01
588.02
588.06
588.15
588.35
587.04
587.15
586.63
586.70
586.42
585.65
585.66
585.76
585.88
586.10
586.31
586.32
586.33
586.34
586.36
586.37
585.42
585.08
584.90
584.71
584.72
583.70
583.71
583.72
583.88
583.89
584.05
584.07
583.40
583.21
582.90
583.11
582.06
582.07
581.41
581.69
581.70
581.71
581.33
581.38
580.95
581.16
581.31
580.44
580.45
580.90
580.91
580.39
580.28
580.29
580.15
579.92
579.45
558.67
557.96
558.18
558.35
557.64
557.68
557.88
557.89
557.21
557.38
556.64
557.01
556.38
556.39
556.40
556.41
556.42
556.02
555.83
555.86
554.82
554.84
555.35
554.65
554.14
554.16
554.03
553.81
553.85
553.88
553.37
553.38
553.39
553.58
553.59
553.72
552.67
552.70
552.71
552.85
553.04
552.63
552.08
551.73
551.89
551.38
551.39
551.11
551.12
551.15
551.16
550.86
550.87
550.90
550.91
550.41
529.37
529.38
529.33
528.66
528.84
528.95
528.96
528.97
529.08
529.09
528.38
528.39
528.40
528.02
527.86
527.88
527.89
527.91
527.92
527.67
527.35
527.38
526.85
526.86
526.87
527.04
527.05
526.68
526.36
526.38
526.33
525.65
525.67
525.68
525.04
525.01
525.02
524.91
523.80
523.84
523.71
523.77
523.36
523.03
522.86
522.37
522.38
521.35
521.36
521.37
521.80
521.81
521.90
522.04
522.33
495.17
495.18
495.27
495.28
494.79
494.34
494.35
494.58
493.99
494.00
494.28
493.66
493.33
493.34
492.86
492.87
493.28
493.29
492.33
492.34
492.35
492.36
492.77
492.79
492.80
492.28
491.88
491.86
491.38
491.67
490.34
490.35
490.36
490.37
490.63
490.78
490.79
490.95
490.03
489.68
489.76
488.60
488.79
488.81
488.98
489.30
488.34
488.55
488.30
487.54
486.94
487.29
486.36
486.59
485.94
485.97
486.04
486.05
486.31
485.33
452.98
453.24
452.35
452.37
451.37
451.61
452.24
452.25
452.27
451.25
451.13
451.14
451.19
451.20
451.22
450.30
450.23
449.63
449.29
449.31
449.32
448.28
448.29
448.31
449.18
449.21
449.22
445.20
445.28
444.62
444.79
445.08
445.11
444.27
443.30
443.77
442.56
443.26
442.33
442.20
441.33
441.31
440.91
441.23
441.26
440.36
440.34
439.32
439.77
440.23
440.26
440.32
439.29
439.30
439.24
438.38
438.75
438.78
438.26
437.79
438.20
437.25
436.60
436.61
436.80
422.69
423.23
423.24
422.21
422.23
421.75
409.22
409.23
409.24
409.26
408.34
408.68
409.20
396.23
396.24
396.26
396.27
396.28
396.29
395.27
395.28
395.24
394.76
395.18
394.24
394.28
394.18
394.19
392.32
392.61
392.62
392.64
392.65
392.75
393.18
393.19
392.28
392.15
392.13
391.29
391.33
391.68
391.26
391.22
391.19
390.68
390.73
390.26
390.18
390.21
390.22
388.71
389.08
388.24
387.30
387.25
387.19
387.21
387.22
386.28
386.29
386.30
386.31
386.32
386.21
386.23
385.66
386.11
386.12
386.16
386.17
386.18
386.19
385.24
384.74
384.75
384.77
385.16
384.30
384.25
384.27
384.28
383.66
383.83
383.98
384.17
384.18
384.19
383.24
383.27
383.16
383.17
383.18
382.24
382.25
382.27
382.28
381.31
381.72
381.28
381.29
381.22
380.73
381.18
381.19
380.32
380.33
380.26
380.20
380.21
379.20
379.21
379.22
378.29
378.30
378.31
378.32
378.33
379.15
378.21
378.22
378.23
378.24
377.76
376.34
377.21
376.20
376.21
376.22
376.23
376.24
376.25
376.26
376.27
376.28
376.29
375.32
314.19
314.16
313.24
313.68
313.18
312.25
312.27
312.36
313.13
312.22
312.23
312.15
312.19
310.24
310.26
310.29
310.31
311.15
311.17
311.18
309.24
309.25
310.13
310.14
310.15
310.16
310.18
307.23
307.24
306.18
306.19
306.20
306.22
306.25
305.18
287.18
288.13
288.14
288.16
288.19
287.13
287.14
286.31
286.32
286.18
286.09
286.10
286.14
286.15
285.17
284.62
283.28
284.11
284.12
284.13
284.14
284.15
284.16
284.17
284.29
284.30
283.09
282.20
282.13
282.14
282.15
282.16
281.24
281.13
280.18
280.25
280.28
281.08
279.45
279.46
279.23
279.31
248.12
248.13
245.15
245.11
244.12
244.26
242.14
242.28
243.11
243.12
243.13
243.16
242.12
241.10
240.12
240.14
240.18
239.14
238.08
237.19
235.17
235.18
234.12
234.13
234.14
235.12
230.08
230.09
230.11
227.12
228.11
228.12
228.27
229.10
227.08
226.13
226.17
226.25
226.11
225.07
224.17
223.12
223.13
224.12
222.06
222.10
222.11
221.10
221.11
221.12
219.14
219.16
219.17
219.19
220.10
220.11
219.10
218.03
218.09
218.10
218.11
218.12
217.09
435.27
435.80
436.22
436.25
436.27
436.28
436.29
434.76
435.20
435.22
434.26
434.28
434.29
434.30
433.30
433.31
433.32
433.33
434.20
434.22
433.21
433.22
432.74
420.70
420.30
420.31
419.30
419.69
420.20
420.21
420.25
420.26
420.27
419.19
417.69
418.24
418.27
418.28
418.29
418.30
418.31
417.28
417.29
417.18
416.69
415.29
415.32
415.69
415.78
416.19
416.20
416.22
416.23
416.24
415.21
414.70
414.77
414.78
414.29
413.97
414.19
414.20
413.69
413.23
413.24
413.25
413.21
411.30
412.19
412.20
412.21
412.26
412.30
412.70
412.74
412.75
413.19
411.20
411.22
411.23
411.24
411.26
410.18
410.19
410.21
410.23
0,1
0,0
-0,10
-0,05
0,00
0,05
PC2 (10,48%)
0,10
0,15
0,20
Figura 4.4 - Relação entre a primeira e a segunda componentes principais da matriz
Loadings dos íons gerados no modo positivo de ionização.
72
Tabela 4.1 – Valores de Loadings das componentes principais para os íons que se
destacaram na análise de PCA.
MODO DE IONIZAÇÃO
m/z
POSITIVO
PC1
PC2
+236,0793
+301,1421
+214,0954
+231,1290
+279,1611
+341,0800
+659,1751
+399,2561
+413,2709
+251,1327
+421,2469
+304,3084
0,684454 -0,10349 0,107077
0,325568 0,004969 -0,29972
0,230528 -0,04727 -0,03919
0,215602 -0,03948 -0,00819
0,205420 0,051045 -0,31461
0,191686 -0,07503 0,00456
0,152769 -0,06818 -0,01583
0,140356 -0,06933 -0,06802
0,105705 -0,00692 0,123154
0,097037 -0,02281 0,026246
0,068685 -0,06424 -0,01464
0,059467 -0,04944 -0,08046
PC3
m/z
NEGATIVO
PC1
PC2
PC3
-311,1768
-325,1923
-339,1999
-297,1509
-279,2350
-281,2493
-212,0733
-248,9611
-199,1728
0,641947
0,438636
0,387058
0,287925
0,149664
0,101099
0,093873
0,088545
0,073619
-0,25577
-0,10195
0,338495
-0,37763
0,437155
0,409953
0,08235
0,020879
0,271134
0,084932
-0,65209
0,076965
0,306287
-0,03529
-0,11074
0,162711
-0,13383
0,187697
Para cada um dos íons destacados na análise de PCA, foi feita a tentativa de elucidação
estrutural através do programa Formula Predictor. Para isso, foram inseridos os valores
exatos das massas calculadas, além dos seguintes parâmetros fixados como: C: 0 a 50, H: 0
a 100, N: 0 a 20, O: 0 a 20, F: 0 a 20 e P: 0 a 3, DBE: -0,5 a 50 (faixa padrão do
equipamento). Através desses cálculos, são geradas fórmulas elementares possíveis para
cada um dos compostos desconhecidos. Em seguida, estruturas químicas para cada uma
das fórmulas resultantes foram pesquisadas nas bases de dados NIST e Merck Index. As
elucidações estruturais correspondentes a cada um dos íons destacados são mostradas
abaixo.
4.2.1. Íons Deprotonados de m/z = -311,1768; -325,1923; -339,1999; -297,1509
Os íons negativos com os quatro maiores valores de PC1 apresentam valores de m/z iguais
a -311,1768; -325,1923; -339,1999 e -297,1509. Experimentos MS2 com colisão induzida
por argônio desses íons foram feitos, com o intuito de se obter os padrões de fragmentação,
e se revelaram iguais aos quatro íons. Os espectros de massa desses íons, nos modos MS1
MS2 , são mostrados na Figura 4.5.
73
4.0
311.1768
(a)
3.0
2.0
1.0
0.0
50.0
75.0
4.0
3.0
(b)
100.0
125.0
150.0
175.0
200.0
225.0
250.0
275.0
300.0
325.0
350.0
375.0
m/z
325.1923
2.0
1.0
0.0
25
1.5
50
75
100
125
150
175
200
225
250
275
m/
339.1999
(c)
1.0
0.5
0.0
300.0
325.0
350.0
375.0
400.0
425.0
450.0
475.0
500.0
297.1509
1.00
(d)
0.75
0.50
0.25
0.00
50.0
1.25
1.00
75.0
100.0
125.0
150.0
175.0
200.0
225.0
250.0
275.0
300.0
325.0
350.0
375.0
m/z
183.0105
197.0260
(e)
0.75
0.50
0.25
0.00
50.0
75.0
100.0
125.0
150.0
175.0
200.0
225.0
250.0
275.0
300.0
325.0
350.0
375.0
m/z
Figura 4.5 - Espectros de massas dos íons moleculares deprotonados do modo MS1 (a)
m/z=-311,1768; (b) m/z=-325,1923; (c) m/z=-339,1999; (d) m/z=-297,1509; e (e) espectro
de massas do modo MS2, comum às quatro substâncias.
O software utilizado revelou que, para os quatro íons, a relação isotópica entre o íon
molecular e seu isótopo acrescido de duas unidades de massa atômica (M-H+2) é
característica da presença de um átomo de enxofre (aproximadamente 4%). O espectro
74
m/z
resultante de experimentos MS2 com colisão induzida a argônio mostra um fragmento de
massa exata igual a m/z -183,0167 (fórmula calculada igual a C8H8SO3-), bem como um
fragmento de m/z -197,0274 (C9H10SO3-), possivelmente resultados da fragmentação de
diferentes isômeros de cadeia (Figura 4.6). O cromatograma específico dessas substâncias
(Figura 4.7) revela que essas substâncias não foram completamente resolvidas pela précoluna cromatográfica.
n(H2C)
H3C
H
C
(CH2)n'
CH3
SO3-
Figura 4.6 - Fragmentações provenientes dos íons investigados.
1.75
1.50
1.25
297.1509
311.1768
325.1923
339.1999
1.00
0.75
0.50
0.25
0.00
5.0
5.5
6.0
6.5
7.0
7.5
8.0
8.5
9.0
Figura 4.7 - Cromatograma específico dos íons de m/z=311,1768; 325,1923; 339,1999 e
297,1509.
A relação isotópica e os fragmentos característicos resultantes dos experimentos MS2,
foram inseridos no programa Formula Predictor, que calculou as possíveis fórmulas
moleculares referentes aos íons desconhecidos. O resultado é mostrado na Tabela 4.2.
75
Tabela 4.2 - Resultados gerados pelo programa Formula Predictor, na busca por fórmulas
correspondentes aos íons 311,1768; 325,1923; 339,1999 e 297,1509.
Íon Deprotonado m/z=311,1768
Fórmula
Proposta (M)
C20 H24 O3
C13 H28 O8
C17 H28 O3 S
Íon
m/z medido m/z calculado Diferença (mDa)
[M-H] -
311,1768
311,1653
11,5
[M-H]
-
311,1768
311,1711
5,7
[M-H]
-
311,1768
311,1686
8,2
Íon Deprotonado m/z=325,1923
Fórmula
Proposta (M)
C21 H26 O3
C18 H30 O3 S
Íon
m/z medido m/z calculado Diferença (mDa)
[M-H] - 325,1923
325,1809
[M-H] - 325,1923
325,1843
Íon Deprotonado m/z=339,1999
11,4
8,0
Fórmula
Proposta (M)
C19 H32 O3 S
C15 H32 O8
C22 H28 O3
[M-H] [M-H] [M-H] -
339,1999
339,1999
339,1999
339,1999
339,2024
339,1966
0,0
-2,5
3,3
C12 H36 O8 S
[M-H] -
339,1999
339,2058
-5,9
Íon
m/z medido m/z calculado Diferença (mDa)
Íon Deprotonado m/z=297,1509
Fórmula
Proposta (M)
C16 H26 O3 S
C15 H32 O8
C22 H28 O3
Íon
[M-H] [M-H] [M-H] -
m/z medido m/z calculado Diferença (mDa)
297,1509
297,1509
297,1509
297,1530
297,1496
297,1555
-2,1
1,3
-4,6
A busca por essas fórmulas nos bancos de dados disponíveis resultou na elucidação das
mesmas. As quatro correspondem a homólogos de LAS, de 11, 12, 13 e 10 átomos de
carbono na cadeia alquídica (C11-LAS, C12-LAS, C13-LAS e C10-LAS, respectivamente).
4.2.2. Íon Deprotonado de m/z = -279,2350
O íon negativo que, na análise de PCA, obteve o quinto maior valor entre as PC1,
apresentou m/z=-279,2350. Os espectros de massas, resultantes de experimentos MS1 e
MS2 (com fragmentação por colisão induzida) estão apresentados na Figura 4.8.
76
279.2350
1.00
(a)
0.75
0.50
0.25
255.2340
0.00
100
200
300
400
500
600
700
800
900
m/z
3.
2.
261.2139
(b)
2.
1.
1.
0.
0.
250.
252.
255.
257.
260.
262.
265.
267.
270.
272.
275.
277.
280.
282.
285.
287.
Figura 4.8 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-279,2350;
(b) espectro de massas dos fragmentos gerados por colisão induzida.
O espectro de massas gerado pelo experimento MS2 mostra a perda de uma molécula de
água (18,021 u.m.a) através da colisão induzida. Essa fragmentação é também observada
por Kerwin et al. (1995), que cita que em ácidos graxos com até duas insaturações, a
fragmentação principal é a perda de água do grupo carboxila. A fragmentação proposta é
representada na Figura 4.9.
Figura 4.9 - Fragmentação proposta para o íon m/z=-279,2350.
O programa Formula Predictor calculou, apenas com os dados supracitados, as possíveis
estruturas moleculares para o composto, mostradas na Tabela 4.3.
77
m/
Tabela 4.3 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 279,2350.
FÓRMULA (M)
ÍON
m/z MEDIDO
m/z CALCULADO DIFERENÇA (mDa)
C11 H30 N5 O3
[M-H] -
279,2350
279,2276
7,4
C12 H33 N4 O P
[M-H] -
279,2350
279,2319
3,1
C16 H30 N3 O
[M-H] -
279,2350
279,2316
3,4
C14 H35 N O2 P
[M-H] -
279,2350
279,2333
1,7
C18 H32 O2
[M-H] -
279,2350
279,2330
2,0
Após a busca nos banco de dados disponíveis, a última fórmula mostrada na Tabela 4.3
(C18H32O2) foi selecionada, correspondente ao ácido linoléico.
4.2.3. Íon Deprotonado de m/z = -281,2493
Um dos íons a serem identificados apresenta relação massa/carga igual a -281,2493. A
Figura 4.10 mostra os espectros obtidos nas análises.
2.5
2.0
281.2493
(a)
1.5
1.0
0.5
0.0
275
276
277
278
279
280
281
282
283
284
285
286
287
288
289
m/z
1.25
1.00
(b)
263.2322
0.75
0.50
0.25
110.07
267.1988
0.00
110
120
130
140
150
160
170
180
190
200
210
220
230
240
250
260
m/z
Figura 4.10 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-281,2493;
(b) espectro de massas dos fragmentos gerados por colisão induzida.
O espectro mostrado na Figura 4.10b mostra fragmentos com m/z iguais a -110,0751
(fragmento não identificado); -263,2322 (referente a perda de água) e -267,1988 (referente
a perda de um fragmento CH2), de acordo com a Figura 4.11.
78
O
O-
-H2O
-CH2
-
O
O
O-
Figura 4.11 - Fragmentações propostas obtidas nos experimentos MS2 provenientes do íon
m/z=-281,2493.
Através desses dados, o programa calculou as possíveis fórmulas para o composto. Com os
parâmetros-padrão estabelecidos, o calculo feito pelo software resultou em 10 compostos,
mostrados na Tabela 4.4.
Tabela 4.4 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a -281,2493.
FÓRMULA (M)
ÍON
m/z MEDIDO
m/z CALCULADO DIFERENÇA (mDa)
C13 H36 N3 O S
[M-H] -
281,2493
281,2506
-1,3
C14 H37 N O2 P
[M-H] -
281,2493
281,2489
0,4
C18 H34 O2
[M-H] -
281,2493
281,2486
0,7
C12 H35 N4 O P
[M-H] -
281,2493
281,2476
1,7
C16 H32 N3 O
[M-H] -
281,2493
281,2473
2,0
C15 H38 O2 S
[M-H] -
281,2493
281,2520
-2,7
C15 H40 P2
[M-H] -
281,2493
281,2532
-3,9
C15 H39 P S
[M-H] -
281,2493
281,2437
5,6
C11 H32 N5 O3
[M-H] -
281,2493
281,2432
6,1
C12 H34 N4 O3
[M-H] -
281,2493
281,2558
-6,5
Uma extensa busca foi feita nos bancos de dados, que encontrou a fórmula C18H34O2 como
a ideal, a qual caracteriza o ácido oléico.
4.2.4. Íon Deprotonado de m/z = -212,0733
O ânion de relação massa/carga -212,0733 foi destacado na análise de PCA. O resultado
das análises referente a ele são apresentados na Figura 4.12.
79
4.0
(a)
3.5
212.0733
3.0
2.5
2.0
226.9790
1.5
1.0
199.1709
0.0
200.0
205.0
210.0
7.0
6.0
241.1805
213.0751
0.5
215.0
220.0
225.0
230.0
235.0
240.0
m/z
325.0
m/z
148.1165
(b)
5.0
4.0
3.0
2.0
1.0
0.0
50.0
75.0
100.0
125.0
150.0
175.0
200.0
225.0
250.0
275.0
300.0
Figura 4.12 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-212,0733;
(b) espectro de massas dos fragmentos gerados por colisão induzida.
O espectro de massas no modo MS1 mostra que vários outros íons estão presentes no
espectro do íon pré-selecionado. Provavelmente, isso ocorre devido à cromatografia não
satisfatória nesse instante, uma vez que esses íons podem estar relacionados a outros
compostos que, eventualmente, não foram resolvidos apenas com a pré-coluna usada nos
experimentos.
A Figura 4.12b mostra que a fragmentação do íon molecular resultou apenas no fragmento
de m/z 148,1165. O software de cálculo estrutural indica que esse fragmento pode
equivaler à estrutura do fragmento C8H4O3-, característico da classe dos ftalatos. Em
relação ao cálculo da estrutura por completa, o programa não retornou qualquer fórmula
quimicamente possível: foram propostas nove fórmulas (Tabela 4.5) e a pesquisa feita nos
bancos de dados não retornou resultado positivo sobre qualquer uma delas. Essas
observações levam a crer que esse composto é da classe dos ftalatos, ou um subproduto de
degradação deles. Entretanto não foi possível apenas com a presente técnica, desvendar a
estrutura dessa substância por completo.
80
Tabela 4.5 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 212,0733.
FÓRMULA (M)
ÍON
m/z MEDIDO
m/z CALCULADO DIFERENÇA (mDa)
C9 H4 N2 O3 P2
[M-H] -
212,0733
212,0751
-1,8
C7 H2 N5 O2 P2
[M-H] -
212,0733
212,0737
-0,4
C5 H7 N3 O3 P3
[M-H] -
212,0733
212,0789
-5,6
C13 H N O3 P
[M-H] -
212,0733
212,0717
1,6
4.2.5. Íon Deprotonado de m/z = -248,9611
Um dos compostos destacados na análise de PCA apresenta m/z exata igual a -248,9611.
Seus espectros, resultados das análises nos modos MS1 e MS2 são apresentados na Figura
4.13.
1.0
(a)
0.7
248.9611
0.5
0.2
0.0
200.
205.
210.
215.
220.
225.
230.
235.
240.
245.
250.
255.
260.
265.
270.
275.
280.
285.
290.
295.
m/
154.9736
2.0
(b)
1.5
152.9787
1.0
204.9694
0.5
112.9905
0.0
50.0
75.0
100.0
125.0
150.0
175.0
200.0
225.0
250.0
275.0
m/z
Figura 4.13 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-248,9611;
(b) espectro de massas dos fragmentos gerados por colisão induzida.
As fragmentações observadas no modo MS2 serviram como dados de entrada no programa
Formula Predictor, o qual gerou os seguintes resultados como prováveis fórmulas
elementares (Tabela 4.6).
81
Tabela 4.6 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 248,9611.
FÓRMULA (M)
ÍON
m/z MEDIDO
m/z CALCULADO DIFERENÇA (mDa)
C9 H4 N2 O3 P2
[M-H] -
248,9611
248,9624
-1,3
C7 H2 N5 O2 P2
[M-H] -
248,9611
248,9611
0,0
C5 H7 N3 O3 P3
[M-H] -
248,9611
248,9627
-1,6
C13 H N O3 P
[M-H] -
248,9611
248,9621
-1,0
C8 H3 N4 O2 P S
[M-H] -
248,9611
248,9642
-3,1
C4 H6 N5 O2 P2 S
[M-H] -
248,9611
248,9645
-3,4
C6 H9 N2 O P3 S
[M-H] -
248,9611
248,9576
3,5
C12 H2 N3 P2
[M-H] -
248,9611
248,9651
-4,0
C10 H6 N O P2 S
[M-H] -
248,9611
248,9573
3,8
A pesquisa pelas estruturas correspondentes às fórmulas foi realizada nos bancos de dados
disponíveis, entretanto nenhuma delas gerou um resultado satisfatório. Portanto, conclui-se
que as informações disponíveis não foram suficientes para a elucidação estrutural dessa
substância.
4.2.6. Íon Deprotonado de m/z = -199,1728
O valor de m/z de um dos íons destacados na análise de PCA foi determinado como sendo
igual a -199,1728, e os espectros resultantes das análises espectrométricas nos modos MS1
e MS2 são ilustrados na Figura 4.14.
199.1728
(a)
5.0
0.0
50.0
75.0
100.0
125.0
150.0
175.0
200.0
225.0
250.0
275.0
300.0
325.0
350.0
375.0
m/z
175.0
200.0
225.0
250.0
275.0
300.0
325.0
350.0
375.0
m/z
133.0662
1.0
(b)
0.5
0.0
50.0
75.0
100.0
125.0
150.0
Figura 4.14 - (a) Espectro de massas do íon molecular deprotonado, com m/z=-199,1728;
(b) espectro de massas dos fragmentos gerados por colisão induzida.
Inserindo as informações espectrométricas do íon molecular, bem como a fragmentação
observada na Figura 4.14b no programa Formula Predictor, obtiveram-se, como resultado,
apenas duas fórmulas elementares possíveis, de acordo com a Tabela 4.7. Não foi possível
82
predizer, entretanto, a fórmula elementar exata para o fragmento gerado na colisão
induzida por argônio, de m/z igual a -133,0662.
Tabela 4.7 - Possíveis composições elementares das estruturas moleculares referentes ao
íon negativo de m/z igual a 199,1728.
FÓRMULA (M)
ÍON
m/z MEDIDO
m/z CALCULADO DIFERENÇA (mDa)
C10 H22 N3 O
[M-H] -
199,1728
199,1690
3,8
C12 H24 O2
[M-H] -
199,1728
199,1704
2,4
A busca por essas fórmulas nos bancos de dados da NIST e Merck Index indicou a
estrutura como o ácido láurico (C12H24O2).
A tentativa de elucidação estrutural dos micropoluentes destacados pela análise de
componentes principais no modo de ionização positiva não gerou nenhum resultado
quimicamente possível. As estruturas do modo de ionização negativa estão apresentadas na
Figura 4.15.
83
NOME DO
FÓRMULA
MASSA MOLAR
COMPOSTO
MOLECULAR
EXATA (u.m.a)
C10-LAS
C16H25SO3H
298,1603
C11-LAS
C17H27SO3H
C12-LAS
C18H29SO3H
326,1916
C13-LAS
C19H31SO3H
340,2072
ÁCIDO LÁURICO
C12H2402
ESTRUTURA
312,1759
O
200,1776
OH
ÁCIDO
LINOLEICO
C18H32O2
280,2402
282,2589
ÁCIDO OLEICO
C18H34O2
FTALATO
N.A.
213,0811
N.A.
N.A.
249,9689
N.A.
SUBSTÂNCIA
DESCONHECIDA
Figura 4.15 - Dados sobre as substâncias elucidadas. N.A. – não se aplica.
84
4.3. Monitoramento dos Compostos Elucidados no Sistema UASB-FBP
Uma vez conhecida a estrutura dos compostos destacados na análise de PCA, é de interesse
conhecer como esses poluentes se comportam durante o tratamento pelo qual foram
submetidos. Para isso, foram feitos gráficos boxplot, de cada ponto de coleta, em relação a
cada um dos poluentes.
4.3.1. Alquilbenzeno Sulfonados Lineares (LAS)
O comportamento dos LAS identificados na ETE é mostrado na Figura 4.16.
8
3
C 1- Nov embro 2007
4
C 2- Nov embro 2007
5
C 1- Nov embro 2007
6
C2- Nov embro 2007
C 1- Nov embro 2007
7
2
1
0
Origem
A
B C1 C2
C10-LAS
A
B C1 C2
C11-LAS
A
B C1 C2
C12-LAS
A
B C1 C2
C13-LAS
Figura 4.16 - Comportamento dos LAS durante o tratamento estudado.
Através da análise da Figura 4.16 observa-se comportamento similar de todos os poluentes
durante o tratamento. A biodegradação anaeróbia não é efetiva para remover esses
poluentes, que se concentra no lodo presente no reator UASB. Por outro lado, a etapa
aeróbia é capaz de degradar e remover de maneira eficaz o LAS do efluente sanitário, nas
condições operacionais da ETE em estudo.
A degradação aeróbia dos LAS inicia com a formação de carboxilados sulfofenílicos como
intermediários da biodegradação, resultando, então na perda de atividade interfacial e de
toxicidade em organismos presentes no meio ambiente. A biodegradação prossegue com a
clivagem do anel aromático e a completa conversão do LAS e intermediários em
85
substâncias inorgânicas (H2O, CO2, Na2SO4) e a incorporação de seus constituintes à
biomassa dos microorganismos (Tavares, 2008).
Tavares (2008) pesquisou a degradação dos LAS no mesmo sistema de tratamento aqui
estudado, resultados dos quais estão de acordo com os apresentados pela autora, que usou o
método analítico de substâncias ativas ao azul de metileno para quantificar os LAS
presentes em amostras afluentes e efluentes ao reator UASB. A autora acrescenta que o
aumento de concentração de LAS após o reator UASB seria devido à superestimação das
concentrações dos surfactantes aniônicos pelo método por ela utilizado, uma vez que o
mesmo está sujeito a interferentes presentes na própria amostra.
Uma vez que esse aumento de concentração foi percebido também na análise por
cromatografia líquida acoplada à espectrometria de massas aqui apresentada, e tendo em
vista que esse método é seletivo aos LAS e está livre das interferências supracitadas, outros
fenômenos parecem explicar essa observação. Hipoteticamente, pensa-se que o lodo
presente no reator UASB, uma vez já saturado desses surfactantes, libera, por lixiviação,
esses compostos em seu efluente, o que culminaria, então no aumento da concentração de
LAS observado.
O estudo de Berna et al. (1988) cita ainda que é observada a degradação anaeróbia parcial
do LAS, no entanto, usando-se os tempos de detenção hidráulica normalmente empregados
nos reatores UASB (sete a nove horas) a degradação desses compostos não é significativa.
4.3.2. Demais Compostos Destacados Pela PCA no Modo Negativo de Ionização
O perfil de degradação dos demais micropoluentes identificados no modo negativo de
ionização pode ser visto na Figura 4.17.
86
1
C1- Outubro 2007
B- Outubro 2007
A- Outubro 2007
C2- Outubro 2007
2
B- Agosto 2007
3
A - Nov embro 2007
Data
4
C1- Fev ereiro 2007
B- Maio 2007
5
C1- Fev ereiro 2007
6
0
Origem
A
Á
d
ci
o
lá
B C 1 C2
i co
ur
A
Ác
i
do
lin
o
B C1 C2
ic o
le
A
id
Ác
o
o
B C1 C 2
ic o
le
F
l
ta
at
o
o
nã
A
i
n
de
t if
B C1 C2
do
ic a
o
Nã
A
i
n
de
t if
B C1 C2
do
ic a
Figura 4.17- Perfis de monitoramento dos ácidos graxos láurico, linoléico e oléico, de um
ftalato e um composto não identificado, presentes no esgoto doméstico.
O ácido láurico, ou ácido dodecanóico, mostrou-se recalcitrante durante o tratamento
combinado, uma vez que as medianas das concentrações relativas permaneceram
praticamente constantes após os tratamentos anaeróbio e aeróbio. O ácido láurico é
suspeito de apresentar propriedades bactericidas e, sendo tóxico às bactérias presentes no
sistema de tratamento, a sua passagem incólume pelo sistema é explicada. O material de
preenchimento dos filtros biológicos percoladores não provocou diferença significativa na
remoção do composto.
O ácido oléico está presente em cosméticos como sabonetes, bronzeadores e protetores
solares, ao passo que o linoléico é encontrado em carnes e produtos lácteos. Esses
compostos parecem não serem tóxicos aos microorganismos degradadores de matéria
orgânica, uma vez que o perfil de degradação indica biodegradabilidade nos reatores
anaeróbio e aeróbio.
O ftalato e o composto não identificado se mostraram recalcitrante ao tratamento, tendo em
vista que suas medianas se mostraram praticamente constantes.
87
4.3.3. Compostos Destacados Pela PCA no Modo de Ionização Positivo
Os íons monitorados pelo espectrômetro de massas no modo positivo não puderam ter suas
estruturas elucidadas, uma vez que o software de identificação retornou inúmeros
resultados possíveis. No entanto, foi possível traçar o perfil de cada um deles no sistema de
tratamento em questão. Esses perfis são mostrados nas Figuras 4.18, 4.19 e 4.20.
9
8
7
6
B- Abril 2007
5
B- A bril 2007
4
3
2
1
0
Origem
A
B C1 C2
214,0954
A
B C1 C2
231,1290
A
B C1 C2
236,0793
A
B C1 C2
251,1327
Figura 4.18 - Perfis de monitoramento de íons positivos de estruturas não elucidadas
214,0954; 231,1290; 236,0793 e 251,1327, presentes no esgoto doméstico.
88
7
6
5
4
3
2
1
0
Origem
A
B C1 C2
279,1611
A
B C1 C2
301,1421
A
B C1 C2
304,3084
A
B C1 C2
341,0800
Figura 4.19 - Perfis de monitoramento de íons positivos de estruturas não elucidadas
279,1611; 301,1421; 304,3084; 341,0800, presentes no esgoto doméstico.
4
1
B- Outubro 2007
A- Janeiro 2008
A- Julho 2007
2
A - Janeiro 2008
3
0
Origem
A
B C1 C2
399,2561
A
B C1 C2
413,2709
A
B C1 C2
421,2469
A
B C1 C2
659,1751
Figura 4.20 - Perfis de monitoramento de íons positivos de estruturas não elucidadas
399,2561; 413,2709; 421,2469 e 659,1751, presentes no esgoto doméstico.
89
O comportamento dessas substâncias no sistema de tratamento mostra, de maneira geral, a
possível síntese dos mesmos nos reatores. Todos os compostos apresentaram maior
concentração dos pontos C1 e/ou C2, em relação ao B, o que indica que esses íons são
sintetizados no filtro biológico percolador. Assim sendo, é provável que sejam subprodutos
de degradação de outros compostos, não completamente mineralizados pela ETE.
4.4. Compostos-Alvo Encontrados Durante o Tratamento Biológico de Esgotos
Sanitários
Quatro amostras, cada uma coletada em um dos pontos do sistema de tratamento (mês de
janeiro de 2008), foram analisadas no modo MS2 do espectrômetro de massas, objetivandose encontrar alguns micropoluentes previamente selecionados (Tabela 4.8 e Figura 4.21), e
avaliar como se comportam durante o tratamento pelo qual foram submetidos através de
uma análise semi-quantitativa (quantificação relativa ao padrão interno). Os compostos
dibutilftalato, bisfenol A, nonilfenol e bezafibrato foram escolhidos como os compostosalvo para essa pesquisa, uma vez que são freqüentemente reportados na literatura, seja
devido ao potencial risco decorrente da exposição (ex. bezafibrato), à elevada concentração
com que ocorrem nas águas naturais (ex. bisfenol e nonilfenol) ou à freqüência com que
ocorrem em matrizes ambientais (ex. dibutilftalato). Apenas as amostras coletadas em
janeiro de 2008, as quais foram escolhidas ao acaso, foram analisadas neste estudo, devido
ao curto período de tempo para finalização do presente projeto de pesquisa e
indisponibilidade integral do instrumento analítico.
A cada uma delas foi adicionada a mesma quantidade de um padrão interno, a fim de
corrigir as eventuais variações de resposta instrumental entre as diferentes amostras. Uma
vez que o resultado dessa correção (quociente da divisão da área do analito pela área do
padrão interno) é diretamente proporcional à concentração daquele analito em um dado
instante do tratamento; logo, através dele, é possível acompanhar a variação da
concentração do poluente ao longo do tratamento, caracterizando uma análise semiquantitativa.
Para cada uma das substâncias pesquisadas nesse experimento, apresenta-se aqui, a caráter
ilustrativo, o cromatograma e espectro de massas apenas da amostra, que foi coletada no
ponto A (esgoto bruto) no mês de janeiro de 2008. Isso foi feito, uma vez que os perfis
90
obtidos são semelhantes para outras amostras (coletadas em outros pontos e em outros
meses).
Tabela 4.8 - Composto-alvo selecionados para o estudo de comportamento de degradação
na ETE.
Amostra
Dibutilftalato
Bisfenol A
Nonilfenol
Bezafibrato
A-Janeiro 2008
100,0%
100,0%
15,35%
100,0%
B-Janeiro 2008
93,10%
84,10%
34,90%
81,93%
C1-Janeiro 2008
79,31%
7,630%
100,0%
34,67%
C2-Janeiro 2008
55,17%
8,272%
98,60%
38,05%
Substância
Dibutilftalato
Bisfenol A
Nonilfenol
Bezafibrato
Estrutura
Molecular
Figura 4.21- Estruturas moleculares dos compostos-alvo.
4.4.1. Dibutilftalato
O dibutilftalato é uma substância amplamente utilizada na indústria. Dentre suas principais
aplicações, destacam-se os ramos de tintas para impressoras, adesivos, cosméticos, como o
esmalte para unhas, e plastificante para polímeros, sobretudo o PVC, sendo essa a
utilização responsável por 75% de seu consumo. A literatura reporta que o dibutilftalato
está associado ao desenvolvimento anormal do sistema reprodutivo humano (Colon et al.,
2000) e disfunções metabólicas no fígado, coração, cérebro, além de afetar o nível de
lipídeos no sangue (Bell et al., 1982). Esses efeitos adversos justificam a preocupação com
o seu comportamento durante o tratamento de efluentes domésticos, bem como a
eliminação desse poluente do meio ambiente. O espectro de massas do dibutilftalato é
mostrado na Figura 4.22, e a Figura 4.23 demonstra o comportamento da substância ao
longo do sistema de tratamento em estudo.
91
3.5
277.1494
3.0
(a)
2.5
2.0
1.5
1.0
0.5
0.0
0.0
2.5
5.0
7.5
10.0
12.5
15.0
17.5
9.0
8.0
(b)
277.1494
7.0
6.0
5.0
4.0
3.0
2.0
1.0
0.0
279.1471
272.5
275.0
277.
280.0
285.2031
282.5
285.0
287.
290.0
292.5
295.0
297.
300.0
302.5
305.0
Figura 4.22 - (a) cromatograma e (b) espectro de massas do dibutilftalato, modo MS1,
mostrando o íon molecular do poluente (m/z=277,1494). Os outros íons referem-se a
compostos não identificados, que coeluiram com o dibutilftalato ao longo da
cromatografia.
Através da análise do cromatograma e do espectro de massas percebe-se que vários outros
poluentes coeluiram juntamente com o composto-alvo. Certamente, o uso de uma coluna
cromatográfica adequada promoveria uma melhor separação entre o dibutilftalato e as
demais substâncias que com ele coeluem, contribuindo para a redução do efeito supressivo
da matriz ambiental.
92
m/z
Degradação do dibutilftalato ao longo do tratamento
100,00%
90,00%
80,00%
70,00%
60,00%
50,00%
40,00%
30,00%
20,00%
10,00%
0,00%
A-Janeiro 2008
B-Janeiro 208
C1-Janeiro 2008
C2-Janeiro 2008
Figura 4.23 - Perfil da concentração do dibutilftalato relativa à do padrão interno, em
diferentes pontos da ETE, onde: A- esgoto bruto (entrada do UASB); B- saída do
UASB/entrada do FBP; C1- saída do FBP (conduíte); C2- saída do FBP (pedra britada).
O perfil de degradação do dibutilftalato ao longo do tratamento indica baixa eficiência do
sistema na remoção desse poluente. Apenas 20,69% da concentração do poluente que
entrou no sistema foi removido pelo FBP com leito em conduíte (ponto C1) e 44,83% com
o leito em pedra britada (C2). O tratamento anaeróbico demonstrou-se, também, pouco
eficiente, uma vez que promoveu a redução de apenas 6,90%. Uma hipótese válida é que o
dibutilftalato, supostamente presente nas aparas de conduíte, poderia ser lixiviado e
incorporar-se ao esgoto tratado, o que aumentaria a concentração desse poluente nesse
ponto do tratamento, contribuindo, assim, para a percepção errônea de menor remoção
quando comparado ao filtro preenchido com pedra britada.
O baixo percentual de remoção observado demonstra que o sistema em estudo não é eficaz
na degradação do dibutilftalato, permitindo que o mesmo chegue aos corpos receptores nos
quais os efluentes desse sistema são lançados. Uma vez que é uma substância de potencial
risco à saúde e ao meio ambiente, suspeita de provocar danos ao sistema endócrino de
seres a ela expostos (ex. anfíbios e peixes) por um longo período de tempo e baixa
concentração, é preocupante que existam corpos d’água potáveis que contenham esse
poluente, mesmo em baixas concentrações.
93
4.4.2. Bisfenol A
O bisfenol A é uma substância orgânica amplamente utilizada na indústria de
transformação. Produtos contendo essa substância estão disponíveis no mercado mundial a
mais de cinco décadas, e suas utilizações são inúmeras, as quais abrangem a síntese de
poliésteres, polissulfonas, policetonas, policarbonatos (utilizados na fabricação de artigos
esportivos, lentes, dispositivos eletrônicos, CD’s e DVD’s), garrafas e resinas epóxi
(revestimento de enlatados), antioxidante em plastificantes e já foi usado como fungicida.
A produção mundial de bisfenol A em 2003 foi estimada em dois milhões de toneladas
(Lang et al., 2008).
Esse poluente apresenta baixa toxicidade (DL50 igual a 3250mg/Kg para ratos), entretanto,
a longo prazo, interfere no sistema endócrino, onde mimetiza hormônios naturais dos
organismos, causando efeitos adversos, como doenças cardiovasculares, diabetes tipo 2 e
obesidade, e anomalias nas enzimas do fígado, e até mesmo desenvolvimento de câncer
(principalmente câncer de mama e próstata), quando acontece exposição por tempo
prolongado (Lang et al., 2008, West et al., 2001). É conhecido que o bisfenol A pode ser
lixiviado da camada plástica que existe nas latas de alimentos e de artefatos de
policarbonato quando lavados com produtos ácidos ou líquidos a altas temperaturas,
levando à exposição humana via oral, respiratória ou cutânea (Lang et al., 2008). O
cromatograma no modo MS2, bem como o espectro de massas do íon molecular do
poluente são mostrados na Figura 4.24, enquanto o perfil de remoção do bisfenol A é
ilustrado na Figura 4.25.
94
6.0
227.1060
5.0
(a)
4.0
3.0
2.0
1.0
0.0
0.0
9.0
2.5
5.0
7.5
10.0
12.5
15.0
17.5
(b)
8.0
227.1060
7.0
6.0
5.0
4.0
3.0
2.0
1.0
0.0
220.0
222.5
225.0
227.5
230.
232.5
235.0
237.5
240.0
242.5
245.0
247.5
250.0
252.
255.0
257.5
260.0
262.5
265.0
m/z
Figura 4.24 - (a) cromatograma e (b) espectro de massas do íon molecular do bisfenol A.
O cromatograma mostra aparentemente que não houve co-eluição do bisfenol A com
qualquer outro composto de relação m/z semelhante, indicando que a cromatografia
realizada apenas usando a pré-coluna é satisfatória na análise desse composto. O espectro
de massas mostra a presença de picos de intensidade menor que a do íon referente ao
poluente. Provavelmente, esses picos decorrem do ruído causado pela matriz complexa das
amostras de esgoto.
Degradação do bisfenol A durante o tratamento
100,0%
90,0%
80,0%
70,0%
60,0%
50,0%
40,0%
30,0%
20,0%
10,0%
0,0%
A-Janeiro 2008
B-Janeiro 208
C1-Janeiro 2008
C2-Janeiro 2008
Figura 4.25 - Perfil de degradação do bisfenol A no sistema de tratamento de efluentes
estudado. A- esgoto bruto (entrada do UASB); B- saída do UASB/entrada do FBP; C1saída do FBP (conduíte); C2- saída do FBP (pedra britada).
95
O tratamento anaeróbio se demonstrou pouco eficaz na eliminação do poluente (15,9%), ao
passo que a degradação aeróbia reduziu a concentração de bisfenol A em 92,37% e
91,73%, respectivamente para o filtro preenchido com pedra britada e aparas de conduíte.
A pequena diferença no percentual de degradação entre as duas seções do filtro biológico
percolador (1,0%) indica que o material de preenchimento não influencia na remoção do
poluente.
Da mesma forma, West et al. (2001) reportam a rápida biodegradabilidade aeróbia do
poluente (60% da concentração inicial reduzida, em oito dias) em testes de escala em
laboratório, e Dorn et al. (1987) reporta que a mineralização do bisfenol A atingiu 50% no
período de quatro dias, em amostras reais de efluentes e seus corpos d’água receptores.
Uma vez comprovada a rápida biodegradação do bisfenol A em um sistema aeróbio de
tratamento, é de se esperar que o descarte de efluentes não deva ser uma fonte tão
importante dessa substância quanto alimentos enlatados e artefatos de plástico, os quais
incluem esse plastificante em sua formulação. De qualquer forma, organismos que entram
em contato com o bisfenol A continuamente e em baixas concentrações são susceptíveis
aos seus efeitos adversos.
4.4.3. Nonilfenol
O nonilfenol é um composto orgânico pertencente ao amplo grupo dos alquilfenóis. É
produzido como subproduto da produção de surfactantes polietoxilados, usados na
manufatura de lã, metais, plásticos, pesticidas, alguns detergentes e cosméticos. Por
definição, os surfactantes são substâncias que apresentam, em sua estrutura molecular, uma
cadeia alquídica (fração apolar) e uma fração polar, característica que confere ampla
distribuição da substância em um sistema de tratamento de efluentes e no meio ambiente: a
fração polar possibilita a solubilização em águas residuais e em corpos receptores,
enquanto a fração apolar permite o acúmulo em sedimentos no leito de rios e no lodo dos
sistemas de tratamentos biológicos.
Um dos precursores do nonilfenol, o nonilfenol polietoxilado, é degradado prontamente ao
atingir o sistema biológico de tratamento de efluentes. O mecanismo de degradação desse
surfactante sob condições aeróbias (Figura 4.26) implica a oxidação da função álcool a
96
ácido carboxílico, seguido pela clivagem de unidades de ácido acético da fração etoxilada
(Teurneau, 2004). A completa mineralização do nonilfenol, incluindo a quebra de seu anel
aromático, foi reportada por Ying et al. (2002) como acontecendo apenas em condições
aeróbias.
Figura 4.26 - Metabolismo microbiano aeróbio dos alquilfenóis etoxilados. Adaptado de:
Ahel et al., 1994.
O nonilfenol, bem como outros alquilfenóis etoxilados, interfere no sistema endócrino de
animais e seres humanos expostos a eles no meio ambiente, principalmente em rios que
continuamente recebem o efluente de ETEs (Ahel et al., 1994; Moreira, 2008).
97
O cromatograma e espectro de massas do íon molecular do nonilfenol gerados nesse
experimento são ilustrados na Figura 4.27, e a Figura 4.28 mostra o perfil desse poluente
ao longo do tratamento estudado.
1.75
219.1731
(a)
1.50
1.25
1.00
0.75
0.50
0.25
0.00
0.0
2.5
4.5
7.5
10.0
12.5
15.0
17.5
219.1731
5.5
5.0
5.0
(b)
4.0
3.5
3.0
2.5
2.0
1.5
1.0
0.5
0.0
217.5
220.0
222.5
225.0
227.5
230.0
232.5
235.0
237.5
m/z
Figura 4.27 - (a) cromatograma e (b) espectro de massas do nonilfenol.
Perfil do nonilfenol durante o tratamento
100,00%
90,00%
80,00%
70,00%
60,00%
50,00%
40,00%
30,00%
20,00%
10,00%
0,00%
A-Janeiro 2008
B-Janeiro 208
C1-Janeiro 2008
C2-Janeiro 2008
Figura 4.28 - Perfil do comportamento do nonilfenol no sistema experimental UASB-FBP,
onde: A- esgoto bruto (entrada do UASB); B- saída do UASB/entrada do FBP; C1- saída do
FBP (conduíte); C2- saída do FBP (pedra britada).
98
A cromatografia, realizada apenas com uma pré-coluna, foi capaz de separar o nonilfenol
(tempo de retenção igual a 6,0min) de outras substâncias presentes na amostra, como
mostra o cromatograma da Figura 4.27. O espectro de massas indica a presença de outros
picos, provavelmente provenientes do ruído instrumental, elevado quando a matriz da
amostra é demasiadamente complexa, como é o caso do esgoto doméstico.
O perfil de comportamento do nonilfenol indica, em um primeiro momento, a ineficácia do
sistema em degradar esse composto. Percebe-se a síntese do poluente ao longo do
tratamento, uma vez que o nonilfenol é um sub-produto da degradação de nonilfenóis
polietoxilados presentes no esgoto doméstico. O efluente do reator UASB mostrou-se com
concentração superior ao esgoto bruto (aumento de, aproximadamente, 127%). O efluente
do FBP apresentou-se com o valor mais elevado do poluente dentre os pontos monitorados.
Não houve diferença significativa entre as remoções promovidas pelos filtros biológicos
percoladores preenchidos com os diferentes materiais (1,4%). De fato, Teurneau (2004) e
Ying et al. (2002) citam que, em condições anaeróbias, ocorre a progressiva diminuição da
cadeia do nonilfenol etoxilados, e conseqüente produção de nonilfenol.
Entretanto, segundo Ying et al. (2002), Soares et al. (2003), e Teurneau (2004) em
condições aeróbias, o nonilfenol é completamente mineralizado a gás carbônico e água,
ocorrendo, inclusive, o rompimento do anel benzênico. Logo, era de se esperar uma
diminuição da concentração relativa nos pontos C1 e C2, em relação ao efluente do UASB,
o que não ocorre, segundo a Figura 4.28. Como a matriz do esgoto é demasiadamente
complexa, uma hipótese que poderia explicar o fato mostrado é a ocorrência de uma
significativa supressão do sinal nas amostras com elevada concentração de matéria
orgânica (esgoto bruto e efluente do reator UASB), fenômeno não muito acentuado nas
amostras de efluente tratado (pontos C1 e C2).
4.4.4. Bezafibrato
O bezafibrato é uma droga usada no tratamento da diabetes e hiperlipidemia, doença
caracterizada pelo aumento da concentração de lipídeos no sangue, ajudando a reduzir os
níveis de lipoproteínas de baixa densidade (LDL) e triglicerídeos, e elevar o nível de
lipoproteínas de alta densidade (HDL). Com isso, a retirada de colesterol da corrente
sanguínea é favorecida, controlando a concentração lipídica no organismo. A interferência
nos mecanismos enzimáticos do fígado é o principal efeito colateral observado em
99
pacientes que utilizaram essa droga (Radjenovic et al., 2007). O cromatograma e espectro
de massas característicos do íon molecular negativo do bezafibrato são mostrados na
Figura 4.29, e a Figura 4.30 ilustra o comportamento do bezafibrato presente no esgoto
doméstico, desde o momento em que atinge a ETE até o descarte no corpo receptor.
1.4
1.3
1.2
1.1
1.0
0.9
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
(b)
360.1063
380.0863
369.1669
347.5
350.0
352.5
355.0
357.5
360.0
362.5
365.0
367.5
370.0
372.5
375.
377.
380.0
Figura 4.29 - (a) cromatograma e (b) espectro de massas correspondentes ao bezafibrato.
Degradação do bezafibrato ao longo do tratamento
100,00%
90,00%
80,00%
70,00%
60,00%
50,00%
40,00%
30,00%
20,00%
10,00%
0,00%
A-Janeiro 2008
B-Janeiro 208
C1-Janeiro 2008
C2-Janeiro 2008
Figura 4.30 - Comportamento do bezafibrato ao longo do sistema de tratamento de
efluentes sanitários em estudo.
100
m/z
A eliminação do bezafibrato pelo sistema de tratamento se mostrou parcialmente eficaz,
com a diferença média entre o afluente e efluente final igual a 64%. O tratamento
anaeróbio promoveu a redução de 18,07% da droga presente no esgoto afluente à estação.
A diferença entre as remoções promovidas pelos FBP preenchidos com pedra britada e
conduíte não se mostrou significativa.
Radjenovic et al. (2007) reportam que o bezafibrato foi um dos fármacos que apresentou
maior concentração na entrada do sistema de uma estação estudada (21,6g/dia), e sua
remoção foi de 48,4%, em um sistema de lodos ativados. Acredita-se que o mecanismo da
remoção do bezafibrato de águas residuais em sistemas de tratamento biológico acontece
pela adsorção no lodo.
É provável que a presença de cloro, dois anéis aromáticos e um grupo nitro adjacente a eles
em sua estrutura, torne essa molécula altamente estável e tóxica aos microorganismos, o
que explicaria a considerável resistência à degradação microbiana.
4.5. Análise Crítica
Em um primeiro momento, experimentos no modo fullscan no modo negativo foram
realizados, objetivando a aquisição de um espectro total (fingerprint) das amostras. Com
esse resultado aliado a uma análise de componentes principais (PCA), foi possível a
seleção dos íons de maior relevância nas amostras, os quais foram selecionados para a
identificação estrutural, através de seus íons moleculares. Ainda mais, experimentos
MS/MS foram realizados para gerar fragmentos dos compostos e auxiliar na elucidação das
estruturas dos poluentes presentes nas amostras. Finalmente, as composições elementares
resultantes foram buscadas nos bancos de dados Merck Index e NIST.
A informação precisa das massas, aliada aos íons produzidos nos experimentos de
fragmentação MS2 no equipamento HPLC-MS-IT-TOF possibilitou a elucidação de
estruturas de poluentes presentes em um sistema simplificado de tratamento de esgotos, se
mostrando uma ferramenta poderosa e de importante aplicabilidade no campo da análise
ambiental.
101
Posteriormente, foram feitas análises no modo MS2, objetivando analisar qualitativamente,
em uma amostra de esgoto bruto, a presença de alguns compostos-alvo que, segundo a
literatura, podem ser encontrados no esgoto bruto e em águas superficiais. Os seguintes
compostos foram buscados: nonilfenol, bisfenol A, dibutilftalato e bezafibrato. Esse tipo de
análise é seletiva e sensível o bastante para se detectar compostos presentes na complexa
matriz que é o esgoto doméstico, em concentrações muito reduzidas.
A separação cromatográfica realizada nesse estudo foi realizada apenas com uma précoluna, a qual efetivamente conseguiu discriminar algumas substâncias, diminuindo,
assim, a quantidade de substâncias a serem ionizadas pela interface electronspray e
amenizando o efeito supressivo da matriz ambiental carregada, facilitando a detecção dos
íons relevantes. Apesar de uma separação cromatográfica realmente efetiva ser desejável
para facilitar ainda mais a detecção e análise espectrométrica, o trabalho de desenvolver tal
método é demasiadamente laborioso, tendo em vista a quantidade inumerável de
compostos presente nas amostras. Ainda mais, tal metodologia se faz desnecessária, uma
vez que o espectro de massas de alta resolução é capaz de identificar separadamente
substâncias que apresentem relações m/z muito próximas, mesmo que não estejam sequer
pouco discriminadas.
Com o intuito de corrigir os efeitos de supressão de sinal espectrométrico pela matriz
complexa, o uso de um padrão interno, adicionado às amostras anteriormente à analise foi
realizada. Entretanto, o ideal é que o padrão interno utilizado para normalizar o sinal dos
analitos apresente resposta o mais semelhante possível ao dos mesmos (motivo pelo qual
são usados, como padrão interno, compostos deuterados), característica que a substância
utilizada como padrão interno nesse estudo certamente não apresenta, mas que, mesmo
assim, foi válida para a análise semi-quantitativa. Além do mais, seria interessante também
a aquisição de padrões dos compostos estudados, para a finalidade de comparar o espectro
de uma substância desconhecida, por exemplo, com a de um padrão de substância a qual é
suspeita, para a confirmação estrutural definitiva.
Algumas limitações intrínsecas à técnica devem ser levadas em consideração. A
necessidade de se escolher um parâmetro de relevância, no caso, o destaque quando
realizado um teste quimiométrico de componentes principais, deixa de lado a análise de
102
vários outros íons, potencialmente correspondentes a outros micropoluentes. Outro fator
importante é que devido às diferentes respostas do sistema instrumental aos diferentes
analitos, áreas maiores e, conseqüentemente, o destaque na análise de PCA, não implicam,
necessariamente, em maiores concentrações. Isso significa que um analito pode apresentar
uma estrutura que implicará em um sinal de grande intensidade no cromatograma, mas não
necessariamente ele está em maior concentração do que outro composto que não apresenta
boa resposta no detector. Ainda mais, a interface utilizada restringe a análise a compostos
facilmente ionizáveis, excluído, então, compostos de baixa polaridade, que poderiam ser
analisados em interfaces do tipo APCI ou APPI, ou ainda utilizando-se um sistema GCMS/TOF.
103
5. Conclusões
O presente trabalho teve como foco principal o desenvolvimento de uma técnica analítica
que combina a cromatografia líquida de alta performance e espectrometria de massas de
alta resolução para a pesquisa sobre micropoluentes encontrados em um sistema de
tratamento de efluentes domésticos simplificado.
Os resultados aqui obtidos possibilitaram a identificação de micropoluentes provenientes
das mais diversas fontes: desde fármacos como o bezafibrato, ao bisfenol A, substância
utilizada na manufatura de artefatos de plástico, todas de uso rotineiro nos grandes centros
urbanos.
A partir da identificação dos poluentes em várias etapas do tratamento e empregando-se a
adição de um padrão interno como método semi-quantitativo, foi possível traçar o
comportamento dos micropoluentes ao longo do sistema e perceber o efeito de diferentes
reatores biológicos (UASB e FBP) sobre eles. A falta de padrões de cada uma das
substâncias não permitiu mensurar as concentrações de cada um dos micropoluentes de
interesse.
De um modo geral, os procedimentos analíticos desenvolvidos (amostragem, extração por
SPE e análise por LC-MS-IT-TOF) se mostraram eficientes, tanto na pesquisa por
compostos
desconhecidos,
quanto
por
compostos
pré-selecionados.
A
elevada
sensibilidade do equipamento instrumental aliada à sua alta seletividade, ambas obtidas
pela configuração dos espectrômetros de massas em série, possibilitaram a análise
satisfatória dos poluentes apenas com o uso de uma pré-coluna cromatográfica. No entanto,
o uso de uma coluna de maior comprimento certamente facilitaria a aquisição dos
espectros de massas pelo equipamento e a interpretação dos espectros pelo analista. Ainda
mais, o método desenvolvido possibilita a análise qualitativa e semi-quantitativa de toda a
gama de substâncias polares que possam estar presente em águas residuárias de qualquer
natureza, tratadas ou não, desde que adaptado para elas.
Uma vez percebendo que os reatores biológicos anaeróbio e aeróbio combinados ainda não
são suficientes para a total remoção de vários micropoluentes recalcitrantes presentes nos
104
efluentes domésticos, é possível concluir que chegam ao meio ambiente nos corpos d’água
receptores, atingindo e prejudicando os seres vivos e até o ser humano, que com eles
entram em contato, mesmo que em doses reduzidas e constantemente.
Futuras pesquisas direcionadas por esse estudo podem acarretar na inclusão de parâmetros
de lançamento para vários micropoluentes na legislação ambiental brasileira, ou até mesmo
no banimento de algumas dessas substâncias dos processos de manufatura de objetos ou
produtos utilizados no dia-a-dia das grandes metrópoles. Para isso, se fazem necessários
estudos adicionais para o completo conhecimento dos riscos referentes à exposição crônica
a eles. Mesmo na incorporação de novas substâncias a produtos de consumo, é importante
conhecer os mecanismos de toxicidade e degradação nas ETE’s.
105
6. Sugestões Para Trabalhos Futuros
Para futuros trabalhos, sugere-se o estudo de outros poluentes presentes no sistema
(antiinflamatórios, antibióticos, perturbadores endócrinos), pré-selecionados por outros
critérios, como a toxicidade, por exemplo. O uso de técnicas como GC-MS, que possui
uma biblioteca de espectros bem definida, facilitaria a identificação de uma maior gama de
micropoluentes, sendo aplicável para ampliar o conhecimento nessa área. Uma vez
definidas algumas substâncias-alvo, pesquisas quantitativas poderiam ser desenvolvidas,
através da aquisição de padrões e o uso do modo MS2.
A comparação do perfil de remoção de certos micropoluentes entre diferentes sistemas de
tratamento de efluentes poderia ser feita, baseando-se nas metodologias aqui aplicadas, o
que seria aplicável na decisão de implantação de ETEs.
106
7. Referências Bibliográficas
AGÜERA A., FERNÁNDEZ-ALBA A. R., PIEDRA L., MÉZCUA M., GÓMEZ M. J.
Evaluation of triclosan and biphenylol in marine sediments and urban wastewaters by
pressurized liquid extraction and solid phase extraction followed by gas chromatography
mass spectrometry and liquid chromatography mass spectrometry. Analytica Chimica Acta,
v. 480, p.193–205, 2003.
AHEL, M., HRSAK, D., GIGER, W. Aerobic transformation of short-chain alkylphenol
polyethoxylates by mixed bacterial cultures. Archives of Environmental Contamination
and Toxicology, v.26, p.540-548, 1994.
ALMEIDA, P. G. S., DUTRA, P. R., MONTEIRO, T. A. S., OLIVEIRA, J. M.,
CHERNICHARO, C. A. L. Filtros biológicos percoladores utilizados no pós-tratamento de
efluentes de reatores UASB: efeito de diferentes tipos de meios de suporte na remoção de
N-amoniacal. Anais do 24° Congresso Brasileiro de Engenharia Sanitária e Ambiental.
ABES, versão digital (CD), 2007a.
ALMEIDA, P. G. S. Efeitos dos diferentes tipos de meio suporte no desempenho de filtros
biológicos percoladores aplicados ao pós-tratamento de efluentes de reatores UASB, com
ênfase na nitrificação. Dissertação de Mestrado do programa Mestrado em Saneamento,
Meio Ambiente e Recursos Hídricos – Escola de Engenharia, Universidade Federal de
Minas Gerais, Belo Horizonte, Brasil, 2007b.
ALONSO, M. C., CASTILLO, M., BARCELÓ D. Solid-phase extraction procedure of
polar benzene- and naphthalenesulfonates in industrial effluents followed by unequivocal
determination with ion-pair chromatography/electrospray-mass spectrometry. Analytical
Chemistry, v.71, p.2586-2593, 1999.
AMARAL, M. C. S. Caracterização de lixiviados empregando parâmetros coletivos e
identificação de compostos. Dissertação de Mestrado do programa Mestrado em
Saneamento, Meio Ambiente e Recursos Hídricos – Escola de Engenharia, Universidade
Federal de Minas Gerais, Belo Horizonte, Brasil, 2007.
107
ANDREOZZI R., CESARO, R., MAROTTA, R., PIROZZI, F. Evaluation of
biodegradation kinetic constants for aromatic compounds by means of aerobic batch
experiments. Chemosphere, v.62, p.1431-1436, 2006.
AQUINO, S. F. ; CHERNICHARO, C. A. L. Acúmulo de ácidos graxos voláteis (AGVs)
em reatores anaeróbios sob condições de estresse: causas e estratégias de controle.
Engenharia Sanitária e Ambiental, v. 10, n. 2, p. 152-161, 2005a.
AQUINO, S. F., SILVA, S. Q., CHERNICHARO, C. A. L. Considerações práticas sobre o
teste de demanda química de oxigênio (DQO) aplicado a análise de efluentes anaeróbios.
Engenharia Sanitária e Ambiental, v.11, p.295-304, 2005b.
AQUINO, S. F. Caracterização da DQO efluente de sistemas de tratamento biológico.
Engenharia Sanitária Ambiental, v.8, p.135-144, 2003.
AQUINO, S. F. Formation of soluble microbial products (SMP) in anaerobic reactors
during stress conditions. Tese de Doutorado - Departamento de Engenharia Química e
Tecnologia Química, Imperial College of Science Technology and Medicine, Londres,
2004.
BARCELÓ, D., PETROVIC, M. Challenges and achievements of LC-MS in
environmental analysis: 25 years on. Trends in Analytical Chemistry, v.26, n.1, p.2-11,
2007.
BARONTI, C., CURINI, R., D‘ASCENZO, G., DI CORCIA, A., GENTILI, A.,
SAMPERI, R. Monitoring natural and synthetic estrogens at activated sludge sewage
treatment plants and in a receiving river water. Environmental Science and Technology, v.
34, n.24, p.5059-5066, 2000.
BECK, I., BRUHN, R., GANDRASS, J., RUCK, W. Liquid chromatography–tandem mass
spectrometry analysis of estrogenic compounds in coastal surface water of the Baltic Sea.
Journal of Chromatography A, v. 1090, p.98-106, 2005.
108
BELL, F. B.: Effects of phthalate esters on lipid metabolism in various tissues, cells and
organelles in mammals, Environmental Health Perspectives, v. 45, p.41–50, 1982.
BERNA, J. L., COHEN, L., MORENO, A. Influence of LAS counterion and LABcharacteristics on the physicochemical properties of linear alkylbenzene sulfonate. Journal
of the American Oil Chemists Society, v.64, n.4, p.514-514, 1988.
BILLA, D. M., DEZOTTI, M. Fármacos no meio ambiente. Química Nova, v.26, n.4,
p.523-530, 2003.
BOBELDIJK, I., VISSERS, J. P. C., KEARNEY, G., MAJOR, H., VAN LEERDAM, J.
A. Screening and identification of unknown contaminants in water with liquid
chromatography and quadrupole-orthogonal acceleration-time-of-flight
tandem mass
spectrometry. Journal of Chromatography A, v.929, p.63-74, 2001.
BOBELDIJK, I., STOKS, P. G. M., VISSERCS, J. P. C., EMKEA, E., VAN
LEERDAMA, J. A., MUILWIJK, B., BERBEE, R., NOIJ, T. H. M. Surface and
wastewater quality monitoring: combination of liquid chromatography with (geno)toxicity
detection, diode array detection and tandem mass spectrometry for identification of
pollutants. Journal of Chromatography A, v.970, p.167-181, 2002.
BRUCHET, A., PROMPSY, C., FILIPPI, G., SOUALI, A. A broad spectrum analytical
scheme for the screening of endocrine disruptors (EDs), pharmaceuticals and personal care
products in wastewaters and natural waters. Water Science and Technology, v.46, n.3,
p.97–104, 2002.
BUSER, H-R., POIGER, T., MULLER, M. D. Occurrence and fate of the pharmaceutical
drug diclofenac in surface waters: rapid photodegradation in a lake. Environmental Science
and Technology, v.32, n.22, p.3449-4356, 1998a.
BUSER, H.-R.; MÜLLER, M. D. Occurrence of the pharmaceutical drug clofibric acid and
the herbicide mecoprop in various swiss lakes and in the north sea. Environmental Science
and Tecnology, v.32, p. 188-192, 1998b.
109
BUSER, H.-R., POIGER, T., MÜLLER, M. D. Occurrence and environmental behavior of
the chiral pharmaceutical drug ibuprofen in surface waters and in wastewater.
Environmental Science and Technology, v.33, n.15, p.2529-2535, 1999.
BYRNS, G. The fate of xenobiotic organic compounds in wastewater treatment plants.
Water Research, v.35, n.10, p.2523-2533, 2001.
CARBALLA, M., OMIL, F., LEMA, J. M., GARCÍA-JARES, C., RODRÍGUEZ, I.,
GÓMEZ, M., TERNES T. Behavior of pharmaceuticals, cosmetics and hormones in a
sewage treatment plant. Water Research, v.38, n.12, p.2918-2926, 2004.
CARBALLA, M., OMIL, F., LEMA, J. M. Removal of cosmetic ingredients and
pharmaceuticals in sewage primary treatment. Water Research, v.39, n°19, p. 4790-4796,
2005.
CARBALLA, M., OMIL, F., TERNES, T. A., LEMA, J. M. Fate of pharmaceutical and
personal care products (PPCPs) during anaerobic digestion of sewage sludge. Water
Research, v.41, n.10, p.2139-2150, 2007.
CASTILLO, M., BARCELÓ, D. Identification of polar toxicants in industrial wastewaters
using toxicity-based fractionation with liquid chromatography/mass spectrometry.
Analytical Chemistry, v.71, p.3769-3776, 1999.
CASTILLO, M., ALONSO, M. C., RIUA, J., REINKE, M., KLÖTER, G., DIZER, H.,
FISCHER, B., HANSEN, P. D., BARCELÓ, D. Identification of cytotoxic compounds in
European wastewaters during a field experiment. Analytica Chimica Acta, v.426, p.265277, 2001.
CHEN, H., TSENG, D., HUANG, S. Biodegradation of octylphenol polyethoxylate
surfactant Triton X-100 by selected microorganisms. Bioresource Technology, v.96,
p.1483-1491, 2005.
CHERNICHARO.C.A.L. (coordenador). Pós tratamentode efluentes de reatores
anaeróbios. PROSAB/FINEP, 1ª ed. Rio de Janeiro: Segrac, 2001. 544 p.
110
CIRJA, M., IVASHECHKIN, P., SCHÄFFER, A., CORVINI, P. F. X. Factors affecting
the removal of organic micropollutants from wastewater in conventional treatment plants
(CTP) and membrane bioreactors (MBR). Review Environment Science and
Biotechnology, v.7, p.61-78, 2008.
CLARA, M., STRENN, C. B., AUSSERLEITNER, M., KREUZINGER, N. Comparison
of the behavior of selected micropolutants in a membrane bioreactor and a conventional
wastewater treatment plant. Water Science and Technology, v.50, n.5, p.29-36, 2004.
COLON, I., CARO, D., BOURDONY, C. J. AND RASARIO, O. Identification of
phthalate ester in the serum of Toung Puerto Rican girls with premature breast
development. Environmental Health Perspectives, v. 108, p. 895–900, 2000.
CORCIA, A., COSTANTINO, A., CRESCENZI C., MARIMONI, E., SAMPERI, R.
Characterization of recalcitrant intermediates from biotransformation of the branched alkyl
side chain of nonylphenol ethoxylate surfactants. Environmental Science Technology, n.32,
p.2401-2409, 1998.
DAMSTRA, T. Global Assessment of the state-of-the-science of Endocrine Disruptors.
International Programme on Chemical Safety. Organização Mundial da Saúde, 2002.
DAUGHTON, C.G., TERNES, T. A. Pharmaceuticals and personal care products in the
environment: agents of subtle change? Environmental Health Perspectives, v.107, p.907938, 1999.
DESBROW, C., ROUTLEDGE, E. J., BRIGHTY, G. C., SUMPTER, J. P., WALDOCK,
M. Identification of estrogenic chemicals in STW effluent. 1. Chemical fractionation and
in vitro biological screening. Environmental Science and Technology, v.32, n.11, p.15491558, 1998.
DESTAILLATS, H., HUNG, H. M., HOFFMANN, M. R. Degradation of alkylphenol
ethoxylate surfactants in water with ultrasonic irradiation. Environmental Science
Technology, v.34, n.2, p.311-317, 2000.
111
DING, W. H., TZING, S. H. J. J. Analysis of nonylphenol polyethoxylates and their
degradation products in river water and sewage effluent by gas chromatography–ion trap
(tandem) mass spectrometry with electron impact and chemical ionization. Journal of
Chromatography A, v.824, p.79-90, 1998.
DORN, P. B., CHOU, C.S., GENTEMPO, J. J. Degradation of bisphenol A in natural
waters. Chemosphere, v.16, p.1501-1507, 1987.
EJLERTSSON, J., NILSSON, M. L., KYLIN, H., BERGMAN, Å., KARLSON, L.,
ÖQUIST, M., SVENSSON, B.H. Anaerobic degradation of nonylphenol mono- and
diethoxylates in digestor sludge, landfilled municipal solid waste, and landfilled sludge.
Environmental Science and Technology, v.33, p.301-306, 1999.
FARRÉ, M., KLÖTER, G., PETROVIC, M., ALONSO, M. C., ALDA, M. J. L.,
BARCELÓ, D. Identification of toxic compounds in wastewater treatment plants during a
field experiment. Analytica Chimica Acta, v. 456, p.19-30, 2002.
FARRÉ, M., PETROVIC, M., BARCELÓ, D. Recently developed GC/MS and LC/MS
methods for determining NSAIDs in water samples. Analytical & Bioanalytical
Chemistry, v.387, p.1203-1214, 2007.
FOLMAR, L. C., HEMMER, M., HEMMER, R., BOWMAN, C., FROLL, K.,
DENSLOW, N. D. Comparative estrogenicity of estradiol, ethynyl estradiol and
diethylstilbestrol in an in vivo, male sheepshead minnow (Cyprinodon variegatus),
vitellogenin bioassay. Aquatic Toxiclogy, v.49, p.77-88, 2000.
GALASSI, S., BENFENATI, E. Fractionation and toxicity evaluation of waste waters.
Journal of Chromatography A, v.889, p.149-154, 2000.
GHISELLI, G. Avaliação da Qualidade das Águas Destinadas ao Abastecimento Público
na Região de Campinas: Ocorrência e Determinação dos Interferentes Endócrinos (IE) e
Produtos Farmacêuticos e de Higiene Pessoal (PFHP). Tese de doutorado em química
analítica – Instituto de Química, UNICAMP, Campinas, Brasil, 2006
112
GONZÁLES, S., PETROVIC, M., BARCELÓ, D. Simultaneous extraction and fate of
linear alkylbenzene sulfonates, coconut diethanol amides, nonylphenol ethoxylates and
their degradation products in wastewater treatment plants, receiving coastal waters and
sediments in the Catalonian area (NE Spain). Journal of Chromatography A, v.1052,
p.111-120, 2004.
GONZÁLES, S., BARCELÓ, D., PETROVIC, M. Advanced liquid chromatography-mass
spectrometry (LC-MS) methods applied to wastewater removal and the fate of surfactants
in the environment. Trends in Analytical Chemistry, v. 26, n.2, p.116-124, 2007.
HARTIG, C., STORM, T., JEKEL, M. Detection and identification of sulphonamide drugs
in municipal waste water by liquid chromatography coupled with electrospray ionization
tandem mass spectrometry. Journal of Chromatography A, v.854, p.163-173, 1999.
HIRSCH, R., TERNES, T. A., HABERER, K., KRATZ, K.-L. Occurrence of antibiotics in
the aquatic environment. Science of Total Environment, v.225, p.109-118, 1999.
HOAI, P. M., TSUNOIB, S., IKEA, M., INUIB, N., TANAKAB, M., FUJITA, A. M.
Dicarboxylic degradation products of nonylphenol polyethoxylates: synthesis and
identification by gas chromatography-mass spectrometry using electron and chemical
ionization modes. Journal of Chromatography A, v.1061, p.115-121, 2004.
HUERTA-FONTELA, M., GALCERAN, M. T., VENTURA, F. Ultraperformance liquid
chromatography-tandem mass spectrometry analysis of stimulatory drugs of abuse in
wastewater and surface waters. Analytical Chemistry, v.79, p.3821-3829, 2007.
HUNTER, M., STEPHENSON, T., KIRK, P. W. W., PERRY, R., LESTER, J. N. Effects
of salinity gradients and heterotrophic microbial activity on biodegradation of
nitrilotriacetic acid in laboratory simulation of the estuarine environment. Applied and
Environmental Microbiology, v.51, n.5, p.919-925, 1986.
113
IBÁÑEZ, M., SANCHO, J. V., POZO, O. J., NIESSEN, W., HERNANDÉZ, F. Use of
quadrupole time-of-flight mass spectrometry in the elucidation of unknown compounds
present in environmental water. Rapid Communications in Mass Spectrometry, v.19,
p.169-178, 2005.
IVASHECHKIN, P., CORVINI, P. F. X., DOHMANN. Behaviour of endocrine disrupting
chemicals during the treatment of municipal sewage sludge. Water Science and
Technology, v.50, n.5, p.133–140, 2004.
JAHNKE, A., GANDRASS, J., RUCK, W. Simultaneous determination of alkylphenol
ethoxylates and their biotransformation products by liquid chromatography/electrospray
ionisation tandem mass spectrometry. Journal of Chromatography A, v.1035, p.115-122,
2004.
JONHSON, A. C., BELFROID, A., DI CORCIA, A. Estimating steroid oestrogen inputs
into activated sludge treatment works and observations on their removal from the effluent.
Science of Total environment, v.256, p.163-173, 2000.
JØRGENSEN, S. E., HALLING-SØRENSEN, B. Drugs in the Environment.
Chemosphere, v.40, p.691-699, 2000.
JOSS, A., KELLER, E., ALDER, A. C., GÖBEL, A., MCARDELL, C. S., TERNES, T.
A., SIEGRIST, H. Removal of pharmaceuticals and fragrances in biological wastewater
treatment. Water Research, v.39, p.3139- 3152, 2005.
KANETOSHI, A., OGAWA, H., KATSURA, E., KANESHIMA, H., MIURA, T.
Formation of polychlorinated dibenzo-para-dioxins upon combustion of commercial textile
products containing 2,4,4’-trichloro-2’hydroxydiphenyl ether (Irgasan DP300). Journal of
Chromatography A, v.442, p.289-299, 1988.
KERWIN, J. L., WIENS, A. M., ERICSSON, L. H. Identification of fatty acids by
electrospray mass spectrometry and tandem mass spectrometry. Journal of Mass
Spectrometry, v.31, n.2, p.184-192, 1998.
114
KIMURA, K., TOSHIMA, S., AMY, G., WATANABE, Y. Rejection of neutral endocrine
disrupting compounds (EDCs) and pharmaceutical active compounds (PhACs) by RO
membranes. Journal of Membrane Science, v.245, p.71-78, 2004.
KIMURA, K., HARA, H., WATANABE, Y. Removal of pharmaceutical compounds by
submerged membrane bioreactors (MBRs). Desalination, v.178, p.135-140, 2005.
KNEPPER, T. P., Mass spectrometric strategies for the analysis of polar industrial
chemicals and their by-products in wastewater and surface water. Journal of
Chromatography A, v.974, p.111-121, 2002.
KLOEPFER, A., GNIRSS, R., JEKEL, M., REEMTSMA, T. Occurrence of
benzothiazoles in municipal wastewater and their fate in biological treatment. Water
Science and Technology, v.50, n.5, p.203-208, 2004.
KOH, Y. K. K., CHIU, T. Y., BOOBIS, A., CARTMELL, E., SCRIMSHAW, M. D.,
LESTER, J. N. Treatment and removal strategies for estrogens from wastewater.
Environmental Technology, v.29, p.245-267, 2008.
KOLÁR, M., URBÁNEX, K. LÁTAL, T. Antibiotic selective pressure and development of
bacterial resistance. International Journal of Antimicrobial Agents, v.15, n.5, p.357-363,
2001.
KOLPIN, D. W., SKOPEC, M., MEYER, M. T., FURLONG, E. T., ZAUGG, S. D. Urban
contribution of pharmaceuticals and other organic wastewater contaminants to streams
during differing flow conditions. Science of Total Environment, v.328, p.119-130, 2004.
LANG, L. A., GALLOWAY, T. S., SCARLET, A., HENLEY, W. E., DEPLEDGE, M.,
WALLACE, R. B., MELZER, D. Association of urinary bisphenol A concentration with
medical disorders and laboratory abnormalities in adults. Journal of American Medical
Association, v.300, n.11, p.1303-1310, 2008.
115
LAPARA, T. M., NAKATSU, C. H., PANTEA, L. M., ALLEMAN, J. E. Aerobic
Biological Treatment of a Pharmaceutical Wastewater: Effect of Temperature on COD
Removal and Bacterial Community Development. Water Research, v.35, n.18, p.44174425, 2001.
LARSSON, D. G. J., ADOLFSSON-ERICI, M., PARKKONEN, J., PETTERSSON, M.,
BERG, A. H., OLSSON, P.-E., FÖRLIN, L. Ethinyloestradiol — an undesired fish
contraceptive? Aquatic Toxicology, v.45, p.91-97, 1999.
LAGANÀ A., BACALONI, A., DE LEVA, I., FABERI, A., FAGO, G., MARINO, A.
Analytical methodologies for determining the occurrence of endocrine disrupting
chemicals in sewage treatment plants and natural Waters. Analytica Chimica Acta, v.501,
p.79-88, 2004.
LANGFORD, K. H., SCRIMSHAWA, M. D., BIRKETTB, J. W., LESTER, J. N.
Degradation of nonylphenolic surfactants in activated sludge batch tests. Water Research,
v.39, p.870-876, 2005.
LEE, H., PEART, T. E., SVOBODA, M. L. Determination of endocrine-disrupting
phenols, acidic pharmaceuticals and personal-care products in sewage by solid-phase
extraction and gas chromatography-mass spectrometry. Journal of Chromatography A,
v.1094, p.122-129, 2005.
LUKACHKO, A. M. P. H. Endocrine Disrupters: A Scientific Perspective. The American
Council on Science and Health , 1999.
McKEON, D. M., CALABRESE, J. P., BISSONNNETTE, G., K. Antibiotic resistant
gram-negative bacteria in rural groundwater supplies. Water Research, v.29, n.8, p.19021908, 1995.
MOREIRA, D. S. Desenvolvimento de Metodologia Analítica por Cromatografia/
Espectrometria de massas para avaliação da ocorrência de Perturbadores Endócrinos em
Mananciais de Abastecimento na Região Metropolitana de Belo Horizonte. Dissertação de
116
Mestrado – Programa de Pós-graduação em Engenharia Ambiental, Universidade Federal
de Ouro Preto, Ouro Preto, Brasil, 2008.
NAKADA, N., YASOJIMA, M., OKAYASU, Y., KOMORI, K., TANAKA, H., SUZUKI,
Y. Fate of strogenic compounds and identification of ostrogenicity in a wastewater
treatment process. Water Science and Technology, v.53, n.11, p.51-63, 2006.
NETO, J. M. M. e MOITA, G. C. Uma introdução à análise exploratória de dados
multivariados. Química Nova, v.21, n.4, 1998.
NIMROD, A. C., BENSON, W. H. Environmental estrogenic effects of alkylphenol
ethoxylates. Critical Reviews in Toxicology, v.26, n°3, p.335-364, 1996.
OGUNFOWOKAN, A. O., TORTO, N., ADENUGA, A. A., OKOH, E. K., N. TORTO,
A. A. ADENUGA e E. K. OKOH. Survey of levels of phthalate ester plasticizers in a
sewage lagoon effluent and a receiving stream.
Environmental Monitoring and
Assessment, v. 118, p. 457–480, 2006.
ORVOS, D. R., VESTEEG, D. J., INAUEN, J., CAPDEVIELLE, M., ROTHENSTEIN,
A., CUNNINGHAM, V. Aquatic toxicity of triclosan. Environmental Toxicology and
Chemistry , v.21, n°7, p.1338-1349, 2002.
PETROVIC, M., GROS, M., BARCELÓ, D. Multi-residue analysis of pharmaceuticals in
wastewater by ultra-performance liquid chromatography–quadrupole–time-of-flight mass
spectrometry. Journal of Chromatography A, v.1124, p.68-81, 2006.
RADJENOVIC, J., PETROVIC, M., BARCELÓ, D. Analysis of pharmaceuticals in
wastewater and removal using a membrane bioreactor. Analytical & Bioanalytical
Chemistry, v.387, p.1365-1377, 2007.
REIS, R. W., ARAÚJO, J. C., VIEIRA, E. M. Hormônios sexuais estrógenos:
contaminantes bioativos. Química Nova, v.29, n.4, p.817-822, 2006.
117
SÁNCHEZ-MARTÍNEZ, M. L., AGUILAR-CABALLOS, M. P., EREMIN, S. A.,
GÓMEZ-HENS, A. Determination of linear alkylbenzenesulfonates in water samples by
immunoaffinity chromatography with fluorescence detection. Analytica Chimica Acta,
v.553, p.93-98, 2005.
SAPKOTA A., HEIDLER J., HALDEN R. U. “Detection of triclocarban and two cocontaminating chlorocarbanilides in US aquatic environments using isotope dilution liquid
chromatography tandem mass spectrometry”, Environmental Research, v.103, p.21-29,
2007.
SCHÖBERL, P. Basic principals of LAS biodegradation. Tensid Surfactant Detergent,
v.26, n.2, p.86-94, 1989.
SCHRÖDER, H. FR. Tracing of surfactants in the biological wastewater treatment process
and the identification of their metabolites by flow injection–mass spectrometry and liquid
chromatography–mass spectrometry and –tandem mass spectrometry. Journal of
Chromatography A, v. 926, p. 127-150, 2001.
SEGURA, P. A., GARCÍA-AC A., LAJEUNESSE, A., GHOSH, D., GAGNONB, C.,
SAUVÉ, S. Determination of six anti-infectives in wastewater using tandem solid phase
extraction
and
liquid
chromatography–tandem
mass
spectrometry.
Journal
of
Environmental Monitoring, v.9, p.307-313, 2007.
SHIMADZU CORPORATION. Introduction of LC-MS-IT-TOF. Apostila de treinamento,
2007.
STUMPF, M., TERNES, T. A., WILKEN, R., RODRIGUES, S. V., BAUMANNC, W.
Polar drug residues in sewage and natural waters in the state of Rio de Janeiro, Brazil. The
Science of Total Environment, v.225, p.135-141, 1999.
SOARES, A., GUIEYSSE, B., DELGADO, O., MATTIASSON, B. Aerobic degradation
of nonylphenol by cold adapted bacteria. Biotechnology Letters, v.25, p.731-738, 2003.
118
SOARES, A. MURTO, M. GUIEYSSE, B. Biodegradation of nonylphenol in a continuous
bioreactor at low temperatures and effects on the microbial population. Applied
Microbiology and Biotechnology, v.69, p.597-606, 2006.
SOUZA, P. P. Estudo da composição química de cachaças utilizando a técnica
espectrometria de massas com ionização electronspray e cromatografia gasosa
multidimensional abrangente. Tese de doutorado, Universidade Federal de Minas Gerais,
Belo Horizonte, Brasil, 2008.
TAVARES, F. V. F. Remoção de surfactantes aniônicos em filtros biológicos percoladores
com diferentes meios suporte aplicados ao pós-tratamento de efluentes de reatores UASB.
Dissertação de mestrado, Universidade Federal de Minas Gerais, Belo Horizonte, Brasil,
2008.
TCHOBANOGLOUS, G, METCALF & EDDY, I., BURTON, F. L., BURTON, F.,
STENSEL, H. D. Wastewater Engineering: Treatment and Reuse. 4ª edição. Nova Iorque:
McGraw-Hill Science Engineering, 2005.
TEN HULSCHER, Th. E. M., CORNELISSEN, G. Effect of temperature on sorption
equilibrium and sorption knetics of organic micropolutants – a review. Chemosphere, v.32,
n.4, p.609-626, 1996.
TERNES, T. A. Occurrence of drugs in German sewage treatment plants and rivers. Water
Research, v.32, n°11, p.3245-3260, 1998.
TERNES, T. A. e HIRSCH, R. Occurrence and behavior of x-ray contrast media in sewage
facilities and the aquatic environment. Environmental Science and Technology, v.34,
p.2741-2748, 2000.
TERNES, T. A. Analytical methods for the determination of pharmaceuticals in aqueous
environmental samples. Trends in Analytical Chemistry, v.20, n°8, p. 419-434, 2001.
119
TERZIC, S., MATOSIC, M., AHEL, M., MIJATOVIC, I. Elimination of aromatic
surfactants from municipal wastewaters: comparison of conventional activated sludge
treatment and membrane biological reactor. Water Science & Tecnology, v.51, n.8, p.447453, 2005.
TEURNEAU, B. Biodegradation of Nonylphenol Ethoxylates. Dissertação de mestrado em
Engenharia Química – Departamento de Biotecnologia; Universidade de Lund, Suécia,
2004.
VASSKOG, T., BERGER, U., SAMUELSEN, P., KALLENBORN, R., JENSEN, E.
Selective serotonin reuptake inhibitors in sewage influents and effluents from Tromsø,
Norway. Journal of Chromatography A, v.1115, p.187-195, 2006.
VON SPERLING, M. Princípios do Tratamento Biológico de Águas Residuárias:
Introdução à Qualidade das Águas e ao Tratamento de Esgotos. 3ª edição. Editora da
UFMG, Belo Horizonte, MG, 2005.
XIAO, X.-Y., MCCALLEY, D. V., MCEVOY, J. Analysis of estrogens in river water and
effluents using solid-phase extraction and gas chromatography–negative chemical
ionization mass spectrometry of the pentafluorobenzoyl derivatives. Journal of
Chromatography A, v.923, p.195-204, 2001.
WEST, R. J., GOODWIN, P. A., KLECKA, G. M. Assessment of the ready
biodegradability of bisphenol A. Bulletin of Environmental Contamination Toxicology,
v.67, p.106-112, 2001.
WU, R. S. S. The environmental impact of marine fish culture: towards a sustainable
future. Marine Pollution Bulletin, v.31, p.159-166, 1995.
120
YABUUCHI, E., YANO, I., OYAIZU, H., HASHIMOTO, Y., EZAKI, T., YAMAMOTO,
H. Proposals of Sphingomonas-paucimobilis
gen-nov and comb nov, Sphingonomas-
parapaucimobilis sp-nov, Sphingonomas-yanoikuyae sp-nov, Sphingonomas-Adhaesiva
np-nov, Sphingonomas-capsulata comb nov, and 2 genospecies of the genus
Sphingonomas. Microbiological Immunology, v.34, p.99-119, 1990.
YANG,
S.,
CHA,
J.,
CARLSON,
K.
Trace
analysis
and
occurrence
of
anhydroerythromycin and tylosin in influent and effluent wastewater by liquid
chromatography combined with electrospray tandem mass spectrometry. Analytical
Bioanalytical Chemistry, v.385, p.623-636, 2006.
YING, G. G., WILLIAMS, B., KOOKANA, R. Environmental fate of alkylphenols and
alkylphenol ethoxylates - a review. Environment International, v.28, n.3, p.215-226, 2002.
YOSHIOMOTO, T., NAGAI, F. FUJIMOTO, J., WATANABE, K., MIZUKOSHI, H.,
MAKINO, T., KIMURA, K., SAINO, H., SAWADA, H., OMURA, H. Degradation of
estrogens by Rhodococcus zopfi and Rhodococcus equi isolates from activated sludge in
wastewater treatment plants. Applied Environmental Microbiology, v.70, p.5283-5289,
2004.
ZWIENER, C., GLAUNER, T., FRIMMEL, F. H. Biodegradation of pharmaceutical
residues investigated by SPE-GC/ITD-MS and on-line derivatization. Journal of High
Resolution Chromatography, v.23, p. 474-478, 2000.
121
Baixar