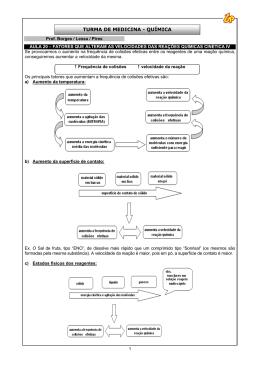
Química – Frente IV – Físico-química Prof. Vitor Terra Lista 08 – Cinética Química – Fatores que Alteram a Velocidade RESUMO EXERCÍCIOS PROPOSTOS Quanto maior for a temperatura, maior será a velocidade da reação. Quanto maior for a superfície de contato entre os reagentes, maior será a velocidade da reação. Uma forma de aumentar a superfície de contato de um reagente sólido é dividindo-o em partes menores, ou seja, deixando-o mais fragmentado. Quanto maior for a concentração dos reagentes, maior será a velocidade da reação* * a influência da concentração será vista com mais detalhes na próxima seção, sobre lei de velocidade. O catalisador: - aumenta a velocidade da reação; - diminui a energia de ativação; - não é consumido na reação; - não altera o ΔH; - não altera o rendimento da reação; - atua tanto na reação direta quanto na reação inversa (pois diminui a energia de ativação das duas) Catálise homogênea: catalisador e reagentes na mesma fase, formando um sistema homogêneo. Catálise heterogênea: catalisador e reagentes em fases diferentes, formando um sistema heterogêneo. Enzimas são catalisadores biológicos, constituídos por proteínas complexas. São altamente específicas (atuam em apenas um tipo de reação) e sensíveis à temperatura e ao pH. Auto-catálise: quando uma reação produz o seu próprio catalisador. Inibidor é uma substância que diminui a velocidade de uma reação (efeito inverso ao do catalisador). Promotor é uma substância que melhora a eficiência de um catalisador. 01. (Unifor-CE) Considerando os fatores que alteram a rapidez das transformações químicas, pode-se afirmar que uma fruta apodrecerá mais rapidamente se estiver: a) sem a casca, em geladeira. b) em pedaços, congelada. c) inteira, exposta ao sol. d) em pedaços, exposta ao sol. e) com a casca, exposta ao sol. 02. (UERJ) A sabedoria popular indica que, para acender uma lareira, devemos utilizar inicialmente lascas de lenha e só depois colocarmos as toras. Em condições reacionais idênticas e utilizando massas iguais de madeira em lascas e em toras, verifica-se que madeira em lascas queima com mais velocidade. O fator determinante, para essa maior velocidade da reação, é o aumento da: a) pressão b) temperatura c) concentração d) superfície de contato 03. (UFG) Em aquários, utilizam-se borbulhadores de ar para oxigenar a água. Para um mesmo volume de ar bombeado nesse processo, bolhas pequenas são mais eficientes, porque em bolhas pequenas a) a área superficial total é maior. b) a densidade é menor. c) a pressão é maior. d) a velocidade de ascensão é menor. e) o volume total é menor. 04. (PUC-MG) A água oxigenada ou solução aquosa de peróxido de hidrogênio (H2O2) é uma espécie oxidante bastante utilizada no dia-a-dia: descoloração dos cabelos, desinfecção de lentes de contato, de ferimentos, etc. A sua decomposição produz liberação de oxigênio e é acelerada por alguns fatores como a exposição à luz ou a catalisadores Fe2+(aq), Fe3+(aq) e Pt(s). Um estudo da cinética da reação 2H2O2 → O2 + 2H2O foi realizado seguindo as condições experimentais descritas na tabela a seguir: Tempo de duração do experimento t1 t2 t3 t4 Temperatura (°C) Catalisador 20 25 35 35 sem sem com sem Veneno é uma substância que diminui a eficiência de um catalisador (efeito inverso ao do promotor). CASD Vestibulares Química – Cinética Química 1 Assinale a opção que classifica, de forma CRESCENTE, os tempos de duração dos experimentos. a) b) c) d) t1, t3, t2, t4, t2, t4, t1, t3, t4, t2, t3, t1, t3. t1. t4 t2 a) Determine o valor da variação de entalpia desta reação, classificando-a como endotérmica ou exotérmica. b) Explique qual o efeito de um catalisador sobre a energia de ativação e sobre a variação de entalpia da reação. 07. (Unesp) Sobre catalisadores, são feitas as quatro afirmações seguintes. 05. (UFRN) Alguns medicamentos de natureza ácida, como vitamina C (ácido ascórbico) e aspirina (ácido acetilsalicílico), são consumidos na forma de comprimidos efervescentes. A efervescência desses comprimidos, responsável pela produção de gás carbônico, decorre da reação (abaixo representada) entre a substância ativa e um bicarbonato do excipiente. HA (aq) + HCO3- (aq) → A- (aq) + H2O (l) + CO2 (g) Um professor partiu desse acontecimento cotidiano para demonstrar a influência de certos fatores na velocidade de reação (ver figura abaixo). Primeiramente (I), pediu que os alunos medissem o tempo de dissolução de um comprimido efervescente inteiro num copo de água natural (25°C). Em seguida (II), sugeriu que repetissem a experiência, usando um comprimido inteiro, num copo de água gelada (5°C). Finalmente (III), recomendou que utilizassem um comprimido partido em vários pedaços, num copo de água natural (25°C). I - São substâncias que aumentam a velocidade de uma reação. II - Reduzem a energia de ativação da reação. III - As reações nas quais atuam não ocorreriam nas suas ausências. IV - Enzimas são catalisadores biológicos. Dentre estas afirmações, estão corretas, apenas: a) I e II. b) II e III. c) I, II e III. d) I, II e IV. e) II, III e IV. 08. (UNIRIO) Um dos objetivos do catalisador no sistema de descarga de um automóvel é o de converter os óxidos de nitrogênio em moléculas menos danosas ao ambiente. A função do catalisador na reação é a de: a) fortalecer as ligações no reagente. b) impedir a formação do produto. c) diminuir a velocidade de decomposição do NO(g). d) diminuir a energia cinética da reação. e) diminuir a energia de ativação da reação. 09. (PUC-RS - Adapt) Para responder à questão, analise as afirmativas abaixo. Os estudantes observaram que, em relação ao resultado do primeiro experimento, os tempos de reação do segundo e do terceiro foram, respectivamente: a) menor e maior. b) menor e igual. c) maior e igual. d) maior e menor. 06. (UFRJ) A figura a seguir apresenta a variação da entalpia ao longo do caminho de uma reação. I. Uma reação com energia de ativação 40 kJ é mais lenta que uma outra reação que apresenta energia de ativação igual a 130 kJ. II. A adição de um catalisador a uma reação química proporciona um novo "caminho" de reação, no qual a energia de ativação é diminuída. III. Um aumento de temperatura geralmente provoca um aumento na energia de ativação da reação. IV. A associação dos reagentes quando a eles é fornecida energia maior ou igual à energia de ativação constitui o complexo ativado. Pela análise das afirmativas, conclui-se que somente estão corretas: a) I e II b) I e III c) II e IV d) I, III e IV e) II, III e IV CASD Vestibulares Química – Cinética Química 2 10. (UFMG) Em dois experimentos, massas iguais de ferro reagiram com volumes iguais da mesma solução aquosa de ácido clorídrico, à mesma temperatura. Num dos experimentos, usou-se uma placa de ferro; no outro, a mesma massa de ferro, na forma de limalha. Nos dois casos, o volume total de gás hidrogênio produzido foi medido, periodicamente, até que toda a massa de ferro fosse consumida. Assinale a alternativa cujo gráfico melhor representa as curvas do volume total do gás hidrogênio produzido em função do tempo. 12. (Mackenzie) As seguintes afirmações referem-se ao diagrama energético dos caminhos A e B da reação “REAGENTES -> PRODUTOS”: I - Z representa a energia de ativação na presença de catalisador. II - Y representa a energia de ativação na presença de catalisador. III - X representa a variação de entalpia. IV - A velocidade de formação dos produtos é menor no caminho B. Somente são corretas: 11. (Fatec) Para se estudar a reação que ocorre entre magnésio e ácido clorídrico, três experimentos foram feitos: Experimento I - adicionou-se uma certa massa de magnésio a excesso de solução de ácido clorídrico, a 25°C, medindo-se o volume de hidrogênio produzido a cada 30 segundos. Experimento II - a massa de magnésio utilizada foi igual à metade da usada no experimento I, mantendo-se todas as outras condições inalteradas (volume do ácido, temperatura, tempo de recolhimento do gás). Experimento III - utilizaram-se as mesmas quantidades de magnésio e de ácido do experimento I, aquecendo-se a solução de ácido a 35°C.Os resultados obtidos foram colocados em um gráfico a) I e III. b) II e III. c) II e IV. d) III e IV. e) I e IV. 13. (UFSM- Adapt) A vitamina C é muito usada como aditivo de alimentos processados. Ela é oxidada pelo ar, o que protege outras substâncias presentes nos alimentos. Um certo alimento processado, inicialmente embalado a vácuo, é aberto e armazenado sob duas condições diferentes: em refrigerador a 4 °C e em armário fechado à temperatura ambiente, 25°C. O gráfico mostra a variação do teor de vitamina C em cada uma dessas condições. Analisando o gráfico, é correto afirmar que a velocidade de oxidação da vitamina C: As curvas que correspondem aos experimentos I, II e III são respectivamente, a) B, A, C. b) C, A, B. c) C, B, A. d) A, B, C. e) A, C, B. CASD Vestibulares a) é maior a 4°C do que a 25°C. b) aumenta com o aumento da temperatura de armazenagem do produto. c) diminui com o aumento da temperatura de armazenagem do produto d) não depende da temperatura de armazenagem do produto. e) é maior no refrigerador, por causa da umidade. Química – Cinética Química 3 14. (UFRGS) A deterioração de alimentos é ocasionada por diversos agentes que provocam reações químicas de degradação de determinadas substâncias. Alguns alimentos produzidos industrialmente, como embutidos à base de carne triturada, apresentam curto prazo de validade. Essa característica deve-se a um fator cinético relacionado com a) a presença de agentes conservantes. b) reações químicas que ocorrem a baixas temperaturas. c) a elevada concentração de aditivos alimentares. d) a grande superfície de contato entre os componentes do produto. e) o acondicionamento em embalagem hermética. 15. (UFRGS) O carvão é um combustível constituído de uma mistura de compostos ricos em carbono. A situação em que a forma de apresentação do combustível, do comburente e a temperatura utilizada favorecerão a combustão do carbono com maior velocidade é: a) Combustível - carvão em pedaços; Comburente - ar atmosférico; Temperatura 0°C. b) Combustível - carvão pulverizado; Comburente - ar atmosférico; Temperatura 30°C. c) Combustível - carvão em pedaços; Comburente oxigênio puro; Temperatura 20°C. d) Combustível - carvão pulverizado; Comburente oxigênio puro; Temperatura 100°C. e) Combustível - carvão em pedaços; Comburente oxigênio liquefeito; Temperatura 50°C. 16. (UFSM) Numere a segunda coluna de acordo com a primeira: 1. Catalisador 2. Veneno 3. Promotor ou ativador 4. Catálise homogênea 5. Catálise heterogênea 6. Autocatálise ( ) um dos produtos da reação age como catalisador da própria reação ( ) todos os participantes da reação constituem uma só fase ( ) há diminuição ou anulação do efeito catalisador ( ) há acentuação do efeito catalisador ( ) uma substância sólida catalisa a reação entre dois gases ou líquidos 17. (UFRRJ) A decomposição da água oxigenada sem catalisador exige uma energia de ativação de 18,0 kcal/mol. Entretanto, na presença de platina (catálise heterogênea) e de catalase (catálise homogênea) a energia de ativação cai para 12,0 e 5,0 kcal/mol, respectivamente, como pode ser observado no gráfico a seguir. a) A reação de decomposição é endo ou exotérmica? Justifique. b) Associe cada uma das curvas (a, b, c) com as condições de decomposição da água oxigenada. 18. (Fuvest) Para remover uma mancha de um prato de porcelana fez-se o seguinte: cobriu-se a mancha com meio copo de água fria, adicionaram-se algumas gotas de vinagre e deixou-se por uma noite. No dia seguinte a mancha havia clareado levemente. Usando apenas água e vinagre, sugira duas alterações no procedimento, de tal modo que a remoção da mancha possa ocorrer em menor tempo. Justifique cada uma das alterações propostas. 19. (Fuvest) Foram realizados quatro experimentos. Cada um deles consistiu na adição de solução aquosa de ácido sulfúrico de concentração 1 mol/L a certa massa de ferro. A 25°C e 1 atm, mediram-se os volumes de hidrogênio desprendido em função do tempo. No final de cada experimento, sempre sobrou ferro que não reagiu. A tabela mostra o tipo de ferro usado em cada experimento, a temperatura e o volume da solução de ácido sulfúrico usado. O gráfico mostra os resultados. A sequência correta é a) 6 - 4 - 2 - 3 - 5. b) 6 - 5 - 3 - 1 - 2. c) 3 - 4 - 2 - 6 - 5. d) 4 - 2 - 3 - 1 - 6. e) 4 - 2 - 6 - 3 - 5. CASD Vestibulares Química – Cinética Química 4 As curvas de 1 a 4 correspondem, respectivamente, aos experimentos. a) 1-D; 2-C; 3-A; 4-B b) 1-D; 2-C; 3-B; 4-A c) 1-B; 2-A; 3-C; 4-D d) 1-C; 2-D; 3-A; 4-B e) 1-C; 2-D; 3-B; 4-A 22. (Fuvest) Quando certos metais são colocados em contato com soluções ácidas, pode haver formação de gás hidrogênio. Abaixo, segue uma tabela elaborada por uma estudante de Química, contendo resultados de experimentos que ela realizou em diferentes condições. 20. (UFRJ) O Grito de Satanás nas Melancias in "Zé Limeira, Poeta do Absurdo" Orlando Tejo "Possantes candeeiros a carbureto iluminam a sala espaçosa pintada a óleo, refletindo a luz forte nas lentes escuras que protegem os grandes olhos firmes do poeta, sob as grossas pestanas negras." Em duas lanternas idênticas, carregadas com a mesma massa de carbureto, goteja-se água, na mesma vazão, sobre o carbureto. Na lanterna I, o carbureto encontra-se na forma de pedras e, na lanterna II, finamente granulado . a) Indique qual das lanternas apresentará a chama mais intensa. b) Indique qual delas se apagará primeiro. Justifique sua resposta, com base em seus conhecimentos de cinética química. 21. (Fuvest) A reação representada pela equação acima é realizada segundo dois procedimentos: H2SO4 + CH3COONa CH3COOH + Na2SO4 I. Triturando os reagentes sólidos. II. Misturando soluções aquosas concentradas dos reagentes. Após realizar esses experimentos, a estudante fez três afirmações: I. A velocidade da reação de Zn com ácido aumenta na presença de Cu. II. O aumento na concentração inicial do ácido causa o aumento da velocidade de liberação do gás H2. III. Os resultados dos experimentos 1 e 3 mostram que, quanto maior o quociente superfície de contato/massa total de amostra de Zn, maior a velocidade de reação. Com os dados contidos na tabela, a estudante somente poderia concluir o que se afirma em a) I. b) II. c) I e II. d) I e III. e) II e III. 23. (Unicamp) Soluções aquosas de água oxigenada, H2O2, decompõem-se dando água e gás oxigênio. A figura a seguir representa a decomposição de três soluções de água oxigenada em função do tempo, sendo que uma delas foi catalisada por óxido de ferro (III), Fe2O3. Utilizando mesma quantidade de NaHSO4 e mesma quantidade de CH3COONa nesses procedimentos, à mesma temperatura, a formação do ácido acético: a) é mais rápida em II porque em solução a freqüência de colisões entre os reagentes é maior. b) é mais rápida em I porque no estado sólido a concentração dos reagentes é maior. c) ocorre em I e II com igual velocidade porque os reagentes são os mesmos. d) é mais rápida em I porque o ácido acético é liberado na forma de vapor e) é mais rápida em II porque o ácido acético se dissolve na água. CASD Vestibulares a) Qual das curvas representa a reação mais lenta? Justifique em função do gráfico. b) Qual das curvas representa a reação catalisada? Justifique em função do gráfico. Química – Cinética Química 5 24. (UFPR) Na questão a seguir, escreva no espaço apropriado a soma dos itens corretos. No diagrama a seguir estão representados os caminhos de uma reação na presença e na ausência de um catalisador 26. (ENEM) O milho verde recém-colhido tem um sabor adocicado. Já o milho verde comprado na feira, um ou dois dias depois de colhido, não é mais tão doce, pois cerca de 50% dos carboidratos responsáveis pelo sabor adocicado são convertidos em amido nas primeiras 24 horas. Para preservar o sabor do milho verde pode-se usar o seguinte procedimento em três etapas: 1) descascar e mergulhar as espigas em água fervente por alguns minutos; 2) resfriá-las em água corrente; 3) conservá-las na geladeira. Com base neste diagrama, é correto afirmar que: 01) A curva II refere-se à reação catalisada e a curva I refere-se à reação não catalisada. 02) Se a reação se processar pelo caminho II, ela será, mais rápida. 04) A adição de um catalisador à reação diminui seu valor de ∆H. 08) O complexo ativado da curva I apresenta a mesma energia do complexo ativado da curva II. 16) A adição do catalisador transforma a reação endotérmica em exotérmica. Soma: ( ) 25. (UFMG) Em dois experimentos, soluções de ácido clorídrico foram adicionadas a amostras idênticas de magnésio metálico. Em ambos os experimentos, o magnésio estava em excesso e a solução recobria inteiramente esse metal. O gráfico a seguir representa, para cada experimento, o volume total de hidrogênio desprendido em função do tempo. Com relação a esses experimentos, assinale a afirmativa FALSA. a) A concentração do ácido no experimento I é igual a zero no tempo t = 80 s. b) A concentração do ácido usado no experimento I é menor do que a do ácido usado no experimento II. c) O volume de ácido usado no experimento II é maior do que o volume usado no experimento I. d) O volume total produzido de hidrogênio, no final dos experimentos, é maior no experimento II do que no I. A preservação do sabor original do milho verde pelo procedimento descrito pode ser explicada pelo seguinte argumento: a) O choque térmico converte as proteínas do milho em amido até a saturação; este ocupa o lugar do amido que seria formado espontaneamente. b) A água fervente e o resfriamento impermeabilizam a casca dos grãos de milho, impedindo a difusão de oxigênio e a oxidação da glicose. c) As enzimas responsáveis pela conversão desses carboidratos em amido são desnaturadas pelo tratamento com água quente. d) Micro-organismos que, ao retirarem nutrientes dos grãos, convertem esses carboidratos em amido, são destruídos pelo aquecimento. e) O aquecimento desidrata os grãos de milho, alterando o meio de dissolução onde ocorreria espontaneamente a transformação desses carboidratos em amido. 27. (Unesp) O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador. Com base no esquema, responda qual a curva que representa a reação na presença de catalisador. Explique sua resposta e faça uma previsão sobre a variação da entalpia dessa reação na ausência e na presença do catalisador. 28. (Unesp) A China, sede das Olimpíadas de 2008, foi o berço de muitas invenções e descobertas de grande impacto para a humanidade, como o papel, a bússola e a pólvora, entre outras. O uso bélico da pólvora implica a adequação da velocidade de sua queima ao tipo de arma a que se destina. Considerando-se a reação química da queima da pólvora, representada pela equação: 4KNO3 + 7C + S → 3CO2 + 3CO + 2N2 + K2CO3 + K2S CASD Vestibulares Química – Cinética Química 6 identifique a alternativa que corresponde à melhor opção para aumentar a velocidade da explosão da pólvora. a) Promover a reação sob atmosfera de N2. b) Utilizar pólvora previamente refrigerada. c) Utilizar pólvora finamente pulverizada. d) Utilizar excesso de carvão. e) Usar uma solução supersaturada de pólvora. 29. (IME-RJ) O gráfico abaixo ilustra as variações de energia devido a uma reação química conduzida nas mesmas condições iniciais de temperatura, pressão, volume de reator e quantidades de reagentes em dois sistemas diferentes. Estes sistemas diferem apenas pela presença de catalisador. Com base no gráfico, é possível afirmar que: a) A curva 1 representa a reação catalisada, que ocorre com absorção de calor. b) A curva 2 representa a reação catalisada, que ocorre com absorção de calor. c) A curva 1 representa a reação catalisada com energia de ativação dada por E1 + E3 d) A curva 2 representa a reação não catalisada, que ocorre com liberação de calor e a sua energia de ativação é dada por E2 + E3 e) A curva 1 representa a reação catalisada, que ocorre com liberação de calor e a sua energia de ativação é dada por E1. 30. (Fuvest) Para estudar a velocidade da reação que ocorre entre magnésio e ácido clorídrico, foram feitos dois experimentos a 15°C utilizando a mesma quantidade de magnésio e o mesmo volume de ácido. Os dois experimentos diferiram apenas na concentração do ácido utilizado. O volume de hidrogênio produzido em cada experimento, em diferentes tempos, foi medido a pressão e temperatura ambientes. Os dados obtidos foram: a) Em qual dos experimentos a velocidade da reação foi maior? Justifique com base nos dados experimentais. b) A curva obtida para o experimento I (15°C) está no gráfico acima. Neste mesmo gráfico, represente a curva que seria obtida se o experimento I fosse realizado a uma temperatura mais alta. Explique 31. (Unesp) Em duas condições distintas, a decomposição do NH4NO3, por aquecimento, conduz a diferentes produtos: I. NH4NO3 puro NH4NO3(s) → N2O(g) + 2H2O(g) + 169kJ II. NH4NO3 em presença de impurezas de cloreto: NH4NO3(s) → N2(g) + 2H2O(g) + 1/2O2(g) + 273kJ Explique, em termos de energia de ativação: a) Por que a decomposição do NH 4NO3 puro ocorre pelo processo representado em I, embora aquele representado em II corresponda a um processo mais exotérmico. b) O papel do íon cloreto na decomposição representada em II. 32. (Unesp) Na química atmosférica, os óxidos de nitrogênio desempenham um papel importante, mantendo e poluindo a atmosfera, e são conhecidos coletivamente como NOx. O óxido de nitrogênio, NO, contribui, como os clorofluorcarbonos, na destruição da camada de ozônio, segundo as reações: NO + O3 → NO2 + O2 (I) NO2 + O → NO + O2 (II) O resultado final dessas reações é a destruição de uma molécula de ozônio, O3 + O → 2O2. Considerando as reações (I) e (II): a) determine o número de oxidação do nitrogênio nos compostos presentes nas equações; b) indique, com justificativa, por que o NO é tão prejudicial na destruição da camada de ozônio. 33. (Fuvest) Um estudante desejava estudar, experimentalmente, o efeito da temperatura sobre a velocidade de uma transformação química. Essa transformação pode ser representada por: Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela: Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto? CASD Vestibulares Química – Cinética Química 7 a) Manter as amostras à mesma temperatura em todos os experimentos. b) Manter iguais os tempos necessários para completar as transformações. c) Usar a mesma massa de catalisador em todos os experimentos. d) Aumentar a concentração dos reagentes A e B. e) Diminuir a concentração do reagente B. 34. (Fuvest) Investigou‐se a velocidade de formação de gás hidrogênio proveniente da reação de Mg metálico com solução aquosa de HC . Uma solução aquosa de HC foi adicionada em grande excesso, e de uma só vez, sobre uma pequena chapa de magnésio metálico, colocada no fundo de um erlenmeyer. Imediatamente após a adição, uma seringa, com êmbolo móvel, livre de atrito, foi adaptada ao sistema para medir o volume de gás hidrogênio produzido, conforme mostra o esquema abaixo. DICAS Tente fazer o exercício primeiro antes de olhar as dicas. 01. Aqui são dois os fatores que vão influenciar na velocidade: a temperatura e a superfície de contato. Veja em qual das alternativas temos maior superfície de contato entre os reagentes E maior temperatura. 03. Imagine o ar bombeado como um reagente sólido. Bolhas grandes seriam como o reagente em pedaços, enquanto bolhas pequenas seriam como o reagente em pó. Ou seja, bolhas pequenas têm maior... Os dados obtidos, sob temperatura e pressão constantes, estão representados na tabela abaixo e no gráfico do item b. Tempo (min) 0 1 2 3 4 5 6 7 8 9 10 Volume de H2 acumulado (cm3) 0 15 27 36 44 51 57 62 66 69 71 a) Analisando os dados da tabela, um estudante de Química afirmou que a velocidade de formação do gás H2 varia durante o experimento. Explique como ele chegou a essa conclusão. Em um novo experimento, a chapa de Mg foi substituída por raspas do mesmo metal, mantendo‐se iguais a massa da substância metálica e todas as demais condições experimentais. b) No gráfico a seguir, esboce a curva que seria obtida no experimento em que se utilizou raspas de Mg. 04. Note que, quanto maior a velocidade da reação, menor o tempo de duração do experimento. Nessas questões de comparar vários experimentos, lembre-se que você só pode comparar experimentos que só possuam um fator diferente. Nesse caso, dá pra comparar a velocidade dos experimentos 1 e 2 (possuem apenas temperatura diferente), mas não dá pra comparar diretamente os experimentos 2 e 3, por exemplo. 05. Atenção: a questão está comparando os tempos de reação de cada experimento, e não a velocidade. Lembre-se de que, quanto maior o tempo de reação, menor a velocidade. 10. Limalha de ferro é a mesma coisa que ferro em pó. Note que, nos dois casos, foi usada a mesma massa de ferro e todo o ferro foi consumido. O que podemos afirmar sobre o volume total de H2 produzido nos dois experimentos? Lembre-se do gráfico visto em sala de aula, na parte sobre influência da superfície de contato. 11. Na curva A, o volume de H2 produzido foi metade do produzido nas curvas B e C. Ou seja, a massa de magnésio usada no experimento da curva A é metade da massa dos outros experimentos. Com isso, dá pra descobrir a qual experimento corresponde a curva A. Agora veja os dois experimentos restantes. Qual é a única diferença entre os dois? Como essa diferença influencia na velocidade da reação? 12. Lembre-se de que o catalisador diminui a energia de ativação. Assim, o caminho com menor energia de ativação é aquele na presença de catalisador. CASD Vestibulares Química – Cinética Química 8 15. Aqui são três os fatores que vão influenciar na velocidade: a temperatura, a superfície de contato e a concentração do reagente (oxigênio). Veja em qual das alternativas temos maior superfície de contato entre os reagentes, maior temperatura E maior concentração de oxigênio. 17. Note que a curva a é a de maior energia de ativação, seguida de b e de c. O enunciado diz quais são os valores da energia de ativação em cada uma das condições (sem catalisador, com platina e com catalase). 18. Fatores que podem diminuir o tempo de remoção da mancha: temperatura, superfície de contato, concentração de reagentes e catalisador. Quais desses fatores podem ser alterados sem usar outra substância (apenas água e vinagre) e sem danificar o prato? 19. Note que as curvas 1 e 2 levam a um maior volume de hidrogênio produzido do que as curvas 3 e 4. Isso quer dizer que foi utilizado mais reagente nas curvas 1 e 2 do que nas curvas 3 e 4. Como a massa de ferro é a mesma, então nas curvas 1 e 2 necessariamente foi usado mais ácido sulfúrico (H2SO4). Então temos 1-C e 2-D, ou 1-D e 2-C. Como saber qual é qual? Pela diferença na velocidade das duas. Note que a temperatura do experimento C foi maior do que a do experimento D. 20. A chama mais intensa ocorrerá na lanterna com maior velocidade de queima. No entanto, se a velocidade da queima for maior, isso quer dizer que o carbureto vai ser consumido mais rapidamente e a lanterna correspondente se apagará primeiro. 21. Usando reagentes sólidos, há pouco contato entre os reagentes. Quanto maior o contato entre os reagentes, maior vai ser... 22. Em todos os experimentos, a concentração inicial de ácido é a mesma. Logo, com os dados contidos na tabela, não se pode afirmar nada sobre a influência da concentração. Nos experimentos 1 e 3, note que a massa total da amostra de Zn é a mesma (1,0 g). Ou seja, o item III está afirmando que os resultados mostram que: “quanto maior a superfície de contato, maior a velocidade de reação”. 23. Use os “tracinhos” nos eixos do gráfico para comparar a velocidade média em cada uma das curvas (lembrando que velocidade média = variação da concentração / intervalo de tempo). A reação mais lenta será a que tiver menor velocidade média, e a reação catalisada será a que tiver maior velocidade média. 25. Concentração do ácido igual a zero quer dizer que todo o ácido (reagente) foi consumido, o que quer dizer que a reação parou de ocorrer. Note que o volume total de hidrogênio produzido vai ser maior no experimento II do que no I. Lembre-se de que a concentração não influencia somente na quantidade de reagente, mas também na CASD Vestibulares velocidade de reação (em qual dos experimentos ela é maior?) 28. Note que: - o N2 é um produto, não um reagente; - o carvão (C) é um reagente sólido, então aumentar a sua quantidade não vai aumentar a sua concentração (por quê?); - carvão e enxofre são insolúveis em água. Essas dicas podem parecer aleatórias, mas cada uma delas está intimamente relacionada a uma das alternativas. 30. Para fazer a curva no item b, lembre-se do exemplo semelhante visto em sala. 31. Se uma reação pode ocorrer por diferentes caminhos, com diferentes energias de ativação, ela preferencialmente vai ocorrer pelo caminho de menor energia de ativação. Sem a presença de cloreto, o caminho preferencial é o I. Na presença de cloreto, o caminho preferencial é o II. Qual deve ter sido a ação do cloreto para que a reação “preferisse” seguir pelo caminho II? 32. Note que o NO consumido na etapa I é devolvido em seguida na etapa II. 33. Para estudar o efeito da temperatura, apenas a temperatura deve mudar de um experimento para o outro – os outros fatores devem ser os mesmos nos quatro experimentos. Note que o tempo decorrido indica o resultado do experimento (quanto maior o tempo, menor a velocidade), ou seja, é esperado que ele seja diferente nos quatro casos. 34. Essa questão é muito parecida com a questão 30, em especial o item b. Lembre-se novamente do exemplo parecido visto em sala. GABARITO 1. 2. 3. 4. 5. 6. D D A B D a) ΔH = -200 kJ/mol, reação exotérmica. b) O catalisador diminui a energia de ativação e não altera a variação de entalpia da reação. 7. D 8. E 9. C 10. B 11. A 12. B 13. B Química – Cinética Química 9 14. D 15. D 16. A 17. a) Exotérmica, pois a entalpia dos produtos é menor do que a entalpia dos reagentes. b) a – sem catalisador b – com platina (catálise heterogênea) c – com catalase (catálise homogênea) 29. E 30. a) Da tabela, verifica-se que nos instantes iniciais da reação, a variação do volume de H2‚ é maior no experimento II que no I. Como a velocidade média da reação pode ser dada por vm = |∆𝑉𝐻2 |⁄∆𝑡, pode se afirmar que a velocidade da reação foi maior no experimento II. b) 18. - Adicionar mais vinagre (maior concentração de reagente) - Aumentar a temperatura. - Agitar o sistema (maior contato entre os reagentes). 19. E 20. a) A lanterna II apresentará chama mais intensa pois o estado de divisão do carbureto (finamente granulado) possui maior superfície de contato do que o da lanterna I, resultando em uma maior velocidade da reação de formação de acetileno. Assim, a queima de uma maior quantidade de acetileno por unidade de tempo faz com que a chama da lanterna II seja mais intensa. b) A lanterna II se apagará primeiro pois o carbureto finamente granulado reagirá mais rapidamente, sendo totalmente consumido em menos tempo. 21. A 22. D 23. a) Curva 3 - menor variação de concentração em função do tempo (menor velocidade média) b) Curva 2 - final da reação num tempo menor (maior velocidade média). 24. 01 + 02 = 03 25. B 26. C 27. O catalisador diminui a energia de ativação do sistema, pois altera o “caminho” da reação. Logo, a curva II representa a reação na presença de catalisador. O valor da variação de entalpia ( H) permanece constante. A velocidade da reação aumenta, pois um aumento da temperatura causa elevação da energia cinética média das moléculas. O resultado é que ocorrerão colisões mais eficazes com os mesmos reagentes ao medirmos o volume do gás nas mesmas condições de pressão e temperatura. 31. a) A decomposição do NH4NO3 ocorre em I, pois possui menor energia de ativação. b) O íon cloreto funciona como catalisador. 32. a) NOX do N no NO: +2 NOX do N no NO2: +4 b) O NO é consumido na reação I e formado na II. Desse modo, uma única molécula de NO poderá reagir com diversas moléculas de O3. 33. C 34. a) De acordo com a tabela fornecida, verificase que a cada intervalo de tempo diminui a velocidade média de formação do H2. Além disso, a inclinação da curva diminui ao longo do tempo, o que mostra que a velocidade da reação diminui (ou seja, varia) durante o experimento. b) 28. C CASD Vestibulares Química – Cinética Química 10
Download