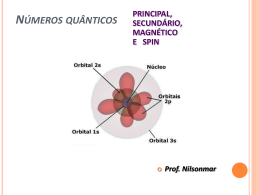
Aula 3 Estrutura Atômica – cont… Tabela Periódica Mecânica quântica e orbitais atômicos • Schrödinger propôs uma equação que contém os termos onda e partícula. • A resolução da equação leva às funções de onda. • A função de onda fornece o contorno do orbital eletrônico. • O quadrado da função de onda fornece a probabilidade de se encontrar o elétron, isto é, dá a densidade eletrônica para o átomo. Mecânica quântica e orbitais atômicos Distribui€•o da densidade eletronica no estado fundamental do ‚tomo de hidrogƒnio. Mecânica quântica e orbitais atômicos Orbitais e números quânticos • • • Se resolvermos a equação de Schrödinger, teremos as funções de onda e as energias para as funções de onda. Chamamos as funções de onda de orbitais. A equação de Schrödinger necessita de três números quânticos: 1. Número quântico principal, n. Este é o mesmo n de Bohr. À medida que n aumenta, o orbital torna-se maior e o elétron passa mais tempo mais distante do núcleo. Mecânica quântica e orbitais atômicos Orbitais e números quânticos 2. O número quântico azimuthal, l. Esse número quântico depende do valor de n. Os valores de l começam de 0 e aumentam até n -1. Normalmente utilizamos letras para l (s, p, d e f para l = 0, 1, 2, e 3). Geralmente nos referimos aos orbitais s, p, d e f. 3. O número quântico magnético, ml. Esse número quântico depende de l. O número quântico magnético tem valores inteiros entre -l e +l. Fornecem a orientação do orbital no espaço. Mecânica quântica e orbitais atômicos Orbitais e números quânticos Representações orbitias Orbitais s • • • • • • Todos os orbitais s são esféricos. À medida que n aumenta, os orbitais s ficam maiores. À medida que n aumenta, aumenta o número de nós. Um nó é uma região no espaço onde a probabilidade de se encontrar um elétron é zero. Em um nó, Ψ2 = 0 Para um orbital s, o número de nós é n-1. Representações orbitias Representações orbitias Orbitais s Representações orbitias Orbitais p • • • • • • Existem três orbitais p, px, py, e pz. Os três orbitais p localizam-se ao longo dos eixos x-, y- e z- de um sistema cartesiano. As letras correspondem aos valores permitidos de ml, -1, 0, e +1. Os orbitais têm a forma de halteres. À medida que n aumenta, os orbitais p ficam maiores. Todos os orbitais p têm um nó no núcleo. Representações orbitias Orbitais p Representações orbit a i s Orbitais d e f • • • • • Existem cinco orbitais d e sete orbitais f. Três dos orbitais d encontram-se em um plano bissecante aos eixos x-, y- e z. Dois dos orbitais d se encontram em um plano alinhado ao longo dos eixos x-, y- e z. Quatro dos orbitais d têm quatro lóbulos cada. Um orbital d tem dois lóbulos e um anel. Representações orbitias Representações orbitias Átomos polieletrônicos Orbitais e suas energias • • • Orbitais de mesma energia são conhecidos como degenerados. Para n ≥ 2, os orbitais s e p não são mais degenerados porque os elétrons interagem entre si. Portanto, o diagrama de Aufbau apresenta-se ligeiramente diferente para sistemas com muitos elétrons. Átomos polieletrônicos Orbitais e suas energias Átomos polieletrônicos Spin eletrônico e o princípio da exclusão de Pauli • • • • O espectro de linhas de átomos polieletrônicos mostra cada linha como um par de linhas minimamente espaçado. Stern e Gerlach planejaram um experimento para determinar o porquê. Um feixe de átomos passou através de uma fenda e por um campo magnético e os átomos foram então detectados. Duas marcas foram encontradas: uma com os elétrons girando em um sentido e uma com os elétrons girando no sentido oposto. Átomos polieletrônicos Spin eletrônico e o princípio da exclusão de Pauli Átomos polieletrônicos Spin eletrônico e o princípio da exclusão de Pauli • Já que o spin eletrônico é quantizado, definimos s = número quântico de rotação = ± ½. • O princípio da exclusão de Pauli: dois elétrons não podem ter a mesma série de 4 números quânticos. Portanto, dois elétrons no mesmo orbital devem ter spins opostos. • Portanto, cada orbital de um mesmo átomo, definido por três números quânticos iguais, poderá ter no máximo dois elétrons. Configurações eletrônicas Regra de Hund • • As configurações eletrônicas nos dizem em quais orbitais os elétrons de um elemento estão localizados. Três regras: - Os orbitais são preenchidos em ordem crescente de n. - Dois elétrons com o mesmo spin não podem ocupar o mesmo orbital (Pauli). - Para os orbitais degenerados, os elétrons preenchem cada orbital isoladamente antes de qualquer orbital receber um segundo elétron (regra de Hund). O desenvolvimento da tabela periódica • Em 2002, havia 115 elementos conhecidos. • A maior parte dos elementos foi descoberta entre 1735 e 1843. • Como organizar 115 elementos diferentes de forma que possamos fazer previsões sobre elementos não descobertos? Tabela Periódica Dmitri Ivanovich Mendeleyev Henry Moseley O desenvolvimento da tabela periódica • Ordenar os elementos de modo que reflitam as tendências nas propriedades químicas e físicas. • A primeira tentativa (Mendeleyev e Meyer) ordenou os elementos em ordem crescente de massa atômica. • Faltaram alguns elementos nesse esquema. Exemplo: em 1871, Mendeleyev observou que a posição mais adequada para o As seria abaixo do P, e não do Si, o que deixou um elemento faltando abaixo do Si. Ele previu um número de propriedades para este elemento. Em 1886 o Ge foi descoberto. As propriedades do Ge se equiparam bem à previsão de Mendeleev. Configurações eletrônicas e a tabela periódica • • • • • • A tabela periódica pode ser utilizada como um guia para as configurações eletrônicas. O número do periodo é o valor de n. Os grupos 1A e 2A têm o orbital s preenchido. Os grupos 3A -8A têm o orbital p preenchido. Os grupos 3B -2B têm o orbital d preenchido. Os lantanídeos e os actinídeos têm o orbital f preenchido. Configurações eletrônicas e a tabela periódica Configurações eletrônicas Configurações eletrônica condensadas • • • O neônio tem o subnível 2p completo. O sódio marca o início de um novo período. Logo, escrevemos a configuração eletrônica condensada para o sódio como Na: [Ne] 3s1 • • • [Ne] representa a configuração eletrônica do neônio. Elétrons mais internos: os elétrons no [Gás Nobre]. Elétrons de valência: os elétrons fora do [Gás Nobre].
Download