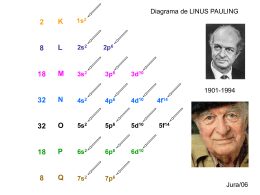
COLÉGIO MARIA IMACULADA VALOR:10 pontos. QI 05 ch. 72 LAGO SUL BRASÍLIA – DF E-MAIL: [email protected] FONE: 248 4768 SITE: www.cmidf.com.br 9ºano NOTA: 2º PERÍODO Prova de Recuperação Bimestral de Ciências Nome Completo: ___________________________________________ Data: __/__/2010 IMPORTANTE: 1. LEIA ATENTAMENTE OS ENUNCIADOS DAS QUESTÕES E DÊ RESPOSTAS COMPLETAS. 2. 3. 4. 5. 6. 7. 8. Confira a constituição da avaliação. Qualquer dúvida peça a orientação do professor. Use somente caneta azul ou preta. Leia com atenção os enunciados, pois a compreensão faz parte da avaliação. Não serão aceitas respostas com duplicidade de interpretação, borradas ou a lápis. Não use corretivo. No caso de rasuras risque discretamente o termo errado e escreva-o na forma correta. Não serão aceitas rasuras em questões objetivas Releia a avaliação antes de entregá-la, verificando se nenhuma questão ficou sem resposta e faça a correção ortográfica. Erros ortográficos serão descontados. 9. Seja claro e organizado nas respostas! 1) Sabendo-se que o número atômico do ferro é 26, indique, com base na configuração eletrônica do íon Fe3+, o último subnível ocupado e o número de elétrons deste subnível. O átomo neutro possui 26 protons e 26 eletrons. No entanto, o íon que possui carga +3 possui 3 eletrons a menos, ou seja, 23 eletrons. Então a distribuição fica: 1s2 2s2 2p6 3s2 3p6 4s2 3d3 . o último subnivel é o 3d, com 3 eletrons e a ultima camada é a 4. 1 2) Considere três átomos, A, B e C. Os átomos A e C são isótopos; os átomos B e C são isóbaros e os átomos A e B são isótonos. Sabendo que o átomo A tem 20 prótons e número de massa 41 e que o átomo C tem 22 nêutrons, indique qual o subnível mais energético do átomo B. Átomo B possui 21 prótons e, como é um átomo sem carga, possui 21 elétrons. Entao, a distribuição fica: 1s2 2s2 2p6 3s2 3p6 4s2 3d1. Obs: o motivo de B possuir 21 protons está em seu caderno, exercício que fizemos na aula de recuperação. 3) Um determinado átomo apresenta sete (7) elétrons no subnível d da camada M. A respeito desses elétrons, indique: a) Qual o elemento químico em questão. Ele termina em 3d7. (A camada M é a terceira). Entao eu faço a distribuiçao eletrônica ate 3d7. Fica: 1s2 2s2 2p6 3s2 3p6 4s2 3d7. Então eu somo o numero de eletrons, que dá 27. Olho na tabela e vejo que é o elemento cobalto. b) Qual o período que ele ocupa na tabela periódica? Ocupa o 4 periodo (a ultima camada) c) Qual a família que ele ocupa na tabela periódica? 9 d) Qual o número de elétrons que ele possui na ultima CAMADA? 2 4) Para que o átomo de silício, 14Si28, seja isótono de um dos isótopos do enxofre, 16S, e isóbaro de um dos isótopos do alumínio, 13Al, é necessário que os isótopos desses elementos apresentem qual massa atômica? 2 30 e 28, respectivamente. 5) Considerando as espécies químicas: (17Cl35)1- 20Ca 40 (40Zr42)2+ (27Co29)2+ (28Ni59)2+ 65 30Zn a) Quais delas possuem o mesmo número de elétrons? Nenhum b) Quais deles possuem o mesmo número de nêutrons? Zr e Co (ambos com 2 neutrons) c) Faça a distribuição eletrônica do átomo do íon cobalto (Co). O ion cobalto possui 25 eletrons (27 – 2) 1s2 2s2 2p6 3s2 3p6 4s2 3d5 6) Com relação às duas configurações eletrônicas de um mesmo átomo, raciocine e responda: I. II. 1s2 2s2 2p6 3s1 1s2 2s2 2p6 6s1 a) Qual é a configuração normal do átomo em questão? I b) O que pode ter ocorrido para que essa configuração tenha sido modificada? O elétron ganhou energia e saltou para um subnivel mais energetico 7) Julgue os itens em V ou F e justifique os itens falsos: 3 a) (F) Se dois átomos tem o mesmo número de elétrons, mesmo momentaneamente, isso quer dizer que eles tem o mesmo numero atômico. Podem ser íons que b) ( F ) Átomos são compostos por nêutrons, elétrons e prótons, sendo que os dois primeiros constituem a massa atômica e os dois últimos são as partículas que contém carga, que nos elétrons é negativa e nos prótons é positiva. Protons e nêutrons constituem a massa atômica. c) ( F) Todas as ligações químicas são realizadas pela necessidade dos átomos de ganharem elétrons para estabilizarem suas eletrosferas. Alguns perdem eletrons d) (F ) Não existem ligações químicas realizadas entre dois metais. Existe e se chama ligação metálica 8) Um elemento químico A de número atômico 38 combina-se com um elemento químico B de número atômico 7. A fórmula do composto formado será: ( ) A1B2 ( ) A2B5 ( ) A2B3 (X) A3B2 Agora JUSTIFIQUE sua resposta: O elemento A possui 2 eletrons na ultima camada e o átomo B possui 5. Para que todos se estabilizem com 8 eletrons, é necessário 3 atomos de A e dois de B. 9) Considere as configurações eletrônicas de quatro elementos químicos: I. 1s2 2s2 II. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 III. 1s2 2s2 2p6 3s2 3p6 3d10 4s24p5 IV. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2 a) Qual deles apresenta tendência a formar um ânion? 4 I, II e IV (porque possuem apenas 2 eletrons na ultima camada. É mais fácil perder dois que ganhar 6 eletrons.) b) Qual deles tem tendência a formar um cátion? III, possui 7 elétrons na ultima camada, é mais fácil ganhar 1 que perder 7 para completar 8 elétrons na última camada. c) Qual seria o tipo de ligação que ocorreria entre os elementos II e III e como seria a fórmula do composto formado? Ligação iônica II1III2 10) Analise as moléculas e responda qual o tipo de ligação está ocorrendo e quantos elétrons estão sendo compartilhados no total: Obs: Pode consultar a tabela periódica, se necessário. a) NaCl iônica 2 eletrons b) H2O Covalente 4 eletrons c) NH3 covalente 6 eletrons d) KCl Ionica 2 eletrons e) CH4 Covalente 8 eletrons 5 6 EXERCÍCIOS DE FIXAÇÃO RECUPERAÇÃO SEMESTRAL DE CIÊNCIAS 01. Utilizando o diagrama de Pauling e considerando o elemento químico tungstênio (W), de número atômico igual a 74, responda as seguintes questões: a) Qual a distribuição por subníveis energéticos? b) Qual a última camada e a qual período da tabela periódica ele pertence? c) QUAL o subnível de maior energia? 02. (UFAC) Um átomo neutro apresenta número atômico igual a 37. Em relação a esse átomo, mostre a distribuição eletrônica em ordem crescente de energia de subníveis; 03. Se o subnível mais energético de um átomo é o 4s1, pergunta-se: a) Qual o total de elétrons desse átomo? b) Quantas camadas esse átomo possui? c) Qual família e período em que se encontra esse elemento? d) Dê sua configuração eletrônica. 04. Considere um átomo cuja configuração eletrônica é 1s2, 2s2, 2p6, 3s2, 3p6, 4s2. Responda: a) Qual o número atômico desse elemento? b) A qual período e família da tabela periódica ele pertence? c) Ele apresenta tendência de formar cátions ou ânions? 05. Um átomo X é isóbaro de (29Y13) e possui 14 nêutrons e carga de -6. Qual o número atômico e o numero de elétrons, no último nível, que o átomo X possui? a) 7 b) 13 c) 6 d) 5 e) 4 06. A última camada de um átomo possui configuração eletrônica 3s2, 3p4. Qual é o número atômico desse elemento? 07. Por que os gases nobres não participam de nenhuma ligação química, ou seja, estão sempre na forma monoatômica (1 átomo apenas)? 08. Um elemento químico de configuração eletrônica 1s2 2s2 2p6 3s2 3p5 possui forte tendência para que? Ganhar ou perder elétrons? 09. Ao se compararem os íons K+ e Br– com os respectivos átomos neutros de que se originaram, o que podemos dizer sobre seu núcleo e sua elestrosfera? 7 10. Uma substância iônica foi representada pela fórmula X2Y. Sendo assim, na tabela periódica, é possível que X e Y se localizem em quais famílias? 11. Qual seria uma boa opção para separar uma mistura de cloreto de sódio, areia e álcool? 12. Um copo contém uma mistura de água, acetona, cloreto de sódio e cloreto de prata. A água, a acetona e o cloreto de sódio estão numa mesma fase líquida, enquanto o cloreto de prata está numa fase sólida. Descreva como podemos realizar a separação destes componentes. GABARITO 1. 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d4. b) 6 e 6° respectivamente. c) 5d4, mas a última camada é a 6, com 2 elétrons (6s2). 2. 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s1 3. a) 19 b) 4 c) Família 1A. e 4° período. d) Dê sua configuração eletrônica. 1s2, 2s2, 2p6, 3s2, 3p6, 4s1 4. A) 20 b) 4 periodo família 2ª c) tendência a formar um cátion 5. Número atômico é 29- 14=15 prótons. 15 +6= 21 eletrons. 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d1 6. numero atômico 16 7. Porque sua eletrosfera já possui 8 elétrons na ultima camada. Portanto, já esta estável. 8. ganhar 1 elétron. 9. Houve manutenção da carga nuclear de ambos os íons, mas no primeiro houve perda de 1 elétron e no segundo houve ganho de um elétron. 10. 1A e 6A respectivamente. 11. adicionar água, filtração, destilação fracionada. 12. catação e destilação fracionada. 8
Download