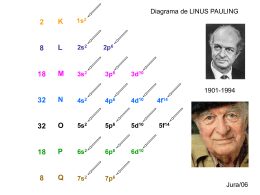
Partículas básicas do átomo Prof. Francisco Sallas O átomo é constituído por um núcleo onde ficam as partículas prótons e nêutrons, e uma eletrosfera onde ficam os elétrons. Como já foi visto na aula 2 os elétrons foram descobertos por Joseph John Thomson, os prótons pelo cientista alemão Eugen Goldstein e os nêutrons pelo físico inglês James Chadwick. Características das partículas do átomo Nome Região do átomo Símbolo Carga relativa ao próton Elétron eletrosfera e Próton Núcleo Nêutron núcleo Carga Coulombs Massa relativa ao próton Massa g 1- -1,6x10-19 1/1840 9,11x10-28 P 1+ 1,6x10-19 1 1,67x10-24 N 0 0 1 1,67x10-24 Em nossos estudos, duas expressões serão de fundamental importância: Número atômico (Z) – que é o número de prótons presentes no núcleo de um átomo. Número de massa (A) – que é a soma do número de prótons (Z) e de nêutrons (N) presentes no núcleo do átomo. O número de massa pode ser expresso matematicamente da seguinte maneira: A = Z + N Representação química Convencionalmente, ao representar um átomo, o número atômico vem na parte inferior esquerda e a massa na parte superior à direita ou esquerda. número de massa 6 número atômico C 12 Quando um átomo possui prótons e elétrons em igual número este átomo é eletricamente neutro. Quando um átomo perde ou ganha elétrons, ele deixa de ser eletricamente neutro e se transforma em um íon. Se um átomo ganha elétrons, fica com excesso de carga negativa, ou seja, se transforma em um íon ânion. Se um átomo neutro perde elétrons, fica com excesso de prótons, ou seja, se transforma em um íon positivo, em um íon cátion. Átomo neutro 37 17 Átomo neutro 27 13 Cl Al 20 nêutrons 14 nêutrons 17 prótons 13 prótons 17 elétrons 13 elétrons Íon Ânion 37 17 Cl Íon Cátion - O núcleo não se 20 nêutrons altera. Portanto, A e 17 prótons Z também não. Ocorre alteração na 18 elétrons eletrosfera, está com excesso de 1 carga negativa. 27 13 Al 3+ O não se 14núcleo nêutrons altera. Portanto, A e 13 prótons não. Z também Ocorre alteração na 10 elétrons eletrosfera, está com excesso de 3 cargas positivas. Assim temos: Átomo neutro: 23 11 Na Íon Cátion: 39 19 K + Íon Ânion: 19 9 F - A = 23 A = 39 A = 19 Z Z Z = 11 = 19 = 9 np = 11 np = 19 np = 9 ne = 11 ne = 18 ne = 10 nN = 23 A – 11 Z = 12 nN = 39 A – 19 Z = 20 nN = 19 A – 9Z= 10 20 10 A Isóbaros 20 9 B Quando dois ou mais átomos possuem o mesmo número de massa e diferentes números de prótons e nêutrons chamamos estes átomos de ISÓBAROS. 12 13 Isótopos C D 6 6 Quando dois ou mais átomos possuem o mesmo número de prótons e diferentes números de massa e nêutrons chamamos estes átomos de ISÓTOPOS. Isótonos 40 E 20 F 20N 20N Isoeletrônicos 39 19 Quando dois ou mais átomos possuem o mesmo número de nêutrons e diferentes números de prótons e massa chamamos estes átomos de ISÓTONOS. 19 9 G - 9 + 1 = 10 elétrons 27 13 H 3+ 13 - 3 = 10 elétrons Quando átomo de elementos químicos diferentes possuem o mesmo número de elétrons são chamados de ISOELETRÔNICOS. DIAGRAMA DE LINUS PAULING NÍVEIS DE ENERGIA NA ELETROSFERA DISTRUBUIÇÃO 2 K 1s2 8 L 2s2 2p6 18 M 3s2 3p6 3d10 1901-1994 32 N 4s2 4p6 4d10 4f14 32 O 5s2 5p6 5d10 5f14 18 P 6s2 6p6 6d10 8 Q 7s2 7p6 EXEMPLOS 01) 35 Br80 35 elétrons 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 K2 02) L8 M18 N7 Camada de valência 2S 16 18 elétrons 1s2 2s2 2p6 3s2 3p6 K2 03) L8 M8 Camada de valência 28Ni 28 elétrons 1s2 2s2 2p6 3s2 3p6 4s2 3d8 K2 L8 M16 N 2 Camada de valência K 1s2 L 2s2 2p6 M 3s2 3p6 N 4s2 4p5 3d10 DISTRIBUIÇÃO PARA CÁTIONS DE METAIS DE TRANSIÇÃO DEVE-SE : 1) DISTRIBUIR OS ELÉTRONS DO ÁTOMO NEUTRO . 2) RETIRAR ELÉTRONS DA ÚLTIMA CAMADA. 3) RETIRAR ELÉTRONS DOS SUBNÍVEIS PERTENCENTES A ÚLTIMA CAMADA. 04) 3+ Ni 28 25 elétrons 1s2 2s2 2p6 3s2 3p6 4s2 3d87 K 2 L 8 M16 M15 N 2 2 K 1s2 8 L 2s2 15 M 3s2 N 4s2 05) 4+ Co 27 23 elétrons 1s2 2s2 2p6 3s2 3p6 4s2 3d75 K2 L8 M M15 13 N 2 2p6 3p6 3d8 3d7 EXERCÍCIOS Faça a distribuição por subníveis e níveis de energia para as seguintes espécies: 01) 88 Sr 38 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 2 e- no subnível mais energético K 2 L 8 M18 N 8 0 2 2 e- na sua camada de valência 02) 1F 9 03) 2+ 25Mn 1s2 2s2 2p6 3s2 3p6 4s2 3d5 K 2 L 8 M13 N 2 6 e- no subnível mais energético 1s2 2s2 2p6 K2 L8 8 e- na sua camada de valência
Baixar