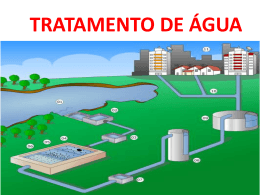
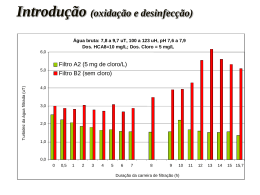
Conheça um pouco mais sobre a água A água é um elemento fundamental à sobrevivência de qualquer ser vivo e é indiscutível sua a responsabilidade pela longevidade e qualidade de vida do homem. Graças aos conhecimentos acumulados desde que John Snow descobriu a relação existente entre o consumo de água contaminada e a incidência de cólera em Londres, foi possível eleger as ações necessárias ao controle da potabilidade da água como prioritárias; a prática dessas ações é função do SIMAE, Serviço Intermunicipal de Água Esgoto nas cidades e localidades do interior de Capinzal e Ouro. A ÁGUA NA TRANSMISSÃO DE DOENÇAS Doenças provocadas por agentes microbiológicos, a água é normalmente habitada por vários tipos de microorganismos de vida livre e não parasitária, que dela extraem os elementos indispensáveis à sua sobrevivência. Ocasionalmente são organismos patogênicos, que utilizam a água como veículo, e constitui um perigo sanitário potencial para a saúde da população. É interessante notar que a quase totalidade dos organismos patogênicos são incapazes de viver em sua forma adulta ou se reproduzirem fora do organismo que lhe serve de hospedeiro. Portanto, têm a vida limitada quando se encontram na água, isto é fora do hospedeiro. Alexandre Houstron demonstrou em 1908 que quando uma água contaminada com bacilos da febre tifóide era armazenada por uma semana, mais de 99% desses germes eram destruídos. São vários os agentes de destruição natural de patogênicos nas águas armazenadas. Além da temperatura, destacam-se os efeitos da luz, a sedimentação, a presença ou não de oxigênio dissolvido, de parasitas ou predadores de bactérias, substâncias tóxicas ou antibióticos produzidos por outros microorganismos (como algas ou fungos). Os microorganismos patogênicos são classicamente agrupados em vírus, bactérias e helmintos. Para cada grupo determinam-se famílias, gêneros e espécies, que identificam os diversos agentes causadores de doenças, denominados agentes etiológicos. Forma, uma bactéria do gênero Vibrium, espécie V.cholerae é causadora de cólera, um protozoário do gênero Giárdia, espécie G.lamblia, provoca a giardíase e a larva do helminto do gênero Taenia, Espécie T.solium, é responsável pela teníase. Entretanto, para efeito de prevenção e controle de doenças, particularmente aquelas relacionadas com água, uma outra classificação se mostra útil. Trata-se da classificação que enfoca as vias de transmissão e o ciclo do agente, também conhecida como classificação ambiental das infecções relacionadas com a água, proposta por Cairncross e Feachem em 1990. Entre as infecções do Grupo I figuram as diarréias e as disenterias, cujos agentes etiológicos podem ser bactérias, como o V.cholerae no caso da cólera ou protozoários, como a Giárdia lamblia, no caso giardíase. O que agrupa essas informações é o fato desses encontrarem-se na água, sendo sua ingestão fator importante para a instalação da doença. Portanto, o tratamento e a desinfecção da água é uma ação muito importante na prevenção dessas infecções, pois melhora a qualidade da água. O Grupo II, por outro lado, aparecem duas infecções que se manifestam em condições de carência de água, Cuja falta ou escassez impede o desenvolvimento de práticas efetivas de higiene. Nesse caso, a medida de prevenção passa por facilitar ou aumentar o acesso à água, isto é, aumento na quantidade de água. A esquistossomose é um exemplo clássico do Grupo III, quando a infecção se instala mediante o contato do homem com os agentes existentes na água, sem haver, necessariamente, sua ingestão. As medidas de prevenção para esse caso devem envolver um conhecimento maior do cotidiano da população, inclusive aspectos ligados às atividades produtivas (agricultura em áreas alagadas, pesca garimpo), de modo a avaliar a vulnerabilidade do grupo frente ao risco de contrair a doença. Finalmente, a dengue, a malária e a filariose são infecções do Grupo IV, cujos agentes etiológicos (vírus, protozoário e nematóide, respectivamente) entram em contato com o homem através de mosquitos que se procriam na água. Nesses casos, a água oferece as mais apropriadas condições para a proliferação do vetor. Sendo a medida de prevenção mais adequada o reconhecimento e eliminação do habitat que serve de criadouro, já que os aspectos como qualidade e quantidade de água não são relevantes. AS DOENÇAS PROVOCADAS POR AGENTES QUÍMICOS Através do ciclo hidrológico, a água está em permanente contato com os componentes do meio ambiente (ar e solo), dissolvendo muitos elementos e carreando outros em suspensão. A atividade humana, por outro lado, vem introduzindo nas águas um número crescente de substâncias. Várias são as substâncias químicas que podem poluir as águas subterrâneas ou superficiais e comprometer a saúde do homem. Dentre elas podemos citar os agrotóxicos (herbicidas, inseticidas, raticidas, etc) e os despejos industriais contendo metais pesados como cromo, mercúrio e chumbo. Os efeitos que estas substâncias químicas podem ter sobre o organismo humano dependem de sua concentração, toxidez e da sua suscetibilidade individual, que é variável. No item "Parâmetros Físico-Químicos" encontram-se detalhados alguns efeitos à saúde decorrentes do consumo de água com concentrações elevadas de algumas dessas substâncias. PARÂMETROS BACTERIOLÓGICOS O papel da água na transmissão de determinadas doenças infecciosas e parasitárias é fato bastante conhecido. Portanto, uma avaliação de potabilidade da água deve passar, necessariamente, pelo parâmetro bacteriológico. Apesar de conhecer bem cada um dos microorganismos responsáveis pelas doenças infecto-parasitárias, sua identificação e quantificação em águas de abastecimento são impraticáveis. Além das técnicas laboratoriais serem trabalhosas, esses microorganismos patogênicos, quando presentes em águas de abastecimento, ocorrem em número reduzido, sendo necessário pesquisar grandes volumes de água. Além disso, chegam na água de forma intermitente. Essas dificuldades foram solucionadas com descoberta de microorganismos indicadores. Isso é possível porque, no caso das doenças citadas no Grupo I, os microorganismos patogênicos são eliminados pelas fezes do indivíduo doente. Como o intestino humano é habitado por vários outros microorganismos não patogênicos e que existem em maior número, decidiu-se pesquisar a presença destes em água de abastecimento. Entre os vários gêneros e espécies de microorganismos não patogênicos presentes no intestino humano, aqueles conhecidos como Grupo Coliforme passaram a ser denominados indicadores da presença de microorganismos patogênicos em águas de abastecimento. As principais razões dessa escolha são as seguintes: Aparecem em grande quantidade nas fezes humanas. Cada individuo pode eliminar até 100 bilhões deles num único dia, devido a isso a possibilidade de serem encontrados na água é muito grande. São encontrados apenas nas fezes, de animais de sangue quente ou homeotermos, classe que inclui o homem e todos os mamíferos. Essa característica é importante, pois uma vez identificada a sua presença, pode-se afirmar que a água teve contato com excretas desses animais. Do ponto de vista da resistência às condições ambientais (temperatura e outros agentes desinfetantes), são muito semelhantes aos microorganismos patogênicos intestinais. Trata-se de característica importante, pois se fossem mais suscetíveis (sobrevivessem menos tempo que os patogênicos), não poderiam ser identificados, isto é, não seriam indicadores. Se fossem menos suscetíveis (sobrevivessem por mais tempo), poderia aparecer em águas já livres dos patogênicos. Sua identificação, do ponto de vista laboratorial, requer técnicas simples e econômicas, ao contrário daquelas necessárias à identificação dos microorganismos patogênicos. Embora seja usual denominar esses microorganismos como Grupo Coliforme, é conveniente dividi-los em três principais subgrupos mais comumente utilizados como indicadores de contaminação de água de abastecimento: coliformes totais, coliformes fecais ou termotolerantes e estreptococos fecais (os estreptococos não pertencem ao grupo coliforme). COLIFORMES TOTAIS (CT) Reúne um grande número de bactérias, entre elas a Eschrichia coli, de origem exclusivamente fecal e que dificilmente se multiplica fora do trato intestinal. O problema é que outras bactérias dos gêneros Citrobacter, Enterobacter e Klebsiella, igualmente identificadas pelas técnicas laboratoriais como coliformes totais, podem ser encontrados no solo e nos vegetais. Desta forma, não é possível afirmar categoricamente que uma amostra de água com resultado positivo para coliformes totais tenha entrado em contato com fezes. COLIFORMES FECAIS Pertencem a esse subgrupo os microorganismos que aparecem exclusivamente no trato intestinal. Em laboratório, a diferença entre coliformes totais e fecais é feita através da temperatura (os coliformes fecais continuam vivos mesmo a 44ºC, enquanto os coliformes totais têm crescimento à 35ºC). Sua identificação na água permite afirmar que houve presença de matéria fecal, embora não exclusivamente humana. ESTREPTOCOCOS FECAIS (EF) Embora sua identificação não seja rotina em laboratórios de análise de água, trata-se de um subgrupo importante, já que fazem parte dele as espécies do gênero Streptococos que ocorrem apenas no trato intestinal do homem e de animais de sangue quente, como os Coliformes Fecais. Existe uma correlação entre a ocorrência de Coliformes Fecais e Estreptococos Fecais. Normalmente empregada em cursos de água, consiste em quantificar o número de microorganismos de cada um dos subgrupos existentes em uma amostra. Se a relação CF/EF resultar maior que 4, diz-se que a amostra apresenta contaminação fecal predominantemente humana. Se essa relação for menor que 1 a contaminação fecal predominante será de animais de sangue quente. Os resultados que se encontrarem entre esses dois valores não permitem inferir nada a respeito da origem da contaminação fecal. PARÂMETROS FÍSICO-QUÍMICOS A definição dos parâmetros físico-químicos e organolépticos parte da premissa que a presença de alguns minerais em águas destinadas ao consumo humano é inevitável e, em determinadas concentrações, é até desejável. Quando se trata de minerais de ocorrência natural, como ferro, manganês e cálcio e seus compostos (carbonatos e sulfatos), diz-se que sua presença se relaciona à gênese do manancial. É o caso de poços profundos, cuja água muitas vezes adquire características da rocha por onde se infiltra e se acumula. Existem alguns outros elementos que podem estar presentes na água intencionalmente ou não. O cloro aparece na água porque é adicionado na etapa de desinfecção. A água também pode apresentar resíduos de alumínio, já que esse elemento é empregado no tratamento, na etapa de coagulação e floculação. Por outro lado, a atividade industrial, ao lançar efluente não tratado no meio ambiente, pode ser responsável pela presença na água de elementos como cromo hexavalente, chumbo e cádmio, e de compostos como fenóis e organoclorados. Finalmente, a atividade agrícola, particularmente aquela que se utiliza insumos químicos, pode trazer para a água os organoclorados e organofosforados, que se constituem nos principais agrotóxicos utilizados no país. Além disso, o escoamento superficial costuma arrastar para os rios e lagoas parte dos adubos utilizados, cujos compostos nitrogenados são os mais comumente encontrados. Listam-se a seguir uma série de parâmetros físico-químicos relacionados à qualidade de água e respectiva importância do ponto de vista da saúde COR A presença na água de partículas muito pequenas é que lhe conferem cor. Diz-se que essas partículas encontram-se em solução na água, e podem ter origem em material orgânico (húmus, algas, entre outras) ou inorgânico (compostos de ferro e manganês, por exemplo). Do ponto de vista sanitário, águas de abastecimento com valores altos de cor são inadequadas porque podem ser rejeitadas pelo consumidor, a despeito de poderem estar livres da presença de microorganismos (ao utilizarse de "águas cristalinas" de outras fontes, o consumidor pode acabar utilizando água contaminada, pois a ausência de cor na água não lhe dá garantia de água isenta de contaminação). TURBIDEZ Nas águas com turbidez, as partículas encontram-se em suspensão, sendo maiores do que aquelas que produzem cor. Podem ter origem orgânica ou inorgânica, estando mais comumente associadas à presença de algas e argilas na água. Esgotos domésticos e efluentes industriais podem conferir turbidez à água. As partículas em suspensão são suficientemente grandes para abrigar microorganismos, que não serão atingidos com a adição de cloro na água. Portanto, a remoção da turbidez é necessária antes de fazer a cloração, a unidade de medida da turbidez é a Unidade Nefelométrica de Turbidez (NTU). SABOR E ODOR Embora não exista unidade para medir sabor e odor, sua presença em águas de abastecimento é extremamente indesejável, por provocar a imediata recusa pelo consumidor. Podem ter as mais diversas origens, desde naturais (caso das águas sulfurosas) até artificiais, pelo aparecimento na água de compostos presentes em efluentes industriais. O fenol, por exemplo, produz sabor e odor perceptíveis em concentrações acima de 1,0 mg/L. Dependendo da qualidade da água do manancial. A remoção de sabor e odor presentes na água devem ser realizados na etapa de tratamento, onde o processo mais utilizado é o de filtração em carvão ativado. DUREZA A presença de sais alcalinos de cálcio, sódio e magnésio, e algumas vezes de ferro, conferem à água uma característica denominada dureza. Os sais de cálcio e magnésio, que são os carbonatos e os bicarbonatos, têm ocorrência natural em alguns mananciais. A dureza que conferem à água recebe o nome de dureza temporária. . Níveis elevados desses sais podem alterar o sabor da água, mas o principal prejuízo é econômico, devido ao aumento de consumo de sabão e alguns tipos de detergentes dependendo da sua composição, já que as águas duras requerem mais sabão para produzir espuma. Além do prejuízo econômico, o aumento de sabão implica num porte maior de fosfatos aos esgotos, aumentando a poluição. FERRO Por se tratar de um elemento abundante no planeta, é comum aparecer em águas de abastecimento na forma de óxidos de ferro (Fe2O3). A forma (Fe3+) é mais freqüente em águas provenientes de aqüíferos, pois no contato com oxigênio oxida-se para a forma reduzida (Fe2+), resultando compostos menos solúveis. Águas com concentrações de ferro acima de 0,3 mg/ L mancham louças sanitárias e roupas quando da sua lavagem. Águas ferruginosas dão condições ao aparecimento de ferrobactérias, como o gênero Galionella, por exemplo. Essas bactérias oxidam o ferro, que precipita dentro das canalizações provocando entupimentos. Além disso, conferem um odor fétido à água, fazendo o consumidor recusá-la. Os processos de remoção do ferro no tratamento da água incluem aeração, cloração e filtração. MANGANÊS Tal qual o ferro, o manganês altera a cor e sabor das águas quando atinge concentrações acima de 0,1 mg/L. O estado reduzido (Mn2+) é mais freqüente em águas subterrâneas, pois em contato com a superfície se oxida formando compostos menos solúveis. Sua remoção, realizada em estação de tratamento, é feita através de aeração e filtração, evitando que com isso ocorra precipitação de manganês ao longo da rede de distribuição, provocando entupimentos. NITROGÊNIO Presente na atmosfera na forma de gás (N2), o nitrogênio é mais abundante que o oxigênio (79% N2 para 20% O2 e 1% para os demais gases). Entretanto, não é na respiração que ele é requerido pelos seres vivos, mas na forma de proteínas, cujas unidades formadoras são aminoácidos, que possuem nitrogênio na molécula. Sendo as proteínas as unidades estruturais de todos os organismos, a presença de compostos nitrogenados na água indica que ela entrou em contato com matéria orgânica. Pode-se dizer que na composição de matéria orgânica, o nitrogênio presente nas proteínas passa por uma fase amoniacal (NH4+), passando pela fase de nitrito NO2 convertendo-se daí em nitrato (NO3-). Nesta forma, ele pode ser absorvido pelos vegetais, chegando até os outros organismos vivos, fechando o ciclo. A presença na água de compostos nitrogenados descritos acima permite inferir sobre o tipo, freqüência e distância da contaminação orgânica. O nitrogênio albuminóide é aquele resultante da morte de seres vivos. Sua transformação em NH4- (nitrogênio amoniacal) indica o início de oxidação, que produzirá NO2- (nitrogênio nitroso) e, em seguida, NO3- (nitrogênio nítrico). Um resultado de análise de água onde o nitrogênio albuminóide aparece em concentrações maiores que o nitrogênio amoniacal indica presença de matéria orgânica não decomposta. Caso o resultado seja o contrário, isto é, o nitrogênio amoniacal maior que o nitrogênio albuminóide, admite-se que a matéria orgânica presente na água já se encontra em processo de decomposição. Como a transformação N-albuminóide à N-amoniacal é mais rápida quando a matéria orgânica provém de excretas de animais do que de vegetais (folhas e galhos, por exemplo), esse resultado deverá ser investigado fazendo uma análise se esta água teve contato recente com excretas. A presença de nitritos (NO2- ou nitrogênio nitroso) em concentrações elevadas indica que a matéria orgânica presente na água encontra-se a pouca distância do ponto onde foi feita a coleta para análise. Os nitritos são uma forma transitória, sendo rapidamente oxidado à nitrato (NO 3-). Sua persistência indica despejo contínuo de matéria orgânica. Os nitratos (NO3- ou nitrogênio nítrico) são o último estágio da oxidação do nitrogênio. Resultados de análises com altas concentrações de nitratos indicam que a matéria orgânica que entrou em contato com a água encontrava-se totalmente decomposta. Esse fato não significa que a água esteja isenta de outros contaminantes. Do ponto de vista sanitário, altas concentrações de nitratos podem provocar metahemoglobinemia, uma alteração na hemoglobina que pode provocar sintomas semelhantes à asfixia. pH O pH é um parâmetro importante no processo de tratamento, pois está relacionado com: • Coagulação e Floculação; • Desinfecção; • Solubilidade de metais; • Corrosão; • Incrustações. No Brasil a maioria das águas são ácidas ou levemente ácidas. No processo de tratamento de água, o pH comanda boa parte das reações, sendo determinante para a eficiência dos coagulantes. ALCALINIDADE Alcalinidade está relacionada a sais alcalinos de sódio, cálcio e magnésio, mas nem sempre a alcalinidade está associada a sais alcalinos. A alcalinidade é devida a hidróxidos carbonatos e bicarbonatos e mede a capacidade da água neutralizar ácidos. A maioria das águas naturais brasileiras tem baixa alcalinidade. O tratamento de água pode alterar o valor da alcalinidade. A alcalinidade nas águas naturais também está relacionada com o pH. Quando o pH é maior que 9,4 a alcalinidade é devida a hidróxidos e carbonatos. Quando o pH está entre 8,3 e 9,4 a alcalinidade é devida a carbonatos e bicarbonatos. A alcalinidade é expressa em mg/L de CaCO3. Em concentrações moderadas não há restrição ao consumo humano. Em níveis elevados pode conferir sabor desagradável. OXIGÊNIO CONSUMIDO O oxigênio consumido avalia o conteúdo de matéria orgânica presente na água. Em uma Estação de Tratamento de Água, se houver queda no oxigênio podem estar ocorrendo anormalidades, como, por exemplo, reservatório sujo, filtro excessivamente colmatado, desenvolvimento de matéria orgânica no decantador etc. Outras medidas de avaliação da quantidade de oxigênio consumido nas reações químicas são a Demanda Química de Oxigênio (D.Q.O.) e a Demanda Bioquímica de Oxigênio (D.B.O.). A diferença entre D.B.O. e D.Q.O. é que a DQO refere-se à oxidação da matéria orgânica e outros compostos através de reações químicas, enquanto na D.B.O. essa oxidação é realizada por microorganismos. FENÓIS Os compostos fenólicos são definidos como hidróxidos derivados do benzeno e seus condensados. À origem dos fenóis em uma água pode ser atribuída aos dejetos industriais, hidrólise e oxidação fotoquímica dos agrotóxicos organofosforados e degradação microbiana de herbicidas. Alguns compostos fenólicos são resistentes à degradação microbiológica e são transportados a longas distâncias pela água. Concentrações de compostos fenólicos acima de 1,0 mg/L afetam as propriedades organolépticas para o consumo humano. Não são eficientemente removidos no tratamento convencional, ocorrendo formação de compostos fenólicos quando é feita pré-cloração em águas com altas concentrações de fenóis. ALUMÍNIO A concentração de alumínio em águas de abastecimento é geralmente devida a refloculação na rede e reservatórios do sulfato de alumínio utilizado no processo de floculação na ETA, que pode trazer problemas estéticos ou de desinfecção. CROMO HEXAVALENTE A ocorrência natural de sais de cromo (cromatos) é muito rara. Quando presentes, se originam da poluição de despejos industriais. A dose tóxica para o homem é de 0,5 mg/L de bicarbonato de potássio (Rothstein). Sendo que a portaria 518 limita a 0,05 mg/L como valor máximo permitido em água potável. TRIHALOMETANOS Os trihalometanos (THMs) constituem um grupo de compostos orgânicos que, como seu nome indica, são derivados do metano (CH4), em cuja molécula os três átomos de hidrogênio são substituídos por igual número de halogênios (cloro, flúor, bromo ou iodo). Ainda que por sua denominação esses compostos sejam considerados como procedentes do metano, este gás não tem nada a ver com sua formação. Eles se originam de substâncias orgânicas muito mais complexas que o metano, cuja ocorrência é comum em águas superficiais. Entre essas substâncias aparecem os ácidos húmicos e fúlvicos (derivados de húmus presente no solo), que reagem com o cloro durante a desinfecção produzindo os trihalometanos, obedecendo a um complicado mecanismo onde halogênios acondicionados à água reagem com os derivados do húmus que este meio habitualmente contém. Em relação à contaminação de água potável, o problema refere-se à presença de quatro compostos desse grupo: Clorofórmio(CHCl3); DibromoClorometano(CHBr2Cl); Bromodiclorometano(CHBr2Cl2); Bromofórmio (CHBr3) O mais comumente encontrado é o clorofórmio, razão pela qual a maioria das informações toxicológicas referemse a esta substância. FLUORETOS Os fluoretos ocorrem naturalmente em muitos sistemas de abastecimento. Considera-se que são componentes essenciais da água potável, sobretudo para a prevenção de cáries dentárias. Uma coletividade consumindo água com concentrações inferiores a 0,6 mg/L de fluoretos apresentam alta incidência de cárie. Evidências epidemiológicas permitem afirmar que em concentrações elevadas os fluoretos podem causar a fluorose dentária em crianças e até fluorose endêmica acumulativa, com conseqüentes lesões em crianças e adultos. As concentrações de fluoretos em água potável são estabelecidas considerando a quantidade de fluoreto ingerida diariamente. Conforme a legislação federal sobre fluoretação das águas de abastecimento público a portaria Nº 635/BSB de 26 de dezembro de 1975: Tabela das dosagens do íon Fluoreto segundo média diária das temperaturas máximas do ar (ºC) Limites recomendados para a concentração do íon Fluoreto em função da média das temperaturas máximas diárias Média das temperaturas Limites recomendados para a concentração do íon fluoreto máximas diárias do ar ºC em mg/L Limite Inferior Limite Superior Recomendado 1,2 10,0 - 12,1 C° 0,9 1,7 1,1 12,2 - 14,6C° 0,8 1,5 1,0 14,7 - 17,7 C° 0,8 1,3 0,9 17,8 - 21,4 C° 0,7 1,2 0,8 21,5 - 26,3 C° 0,7 1,0 0,7 26,4 - 32,6 C° 0,6 0,8 ASPECTOS GERAIS DAS TÉCNICAS DE COLETA DE ÁGUAS PARA ANÁLISES BACTERIOLÓGICAS E FÍSICO-QUÍMICOS A técnica a ser adotada para coleta das amostras depende do tipo de água a ser coletada (água tratada, água bruta, água residuária, etc.) e do tipo de análise a ser solicitada (análises físico-químicas, microbiológicas ou radiológicas). Em qualquer situação deve-se observar os seguintes aspectos: As amostras não devem incluir partículas grandes, detritos, folhas, ou outro tipo de material acidental, salvo quando se tratar de amostra de sedimento; Quando se tratar de água corrente, a amostra deve ser coletada com a boca do frasco contra a corrente, de modo a minimizar o risco de contaminação da amostra; Deve-se coletar volume suficiente de amostra para eventual necessidade de se repetir alguma análise no laboratório; Realizar todas as determinações de campo (ex: pH, cloro, temperatura) em alíquotas de amostras separadas daquelas que serão enviadas ao laboratório, evitando-se assim risco de contaminação; Empregar somente frascos e acondicionamento adequado para cada tipo de determinação, verificando se todos materiais para conservação adequados para o uso. Em caso de dúvida, substituí-los. Verificar também a limpeza dos frascos e demais materiais de coleta (baldes, garrafas, pipetas, isopor, etc.). As partes internas dos frascos e do material de coleta, como batoques e tampas, não podem ser tocados com a mão ou ficar expostos ao pó, fumaça e outras impurezas, tais como gasolina, óleo e fumaça de exaustão de veículos, que podem ser grandes fontes de contaminação de amostras. Cinzas e fumaça de cigarro podem contaminar fortemente as amostras com metais pesados e fosfatos, entre outras substâncias. Recomenda-se que os coletores mantenham as mãos limpas ou usem luvas plásticas cirúrgicas, e não fumem durante a coleta das amostras; Imediatamente após a coleta o acondicionamento das amostras, deve-se mantê-las ao abrigo da luz solar; As amostras que exigem refrigeração para sua correta conservação devem ser acondicionadas em caixas de isopor com gelo, porém sem o contato direto com o mesmo; Deve-se manter registro de todas as informações de campo, preenchendo uma ficha de coleta por amostra ou conjunta de amostras com a mesma característica. A ficha de coleta de campo deve conter as seguintes informações: • Número de identificação da amostra. • Identificação do ponto de amostragem e sua localização. • Data e hora da coleta • Procedência da água (rede pública, mina poço, etc.). • Medidas de campo (temperatura ar/água, pH, cloro, etc.). • Eventuais observações de campo. • Condições meteorológicas nas últimas 24 horas que possam interferir na qualidade da água. • Identificação dos parâmetros a serem analisados no laboratório. • Nome do responsável pela coleta. • Nome do solicitante, com telefone para contato. UNIDADES DE UM SISTEMA DE ABASTECIMENTO DE ÁGUA A Portaria 518/2004 do Ministério da Saúde - Define Sistema de abastecimento de água para consumo humano como um conjunto de instalações de obras civis, materiais, equipamentos, atividades, destinados à produção e à distribuição canalizada de água potável para populações, sob a responsabilidade do poder público, mesmo que administrada sob regime de concessão ou permissão.. Um sistema de abastecimento público de água, geralmente compreende as seguintes unidades: captação, adução, , tratamento, reservação e distribuição. A seguir, apresenta-se um rápido resumo de cada uma delas, quanto à etapa de tratamento, será mais completa. 1. CAPTAÇÃO A captação é o local de onde é extraída a água bruta para o tratamento e posterior distribuição da água tratada. Os mananciais utilizados para abastecimento podem prover das águas pluviais, superficiais e subterrâneos. Os provenientes de águas pluviais normalmente não são utilizados pelos sistemas de abastecimento de água. CAPTAÇÃO DE ÁGUAS SUPERFICIAIS A captação de águas superficiais é a extração da água dos rios, córregos, represas e lagos. Uma captação de água superficial deve atender aos seguintes requisitos: Garantir o suprimento e funcionamento contínuo inclusive em épocas de estiagem. Localizar-se em ponto de maior proteção sanitária contra eventual poluição e acidente com produtos químicos, a fim de garantir a melhor qualidade da água bruta. Nas represas e lagos, é comum a qualidade da água alterar conforme a profundidade, devido à existência de matéria orgânica e outras substâncias. É também comum o aparecimento de algas nessas águas. CAPTAÇÃO DE ÁGUAS SUBTERRÂNEAS As águas subterrâneas são aquelas provenientes do subsolo, sendo classificadas em águas de lençol freático e águas de lençol confinado. As águas de lençol freático são aquelas que se encontram livres, sob pressão da atmosfera. Um poço perfurado nessas condições recebe a denominação de poço freático, poço raso, cacimba ou amazonas. As águas de lençol confinado são aquelas que se encontram confinadas por camadas impermeáveis e sujeitas a uma pressão maior que a pressão atmosférica. O aproveitamento se dá por meio de poços profundos ou artesianos. 2. ADUÇÃO Entende-se por adução o conjunto de tubulações, peças e obras destinadas a levar a água bruta do ponto de captação até o a estação de tratamento ou reservatório de tratamento em caso de águas subterâneas que não necessitam do tratamento convencional. Também são consideradas adutoras redes instaladas que levam água tratada de um ponto a outro para depois ser distribuída. A adução tanto de água tratada quanto de água bruta e podem ser realizadas por gravidade, por recalque por meio de conjuntos moto bombas ou de forma mista. 3. TRATAMENTO O tratamento de água tem por finalidade adequar a água aos padrões de potabilidade. Existem vários processos de tratamento e a sua escolha é em função da qualidade da água bruta e da eficiência desejada na redução de agentes físicos, químicos e microbiológicos e de outros fatores como custo de implantação, operação e manutenção. A Estação de Tratamento de Água (ETA) é o local onde se localizam as instalações e equipamentos destinados a realizar o tratamento de água. OS PRINCIPAIS PROCESSOS DE TRATAMENTO SÃO: AERAÇÃO A aeração é o processo pelo qual uma fase gasosa, normalmente o ar, e a água são colocados em contato, com a finalidade de transferir substâncias voláteis da água para o ar e substâncias voláteis do ar para a água, de forma a obter o equilíbrio entre as substâncias químicas presentes. A aeração se justifica caso a água a ser tratada apresente carência ou excesso de gases e substâncias voláteis intercambiáveis ou a presença de minerais como ferro e manganês a aeração provoca a oxidação e a precipitação facilitando a remoção do precipitado através de decantação. Geralmente o processo se aplica em águas que não estão em contato com o ar, como águas subterrâneas. Este caso não ocorre no tratamento de água do SIMAE, pois não é necessário. MISTURA RÁPIDA, COAGULAÇÃO E FLOCULAÇÃO. A mistura rápida consiste em colocar a água em contato com o coagulante para a obtenção da reação química uniforme e contínua. É empregada na mistura rápida, a energia hidráulica ou mecânica (difusores, ressalto hidráulico, agitadores mecânicos e motores de bombas). A coagulação é o processo de reação química rápida do coagulante na água. Para a formação de coágulos, o coagulante de ser aplicado em pontos de maior turbilhonamento, para que possa ter distribuição homogênea na massa de água. A coagulação é empregada para a remoção de impurezas que se encontram em suspensão fina, em estado coloidal ou em solução, sendo suas principais funções desestabilizar, agregar e aderir os colóides, para transformá-los em coágulos. A floculação é o processo pelo qual as partículas em estado de equilíbrio eletrostaticamente instável no seio da massa líquida são forçadas a se movimentar, a fim de que sejam atraídas entre si, formando flocos. Com a continuidade da agitação, os flocos tendem a aderir uns nos outros, tornado-se pesados para posterior decantação nas unidades seguintes. No processo de floculação, a velocidade da água deve ser lenta, de modo a haver formação de flocos e não o seu rompimento. Na ETA, a coagulação e a floculação ocorrem em dois pontos distintos: a coagulação é a aplicação de produto químico coagulante na água entrando na ETA, em velocidade rápida, e a floculação é uma agitação na massa coagulante em velocidade lenta. Para a fase da coagulação, há necessidade de aplicação de produtos químicos. Os mais utilizados são: Coagulantes, Alcalinizantes e Auxiliares de Floculação: • Sulfato de Alumínio • Policloreto de alumínio (PAC) • Floculante a base de tanino-extraído da acácia negra • Cal Virgem • Argila • Sulfato Ferroso • Cal Hidratada • Sílica Ativada • Sulfato Férrico • Carbonato de Sódio • Polieletrólitos etc • Sulfato Ferroso Clorado • Hidróxido de Sódio • Cloreto Férrico Para determinar a escolha do coagulante deve-se levar em conta o pH da água a ser tratada, pois o pH de trabalho de cada floculante é distinto: Coagulantes Faixa de pH Sulfato de Alumínio Sulfato Ferroso Sulfato Férrico Sulfato Ferroso Clorado Cloreto Férrico 5,0 a 8,0 8,5 a 11,0 5,0 a 11,0 5,0 a 11,0 > 4,0 Para aplicação dos coagulantes são utilizados aparelhos dosadores que servem para regular a dosagem conforme a necessidade. DECANTAÇÃO Entre as impurezas contidas na água encontram-se partículas em suspensão e partículas em estado coloidal. Partículas mais pesadas que a água podem manter-se suspensas nas correntes líquidas pela ação das forças relativas à turbulência. A decantação é a separação das partículas sólidas (flocos), que sendo mais pesadas que a água tendem a cair para o fundo do tanque decantador com uma certa velocidade (velocidade de decantação). Anulando-se ou diminuindo-se a velocidade de escoamento das águas, reduzem-se os efeitos da turbulência, provocando a deposição das partículas. O decantador é um tanque de sedimentação usualmente retangular ou circular, onde acontecem as fases de turbilhonamento, decantação, ascensão e repouso do material. O escoamento horizontal dá-se com a água entrando por uma extremidade, movendo-se na direção longitudinal e saindo na outra extremidade. No escoamento vertical, a água é dirigida para a parte inferior, elevando-se em movimento ascendente até a superfície do tanque. Com relação ao sistema de limpeza e lavagem no decantador, tem-se a manual, hidráulica e mecanizada. Consiste, basicamente, na remoção de flocos acumulados no fundo do tanque, de modo que estes não interfiram na qualidade da água retirada da superfície e encaminhada para as etapas seguintes. FILTRAÇÃO O objetivo da filtração é principalmente a retenção física de partículas e microorganismos que não foram removidos no decantador, resultando num efluente final de melhores características que o efluente do decantador. Na filtração ocorre o processo de filtragem e de absorção, isto é, adesão das impurezas nos grãos do leito filtrante. OS FILTROS SÃO CLASSIFICADOS SEGUNDO AS SEGUINTES CARACTERÍSTICAS: Quanto ao tipo de material: Areia Carvão ou Antracito Carvão-areia Terra diatomácea Quanto à camada filtrante: Camadas superpostas Múltiplas camadas Quanto ao tipo de energia: Pressão Gravidade Quanto à taxa de filtração: Filtros Lentos: são aqueles que funcionam baixa taxa de filtração (4 m3/m2/dia) e são usados quando as águas têm baixa cor e turbidez (< 50 ppm). São normalmente utilizados em pequenas localidades. O filtro lento substitui as unidades de coagulação floculação e decantação é utilizado também como auxiliar dos filtros rápidos para águas com turbidez acima de 50ppm , onde primeiro faz-se a filtração rápida, seguida da filtração lenta. O uso do filtro lento é limitado por níveis de turbidez da água e demanda de área para implantação e operação. Filtros Rápidos: são aqueles que funcionam com altas taxas de filtração (180 a 300 m3/m2/dia). Normalmente são de seção quadrada ou retangular e a altura varia com a taxa de filtração. DESINFECÇÃO Entende-se por desinfecção a destruição ou inativação de organismos patogênicos e de outros indesejáveis. Entre os fatores que influem na eficiência da desinfecção e, conseqüentemente, no tipo de desinfetante a ser utilizado estão: • Espécie e concentração do organismo a ser destruído • Espécie e concentração do desinfetante • Tempo de contato • Características químicas e físicas da água • Grau de dispersão do desinfetante na água • Atributos necessários a um desinfetante: • Poder destruir, em tempo razoável, os microorganismos patogênicos. • Não ser tóxico ao homem e animais nas dosagens usuais • Estar disponível no mercado • Ter custo razoável, e apresentar facilidade e segurança no transporte e manuseio. • Produzir residuais, de maneira a constituir barreira sanitária contra eventual contaminação. A resistência de algumas espécies de microorganismos a desinfetantes específicos varia consideravelmente. A destruição de organismos por um determinado desinfetante é proporcional a concentração do desinfetante e ao tempo de reação. Assim sendo, pode-se trabalhar com altas concentrações e curto espaço de tempo ou baixas concentrações e tempo elevado. As características químicas da água a ser tratada devem ser o fator de escolha do desinfetante, pois se o agente desinfetante for oxidante, a presença de matéria orgânica e outros materiais oxidáveis irá consumir parte da quantidade necessária para destruir os organismos. A temperatura também influi no processo de desinfecção. Em geral, altas temperaturas favorecem a ação do desinfetante. Para que os desinfetantes químicos serem eficientes devem ser atribuídos uniformemente na massa de água por meio de agitação. TIPOS E MÉTODOS DE DESINFECÇÃO MAIS USADOS QUE PODEM SER: FÍSICOS Calor - a ebulição em fervura é um método de desinfecção doméstica, que elimina os microorganismos presentes na água. Por tratar-se de processo térmico, ocorre à perda de gases presentes na água, havendo necessidade da aeração da água após a fervura. Raio ultravioleta - a água pode ser desinfetada pela exposição aos raios ultravioletas que são obtidos por meio de passagem de corrente elétrica através de lâmpadas de quartzo-mercúrio. Pasteurização - a água passa por um aquecimento seguido de resfriamento rápido, nos moldes da pasteurização do leite. QUÍMICOS Ozona - é um oxidante muito poderoso. Elimina a matéria orgânica, remove cor, turbidez, odor e sabor. As limitações estão no custo, técnicas mais sofisticadas de aplicação e por não deixar residual na água. Iodo - é um bom desinfetante, mas seu custo é alto para ser utilizado em sistemas públicos de água. Prata - é eficiente e sob a forma coloidal ou iônica, não confere sabor e odor. Em águas contendo cloretos sua eficiência diminui. Cloro - é o desinfetante utilizado em sistemas de tratamento de água para consumo humano, pois além de atender os requisitos necessários para realizar a desinfecção da água, é o único desinfetante reconhecido pela portaria 518/2008 do Ministério da Saúde devido a sua alta eficiência, poder residual, médio custo e por ser facilmente encontrado no mercado. Nos sistemas de abastecimento de água o cloro tem as seguintes utilidades: • Desinfecção da água; • Desinfecção de tubulações novas; • Desinfecção de tubulações em manutenção e reparos; • Desinfecção de reservatórios; • Desinfecção de poços. A CLORAÇÃO E SUAS REAÇÕES QUÍMICAS Quando o cloro é aplicado em águas naturais, as substâncias nelas existentes, principalmente a matéria orgânica e a amônia, são responsáveis por reações secundárias das quais as mais importantes são as que levam a formação de cloretos inativos (aumentam o teor de cloretos na água) e as que causam a formação de cloraminas (NH2 e NHCl2). As cloraminas têm o poder bactericida, porém exigem, para um mesmo efeito desinfetante, um residual 10 vezes maior que o cloro livre. Portanto, pode-se ter dois tipos de residual de cloro: livre e combinado. Os Sistemas de Abastecimento Público de Água fazem desinfecção com cloro, denominando-se este procedimento como cloração. O uso do cloro também pode ser em mananciais como algicida ou na pré-cloração, como oxidante do ferro e manganês que tem presença natural em águas principalmente subterâneas, também como oxidante da amônia e outros compostos. Quando se adiciona cloro gasoso à água ele se combina formando ácido clorídrico e ácido hipocloroso: Cl2 + H2O → HCl + HClO Na adição de hipoclorito de cálcio, o sal se dissocia e por hidrólise tem-se: Ca (CLO)2 + 2H2O → Ca (OH)2 + 2HClO Na adição de hipoclorito de sódio, tem-se a seguinte reação: NACLO + H2O → NaOH + HClO Pela adição de qualquer das substâncias acima, verifica-se a formação do HClO (ácido hipocloroso), que por sua vez também se dissocia: HCl H+ + ClOEssa dissociação varia com a temperatura e com o pH. Desta forma, o cloro pode ser encontrado na água nas seguintes formas: Cl- (cloro molecular), HClO (ácido hipocloroso) e ClO- (íon hipoclorito). Em pH < 5,0, prevalece o cloro na forma molecular. Na faixa de pH entre 5,0 e 7,5 prevalece a forma de ácido hipocloso e em pH > 7,5 prevalece a forma de íon hipoclorito. Em todos os casos, as outras formas também estão presentes, porém em menor concentração. Sendo o ácido hipocloso (HClO) aproximadamente 80 vezes mais poderoso como desinfetante que o íon hipoclorito (ClO-), conclui-se, que o poder bactericida do cloro decresce à medida que o pH aumenta. Para valores correntes do pH das águas a serem tratadas (acima de 5,0) o cloro predominante será sempre nas formas HCLO e ClO-, sendo denominado cloro residual livre. Quando se adiciona cloro à água ele reage com a matéria orgânica e inorgânica nela contida, combinando, provocando oxidações ou originando a coagulação de certos compostos orgânicos. Enquanto ele reage rapidamente com a matéria inorgânica, a reação com a matéria orgânica é mais lenta, fato importantíssimo a ser considerado no processo de desinfecção da água. Há uma aceleração das reações, proporcional à quantidade de cloro. Entre as substâncias freqüentemente contidas na água com as quais o cloro reage, tem significado especial a amônia (NH3) e outros compostos nitrogenados, como proteínas e aminoácidos, com os quais o cloro forma as chamadas cloraminas e outros cloros derivados de menor interesse. A importância das cloraminas na desinfecção da água reside na particularidade de conterem cloro disponível para novas reações, embora menos energéticas do que as de cloro livre. NH3 + HClO NH2Cl + H2O (monocloramina) NH2Cl + HClO NHCl2 + H2O (dicloramina) NHCl2 + HClO NCl3 + H2O (tricloreto de nitrogênio) Para valores de pH > 9,0 predominam as monocloraminas; para valores de pH < 5,0 predominam a dicloramina à medida e tricloreto de nitrogênio. Para valores 5,0 < pH < 9,0 forma-se uma mistura de mono e dicloramina, com concentrações crescentes para a monocloramina e decrescente para a dicloramina à medida que o pH aumenta. A ação bactericida das cloraminas deve-se principalmente à dicloramina, o que explica porque os valores elevados de pH da água são também desfavoráveis. O residual de cloro na forma de NHCl2 e NH2Cl se designa cloro residual combinado. Quando se aplica cloro à água, uma parte é absorvida pelas reações que se originam, de tal modo que seu poder de desinfecção, em determinado momento, depende somente do cloro disponível para novas reações, ou seja, do cloro residual disponível. E este inclui não somente o cloro residual livre, mas também as cloraminas (cloro residual combinado). Como ambos têm velocidades de reação diferentes, é importante distinguí-los, Através de análise. Define-se demanda de cloro de uma água à quantidade que a água absorve, sem deixar residual. Devido à lentidão de certas reações, tal quantidade é variável com o tempo de contato cloro-água, pelo que se deve referir à demanda de cloro para um determinado tempo de contato. Pode-se ainda definir a demanda de cloro de uma água, para um determinado tempo de contato cloro-água, como a diferença entre a dosagem de cloro aplicada e o residual disponível, ao fim desse período de contato. Variando-se as dosagens de cloro para um mesmo tempo de contato acontece um fenômeno que é chamado ponto de inflexão do cloro ou break point. A inflexão do íon amônio para o nitrogênio (queima úmida) demanda um excesso de cloro de 8-10 vezes por parte do amônio. O ponto de inflexão é alcançado quando houver equilíbrio da relação cloro/matéria oxidável. A partir desse ponto, poderá existir um residual de cloro. A permanência deste residual indica que as reações químicas e/ou biológicas foram completadas. A desinfecção constitui-se medida que deve ser adotada em todos os sistemas de abastecimento, seja em caráter corretivo ou em caráter preventivo. A cloração pode ser feita com cloro líquido, cal clorada ou hipoclorito. O cloro deve ser manuseado com cuidado, pois é perigoso para os indivíduos e é capaz de destruir materiais. Assim, são necessários cuidados constantes por parte dos operadores das ETAS, bem como uma suficiente manutenção do equipamento de cloração. Equipamentos utilizados na cloração: Bombas dosadoras Hidroejetores Dosadores de nível constante Obs: São necessários também os materiais para manutenção e equipamentos de segurança. COMPOSTOS DE CLORO MAIS EMPREGADOS Cloro gás Fornecido liquefeito em cilindros especiais, sob pressão, com pureza de 99,99% e com peso de 40,68 e 900 kg. Cal clorada (cloreto de cálcio) -Pó branco com 25 a 30% de cloro disponível Armazenada em local seco e frio, a perda de cloro é pequena, mas em local úmido e quente deteriora rapidamente. São usadas em instalações pequenas, em fábricas, piscinas e em situações de calamidade, sendo aplicada em soluções de 2,5% de cloro disponível. Hipoclorito de cálcio (Perchloron, HTC etc). Pó branco com cerca de 70% de cloro ativo disponível. Os cuidados de armazenamento são os mesmos utilizados para a cal clorada e é aplicado em solução de até 2,5% de cloro disponível. Pode ser armazenado durante um ano ou mais, desde que esteja bem acondicionado. Hipoclorito de sódio É encontrado sob a forma de solução a 10% de cloro ativo embalado em bombonas de 40kg. Quando de preparo recente, é estável por 3 semanas e deve ser guardado em local escuro e fresco. A água sanitária é uma solução diluída de hipoclorito de sódio contendo entre 2 a 5% de cloro ativo. O uso da água sanitária para a desinfecção da água tem alguns inconvenientes, a concentração de cloro ativo, pois a adulteração deste produto é muito suscetível. A concentração de cloro no produto muitas vezes inferior a declarada em seu rótulo ou comprometida pelo armazenamento incorreto. FLUORETAÇÃO O objetivo convencional do tratamento de água para abastecimento público tem sido o de apresentar uma água de boa qualidade física, química e bacteriológica. Naturalmente nos primeiros tempos houve imposição ao emprego de compostos químicos, como o sulfato de alumínio e cloro, com a finalidade de tratar a água, o que hoje é universalmente aceito. A idéia de adicionarmos à água potável, substâncias cuja presença possa assegurar o adequado desempenho fisiológico do corpo humano constitui-se também numa finalidade de tratamento de água. Sabe-se que muitas substâncias presentes nos alimentos são essenciais à saúde. Certos elementos presentes na água, em quantidades muito pequenas, são igualmente importantes. Assim como o homem necessita de ferro, cobre, iodo, entre outros, para seu bom desempenho fisiológico, o flúor administrado através da água, contribui para a saúde da população. IMPORTÂNCIA DA FLUORETAÇÃO A fluoretação da água previne a decomposição do esmalte dos dentes que, quando comprometido, jamais poderá ser refeito. A fluoretação das águas de abastecimento público auxilia a produção natural de dentes mais resistentes. A constatação dos efeitos benéficos da fluoretação é possível através de estudos epidemiológicos a partir da contagem percentual do chamado Índice de CPO-D (cariados, perdidos e obturados - dentes) numa dada população. Desta forma é calculado este Índice de CPO-D, que é comparado nos períodos em que esta população recebia água não fluoretada e após o período de em que recebeu água fluoretada. Esses permitiram estabelecer a ingestão ótima de fluoreto através da água, pois a ingestão de água com concentrações elevadas, durante longos períodos, podem causar fluorose dentária e danos ósseos em crianças e adultos. A aplicação de fluoreto na água não deve ser intermitente, e seus teores adequados, para que tenha o efeito desejado. Esse limite é estabelecido através de uma estimativa da água ingerida diariamente por uma população. Essa estimativa está baseada nas temperaturas médias anuais, de modo que as concentrações de fluoreto adicionadas à água serão maiores quanto mais baixas as temperaturas médias e menores quanto mais altas estas temperaturas. Os compostos de flúor são encontrados geralmente em quantidades maiores nas águas subterrâneas do que nas superficiais. A solubilidade do fluoreto e a quantidade em que se encontra na água depende da natureza da formação rochosa, da velocidade com que passa sobre as rochas, da porosidade dessas rochas e da temperatura local. A ocorrência de fluoretos tende a ser maior em águas temperadas e alcalinas. COMPOSTOS DE FLÚOR UTILIZADOS NA FLUORETAÇÃO DAS ÁGUAS Fluoreto de sódio comercial É apresentado em forma de pó fino e granulado, com pureza de 95% e com 45% de F-. Possui uma solubilidade quase constante (4,03% à 15ºC e 4,11% a 100ºC). O pH da solução a 1% é de 6,5 e o da solução saturada, entre 6,0 e 7,0, não sendo corrosivo. Fluossílicato de sódio (sílico-fluoreto de sódio) É um pó cristalino, branco-amarelo, não higroscópico, sem água de cristalização. Sua solubilidade é muito baixa (0,54% a 10ºC e 2,45% a 100ºC). O pH de uma solução de fluossílicato de sódio é 3,5. Por ser muito corrosiva, requer cuidados especiais na manipulação. São vendidos em embalagens de 25 a 50 kg, de fácil armazenamento, apresentando, em termos econômicos, uma pequena desvantagem em relação ao ácido fluossilícico. Ácido Fluossilícico É um líquido incolor, requer equipamentos mais simples para as dosagens, sendo economicamente mais vantajoso. Pelo fato de ser um subproduto do processo de produção de fertilizantes, em determinadas épocas do ano (março, abril e maio) é difícil a disponibilidade no mercado. São transportados por caminhões-tanque, não são de fácil armazenamento e apresentam manuseio e transporte perigosos. Fluoreto de Cálcio Solubilidade 0,0016%. Solúvel em ácidos e também em solução de sulfato de alumínio. Praticamente não é utilizado na fluoretação devido às inúmeras dificuldades de sua aplicação, apesar de oferecer vantagens do ponto de vista econômico. Dos produtos acima descritos os mais utilizados são o ácido fluossilícico e o fluossílicato de sódio. A quantidade do composto de flúor, necessária a uma determinada água, depende: • Da pureza do composto a ser utilizado. • Da dosagem de fluoreto natural na água. • Do teor de íon fluoreto do composto. • Da concentração desejada para a água tratada. • Da média das temperaturas máximas diárias. • Os equipamentos mais utilizados para dosagem de flúor são: Bomba dosadora; Dosador de nível constante (DNC). 4. RESERVATÓRIO DE DISTRIBUIÇÃO Os reservatórios de distribuição têm como finalidade: Garantir a quantidade de água, regularizar as diferenças entre abastecimento e consumo; Garantir o armazenamento da água para as demandas de emergência (reserva de incêndio); Melhorar as condições de pressão da água na rede de distribuição. Em função da localização da captação, estação de tratamento e do setor de distribuição, pode-se ter os reservatórios classificados em reservatório de montante, de jusante ou de sobras. Quanto à localização dos reservatórios no terreno, podem ser enterrados, semi-enterrados, stand-pipes e elevados. O material de construção pode ser alvenaria, concreto, aço, entre outros; e seus formatos retangulares, circulares, paralelepipedais ou troncopiramidais. 5. REDE DE DISTRIBUIÇÃO É o conjunto de tubulações que percorre as vias públicas (ruas e passeios), conduzindo água tratada até os consumidores (casas, prédios, unidades de saúde, hotéis, escolas, quartéis etc). A rede de distribuição é constituída de tubulações de diversos diâmetros, sendo que os maiores diâmetros formam a rede principal, que alimenta os de menor diâmetro (rede secundária), responsável por levar a água diretamente ao ponto de consumo. Além das tubulações, as conexões, registros e hidrantes completam a rede de distribuição. Para que a água mantenha o padrão de potabilidade na rede de distribuição, alguns aspectos construtivos devem ser observados, tais como: A pressão deve ser positiva em qualquer ponto da rede de distribuição, isto é, a água deve atingir todos os pontos da rede de distribuição com pressão controlada entre 10 e 60 mca. A rede deve estar protegida de contaminação externa. Além de certificar-se da estanqueidade das tubulações, recomenda-se assentar a rede de distribuição de água a uma distância mínima da três metros da rede coletora de esgotos, em nível superior ou em extremos opostos da via pública. Boas condições de operação do sistema de abastecimento evitam interrupções de fornecimento de água, momento propício à ocorrência de queda de pressão na rede de distribuição, favorecendo a entrada de contaminantes dentro das tubulações. A rede de distribuição deve ser provida de registros e dispositivos que permitam manutenção e descargas de rede sem prejuízo do abastecimento ou alteração no padrão de potabilidade. 6. RAMAL PREDIAL É a tubulação compreendida entre a peça de derivação da rede de distribuição e o hidrômetro do consumidor. Como parte da rede de distribuição, sua instalação e manutenção são da competência do órgão operador do sistema de abastecimento.
Download