UNIVERSIDADE FEDERAL DE PERNAMBUCO
CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE CIÊNCIAS FARMACÊUTICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
SÍNTESE E AVALIAÇÃO DAS ATIVIDADES ANTIMICROBIANA E
ANTI-T.CRUZI DE DERIVADOS NITROARILTIOSSEMICARBAZÔNICOS
DISSERTAÇÃO DE MESTRADO
DYEGO REVORÊDO DE CARVALHO SILVA
RECIFE, PE, BRASIL
2010
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
SÍNTESE E AVALIAÇÃO DAS ATIVIDADES ANTIMICROBIANA E
ANTI-T.CRUZI DE DERIVADOS NITROARILTIOSSEMICARBAZÔNICOS
por
Dyego Revorêdo de Carvalho Silva
Dissertação submetida ao
Programa de Pós-Graduação
em Ciências Farmacêuticas do
Centro de Ciências da Saúde
da UFPE, como requisito
parcial para obtenção do grau
em MESTRE em Ciências
Farmacêuticas.
Orientador: Prof. Dr. Dalci José Brondani
RECIFE-PE, BRASIL
2010
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
Silva, Dyego Revorêdo de Carvalho
Síntese e avaliação das atividades antimicrobiana e
anti-T.Cruzi de derivados nitroariltiossemicarbazônicos /
Dyego Revorêdo de Carvalho Silva. – Recife: O Autor,
2010.
159 folhas: il., fig,, esquemas. ; 30 cm.
Orientador: Dalci José Brondani.
Dissertação (mestrado) – Universidade Federal de
Pernambuco. CCS. Ciências Farmacêuticas, 2010.
Inclui bibliografia e anexos.
1. Tiossemicarbazonas. 2. Chagas.
3. Atividade Antimicrobiana. 4. Atividade Anti-T.Cruzi.
5. Nitrocompostos. I. Brondani, Dalci José.
615.31
CDU (20.ed.)
II.Título.
UFPE
CCS2011-193
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
UNIVERSIDADE FEDERAL DE PERNAMBUCO
CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE CIÊNCIAS FARMACÊUTICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
LABSINFA – LABORATÓRIO DE PLANEJAMENTO, SÍNTESE E AVALIAÇÃO DE
FÁRMACOS
Recife, 02 de dezembro de 2010
Defesa de Dissertação de Mestrado defendida e APROVADA por decisão unânime, em
02 de dezembro de 2010 e cuja Banca Examinadora foi constituída pelos seguintes
professores.
PRESIDENTE ORIENTADOR E EXAMINADOR INTERNO: Prof. Dr. Dalci José
Brondani
(Deptº de Ciências Farmacêuticas da Universidade Federal de Pernambuco - UFPE
Assinatura:
SEGUNDO EXAMINADOR INTERNO: Profa. Dra. Janete Magali de Araújo
( Deptº de Antibióticos da Universidade de Pernambuco – UFPE)
Assinatura:
PRIMEIRO EXAMINADOR EXTERNO: Profa. Dra. Ivani Malvestiti
( Deptº de Química Fundamental da Universidade Federal de Pernambuco – UFPE)
Assinatura:
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
UNIVERSIDADE FEDERAL DE PERNAMBUCO
REITOR
Prof. Dr. Amaro Henrique Pessoa Lins
VICE-REITOR
Prof. Dr. Gilson Edmar Gonçalves e Silva
PRÓ-REITOR PARA ASSUNTOS DE PESQUISA E PÓS-GRADUAÇÃO
Prof. Dr. Anísio Brasileiro de Freitas Dourado
DIRETOR DO CENTRO DE CIÊNCIAS DA SAÚDE
Prof. Dr. José Tadeu Pinheiro
CHEFFE DO DEPARTAMENTO DE CIÊNCIAS FARMACÊUTICAS
Prof. Dr. Dalci José Brondani
COORDENADOR DO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS
FARMACÊUTICAS
Prof. Dr. Pedro José Rolim Neto
VICE-COORDENADORA DO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS
FARMACÊUTICAS
Profa. Dra. Beate Saegesser Santos
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
DEDICATÓRIA
À minha mãe Rosely, uma verdadeira
batalhadora, pela dedicação e amor, pois sem isso
não seria o que sou hoje;
Ao meu pai Marconi (in memorian), pelo
exemplo de respeito, caráter, sinceridade e
dignidade;
Ao meu irmão por todo companheirismo
prestados nas horas que precisei;
À minha namorada por todo amor, atenção e
dedicação durante essa etapa da minha vida.
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
“Quem sabe concentrar-se numa coisa e insistir
nela como único objetivo, obtém, ao fim e ao cabo,
a capacidade de fazer qualquer coisa”
Mahatma Gandhi
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
AGRADECIMENTOS
A Deus, por me proporcionar vida e saúde, pois essas são os dois maiores presentes
que um ser humano pode receber.
Ao meu orientador Prof. Dr. Dalci José Brondani pelos ensinamentos, paciência e
ajuda de uma forma geral, além da amizade construída durantes esses anos.
Aos meus pais, Marconi e Rosely por tudo que aprendi durante a vida, pelo apoio e
compreensão, além de carinho, amor e dedicação, me auxiliando a superar todas as
dificuldades e conquistar meus sonhos. As reclamações nas horas pertinentes também
foram importantes. Vocês são os alicerces do meu crescimento.
Ao meu irmão Thyago por todos os momentos de descontração vividos, como também
pelos ensinamentos de determinação e superação.
A minha namorada Priscila por todo amor, dedicação, compreensão, respeito, atenção
e principalmente paciência, com os meus aperreios, e motivação para continuar
vencendo as etapas que a vida oferece.
Aos meus familiares, em especial os mais próximos que sempre estiveram presentes
em todas as etapas da minha vida.
Aos amigos de Laboratório e agregados: Wan, Victor, Lucas Oliveira, Lecílio, Márcia,
Andrea, Daura, Leilane, Jannyeres, Elany, Gevânio, Lucas Coelho, Suellen, Luiz
Carlos, Danniel, Eraldo, Janessa e Tarcilla pela amizade construída nesse tempo, que
tenho certeza que vai durar muito tempo.
Aos Doutorandos Marcos Veríssimo e Diogo Lúcio por todas as dúvidas sanadas, que
não foram poucas, e também por ensinar vários ―macetes laboratoriais‖ que
facilitaram muito a realização das tarefas.
A todos os professores que fazem parte do PPGCF por compartilharem conosco seus
vastos conhecimentos, mostrando-me uma nova visão das coisas.
Aos todos os funcionários do DCFar, em especial Iguaci, Fátima, Conceição e
Margareth.
À FACEPE, pela concessão do auxílio financeiro durante esses dois anos,
possibilitando a realização do projeto.
Aos meus familiares, em especial os mais próximos que sempre estiveram presentes
em todas as etapas da minha vida. Obrigado por todo momento compartilhado, de
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
apoio e força.
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
SUMÁRIO
LISTA DE FIGURAS................................................................................................. XII
LISTA DE ESQUEMAS............................................................................................
VX
LISTA DE TABELAS................................................................................................
XVIII
LISTA DE ABREVIATURAS E SIGLAS................................................................ XIX
RESUMO....................................................................................................................
XXI
ABSTRACT...............................................................................................................
XXII
CAPÍTULO I: INTRODUÇÃO, REVISÃO DA LITERATURA E
OBJETIVOS............................................................................................................... 23
I- 1. INTRODUÇÃO..................................................................................................
24
I- 2. REVISÃO DA LITERATURA.........................................................................
26
I- 2.1 DOENÇA DE CHAGAS..........................................................................
26
I- 2.1.1 Generalidades da doença de Chagas................................................
26
I- 2.1.2 Epidemiologia .................................................................................
28
I- 2.1.3 Ciclo Biológico................................................................................
29
I- 2.1.4 Transmissão.....................................................................................
31
I- 2.1.5 Manifestações clínicas ...................................................................
33
I- 2.1.6. Tratamento e novos alvos terapêuticos...........................................
35
I- 2.2 QUÍMICA DAS TIOSSEMICARBAZONAS.......................................
41
I- 2.2.1 Tiossemicarbazonas- Aspectos Químicos........................................
41
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
I- 2.2.2 Síntese de tiossemicarbazonas.........................................................
42
I- 2.2.3 Tiossemicarbazonas e seus metais complexos.................................
52
I- 2.3 TIOSSEMICARBAZONAS E SUAS APLICAÇÕES
FARMACOLÓGICAS.......................................................................................
57
I- 2.3.1 Atividade antiviral........................................................................... 57
I- 2.3.2 Atividade Antibacteriana.................................................................
59
I- 2.3.3 Atividade Antifúngica.....................................................................
60
I- 2.3.4 Atividade Antitumoral.....................................................................
61
I- 2.3.5 Atividade antiprotozoária.................................................................
62
I- 2.3.6 Atividade antichagásica...................................................................
64
I- 3. OBJETIVOS...................................................................................................... 68
I- 3.1 Objetivo Geral............................................................................................
68
I- 3.2 Objetivos Específicos................................................................................. 68
CAPÍTULO II: OBTENÇÃO DOS DERIVADOS NITROARILTIOSSEMICARBAZÔNICOS........................................................................ 69
II- 1. INTRODUÇÃO ...............................................................................................
70
II- 2. METODOLOGIA ............................................................................................ 70
II- 2.1 Procedimento Geral de Obtenção dos Aril-aldeídos Nitrados..................
70
II- 2.2 Procedimento Geral de Obtenção das Nitro-Aril tiossemicarbazonas.......
71
II- 3. RESULTADOS E DISCUSSÃO.....................................................................
73
CAPÍTULO III: AVALIAÇÃO DAS ATIVIDADES BIOLÓGICAS.................... 89
III- 1. INTRODUÇÃO............................................................................................... 90
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
III- 2. ATIVIDADE ANTIBACTERIANA .............................................................
90
III- 2.1 Metodologia.............................................................................................. 90
III- 2.1.1 Método da difusão em discos de papel..........................................
90
III-2.1.2 Determinação da Concentração Mínima Inibitória (CMI) e
Concentração Mínima Bacteriostática (CMB)............................................
93
III- 2.2 Resultados e discussão.............................................................................. 93
III-
3.
ATIVIDADE
ANTICHAGÁSICA
E
AVALIAÇÃO
DA
CITOTOXICIDADE.................................................................................................. 96
III- 3.1 Metodologia.............................................................................................. 96
III- 3.1.1 Ensaio de citotoxicidade dos compostos em células esplênicas..... 96
III- 3.1.2 Avaliação da atividade dos compostos frente ao T. cruzi...............
97
III- 3.2 Resultados e discussão.............................................................................
97
CAPÍTULO IV: CONCLUSÕES E PERPESCTIVAS........................................... 106
IV-
1. CONCLUSÕES..........................................................................................
107
IV-
2. PERPESCTIVAS .......................................................................................
108
CAPÍTULO V: PARTE EXPERIMENTAL
109
V- 1. PARTE EXPERIMENTAL..............................................................................
110
V- 1.1 Materiais e Métodos................................................................................... 110
V- 1.1.1Cromatografias.................................................................................. 110
V- 1.1.2 Pontos de Fusão...............................................................................
110
V- 1.1.3 Espectroscopias de IV, RMN 1H e RMN 13C...............................
110
V- 1.1.4 Equipamentos................................................................................... 110
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
V- 1.1.5 Reagentes e solventes......................................................................
111
V- 1.2. Procedimentos Experimentais............................................................ 111
V- 1.2.1 Síntese e Caracterização estrutural......................................... 111
V- 1.2.2 Avaliação da Atividade Antibacteriana..................................
125
V- 1.2.2.1 Metodologia............................................................. 125
V- 1.2.3 Avalização da atividade anti- T.cruzi......................................
126
V- 1.2.3.1 Metodologia............................................................. 126
V- 1.2.4 Obtenção de células esplênicas de camundongos isogênicos
e Ensaio de Citotoxicidade...................................................................
126
V- 1.2.4.1 Metodologia............................................................. 126
Referências Bibliográficas......................................................................................... 128
ANEXOS.....................................................................................................................
142
ANEXO A: Espectros de IV dos derivados obtidos………………………………
143
ANEXO B: Espectros RMN 1H................................................................................. 149
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
LISTA DE FIGURAS
Figura 1: Número de novos medicamentos desenvolvidos entre os anos de 1975 e
2004...............................................................................................................................
24
Figura 2: Estrutura química do Benznidazol...............................................................
25
Figura 3. Barbeiro (Triatoma infestans): inseto transmissor da doença de Chagas.......
27
Figura 4: Fatores predisponentes para o aparecimento da doença de Chagas: casas de
pau-a-pique.....................................................................................................................
27
Figura 5: Estimativa da população global afetada pelo Trypanosoma cruzi, 2009.......
29
Figura 6: Formas evolutivas do Trypanosoma cruzi – A: Fibras musculares cardíacas
infestadas pela forma amastigota; B: Forma epimastigota e C: Forma
tripomastigota.................................................................................................................
30
Figura 7: Ciclo biológico da doença de Chagas...........................................................
31
Figura 8: A: Sinal de Romaña; B: chagoma de inoculação..........................................
33
Figura 9: Coração de pacientes que desenvolveram doença de Chagas e morreram
por: (A) morte súbita, (B) megacólon ou mega-esôfago e (C) insuficiência cardíaca
congestiva......................................................................................................................
34
Figura 10: Subestruturas químicas fundamentais de nitrocompostos empregados em
terapêutica.....................................................................................................................
36
Figura 11: Estrutura molecular da nitrofurazona.........................................................
36
Figura 12: Fármacos utilizados na terapia antichagásica.............................................
37
Figura 13: Estrutura química das tiossemicarbazonas..................................................
40
Figura 14: Representação das conformações das tiossemicarbazonas..........................
41
Figura 15: Representação dos estereoisômeros E e Z das Tiossemicarbazonas............
42
Figura 16: Representação das duas formas tautoméricas das TSCs...............................
52
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
Figura 17: Estruturas químicas dos compostos sintetizados por Teitz et al., 1994.......
58
Figura 18: Estrutura química do composto 3 sintetizado por Finkielsztein, 2008.....
58
Figura 19: Estrutura química dos compostos sintetizados por Khan et al., 2007..........
59
Figura 20: Representação geral dos compostos sintetizados por Guzel et al., 2008
que obtiveram melhor atividade.....................................................................................
60
Figura 21: Estruturas químicas das TSCs com atividade antifúngica segundo
Opletalová et al., 2008....................................................................................................
61
Figura 22: Pró- fármaco sintetizado a partir do 3-AP....................................................
62
Figura 23: Estrutura química dos compostos sintetizados por Dilovic et al., 2008 com
melhores atividades.................................................................................................
62
Figura 24 Estrutura química dos compostos sintetizados por Bhart, 2002....................
63
Figura 25: Estruturas químicas dos compostos sintetizados por Abid e grupo, 2000...
63
Figura 26: Estrutura química do protótipo antimalárico segundo Duan & Zhang,
2010.................................................................................................................................. 64
Figura 27: Mecanismo de inibição da TCC por derivados aril-tiossemicarbazônicos
proposta por Du et al., 2002............................................................................................. 65
Figura 28: Compostos sugeridos como inibidores da TCC segundo Chiyanzu et al.,
2003.................................................................................................................................
65
Figura 29: Estrutura Química dos compostos sintetizados por Aguirre e grupo, 2004.
66
Figura 30: Estrutura química do composto que apresentou melhor atividade
antichagásica segundo Fujii e colaboradores 2005.......................................................... 66
Figura 31: Estrutura química dos compostos sintetizados por Siles e grupo, 2006.......
67
Figura 32: Espectro de RMN 1H do composto 2b..........................................................
80
Figura 33: Espectro de RMN 13C do composto 2b........................................................
81
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
Figura 34: Espectro de RMN 1H do composto 2d.........................................................
82
Figura 35: Espectro de RMN 1H do composto 2g. ........................................................
83
Figura 36: Espectro de RMN 1H do composto 2i. ........................................................
84
Figura 37: Espectro de IV do composto 2b. ..................................................................
85
Figura 38: Espectro de IV do composto 2j. ...................................................................
86
Figura 39: Espectro de RMN 1H do composto 2j. ......................................................... 87
Figura 40: Estrutura química dos derivados nitro-aril tiossemicarbazônicos 92
sintetizados.......................................................................................................................
Figura 41: Mecanismo de ação das tiossemicarbazonas proposto por Du e
colaboradores (2002).......................................................................................................
99
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
LISTA DE ESQUEMAS
Esquema 1: Rota de obtenção de tiossemicarbazonas a partir de tiossemicarbazidas.....
43
Esquema 2: esquema da síntese do 1-ciclohexilideno-N (1,2-dihidro-2-oxo-3H-indol3-ilideno) tiossemicarbazona.............................................................................................
43
Esquema 3: Rota sintética de bis-[N(4)-tiossemicarbazonas] a partir do 1-fenilglioxal.
44
Esquema 4: Reação global da isatina com N-[4-(4‘-clorofenil) tiazol-2-il]
tiossemicarbazida, produzindo tiossemicarbazona............................................................
44
Esquema 5: Rota sintética de tiossemicarbazonas a partir de aldeídos naturais ((3R)(+) citronelal......................................................................................................................
Esquema
6:
Rota
sintética
de
novas
tiossemicarbazonas
a
partir
45
de
ferrocenilchalconas............................................................................................................
45
Esquema 7: Rota de síntese de metil-piruvatos tiossemicarbazonas................................
45
Esquema
8:
Rota
de
síntese
do
composto
pirazinaformamida
N(4)- 46
metiltiossemicarbazona.....................................................................................................
Esquema 9: Rota de síntese do derivado tiossemicarbazônico da 3-(5-nitrofurfuril)
acroleína.............................................................................................................................
46
Esquema 10: Rota de síntese do composto 1,3-difenil-4-(4‘-fluro)benzal-5-pirazolona4-etil tiossemicarbazona (DP4FBP–ETSC)....................................................
47
Esquema 11: Rota de síntese de várias α-silil-substituidas tiossemicarbazonas..............
47
Esquema 12: Rota de síntese de uma série de 1-metil-2,6-diarilpiperidina-4-ona
tiossemicarbazonas............................................................................................................. 48
Esquema 13: Rota de síntese do composto (5-Bromobenzofuran-2-il)(3-metil-3mesitilciclobutil) cetona tiossemicarbazona......................................................................
48
Esquema 14: Rota de síntese de tiossemicarbazonas oriundas de derivados do
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
salicilaldeído......................................................................................................................
49
Esquema 15: Rota de síntese de tiossemicarbazonas a partir de hidrazinas..................... 49
Esquema 16: Rota de síntese de bis-tiossemicarbazonas a partir do 3,5´diacetil-1,2,4triazol.................................................................................................................................
49
Esquema 17: Rota de síntese de tiossemicarbazonas esteroidais.....................................
50
Esquema 18: Rota de síntese uma série de 2-etoxi-3-metoxi-benzaldeído
tiossemicarbazonas............................................................................................................. 50
Esquema 19: Rota de síntese novas 1-indanona-tiossemicarbazonas.
51
Esquema 20: Rota de síntese do (E)-2-(2,4-dihidroxi-benzilideno) tiossemicarbazona,
com rendimento de 87%....................................................................................................
51
Esquema 21: Rota de síntese do (E)-2-[(1H-indol-3-il) metileno] tiossemicarbazona
com rendimento de 67%....................................................................................................
Esquema
22:
Rota
de
síntese
de
51
2,4-diaril-3-azobiciclo[3.3.1]nonano-9-ona
tiossemicarbazonas............................................................................................................. 52
Esquema 23: Rota sintética de complexos Pt/TSC segundo Horton & Varela................. 53
Esquema 24: Rota de síntese de complexos Oxovanádio/TSC........................................
54
Esquema 25: Rota de síntese de complexos de Rênio/TSC.............................................
54
Esquema 26: Rota de síntese de complexos de Pd II segundo Shailendra.......................
55
Esquema 27: Rota de síntese de complexos de Ni II/ TSC..............................................
55
Esquema 28: Rota de síntese de complexos de Pd segundo Kostas................................
56
Esquema 29: Rota de síntese de complexos de Mo/TSC segundo Vrdoljak....................
56
Esquema 30: Rota de Nitração dos Aril-aldeídos em presença de CHCl3.......................
71
Esquema 31: Rota de Nitração dos Aril-aldeídos em presença de H2SO4.......................
71
Esquema 32: Rota de obtenção das Nitro-Aril tiossemicarbazonas.................................
72
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
Esquema 33. Rota geral de síntese da bis-tiossemicarbazona 2g e 2l..............................
73
Esquema 34: Mecanismo de condensação de compostos carbonilados com a
tiossemicarbazida...............................................................................................................
78
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
LISTA DE TABELAS
Tabela 1: Principais efeitos colaterais observados na terapia específica da Doença de
Chagas.............................................................................................................................
39
Tabela 2: Estruturas químicas dos derivados 2a-2l e suas respectivas nomenclaturas..
74
Tabela 3: As principais bandas de absorção dos grupos inerentes as moléculas
sintetizadas......................................................................................................................
79
Tabela 4: Valores das ZMI dos compostos testados, em mm........................................
94
Tabela 5: Valores da Concentração Mínima Inibitória e Concentração Mínima
Bactericida para os compostos 2c e 2h frente às cepas avaliadas em µg/mL………….
96
Tabela 6: Atividade anti-T. cruzi dos derivados nitro-aril tiossemicarbazônicos...........
98
Tabela 7: Citotoxicidade dos derivados nitro-aril tiossemicarbazônicos.......................
103
Tabela 8: Relação IC50 X Citotoxicidade.......................................................................
105
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
LISTA DE ABREVIATURAS E SIGLAS
TSC:
Tiossemicarbazona
Bdz-
Benznidazol
Nfx :
Nifurtimox
TCC-
Cruzáina do T. Cruzi
TR-
Tripanotiona Redutase
DCT-
Doença de Chagas Transfusional
HIV:
Human Imunodeficiency virus (Vírus da Imunodeficiência Humana)
DCA:
Doença de Chagas aguda
IC:
Insuficiência Cardíaca
ACTH:
Hormônio Adrenocorticotrófico
NO2:
Grupo nitro
DNA:
Deoxyribonucleic acid (Ácido desoxiribonucléico)
RMN –
Ressonância Magnética nuclear
CCD:
Cromatografia em camada delgada
EtOH:
Álcool etílico
MeOH:
Metanol
p-TsOH:
Ácido para-tolueno sulfônico
EtOAc:
Acetato de etila
Acac:
Acetil-acetonato
DMSO:
Dimetil sulfóxido
t-BuOK:
Tert-butóxido de Potássio
CMI:
Concentração mínima inibitória
CMB:
Concentração mínima Bacteriostática
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
IV:
Infra-vermelho
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
RESUMO
A doença de Chagas apresenta-se como um dos maiores problemas de Saúde Pública
em países da América Latina, chamados países endêmicos. Estima-se que 18 a 20 milhões de
pessoas estejam infectadas e que outros 100 milhões vivam em áreas de risco de
contaminação. No Brasil, apenas o benznidazol (Bdz) está disponível para o tratamento da
doença, e apesar de seu uso clínico, este fármaco apresenta efeitos colaterais severos, sendo
ativo apenas na fase aguda da doença. Neste contexto, faz-se necessário de novas substâncias
com potencial atividade anti-Tcruzi. Dentre os alvos biológicos considerados como mais
promissores no combate a doença de Chagas, encontram-se enzima Cruzaína ou cruzipaína do
T. cruzi (TCC) e a tripanotiona redutase (TR). As tiossemicarbazonas, grupo de moléculas
com amplo perfil farmacológico, vêm sendo relatadas na literatura como potentes inibidores
da TCC, principalmente as aril-tiossemicarbazonas. Nitrocompostos também tem sido
descritos como potentes inibidores irreversíveis da TR em condições anaeróbicas. Focando-se
nessas características, neste trabalho sintetizamos uma série de onze derivados nitro-aril
tiossemicarbazônicos e avaliamos seu potencial antimicrobiano e anti- T. cruzi, assim como as
suas toxicidades. Estes derivados (2a-2l) foram sintetizados a partir de aril-aldeídos
previamente nitrados e tiossemicarbazida, substituida ou não, em etanol sob temperatura
ambiente, acrescidas de quantidades catalíticas de HCl. A elucidação estrutural foi realizada
através da análise dos dados espectroscópicos de RMN 1H,
13
C e IV. Em referência as
atividades biológicas, os testes antimicrobianos foram realizados in vitro, frente aos da
coleção do Departamento de Antibióticos da UFPE, onde se mediram as ZMI, CMB e CMI. A
atividade anti- T. cruzi foi avaliada com parasitos das cepas Y, frente à forma evolutiva
epimastigota. Para determinar o efeito antiproliferativo para T. cruzi, o ensaio colorimétrico
MTT (metil tiazol tetrazólio) foi empregado, obtendo os valores de IC50 em μg/mL. A
citotóxicidade foi avaliada em células esplênicas de camundongos utilizando-se o método de
incorporação da timidina tritiada, sendo os valores obtidos em μg/mL. Dos onze derivados
sintetizados e avaliados, o 2c, 2h e 2i obtiveram os melhores resultados nos testes
antimicrobianos, com merecido destaque para o 2h. Este também se mostrou ativo nos testes
anti- T. cruzi, sendo mais potente que o Bdz e possuindo a mesma citotoxicidade, sendo
considerado um possível protótipo na terapêutica da Deonça de Chagas.
Palavras-Chave: Tiossemicarbazonas, Doença de Chagas, Atividade antimicrobiana,
Atividade antiT.Cruzi, Nitrocompostos.
Dyego Revorêdo de Carvalho Silva
Síntese e Avaliação das Atividades Antimicrobiana e Anti-T.Cruzi de Derivados Nitro-Ariltiossemicarbazônicos
ABSTRACT
Chagas disease presents itself as a major public health problems in Latin America, called
endemic countries. It is estimated that 18 to 20 million people are infected and another 100
million live in areas at risk of contamination. In Brazil, only benznidazole (Bdz) is available
for the treatment of disease, and although its clinical use, this drug has severe side effects,
being active only during acute illness. In this context, it is necessary to new substances with
potential anti-Tcruzi activity. Among the biological targets deemed most promising in the
fight against Chagas disease, there are cruzain enzyme, cruzipain of T. cruzi (TCC) and
trypanothione reductase (TR). The thiosemicarbazones, group of molecules with broad
pharmacological profile, have been reported in the literature as potent inhibitors of TCC,
especially aryl thiosemicarbazones. Nitrocompounds also has been described as potent
irreversible inhibitors of TR under anaerobic conditions. Focusing on these features, in this
work we synthesized a series of eleven nitro-aryl thiosemicarbazones derivatives and we
evaluated their potential antimicrobial and anti-T cruzi, as well as their toxicities. These
derivatives (2a-2l) were synthesized from aryl aldehydes previously nitrated and
the
Thiosemicarbazones substituted or not, in ethanol at room temperature, together with catalytic
amounts of HCl. Structural elucidation was performed by analysis of spectroscopic data of
1H, 13C and IV. With reference to the biological activities, antimicrobial tests were performed
in vitro, against to the collection of the Antibiotics Department of UFPE, where he measured
the ZMI, CMB and CMI. Anti-T. cruzi activity was performed with parasites from the Y
strains, against to the evolving form called epimastigote. To determine the antiproliferative
effect of T. cruzi, the MTT colorimetric assay (methyl thiazole tetrazolium) was used,
obtaining the IC50 values in μg/mL. Cytotoxicity was evaluated in spleen cells of mice using
the method of incorporation of tritiated thymidine, and the values obtained in μg/mL. Of the
eleven derivatives synthesized and evaluated, 2c, 2h and 2i showed the best results in
antimicrobial testing, with deserved attention for 2h. This last one was also active in testing
anti-T. cruzi, being more potent than the BDZ and having the same cytotoxicity, therefore it
can be considered a possible prototype in the treatment of Chagas Disease.
Keywords: Thiosemicarbazones, Chagas disease, Antimicrobial activity, anti- T.Cruzi
activity, nitrocompounds.
Dyego Revorêdo de Carvalho Silva
23
CAPÍTULO I
INTRODUÇÃO, REVISÃO DA LITERATURA
E OBJETIVOS
Dyego Revorêdo de Carvalho Silva
24
1. INTRODUÇÃO
Todo ano morrem mais de um milhão de pessoas em todo mundo vítimas de doenças
intituladas negligenciadas. As opções de tratamento para estas patologias, quando disponíveis,
são ineficazes e ultrapassadas, causando uma série de efeitos colaterais, além de não
promoverem a cura definitiva. As doenças tropicais são os principais representantes das
doenças negligenciadas, atingindo em sua grande maioria, pessoas muito pobres, distribuídas
pelos países com baixo nível de desenvolvimento sócio-econômico.
Levando-se em consideração que as pessoas afetadas por essas doenças não
representam um mercado lucrativo para atrair investimentos necessários para a pesquisa e o
desenvolvimento de novos medicamentos, essas doenças vêm sendo progressivamente
marginalizadas por decisões dos responsáveis pelos programas de pesquisa, tanto no setor
privado, quanto no setor público. Como podemos observar na Figura 1, entre 1975 e 2004,
apenas 21 medicamentos foram registrados para doenças tropicais e tuberculose, ainda que
estas doenças constituam mais de 11% da carga global de doença. Durante o mesmo período,
1.535 medicamentos foram registrados para outras doenças1.
Figura 1: Número de novos medicamentos desenvolvidos entre os anos de 1975 e 2004.
Por sua grande difusão, pela gravidade das manifestações que pode apresentar
e pela complexidade de sua profilaxia, a doença de Chagas, causada pelo parasito
Trypanosoma cruzi, apresenta-se como uma doença extremamente negligenciada,
representando grave e alarmante problema sanitário2. Mesmo após mais de 100 anos da sua
descoberta pelo pesquisador Carlos Chagas, o tratamento específico anti- T. Cruzi
permanece inapropriado e irresoluto, permitindo apenas efeitos supressivos, podendo diminuir
a parasitemia no curso do tratamento, não garantindo a cura definitiva3.
Dyego Revorêdo de Carvalho Silva
25
O único fármaco atualmente disponível para a quimioterapia antichagásica no Brasil é
o Benznidazol (N-benzil-2-nitroimidazol-1-acetamida, Bdz, Figura 2), agindo através da
redução do seu grupo nitro e formação de ligações covalentes com macromoléculas do T.
cruzi 4. É eficaz na fase aguda da doença, com excelentes taxas de cura na fase inicial da
doença, e na infecção congênita. No entanto, é ineficaz no estágio crônico da doença e está
associada com efeitos colaterais severos, os quais podem resultar na interrupção do
tratamento5.
Até o ano de 2007, somente uma única formulação farmacêutica do Bdz (comprimidos
de liberação imediata na dose de 100 mg) estava disponível no mercado, o que tornava não
indicado o tratamento para crianças (no qual a dose recomendada é de 25 mg por dia) e para
idosos, que em alguns casos tem dificuldade em deglutir, exemplificando mais uma
característica agravante desta monoterapia5.
Tendo em vista todo esse panorama que define a terapêutica da doença de Chagas
como algo ineficaz, ultrapassado e inapropriado, têm-se cada vez mais intensificada a
necessidade de recorrer a novas alternativas terapêuticas para a obtenção de fármacos mais
seguros, ativos e com alvos biológicos mais específicos, principalmente para a fase crônica da
doença.
O
N
N
N
NO2
H
Benznidazol
Figura 2: Estrutura química do Benznidazol.
As tiossemicarbazonas apresentam um amplo perfil farmacológico e constituem uma
classe importante de compostos cujas propriedades têm sido extensivamente estudadas na
Química Medicinal. Para o desenvolvimento de fármacos antichagásicos, as pesquisas estão
sendo focadas para a inibição da enzima Cruzaína ou cruzipaína do T. cruzi (TCC)7 e a
Tripanotiona redutase (TR)8. A porção tiossemicarbazona presente em alguns compostos
descritos na literatura, mostra-se como um grupo farmacofórico que apresentam potencial
atividade inibitória da TCC
9,10
, principalmente aril-tiossemicarbazonas, descritos desde 2002
como potentes agentes tripanocidas e de baixa citotoxicidade11.
Dyego Revorêdo de Carvalho Silva
26
Segundo Du e colaboradores (2002), a interação tiossemicarbazona-TCC, acontece via
ataque covalente do resíduo Cys25 da TCC em direção ao carbono da tiocarbonila e
transferência de um próton do resíduo His159, formando um derivado tetraédrico. Em estudos
de ―docking‖ realizados em 2006 e 2007, Leite e colaboradores, comprovaram a afinidade das
aril-tiossemicarbazonas
com
a
TCC,
revelando
a
capacidade
inibitória
que
as
tiossemicarbazonas possuem.
Tendo em vista todos esses estudos que demonstram e comprovam a atividade das
tiossemicarbazonas, em especial aril-tiossemicarbazonas, como potentes armas na terapêutica
contra o T. cruzi, nesse trabalho decidimos aliar essa notável característica com a conhecida
atividade do grupamento nitro como parasitóforo, presente no Bdz, através do planejamento e
síntese de novos derivados nitro-ariltiossemicarbazônicos, os quais possam apresentar real
atividade contra o T. cruzi, principalmente no estágio crônico da doença.
I- 2. REVISÃO DA LITERATURA
II- 2.1 DOENÇA DE CHAGAS
II- 2.1.1 Generalidades da doença de Chagas
A doença de Chagas constitui-se, pela sua vasta distribuição, altos índices de
prevalência e gravidade de evolução, um dos maiores problemas de Saúde Pública em países
do cone sul das Américas12,13. Estima-se que sejam de 18 a 20 milhões os indivíduos
infectados nessa região e que outros 100 milhões vivam em áreas de risco de contaminação14.
Esta enfermidade foi descoberta e descrita pelo grande cientista Carlos Ribeiro
Justiniano das Chagas em Abril de 1909, sendo seu agente etiológico, o protozoário
Trypanosoma cruzi, por ele assim nomeado em homenagem a Oswaldo Cruz, e o inseto vetor,
um triatomíneo conhecido popularmente como barbeiro (Figura 3) pelo hábito de picar o rosto
de suas vítimas, descobertos previamente no final de 190815.
Dyego Revorêdo de Carvalho Silva
27
Figura 3. Barbeiro (Triatoma infestans): inseto transmissor da doença de Chagas.
O parasita possui um complexo ciclo biológico passando por hospedeiros vertebrados
e invertebrados, e apresenta diferentes formas evolutivas subdivididas em flageladas
(epimastigota e tripomastigota) e aflagelada (amastigota).
A doença é um exemplo típico de uma injúria resultante das alterações produzidas pelo
ser humano ao meio ambiente. O protozoário responsável pela parasitose vivia restrito à
situação silvestre, circulando entre mamíferos do ambiente natural através do inseto vetor ou,
também, por via oral através da ingestão de vetores e mamíferos infectados. O homem se fez
incluir no ciclo epidemiológico da doença, oferecendo ao vetor hemíptero vivendas rurais de
péssima qualidade (Figura 4), as chamadas casas de pau-a-pique16.
Figura 4: Fatores predisponentes para o aparecimento da doença de Chagas
As formas mais importantes de transmissão da doença de Chagas ainda são as
vetoriais, seja via lesão resultante da picada, seja por mucosa ocular ou oral. Contudo,
apresenta também grande importância epidemiológica a transmissão transfusional e a
congênita. Mais recentemente, houve surtos de transmissão por meio da via oral, devido
ingestão de alimentos contaminados.
Dyego Revorêdo de Carvalho Silva
28
Embora considerada eminentemente rural, atualmente a doença de Chagas representa
um problema também para os centros urbanos. Admite-se que dos 3,4 milhões de infectados
existentes no Brasil, 60% estejam vivendo no espaço urbano em grandes centros como
Grande São Paulo (cerca de 300 mil) e Grande Belo Horizonte (cerca de 100 mil). A doença
de Chagas é a terceira mais importante causa mortis entre as doenças infecciosas e parasitárias
(13,6%) e o número absoluto de óbitos ainda é muito relevante, chegando a cerca de 6000 por
ano. Os estados de Minas Gerais, Goiás, São Paulo, Bahia, Paraná, Rio Grande do Sul e os da
região Nordeste apresentam a mais alta endemicidade no Brasil 17,18.
Enquadrando-se no setor das doenças negligenciáveis, a doença de Chagas não
representa um mercado lucrativo para atrair investimentos necessários para a pesquisa e o
desenvolvimento de novos medicamentos, sendo por este motivo, progressivamente
marginalizadas por decisões dos responsáveis pelos programas de pesquisa, tanto no setor
privado, quanto no setor público1.
II- 2.1.2 Epidemiologia
Endêmica em 21 países, a doença de chagas afeta atualmente cerca de 18 a 20 milhões
de pessoas distribuídas pelo México, Américas Central e do Sul. Globalmente é descrita como
a terceira mais importante doença parasitária, sendo responsável por significativos encargos
econômicos e de saúde pública na América Latina19. Estimativas informam que essa
enfermidade mata aproximadamente 14 mil pessoas por ano nessa região, matando mais do
que qualquer outra doença negligenciada, inclusive a malária. Relata-se também que outros
100 milhões de indivíduos vivam em áreas de risco de contaminação14,20.
No final da década de setenta, uma alta incidência de casos da doença de Chagas foi
observado no Brasil, chegando a cerca de 100 mil novos casos por ano. Hoje se estima que
cerca de 3,4 milhões de pessoas estejam infectadas 21,22. Atualmente, casos e surtos podem ser
observados em diferentes estados (Bahia, Ceará, Piauí, Santa Catarina, São Paulo), sendo sua
maior a freqüência na região da Amazônia Legal, que engloba os estados do Amazonas,
Maranhão, Mato Grosso, Amapá, Pará, Tocantins23.
Recentes estudos mostraram um crescimento rápido e notável em países fora da
América Latina, intitulados países não-endêmicos (Austrália, Canadá, Espanha e E.U.A). Isto
se deve ao advento da migração de aproximadamente 15 milhões de pessoas vindas de área
conhecidamente endêmicas 24,25.
Dyego Revorêdo de Carvalho Silva
29
Figura 5: Estimativa da população global afetada pelo Trypanosoma cruzi, 2009.
Estima-se que nos EUA existam 300.167 pessoas infectadas, sendo este valor
aproximadamente seis vezes maior que os casos relatados na Espanha26,27. Na Europa
Ocidental, em 2008 foi relatado que o numero total de pessoas infectadas vivendo nesta região
é de 25 a 40 mil, tendendo a aumentar 28,29,30,31.
III-
2.1.3 Ciclo Biológico
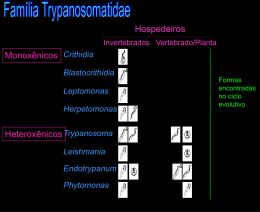
O ciclo biológico do T. cruzi é do tipo heteroxênico, passando o parasito por uma fase
de multiplicação intracelular no hospedeiro vertebrado (homem e mamíferos pertencentes a
sete ordens diferentes) e extracelular no inseto vetor (triatomíneos) 32. Este ciclo compreende
três estágios ou formas principais, dotadas de características morfológicas e biológicas
distintas. As formas evolutivas envolvidas nesse ciclo são a amastigota, tripomastigota e
epimastigota.
Os amastigotas possuem formas arredondadas ou ovóides, imóveis, desprovidas de
flagelo livre. Agrupam-se em "ninhos" na intimidade de tecidos diversos do hospedeiro
vertebrado. Trata-se da forma de multiplicação do parasita no hospedeiro vertebrado e medem
de 1,5 a 4 µm de diâmetro.
Os tripomastigotas apresentam corpo alongado, com cerca de 20 µm de comprimento.
São formas encontradas no sangue dos hospedeiros vertebrados e nas porções terminais do
Dyego Revorêdo de Carvalho Silva
30
intestino dos vetores 33.
A forma epimastigota, apresenta cerca de 20 µm de comprimento e trata-se da forma
multiplicativa do parasita no intestino do triatomíneo, e é também a forma predominante em
cultivo axênico, sendo por isso, mais comumente utilizada em estudos bioquímicos34.
A
B
C
Figura 6: Formas evolutivas do Trypanosoma cruzi – A: Fibras musculares cardíacas infestadas pela forma
amastigota; B: Forma epimastigota e C: Forma tripomastigota
Considerando o mecanismo natural de infecção pelo T. Cruzi, os tripomastigotas
metacíclicos eliminados nas fezes e urina do vetor, durante ou logo após o repasto sanguíneo,
penetram pelo local da picada e interagem com células do sistema mononuclear fagocitário da
pele ou mucosas. O parasita tem acesso facilitado ao interior do organismo pelo toque das
mãos, já que a picada causa irritação local. Se a picada for próxima dos olhos ou da boca, o
parasita pode penetrar diretamente pelas mucosas. Uma vez dentro do organismo, os
tripomastigotas entram em uma variedade de células, dentro das quais se transformam em
amastigotas. Nesse estágio, os parasitas reproduzem-se por fissão binária35,36,37.
A seguir, ocorre a diferenciação dos amastígotas em tripomastigotas, que são liberados
da célula hospedeira caindo no interstício. Estes tripomastigotas caem na corrente circulatória,
atingem células de qualquer tecido ou órgão para cumprir novo ciclo celular. Por vezes, estes
podem ser destruídos por mecanismos imunológicos do hospedeiro ou ainda serem ingeridos
por triatomíneos, onde cumprirão seu ciclo extracelular32.
No estômago do inseto triatomíneo, a forma tripomastigota transforma-se
gradualmente em formas arredondadas, algumas com um longo flagelo colado ao corpo e
outras com um curto flagelo, chamadas de esferomastigotas e epimastigotas, respectivamente.
Em seguida, os parasitas migram para o intestino, onde se multiplicam como formas
epimastigotas, o que pode ser observado cerca de 25 horas após o repasto sanguíneo.
Posteriormente migram para a parte mais posterior, atingindo o reto, e transformam-se em
tripomastigotas metacíclicos, que são eliminados junto com as fezes e urina do triatomíneo
Dyego Revorêdo de Carvalho Silva
31
fechando assim o ciclo evolutivo do T. Cruzi 37. O ciclo evolutivo do T. Cruzi é demonstrado
na Figura 7.
Figura 7: Ciclo biológico da doença de Chagas
I- 2.1.4 Transmissão
A doença de Chagas é transmitida nos países endêmicos principalmente pelo inseto
Triatoma infestans, conhecido popularmente como barbeiro25,38,39. Relatos da literatura têm
informado que a transmissão vetorial foi significativamente reduzida devido aos esforços de
controle, como a Iniciativa do Cone Sul um dos maiores programas de cooperação
internacional contra a doença de Chagas, criada em Brasília em julho de 1991. 40,41.
Em nove de junho de 2006, durante sua primeira reunião anual, a Comissão da
Iniciativa do Cone Sul, declarou formalmente que o Brasil está livre da transmissão da doença
de Chagas pelo Triatoma infestans. O Uruguai foi o primeiro país do Cone Sul a conseguir,
em 1997, a interrupção da transmissão vetorial42. De 100 milhões de pessoas que se estimava
Dyego Revorêdo de Carvalho Silva
32
estarem em risco de contrair a doença nessa região, 60 milhões vivem agora sem esse risco 43.
Levando em consideração este fato, as transfusões de sangue, transplantes de órgãos e as
transmissões congênitas começam a representar riscos reais de transmissão da doença de
Chagas 29.
A Triagem das gestantes para a doença de Chagas durante os cuidados de saúde prénatal, especialmente quando eles nascem em uma área endêmica, tem importante papel para
diminuir a incidência da transmissão de mãe para filho, a chamada transmissão congênita25.
Este tipo de contaminação ocorre quando existem ninhos de amastígotas na placenta, que
podem liberar tripomastigotas, chegando à circulação fetal32.
Na América Latina, a doença de Chagas afeta cerca de dois milhões de mulheres em
idades férteis, que são susceptíveis de transmiti-la para o seu feto44. Estimativas recentes
indicam que na América do Norte, por ano, pelo menos 2.000 recém-nascidos estejam sujeitos
a contraí-la45.
A transmissão transfusional ganhou relativa importância epidemiológica nas duas
últimas décadas, em função da migração de indivíduos infectados para os centros urbanos e da
ineficiência no controle das transfusões, nos bancos de sangue23. A Prevalência de sangue para
doação infectado por T. Cruzi na Europa e América do Norte varia muito, chegando a 0,62%
na Espanha46. Recentemente, E.U.A., Espanha e França implementaram medidas para reduzir
o risco transfusional através da seleção dos doadores de sangue e as estratégias de exclusão
31
.
Comprovada nos anos 50 no Brasil, estima-se que no início da década de 80 cerca de
20 mil novos casos de doença de Chagas transfusional (DCT) eram produzidos anualmente.
Neste mesmo período, a prevalência média de 7,03% em candidatos à doação de sangue, teve
este coeficiente diminuído para 3,18% na década de noventa e atualmente para 0,6% na
hemorrede pública e de 0,7% na rede privada. O risco de transmissão transfusional da
infecção chagásica no Brasil é 10-15 vezes aquela estimada para a infecção pelo HIV, HBV
ou HCV, dependendo da região47.
Ainda a nível de Brasil, uma Nota Técnica do Ministério da Saúde divulgada em 2007
revelou que a transmissão via oral vem mostrando alguma relevância, principalmente devido
ao surto em Santa Catarina no ano de 2005. Nesse episódio foram identificados 45 casos
suspeitos de Doença de Chagas Aguda (DCA) relacionados à ingestão de caldo de cana, 31
com confirmação laboratorial, sendo que cinco pacientes evoluíram para óbito.
Nos anos de 2000, 2001 e 2004, ocorreram 57 casos de doença de DCA por
Dyego Revorêdo de Carvalho Silva
33
transmissão oral; no período de 2005 a 2007, esses números somaram 301 casos. No ano de
2006 houve a confirmação de 115 casos de DCA, na região Norte e Nordeste, sendo 94 casos
de transmissão via oral, devido ao consumo na maioria dos casos de açaí contaminado.
Registrou-se também neste período surto pela ingestão de bacaba e de cana-de-açúcar 48. Em
2008, foram diagnosticados 94 casos de DCA no estado do Pará, dos quais 57 (65%) estavam
envolvidos em transmissão oral; 20, no estado do Amapá, todos por provável transmissão oral
e 7 no estado do Tocantins, 4 por transmissão oral (80%) e 1 vetorial23.
I- 2.1.5. Manifestações clínicas
A infecção chagásica humana pode se manifestar na forma aguda (sintomática ou
assintomática), na forma crônica e indeterminada. Na maioria dos casos, a fase aguda da
doença é oligossintomática, principalmente em adultos, não sendo valorizada pelo paciente ou
pelo agente de saúde. Esta tem seu início evidenciado através das manifestações locais
geradas quando o T. cruzi penetra na conjuntiva ou na pele, denominadas de sinal de Romaña
e chagoma de inoculação, respectivamente (Figura 8). Estas lesões aparecem em 50% dos
casos agudos dentro de 7-10 dias após a picada do barbeiro, regredindo em um ou dois
meses3.
A
B
Figura 8: A: Sinal de Romaña; B: chagoma de inoculação
As manifestações gerais são representadas por febre, mal-estar geral, dor de cabeça,
perda do apetite, fraqueza, edema localizado ou generalizado, inchaço de gânglios linfáticos
(adenopatia), hepato-esplenomegalia. Em alguns pacientes, principalmente crianças ou
indivíduos imunodeficientes, quadros meníngeos graves, alterações no eletrocardiograma e de
Insuficiencia Cardíaca podem estar associados, chegando a óbito. É importante ressaltar que a
gravidade da infecção depende também de outros fatores, como a virulência do parasito e o
tamanho do inóculo 49,50,51. A fase aguda da doença pode durar de um mês a um ano, podendo
Dyego Revorêdo de Carvalho Silva
34
o paciente evoluir para a fase crônica ou indeterminada.
Após a fase aguda, os sobreviventes passam por um longo período assintomático,
cerca de 10 a 30 anos, sendo esta fase chamada de indeterminada. Caracteriza-se por
apresentar positividade de exames sorológicos e/ou parasitológicos, ausência de sintomas e/ou
sinais da doença, eletrocardiograma convencional normal e coração, esôfago e cólon
radiologicamente normais. Aproximadamente 50% dos pacientes chagásicos que tiveram a
fase aguda evoluem para a fase indeterminada, que, apesar de assintomática e de apresentarem
lesões muito discretas, pode causar morte súbita de alguns pacientes mais debilitados32.
Cerca de um terço dos casos agudos da doença de Chagas alcança para a fase crônica.
Esta, em alguns casos, segue imediatamente o período agudo. Em outros, instala-se depois da
fase indeterminada, anteriormente descrita12,52. Pacientes nessa fase da doença apresentam
manifestações clínicas diversas, afetando de forma irreversível um ou mais órgãos. A
cardiopatia chagásica crônica e o aparecimento dos megas (megaesôfago e megacólon,
principalmente) representam as formas clínicas de maior gravidade 53,54,55.
Na forma cardíaca, o coração mostra-se macroscopicamente aumentado de volume e
mais pesado do que o normal, com peso de 550 g em média e hipertrofia das paredes (Figura
9). Dentre os seus principais sintomas enquadram-se arritmias (75.000 casos/ano),
insuficiência cardíaca, trombo-embolismo, insônia, congestão visceral e edema dos membros
inferiores 32.
As manifestações digestivas são representadas principalmente no Brasil e na Argentina
pelos megas, onde aparecem alterações morfológicas e funcionais importantes, como, por
exemplo, a incoordenação motora (aperistalse, discinesia) caracterizando o megaesôfago e o
megacólon.
Figura 9: Coração de pacientes que desenvolveram doença de Chagas e morreram por: (A) morte súbita, (B)
megacólon ou mega-esôfago e (C) insuficiência cardíaca congestiva
Dyego Revorêdo de Carvalho Silva
35
No caso do megaesôfago (45.000 casos/ano), observa-se o aumento do diâmetro do
órgão e alterações na motilidade, além de sintomas como dores epigástricas, regurgitação,
hipertrofia das glândulas salivares, disfagia, pirose, soluço, tosse e sialose. Acomete mais o
sexo masculino do que o feminino, sendo mais freqüente na zona rural endêmica. O
megacólon (30.000 casos/ano) apresenta como principal característica a obstipação do órgão,
podendo durar semanas, e a perfuração levando por vezes à peritonite 32,54, 56.
I- 2.1.6. Tratamento e novos alvos terapêuticos
A doença de Chagas, por sua grande difusão, gravidade das manifestações que pode
apresentar e pela complexidade de sua profilaxia, representa grave e alarmante problema
sanitário2. Mesmo após mais de 100 anos da sua descoberta, o tratamento específico anti- T.
Cruzi permanece inapropriado e irresoluto, permitindo efeitos supressivos, podendo apenas
diminuir a parasitemia no curso do tratamento, não garantindo, portanto, a cura definitiva3.
Os primeiros compostos desenvolvidos experimentalmente para o tratamento
específico da tripanossomíase americana, após a sua descoberta em 1909, foram o atoxyl
(arsênico), a tintura de fucsina, o tártaro emético (antimonial pentavalente) e o cloreto de
mercúrio. Todos estes compostos se mostraram ineficazes no tratamento proposto, além de
exibirem uma alta toxicidade 5,57.
Entre os anos de 1936 e 1960 diversos medicamentos foram testados na tentativa de
obter-se êxito, porém estes apenas obtiveram resultados negativos ou duvidosos. Dentre os
testados destacam-se os derivados de quinoleínas e vários outros antimaláricos, arsenobenzóis
e outros arsemicais, fenantridinas, sais de ouro, bismuto, cobre e de zinco, iodeto de sódio,
violeta de genciana, aminopterinas, ácido para-aminosalicílico, hidrazida do ácido nicotínico,
sulfonamidas, anti-histamínicos, ACTH e cortisona, derivados da estilomicilina, anfotericina
B e mais de 30 antibióticos, e alguns nitrofuranos58.
Maior atenção foi dada aos nitrocompostos a partir da década de 40 com sua
introdução e emprego em terapêutica, período em que milhares de compostos desta classe
foram sintetizados e testados frente a diversas doenças, dentre estas a doença de Chagas
59
.
Estes pareciam ter atividade biológica dependente da presença do grupo nitro ligado à
molécula, que resultava basicamente, em mudanças na estabilidade do mesmo, intermediada
por interações entre o nitrocomposto e o seu alvo na biofase. Dentre estes nitrocompostos,
Dyego Revorêdo de Carvalho Silva
36
destacam-se os derivados nitrotiofênicos, nitrofurânicos, nitrobenzênicos e nitroimidazólicos
(Figura 10).
Derivados
Nitrofurânicos
Derivados
Nitrotiofênicos
Derivados
Nitroimidazólicos
Derivados
Nitrobenzênicos
Figura 10: Subestruturas químicas fundamentais de nitrocompostos empregados em terapêutica.
A década de 60 trouxe diversos avanços na terapia da doença de chagas, com
mudanças benéficas a nível de direcionamento para o desenvolvimento de novos fármacos
eficazes no tratamento anti-chagásico. O primeiro passo foi dado a partir da utilização de um
derivado dos nitrofuranos, a Nitrofurazona (5-nitro-2-furaldeído-semicarbazona), em esquema
de duração prolongada (53 dias em média) na dose de 100mg/kg/dia, que curava mais de 95%
dos camundongos cronicamente infectados. Entretanto, a conclusão final foi de que a
Nitrofurazoma poderia ser curativa, mas os pacientes não toleravam os efeitos colaterais nas
doses e no tempo necessário para a cura, devido a sua alta toxicidade60.
Figura 11: Estrutura molecular da nitrofurazona
No final da década de 1960 e início de 1970 dois novos nitrocompostos, os quais são
utilizados até hoje, surgiram trazendo melhores perspectivas para o tratamento da doença de
Chagas, tanto pelo potencial curativo, particularmente para a fase aguda, como também por
Dyego Revorêdo de Carvalho Silva
37
exibirem uma melhor tolerância quando comparados aos anteriores. Essas duas drogas são o
nifurtimox
(Nfx),
um
derivado
nitrofurânico:
3-metil-4-(5´-nitrofurfurilidenoamino)
tetrahidro-4H-1, 4-tiazina-1,1-dióxido (Bayer 2502) comercializado como nome de Lampit; e
o benznidazol (Bdz), um derivado 2-nitroimidazólico: N-benzyl-2-nitroimidazol acetamida
(RO 7-1051), comercializado com o nome de Rochagan® no Brasil e Radanil® na Argentina.
O
N
N
NO2
N
NO2
O
N
N
SO2
H
Bdz
Nfx
Figura 12: Fármacos utilizados na terapia antichagásica.
A ação destes fármacos é afetada diretamente por algumas condições, como a duração
do tratamento, a idade e a distribuição geográfica dos pacientes, entre outros. O grupamento
nitro (NO2), considerado como parasitóforo, presente em ambas as moléculas está diretamente
relacionado nos seus mecanismos de ação, também contribuindo para a elevada toxicidade
apresentada por estas14.
O nifurtimox é tripanossomicida contra as formas amastigotas do T. cruzi. Seu
mecanismo de ação envolve a redução parcial ao ânion radical seguida por auto-oxidação para
regenerar o nitrofurano original e formar o radical ânion superóxido e outras espécies reativas
de oxigênio, como o peróxido de hidrogênio e radical hidroxila. O T. cruzi mostra-se
deficiente em mecanismos de detoxificação para metabólitos do oxigênio, particularmente o
peróxido de hidrogênio, apresentando assim, mais sensível ao estresse oxidativo do que às
células vertebradas 61.
A ação do benznidazol não envolve danos oxidativos, e seu mecanismo de ação parece
envolver uma diminuição da síntese de proteínas, redução de incorporação dos precursores de
RNA e diminuição da incorporação da timidina em DNA62,63. O radical nitro estaria envolvido
com seu efeito tripanocida através da formação de ligações covalentes com macromoléculas
do T. cruzi 4.
A duração media do tratamento é de cerca de sessenta dias, mas quando a doença
crônica é reativada como em pacientes imunocomprometidos, este pode durar cinco meses ou
Dyego Revorêdo de Carvalho Silva
38
mais. Apenas em tratamentos de pacientes contaminados acidentalmente, como por exemplo,
em um laboratório, a duração da profilaxia é aproximadamente dez dias64.
Segundo requerimentos de 1997 da Organização Mundial de Saúde, uma droga para
ser considerada ideal no tratamento da doença de Chagas deve possuir algumas características
peculiares, que são as seguintes:
1- Cura parasitológica na fase aguda e crônica da doença;
2- Ser efetiva em uma ou poucas doses;
3- Ser de baixo custo para o paciente;
4- Não possuir efeitos colaterais nem teratogênicos
5- Não requerer internação para o tratamento e;
6- Não induzir resistência.
Por não cumprir vários desses pré-requisitos, principalmente as abordadas nos
números 1-4, o Nifurtimox (Lampit®) e o Benznidazol (Rochagan®) mesmo sendo
apresentadas como drogas promissoras, não podem ser consideradas drogas ideais para a
terapia anti- T. cruzi. Ambas não possuem eficácia considerável na fase crônica da doença e
os efeitos colaterais apresentados são o seu inconveniente principal 53,65. Devido a este último
fator, desde a década de 1980 apenas o Benznidazol permanece disponível em território
nacional. A tabela abaixo mostra os principais efeitos colaterais apresentados por ambas,
representando as intensidades por cruzes.
Dyego Revorêdo de Carvalho Silva
39
Tabela 1: Principais efeitos colaterais observados na terapia específica da Doença de Chagas.
Sintoma/sinal
Anorexia
Cefaléia
Dermatopatia
Excitação psíquica
Gastralgia
Insônia
Náusea
Perda de peso
Polineuropatia
Vômito
Bdz
++
+
+++
+
+
++
+
+
++
Nfx
+++
++
+
+++
+++
++
+++
+++
++
++
Tendo em vista todo esse panorama que define a terapêutica da doença de Chagas
como algo ineficaz, ultrapassado e inapropriado, têm-se cada vez mais intensificada a
necessidade de recorrer a novas alternativas terapêuticas para a obtenção de fármacos mais
seguros, ativos e com alvos biológicos mais específicos, principalmente para a fase crônica da
doença. O desenvolvimento deste tipo de fármacos requer um melhor conhecimento do ciclo
de vida e do metabolismo do T. cruzi.
Vários alvos biológicos têm sido apontados como alvos terapêuticos potenciais para a
doença de Chagas, dentre eles destacam-se: enzima tripanotiona redutase, biossíntese de RNA
mensageiro, biossíntese de esteróis, transialidase, cruzaína do T. cruzi, possibilitando assim
um desenvolvimento racional de fármacos menos tóxicos e mais potentes contra o parasito42.
A TR é uma flavoenzima NADPH-dependente e tem sido considerada uma enzima
chave no metabolismo oxidativo do parasito. Ocorre exclusivamente em tripanosomatídeos,
sendo indicada por este motivo como um dos mais promissores alvos na busca por drogas
tripanomicidas10.
Derivados
nitrofurânicos,
como
a
hidroximetilnitrofurazona,
têm
demonstrado produzirem, in vitro, inativação irreversível desta enzima em condições
anaeróbicas 66.
O T. cruzi requer esteróis específicos para a proliferação e a viabilidade de células em
todos os estágios de seu ciclo, sendo este parasito extremamente susceptível a inibidores da
biossíntese de esteróis. O principal esterol para o crescimento do T. cruzi é o ergosterol, o que
torna, portanto, a via de biossíntese desse lipídeo um alvo atrativo para o desenvolvimento de
Dyego Revorêdo de Carvalho Silva
40
fármacos
67
. Atualmente, as enzimas mais bem estudadas desta cascata metabólica são a
esterol 14-demetilase, lanoesterol sintase, esqualeno epoxidase, esqualeno sintase, D-24(25)
esterol metiltransferase, farnesilpirofosfato sintase e a farnesiltransferase14.
A TCC é a principal cisteína protease do T. cruzi sendo liberada em todos os estágios
do ciclo de vida do parasita, porém entregue em diferentes compartimentos celulares em cada
estágio. É a enzima crucial para a atividade proteolítica do T. Cruzi e essencial para a
replicação intracelular do parasita, sendo um alvo em potencial para o desenvolvimento de
novas drogas tripanomicidas 68. Recentemente tem sido demonstrado que a infecção por este
parasito pode ser curada em células de ratos e modelos de cães pelo tratamento com inibição
irreversível da cruzaína69. Diversos trabalhos têm descrito a atividade inibitória provocada por
diversos grupos de compostos, como por exemplo, N-acilhidrazidas, uréias, tiouréias e
tiossemicarbazonas68.
As tiossemicarbazonas (Figura 13) apresentam um amplo perfil farmacológico e
constituem uma classe importante de compostos cujas propriedades têm sido extensivamente
estudadas na Química Medicinal. Dentre estas atividades, destacam-se a antitumoral,
antibacteriana, antiviral, antiprotozoária e citotóxica70.
Figura 13: Estrutura química das tiossemicarbazonas
Engajando-se nesta característica de alta versatilidade farmacológica desta classe de
compostos, vários pesquisadores têm direcionado seus estudos na síntese de novas
tiossemicarbazonas com a intenção de obter moléculas que sirvam como protótipos para o
desenvolvimento de novos fármacos antichagásicos. Desde 2002 as aril-tiossemicarbazonas
estão sendo descritas como potentes agentes tripanocidas e de baixa citotoxicidade 11.
Dyego Revorêdo de Carvalho Silva
41
I- 2.2. QUÍMICA DAS TIOSSEMICARBAZONAS
I- 2.2.1 Tiossemicarbazonas- Aspectos Químicos
As tiossemicarbazonas são compostos amplamente explorados na síntese orgânica,
podendo ainda adquiri-las comercialmente com preços bastante acessíveis. Apresentam-se
como sistemas com extrema deslocalização eletrônica, principalmente quando há grupos
aromáticos ligados ao carbono da imina; aproximadamente planar, com o átomo de enxofre
em posição anti em relação ao átomo de nitrogênio da função imina (Figura 14). Fatores
eletrônicos e estéricos contribuem para este arranjo estrutural, porém, possivelmente o fator
mais importante é que o átomo de enxofre em posição anti possibilita a ocorrência de ligação
de hidrogênio intramolecular entre o nitrogênio da imina e os hidrogênios da tioamida, isso
para as tiossemicarbazonas não substituídas em N-4. Levando em consideração as
substituídas, a conformação sin é a preferida pela molécula. 70
H
S
N
R2
N
R1
N
H
Anti
H
H
NR3R4
Sin
N
R1
N
S
R2
Figura 14: Representação das conformações das tiossemicarbazonas.
Devido à presença da ligação dupla na tiossemicarbazonas, podem ser encontrados
diasteisômeros conformacionais (Z e E). Mesmo a configuração E sendo teoricamente a mais
favorável, estudos têm evidenciado a mudança de configuração de aril-tiossemicarazonas
quando complexadas com metais de transição, tornando difícil a determinação
configuracional absoluta.
Dyego Revorêdo de Carvalho Silva
42
R≠H
Isômero Z
Isômero E
Figura 15: Representação dos estereoisômeros E e Z das Tiossemicarbazonas
Um complicador para a correta elucidação configuracional destes compostos é a difícil
atribuição da configuração por técnicas de RMN, talvez por causa da flexibilidade da ligação
iminíca e os efeitos paramagnéticos do nitrogênio, ou até mesmo devido ao efeito ‗guardachuva‘ que pode ocorrer com os pares de elétrons livres do nitrogênio 71.
Do ponto de vista sintético apresentam como característica principal, sua versatilidade
de obtenção, assim como sua aplicação como intermediários de muitos núcleos importantes.
Em geral, apresentam baixo custo de síntese, além de grande economia de átomos, uma vez
que, com exceção da água que é liberada em sua síntese, todos os outros átomos dos reagentes
estarão presentes na molécula final 9.
I- 2.2.2 Síntese de tiossemicarbazonas
Uma das formas mais simples de obtenção das tiossemicarbazonas se dá pela reação
de condensação equimolar de um derivado carbonilado (aldeído ou cetona), com
tiossemicarbazidas em meio alcoólico sob refluxo, e com quantidades catalíticas de ácido
(Esquema 1). Esta reação é muito utilizada pelo fato de possuir alta quimiosseletividade e
rapidez apresentando geralmente altos rendimentos
72,73
. As tiossemicarbazonas são
geralmente obtidas como misturas de isômeros E e Z, no estado sólido, havendo, em solução,
isomerização da configuração Z para E, devido a uma maior estabilidade termodinâmica.
Dyego Revorêdo de Carvalho Silva
43
H+
Ts = Tiossemiarbazida;
R = H ou metil;
R1 e R2 = H, Aril ou Alquil
Isômero Z
Isômero E
Esquema 1: Rota de obtenção de tiossemicarbazonas a partir de tiossemicarbazidas.
No ano de 1997, Gupta e Narayana, sintetizaram um derivado tiossemicarbazônico,
partindo-se de outra tiossemicarbazona previamente sintetizada segundo metodologia acima
descrita. Nesta nova metodologia, a 1-ciclohexilideno tiossemicarbazona, dissolvido em
álcool (100mL), foi misturado a uma solução
de indol 2,3- diona em água (150mL),
produzindo o 1-ciclohexilideno-N (1,2-dihidro-2-oxo-3H-indol-3-ilideno) tiossemicarbazona.
A mistura foi refluxada em banho de água por 10 minutos, mostrando alto rendimento
(88%)74.
Esquema
2:
esquema
da
síntese
do
1-ciclohexilideno-N
(1,2-dihidro-2-oxo-3H-indol-3-ilideno)
tiossemicarbazona.
Mais tarde, em 1999, Castiñeiras e seu grupo de pesquisa publicaram em um de seus
trabalhos o método de obtenção de duas bis-[N(4)-tiossemicarbazonas]. Estas foram
Dyego Revorêdo de Carvalho Silva
44
preparadas a partir da reação, na proporção 2:1, do 1-fenilglioxal com uma dada
tiossemicarbazida em solução de etanol e gotas de ácido sulfúrico 72.
Esquema 3: Rota sintética de bis-[N(4)-tiossemicarbazonas] a partir do 1-fenilglioxal.
Neste
mesmo
ano,
Pandeya
e
colaboradores
mostraram
a
síntese
de
tiossemicarbazonas através da reação equimolar de isatina (indol 2,3 diona) com N-[4-(4‘clorofenil) tiazol-2-il] tiossemicarbazida. Ambos foram dissolvidos em etanol morno
contendo 1mL de ácido acético glacial. A mistura ficou sob refluxo por 15 horas e o sólido
resultante foi recristalizado uma mistura de etanol e clorofórmio, alcançando rendimento
excelente de 94,6%73.
Esquema 4: Reação global da isatina com N-[4-(4‘-clorofenil) tiazol-2-il] tiossemicarbazida, produzindo
tiossemicarbazona.
Já no ano de 2000, Tarasconi e seu grupo realizaram a síntese de tiossemicarbazonas
através de uma reação de condensação de aldeídos naturais com a tiossemicarbazida, ambas
em solução alcoólica a 95% (10mL), sob irradiação ultrassônica(40°) durante 1 hora. Este
método visava aumentar a solubilidade dos reagentes e conseqüentemente o rendimento,
chegando em alguns casos a 95% 75.
Dyego Revorêdo de Carvalho Silva
45
Esquema 5: Rota sintética de tiossemicarbazonas a partir de aldeídos naturais ((3R)- (+) citronelal.
No ano de 2001, Klimova e seu grupo de pesquisa demonstraram a síntese de uma
série de acetilferroceno- tiossemicarbazonas através da mistura de ferrocenilchalconas (Fcchalconas) com tiossemicarbazida. A reação se processa com excesso de t-BuOK em
isopropanol anidro(150mL) sob agitação e refluxo, durante cerca de 3-5 horas76.
Esquema 6: Rota sintética de novas tiossemicarbazonas a partir de ferrocenilchalconas.
Novas metil-piruvato TSCs foram descritas por Ferrari et al., 2001. Nessa metodologia
fez-se reagir uma mistura de metil-piruvato e tiossemicarbazidas substituídas em etanol sob
refluxo e borbulhamento de gás nitrogênio por 2 horas, obtendo rendimentos que variam de
58 a 76% 77.
Esquema 7: Rota de síntese de metil-piruvatos tiossemicarbazonas.
Em
2002,
Labisbal
e
colaboradores,
realizaram
a
síntese
do
composto
pirazinaformamida N(4)-metiltiossemicarbazona, que serviria de produto de partida para a
Dyego Revorêdo de Carvalho Silva
46
formação de complexos metálicos. Nesse trabalho, uma solução metanólica de cianopirazina
foi deixada sob agitação por meia hora. Nesse tempo, foi então adicionado lentamente a N(4)metiltiossemicarbazida em quantidades equimolares. Em seguida, mais 25 mL de metanol
foram acrescidos a mistura, deixando-se refluxar por no mínimo 4 horas. Não foi mostrado o
rendimento reacional 78.
Esquema 8: Rota de síntese do composto pirazinaformamida N(4)-metiltiossemicarbazona.
Aguirre et al., 2004 sintetizou tiossemicarbazonas oriundas de derivados do 5nitrofuril. O 5-nitrofurfural ou 3-(5-nitrofurfuril) acroleina foram postas para reagir com
derivados da tiossemicarbazida. A reação se procedeu a temperatura ambiente em tolueno
seco, com alíquotas catalíticas de acido p-tolueno sulfônico (p-TsOH) (AGUIRRE et al.,
2004)10.
Esquema 9: Rota de síntese do derivado tiossemicarbazônico da 3-(5-nitrofurfuril) acroleína.
Mais adiante, no ano de 2005, H. Chai e colaboradores descreveram a rota de síntese
do derivado 1,3-difenil-4-(4‘-fluro)benzal-5-pirazolona-4-etil-TSC (DP4FBP–ETSC). Este foi
obtido através da mistura de 1,3-difenil-4-(4‘-fluro)benzal-5-pirazolona com N(4)- etil
tiossemicarbazida, em etanol (40mL) e ácido acético glacial (2mL), em refluxo por 6 horas
sob agitação magnética. O rendimento da reação foi de 71%79.
Dyego Revorêdo de Carvalho Silva
47
Esquema 10: Rota de síntese do composto 1,3-difenil-4-(4‘-fluro)benzal-5-pirazolona-4-etil tiossemicarbazona
(DP4FBP–ETSC).
Também em 2005, Bolm demosntrou a síntese de várias de α-silil-substituidas
tiossemicarbazonas
para
posterior
ciclização.
Nessa
metodologia,
reagiu-se
um
correspondente α-silil-ceto éster (10mmol) em solução de 100mL acetato de etila (EtOAc),
com a tiossemicarbazida (20mmol). A suspensão foi agitada durante 1 hora a 50º C e filtrado
após duas. Obteve rendimento de 84 %80.
Esquema 11: Rota de síntese de várias α-silil-substituidas tiossemicarbazonas.
Utilizando como produtos de partida derivados do 1-metil-2,6-diarilpiperidina-4-ona
(0.01 mol) e a própria tiossemicarbazida (0.01 mol) em metanol (45 ml), Balasubramanian et
al., 2005 sintetizou uma série de 1-metil-2,6-diarilpiperidina-4-ona TSCs. Após adição de
quantidades catalíticas de um acido de força média e refluxo de 3 horas, obteve-se o produto
desejado81.
Dyego Revorêdo de Carvalho Silva
48
Esquema 12: Rota de síntese de uma série de 1-metil-2,6-diarilpiperidina-4-ona tiossemicarbazonas.
Karatas et al., 2006 obteve o composto (5-Bromobenzofuran-2-il)(3-metil-3mesitilciclobutil) cetona-TSC fazendo-se reagir a tiossemicarbazida (10mmol) com (5Bromobenzofuran-2-il)(3-metil-3-mesitilciclobutil) metanona (10mmol) em etanol seco
(80mL) e ácido p-tolueno sulfônico (0,01g), sob refluxo por um período de 8 horas. Obteve
rendimento de 85%, mesmo com a carbonila sofrendo um grande impedimento estérico82.
Esquema 13: Rota de síntese do composto (5-Bromobenzofuran-2-il)(3-metil-3-mesitilciclobutil) cetona
tiossemicarbazona.
Cukurovali em 2006 preparou uma série de tiossemicarbazonas derivadas do
salicilaldeído. A uma solução de tiossemicarbazida e ácido p-tolueno sulfônico metanol
(50mL), foi adicionada lentamente uma solução de um apropriado salicilaldeído em 20 ml de
etanol absoluto. Manteve-se a mistura em agitação magnética contínua e aquecimento de 6070ºC 83.
Dyego Revorêdo de Carvalho Silva
49
Esquema 14: Rota de síntese de tiossemicarbazonas oriundas de derivados do salicilaldeído.
No ano seguinte, Bondock demonstrou a síntese de TSC em duas etapas, sem a
utilização da tiossemicarbazida. Na primeira etapa, fez-se reagir 1-cloro-3,4-dihidronaftaleno2-carboxaldeído com hidrato de hidrazina, originando o composto 1-((4-cloro-1,2dihidronaftaleno-3-il)metileno) hidrazina, uma base de Schiff. Em seguida, essa base de
Schiff foi posta para reagir com uma solução de fenil- isotiocianato em dioxano fervente,
chegando enfim a respectiva tiossemicarbazona. A mistura ficou sob refluxo e agitação por 1
hora, obtendo rendimento de 77%84. Esta metodologia, além de apresentar bom rendimento,
mostra-se basante versátil quimicamente, visto que torna possível sintetizar inúmeras
tiossemicarbazonas, partindo-se de isotiocianatos e hidrazinas com diferentes substituintes.
Esquema 15: Rota de síntese de tiossemicarbazonas a partir de hidrazinas
Matesanz e grupo, 2007, realizaram a síntese de bis-tiossemicarbazonas através da
reação do 3,5´diacetil-1,2,4-triazol (1,6mmol), previamente sintetizado, com a 4-etiltiossemicarbazida (3,2mmol), ambas em solução metanólica. A mistura ficou em refluxo por
no mínimo 6 horas 85.
Esquema 16: Rota de síntese de bis-tiossemicarbazonas a partir do 3,5´diacetil-1,2,4-triazol.
Dyego Revorêdo de Carvalho Silva
50
Mais a frente, no ano de 2008, Khan mostrou a síntese de uma série de
tiossemicarbazonas esteroidais. Estas foram obtidas a partir da reação uma solução etanólica
de ciclopentil, ciclohexil e ciclooctil tiossemicarbazidas, na presença de algumas gotas de
HCl, com uma solução também alcoólica de cetonas esteroidais. A mistura ficou em
aquecimento (60ºC) e agitação magnética por 5 horas, obtendo altos rendimentos86.
Esquema 17: Rota de síntese de tiossemicarbazonas esteroidais.
Núñez-Montenegro et al., 2008 demonstrou a síntese de uma série de 2-etoxi-3metoxi-benzaldeído TSC fazendo-se reagir uma solução aquosa(15mL) de tiossemicarbazidas
N(4)-substituidas com uma solução metanólica (15mL), acrescentando ainda algumas gotas
de ácido sulfúrico concentrado. Para evitar a precipitação do aldeído, mais metanol foi
adicionado. A reação ficou em refluxo e agitação por 2 horas87.
Esquema 18: Rota de síntese uma série de 2-etoxi-3-metoxi-benzaldeído tiossemicarbazonas.
Partindo de derivados da 1-indanona, Finkielsztein e grupo, 2008, sintetizaram novas
1-indanona-tiossemicarbazonas. Nessa metodologia, uma suspensão em etanol de
tiossemicarbazida (2,7mmol) e dos derivados cetônicos (1,2mmol) ficou sob agitação e
refluxo durante 30 minutos. Em seguida adicionou-se 0,1 ml de ácido sulfúrico, mantendo-se
a agitação até o término da reação. Ao término, obteve-se rendimento médio de 65,5%88.
Dyego Revorêdo de Carvalho Silva
51
Esquema 19: Rota de síntese novas 1-indanona-tiossemicarbazonas.
No ano seguinte, Yildiz e grupo demonstraram a síntese de duas tiossemicarbazonas, a
(E)-2-(2,4-dihidroxi-benzilideno) tiossemicarbazona (Esquema 20) e (E)-2-[(1H-indol-3-il)
metileno] TSC (Esquema 21), utlizando uma metodologia simples e diferente. Nesse método,
a tiossemicarbazida foi adicionada a uma solução em THF (100mL) do respectivo aldeído,
ficando sob agitação e aquecimento por 2 horas. Não houve a necessidade de adição do ácido
como catalisador. Houve uma pequena queda do rendimento da primeira para a segunda
reação, tendo como possível causa a solubilidade do produto de partida89, limitando sua
utilização apenas para síntese de tiossemicarbazonas oriundas de aldeídos poucos polares.
Esquema 20: Rota de síntese do (E)-2-(2,4-dihidroxi-benzilideno) tiossemicarbazona, com rendimento de 87%.
Esquema 21: Rota de síntese do (E)-2-[(1H-indol-3-il) metileno] tiossemicarbazona com rendimento de 67%.
Em 2010, Ramachandran e equipe obtiveram uma série de 2,4-diaril-3-
Dyego Revorêdo de Carvalho Silva
52
azobiciclo[3.3.1]nonano-9-ona
TSCs
fazendo-se
reagir
a
2,4-diaril-3-azobiciclo
[3.3.1]nonano-9-ona em solução clorofórmio-etanólica (45mL) fervente com uma mesma
solução de cloridrato de tiossemicarbazida (0,01mol), a frio adicionada gota a gota, por 3
horas sob refluxo em banho de água90.
Esquema 22: Rota de síntese de 2,4-diaril-3-azobiciclo[3.3.1]nonano-9-ona tiossemicarbazonas.
I- 2.2.3 Tiossemicarbazonas e seus metais complexos
As tiossemicarbazonas possuem uma capacidade intrínseca de formar complexos com
metais de transição, seja na sua forma tiona ou na forma tiol (Figura 16), formas essas
coexistentes em equilíbrio tautomérico, oriundas da intensa deslocalização de elétrons nessas
moléculas. A forma tiona atua como ligante neutro bidentado, enquanto a forma tiol se
desprotona e atua como ligante aniônico91. Esta capacidade de formar ligação coordenada
com metais é aumentada se houver grupos doadores de elétrons ligados ao carbono da função
azometina92.
Tiona
Tiol
Figura 16: Representação das duas formas tautomérias das TSCs.
No âmbito da química medicinal, salvo poucas exceções, vantagens podem ser
observadas quando da utilização de moléculas bioativas complexadas com íons metálicos.
Dentre estas, o incremento da atividade biológica, quando comparado somente ao ligante; a
Dyego Revorêdo de Carvalho Silva
53
habilidade de mimetizar substratos endógenos; e a modificação do perfil farmacodinâmico e
farmacocinético são alguns que merecem destaques.
Em 2000, Horton & Varela demonstraram a formação de complexos metálicos com a
3-deox-D-eritro-hexos-2-ulose
bis-tiossemicarbazona.
Essas
bis-tiossemicarbazonas
demonstram particular interesse pelo fato de possibilitarem a formação de complexos
altamente estáveis. Utilizou-se para a reação os metais Pd, Cu II, Pt II, sendo este último o de
maior interesse. Para sua síntese, misturou-se K2PtCl4 (1 mmol) dissolvido em água quente
com uma solução hidroalcoólica (40 mL, 1:1) fervente da bis-tiossemicarbazona (1 mmol). A
solução verde resultante foi fervida por 5 minutos, ficando em seguida por 20 horas em
temperatura ambiente, alcançando rendimento de mais de 80%93.
Esquema 23: Rota sintética de complexos Pt/TSC segundo Horton & Varela.
Mais adiante, no ano de 2001, Gangadharmath e grupo, mostrou a síntese de
complexos de oxovanádio IV tendo como ligantes uma série de 2,6 diformil-p-cresol bis
tiossemicarbazonas, onde o átomo de oxigênio fenólico se complexa com dois átomos de
metal formando a ponte M-O-M. Dessa forma, nota-se que cada metal possui numero de
coordenação cinco. Para a obtenção dos respectivos quelatos, o ligante tiossemicarbazônico
(1mmol) dissolvido em 50 mL de etanol foi tratado com uma solução também etanólica de
0,002mmol de acetil-acetonato de vanádio [(VO)2 acac]. A mistura ficou sob agitação e
refluxo em vapor d‘água por 4-5 horas94.
Dyego Revorêdo de Carvalho Silva
54
Esquema 24: Rota de síntese de complexos Oxovanádio/TSC.
Carballo et al., 2002, sintetizou complexos de rênio I (Re) tendo como ligantes
ferrocenilcarbaldeído tiossemicarbazonas, objetivando com isso investigar a reatividade
destes complexos, assim como a capacidade das TSCs de se comunicar com o ferroceno e
centros metálicos. Nessa síntese, uma mistura de bromopentacarbonilrênio I e TSC foi
refluxada por 1 hora em tolueno, alcançando rendimento que variaram de 99,8% a 63,7%95.
Esquema 25: Rota de síntese de complexos de Rênio/TSC.
Em 2003, Shailendra et al., reportou a obtenção de complexos de paládio II com novas
tiofeno-2-carboxialdeído TSCs, através da reação destas com um precursor necessário para a
síntese complexos Pd II, o [Pd(DMSO)2Cl2]. A mistura foi mantida em refluxo por 5 horas em
metanol. Neste estudo, a forma tiona da TSC parace ser a preferencial para formação destes
quelatos, devido a sua maior nucleofilia96.
Dyego Revorêdo de Carvalho Silva
55
Esquema 26: Rota de síntese de complexos de Pd II segundo Shailendra.
Prabhakaran e grupo, em 2005, obtiveram complexos de níquel II tendo como ligante
a salicilaldeído-N-fenil tiossemicarbazona, fazendo-se reagir [NiCl2(PPh3)2] dissolvido em 25
mL de etanol seco, que foi adicionado lentamente a uma solução de tiossemicarbazona em
diclorometano em quantidade equimolar. A mistura foi deixada por quatro dias em
temperatura ambiente, alcançando rendimento de 90% 97.
Esquema 27: Rota de síntese de complexos de Ni II/ TSC.
No ano de 2006, Kostas et al., demonstrou a síntese de complexos de paládio a partir
de ligantes tiossemicarbazônicos de uma forma diferente daquela utilizada por Shailendra et
al., 2003. Nessa metodologia, dois equivalentes da TSC dissolvidos em metanol, foram
adicionados a 1 equivalente de K2PdCl4 em solução aquosa, sendo o pH em seguida ajustado
para 9,0-9,5 através da adição de NH4OH. A mistura foi agitada por 24 horas em temperatura
ambiente e com pH constante. O rendimento reacional foi de 50% 98.
Dyego Revorêdo de Carvalho Silva
56
Esquema 28: Rota de síntese de complexos de Pd segundo Kostas.
Em 2009, Vrdoljak e colaboradores, descreveram a síntese de novos complexos de
dioxomolibdênio IV tendo como ligantes uma série de N-substituídas piridoxal TSCs. O
molibdênio usualmente atua como ligante tridentado, formando complexos ao se coordenar
com três átomos doadores de elétrons, que no caso dessas TSCs são o oxigênio fenólico, o
nitrogênio da ligação imina e o enxofre (tiol ou tiona). Em alguns casos a complexação com o
nitrogênio azometínico pode ocupar o lugar do enxofre. Nessa síntese, uma mistura equimolar
da respectiva TSC e [MoO2(acac)2] em acetonitrila e metanol anidros foi refluxada por 4
horas, ficando em seguida por repouso durante um dia a temperatura ambiente. O rendimento
reacional foi relativamente baixo, ficando por volta de 48% 99.
Esquema 29: Rota de síntese de complexos de Mo/TSC segundo Vrdoljak.
Dyego Revorêdo de Carvalho Silva
57
I- 2.3 TIOSSEMICARBAZONAS E SUAS APLICAÇÕES FARMACOLÓGICAS
As Tiossemicarbazonas, como já citado anteriormente, representam uma classe de
compostos cujas propriedades têm despertado cada vez mais interesse em pesquisadores
atuantes na área de Química Medicinal Orgânica e inorgânica. Isto se deve principalmente ao
amplo espectro de aplicação farmacológica demonstrados por seus derivados, como também a
capacidade quelante e o papel da coordenação no seu mecanismo bioquímico de ação.
De modo geral pode-se dizer que tiosemicarbazonas agem, seja como inibidores de
enzimas – através da complexação de metais endógenos ou através de reações de redox – seja
através de interações com o DNA e da inibição da síntese deste. Além disso, alguns
complexos metálicos desses ligantes apresentam a habilidade de mimetizar a ação de certas
enzimas. Por vezes, o complexo mostra-se mais ativos que o ligante ou pode ainda ativar o
ligante como agente citotóxico e fazer decrescer a resistência celular a droga100.
Vários relatos literários têm demonstrado a gama de atividades biológicas
concernentes as TSCs, tendo-se como destaque a atividade antitumoral, antibacteriana,
antiviral, antiprotozoária, citotóxica, dentre outras.
I- 2.3.1. Atividade antiviral
Em 1950, Hamre et al., mostrou que benzaldeído tiossemicarbazonas eram ativas no
combate a infecção por neurovaccínia vírus quando administradas oralmente100. Este primeiro
estudo da atividade antiviral dos derivados da TSC serviu como mola propulsora para o
desenvolvimento de várias pesquisas de suas propriedades nessa área.
Em
1994,
Teitz
e
colaboradores
relataram
a
atividade
anti
HIV
para
tiossemicarbazonas, onde foram estudadas duas TSCs dotadas de tal atividade N-metilisatinaβ-4‘:4‘-dietil tiossemicarbazona (Figura 17; composto 1) e N-alil-isatina-β-4‘:4‘-dialil
tiossemicarbazona (Figura 17; composto 2). Ambas mostraram atuar sobre a síntese de
proteínas estruturais do HIV101.
Dyego Revorêdo de Carvalho Silva
58
1
2
Figura 17: Estruturas químicas dos compostos sintetizados por Teitz et al., 1994.
Em 2008, Finkielsztein sintetizou e avaliou a atividade de novos derivados da 1indanona tiossemicarbazonas em inibir a replicação do BDVD (vírus da diarréia bovina) tipo
1, espécie NADL, em células de bois da raça Madin-Darby (MDBK). Esse vírus possui a
organização genômica bastante semelhante ao do vírus da hepatite C (HCV) podendo servir
como modelo para estudos moleculares de proteína virais e avaliação de compostos antivirais
frente ao HCV88.
Dos quinze compostos testados, seis mostraram alta seletividade (SI) nos testes
quando comparados aos valores de referência da ribavirina (EC50= 4,62μM). Dentre estes
compostos, o composto 3 (Figura 18) foi o que apresentou maior atividade antiviral (EC
50=1,75μM) e seletividade cerca de sete vezes maior que o fármaco de referência. Vale
ressaltar que a porção TSC da molécula é essencial para esta atividade, visto que os derivados
da 1-indanona semicarbazônicos e tiossemicarbazídicos são inativos frente ao BDVD.
Figura 18: Estrutura química do composto 3 sintetizado por Finkielsztein, 2008.
Dyego Revorêdo de Carvalho Silva
59
I- 2.3.2. Atividade Antibacteriana
Tiossemicarbazonas apresentam um amplo espectro de atividades antibacterianas e é
sabido que de modo geral, as tiossemicarbazonas, em particular as α(N)-heterocíclicas, inibem
o crescimento de bactérias gram positivas, tais como Neisseria gonorrhoeae, Neisseria
meningitides, Staphylococcus aureus, Streptococcus faecalis e Enterococcus, mas não são
bons inibidores de bactérias gram negativas tais como Pseudomonas, Klebsiella,
Enterobacter, Shigella, Escherichia coli e Proteus100.
Em 2008, Khan et al., sintetizou e avaliou a atividade in vitro de uma série de
tiossemicarbazonas esteroidais contra Staphylococcus aureus, Staphylococcus pyogenes,
Salmonella typhimurium e E. coli. A atividade in vitro foi testada através do método de
difusão em disco e a concentração inibitória mínima (CMI) pelo teste de macro-diluição. Os
compostos que continham o substituinte cloro ou acetóxi na posição R e ciclopentil ou
ciclohexil na posição R1 (Figura 19) foram os que obtiveram melhores resultados dentre os
testados, embora nenhuma deles superasse a atividade da amoxicilina86.
COMPOSTO
4
R
O-Ac
R1
NHC5H9
5
Cl
NHC5H9
6
Cl
NHC6H11
7
O-Ac
NHC6H11
Figura 19: Estrutura química dos compostos sintetizados por Khan et al., 2007.
Ainda nesse ano, Güzel e grupo sintetizaram e avaliaram a atividade contra
Mycobacterium tuberculosis de uma série de 5-metil/trifluorometoxi- 1H-indol-2,3-diona 3tiossemicarbazonas. Nesse mesmo trabalho avaliou-se também a citotoxicidade e o MIC
(IC90). A inibição do crescimento foi avaliada contra M. tuberculosis H37Rv usando o teste de
micro-diluição em caldo, utilizando rifampicina como controle positivo. Dos 62 compostos
testados, três mostraram atividades significativas, sendo considerados promissores no
tratamento anti-tuberculose102.
Dyego Revorêdo de Carvalho Silva
60
8e9
10
R1= CH3, CF3O
R2= C4H9, C6H5, 4-FC6H4, 4-ClC4H6, 3-BrC6H4, Cicl- C6H11
R3= H, CH3, -
Figura 20: Representação geral dos compostos sintetizados por Guzel et al., 2008 que obtiveram melhor
atividade.
I- 2.3.3. Atividade Antifúngica
Em 2008, Opletalová e colaboradores demonstraram a síntese e testaram uma série de
pirazina-tiossemicarbazonas frente suas atividades antifúngicas contra Candida albicans,
Candida tropicalis, Candida krusei, Candida glabrata, Trichosporon asahii, Aspergillus
fumigatus, Absidia corymbifera e Trichophyton mentagrophytes. Essas moléculas foram
estudadas, pois relatos da literatura demonstraram que derivados da pirazina se mostram
ativos contra algumas espécies de fungos. O método utilizado para avaliação da inibição do
crescimento das espécies foi o de micro-diluição em caldo, utilizando fluconazol e
anfotericina B como drogas controles. Dentre os testados, os compostos 11, 12 e
principalmente o 13, foram os que demonstram resultados mais promissores. A eficácia do
composto 13 foi similar ou superior ao do fluconazol frente a todas as espécies analisadas103.
Dyego Revorêdo de Carvalho Silva
61
11
12
13
Figura 21: Estruturas químicas das TSCs com atividade antifúngica segundo Opletalová et al., 2008
I- 2.3.4. Atividade Antitumoral
A atividade de derivados tiossemicarbazônicos como inibidores da Ribonucleosídeo
difosfato redutase (RDR), enzima chave na fabricação do DNA, é conhecida desde 1956
através dos estudos de Brockman e grupo, que demonstrou a atividade antileucêmica da 2formilpiridina tiossemicarbazona. Desde este trabalho pioneiro, vários outros estudos vêm
sendo desenvolvidos.
No ano de 1998, Li e colaboradores desenvolveu o pró-fármaco triapina 3-AP da 3aminopirinida-2-carboxialdeído tiossemicarbazona (3-AP) (Figura 22), uma dos mais
importantes substâncias no combate a vários tipos de células tumorais. Com isso, visava-se
uma melhora no perfil farmacocinético da droga e também torná-la mais ativa frente a células
tumorais de carcinoma hepático (células M-109) 104.
Dyego Revorêdo de Carvalho Silva
62
3-AP
Triapina-3-AP
Figura 22: Pró- fármaco sintetizado a partir do 3-AP.
Mais recentemente, no ano de 2008, Dilovic et al., sintetizaram uma série de 8
compostos e avaliaram suas atividades antitumorais frente a seis linhagens de células
neoplásicas, HeLa (carcinoma cervical), Hep-2 (carcinoma de laringe), MCF-7 (câncer de
mama) SW620 (câncer de cólon), Mia- PaCa-2 (carcinoma pancreático) Hep-2 (Carcinoma
laríngeo) e WI 38 (fibroblastos diplóides). Destes, os compostos 14 e 15 (Figura 23) foram os
que apresentaram maior porcentagem inibitória das células avaliadas, onde o composto 14
apresentou boa atividade frente a três linhagens, e o composto 15 frente a todas testadas 105.
Composto 14
Composto 15
Figura 23: Estrutura química dos compostos sintetizados por Dilovic et al., 2008 com melhores atividades.
I- 2.3.5. Atividade antiprotozoária
Em 2002, Bharti et al., realizaram testes antiprotozoários de alguns derivados da 5nitro-tiofeno-2-carboxialdeído
tiossemicarbazona,
obtendo
bons
resultados
frente
a
Entamoeba histolytica e Trichomonas vaginalis, utilizando metronidazol como droga de
referência. A substância que apresentou melhor atividade frente a E. histolytica foi a 5-NT-
Dyego Revorêdo de Carvalho Silva
63
HMINTS (Figura 24), que apresentou IC50 igual a 1,71μM, ,enquanto que o metronidazol
apresentou nas mesmas condições IC50 de 2,10μM. Já contra T. vaginalis, a melhor resultado
foi o da substância denominada 5-NTBuTSC (Figura 24), que mostrou uma IC50 de 1,49μM,
em comparação a 1,92μM da droga controle106.
5-NT-HMINTS
5-NTBuTSC
Figura 24 Estrutura química dos compostos sintetizados por Bhart, 2002.
Em 2008, Abid e colaboradores sintetizaram e avaliaram a atividade antiprotozoária
contra Entamoeba histolytica de análogos tiossemicarbazônicos do metronidazol. O
metronidazol (IC50= 1,81μM) é a droga de escolha para esta terapia e modificações em sua
molécula, como a adição de alguns grupos relatados como possuidores de atividades antiamoébica (i.e. tiossemicarbazonas) parecem constituir uma boa estratégia para suplantar os
efeitos colaterais e a resistência demonstrada por algumas cepas desse protozoário. O método
utilizado para avaliação da atividade foi a micro-diluição em disco e, dentre os compostos
analisados, merecem maior atenção os compostos 16, 18, e em especial o 17, ( Figura 25) que
mostrou uma IC50 de 0,56μM 107.
Composto 16
Composto 17
Composto 18
Figura 25: Estruturas químicas dos compostos sintetizados por Abid e grupo, 2000.
Dyego Revorêdo de Carvalho Silva
64
Já no ano de 2010, Duan & Zhang testou a atividade contra Plasmodium falciparum de
novas tiossemicarbazonas contendo uma porção aromática com o iodo ligado na posição para.
Os testes foram realizados in vivo em camundongos, respeitando os procedimentos
preconizados pela Organização Mundial de Saúde (OMS). As drogas foram testadas nas
dosagens de 3,9,27 mg/kg de camundongo por dia e, a que apresentou maior grau de inibição
de crescimento do P. falciparum foi o composto 19, se aproximando bastante dos valores para
a droga controle cloroquina, inibindo 88.1 %, 90.7 % e 92.6 % em ordem crescente de
dosagem 108.
Composto 19
Figura 26: Estrutura química do protótipo antimalárico segundo Duan & Zhang, 2010.
I- 2.3.6. Atividade antichagásica
Para o desenvolvimento de fármacos antichagásicos, as pesquisas têm sido focadas,
como já citado anteriormente, para a inibição da enzima TCC7 e a TR8. A porção
tiossemicarbazona presente em alguns compostos descritos na literatura, tem sido evidenciada
como um grupo farmacofórico que apresentam potencial atividade inibitória da enzima
cruzaína9,10. Segundo Du e colaboradores a interação tiossemicarbazona TCC, acontece via
ataque covalente do resíduo Cys25 da TCC em direção ao carbono da tiocarbonila e
transferência de um próton do resíduo His159, formando um derivado tetraédrico.
Em
estudos de ―docking‖ realizados em 2006 e 2007 Leite e colaboradores comprovaram a
afinidade das aril-tiossemicarbazonas com a TCC, revelando a capacidade em inibir a TCC
que moléculas com núcleo tiossemicarbazona possuem 68.
Dyego Revorêdo de Carvalho Silva
65
Figura 27: Mecanismo de inibição da TCC por derivados aril-tiossemicarbazônicos proposta por Du et al., 2002.
Chiyanzu et al., 2003 preparam e avaliaram o grau de inibição da TCC de nove
tiossemicarbazonas oriundas de derivados da isatina. Os resultados foram avaliados em
termos de IC50, sempre os comparando com outros derivados da isatina com atividade
inibitória previamente comprovada. Os mais promissores valores foram apresentados pelos
compostos 20 e 21 (Figura 28), com valores de IC50 de 9 e 10,5μM, respectivamente 109.
Composto 20
Composto 21
Figura 28: Compostos sugeridos como inibidores da TCC segundo Chiyanzu et al., 2003
Em 2004, Aguirre e colaboradores sintetizam e testaram a atividade in vivo de uma
série de tiossemicarbazonas derivadas do 5-nitrofuril frente a duas cepas de T. cruzi. Os
compostos foram testados na concentração de 5μM e suas capacidades de inibição de
crescimento foram avaliadas em comparação com o Nifurtimox. Dentre estes, os que
obtiveram os melhores resultados foram o 22,23, 24 e 25, mostrando serem mais ativos que a
Dyego Revorêdo de Carvalho Silva
66
droga nitrofurânica comercialmente disponível 10.
COMPOSTO
n
R
22
1
H
23
1
Me
24
1
Et
25
1
Ph
Figura 29: Estrutura Química dos compostos sintetizados por Aguirre e grupo, 2004.
Fujii et al., 2005, analisou a atividade inibitória frente à TCC de uma série de
tiossemicarbazonas análogas da 3,4 diclorofenil ou 3-trifluorometil tiossemicarbazonas, que
em estudos anteriores mostraram-se bons inibidores da TCC. Os resultados obtidos revelaram
que a inserção de um grupo fenil, p-metil-fenil, e alquílicos lineares incrementam a atividade
dessa classe de moléculas. Por outro lado, a substituição do fenil por um ciclohexil diminui
altamente a atividade. Foram testados 10 compostos e o que exibiu maior poder de inibição
foi o 26, com IC50 de 19nm 110.
Composto 26
Figura 30: Estrutura química do composto que apresentou melhor atividade antichagásica segundo Fujii e
colaboradores 2005.
Em 2006, Siles et al., preparou e avaliou a capacidade de inibição da atividade da TCC
de uma série de TSCs derivadas do tetrahidronaftaleno, benzofenona e propiofenona. Os
resultados obtidos foram comparados ao de um composto previamente descrito na literatura
como potente inibidor da TCC, a 3-bromo propiofenona tiossemicarbazona, cuja menor IC50
descrita foi de 60nM. Os compostos que apresentaram melhores atividades anti-T. cruzi foram
Dyego Revorêdo de Carvalho Silva
67
o 27 e 28, cujas IC50 foi de 24nm e 17nm, respectivamente 111.
Composto 27
Composto 28
Figura 31: Estrutura química dos compostos sintetizados por Siles e grupo, 2006.
Dyego Revorêdo de Carvalho Silva
68
I- 3. OBJETIVOS
I- 3.1. OBJETIVO GERAL
Síntese e avaliação biológica de derivados tiossemicarbazônicos, visando obtenção de
compostos ativos contra o T. cruzi e de menor toxicidade que os fármacos utilizados
atualmente na farmacoterapia da doença de Chagas.
I- 3.2. OBJETIVOS ESPECÍFICOS
Obtenção de derivados tiosemicarbazônicos nitro-aril substituídos através da
condensação entre a tiossemicarbazida e uma série de aril-aldeídos previamente
nitrados por métodos convencionais.
Determinação das principais propriedades físico-químicas e elucidação estrutural por
meio de Ressonância Magnética Nuclear de Prótons (RMN-1H) e Infra-vermelho (IV).
Avaliação das atividades biológicas das nitro-ariltiossemicarbazonas: atividade
antimicrobiana e principalmente avaliação da ação tripanocida e citotoxicidade.
Dyego Revorêdo de Carvalho Silva
69
CAPÍTULO Ii
OBTENÇÃO DOS DERIVADOS NITROARILTIOSSEMICARBAZÔNICOS
Dyego Revorêdo de Carvalho Silva
70
II- 1. INTRODUÇÃO
Tiossemicarbazonas são compostos obtidos pela reação de condensação de um aldeído
ou uma cetona com uma tiossemicarbazida. Apresentam-se como sistemas com extrema
deslocalização eletrônica, principalmente quando há grupos aromáticos ligados ao carbono da
imina 112, e devido a presença da ligação dupla na tiossemicarbazonas, podem ser encontrados
diastereoisômeros conformacionais (Z e E).
Do ponto de vista sintético, apresentam como característica principal sua versatilidade
de obtenção, assim como sua vasta aplicação como intermediários de muitos núcleos
importantes. Geralmente, apresentam baixo custo de síntese, além de grande economia de
átomos, já que, com exceção da água que é liberada na sua obtenção, todos os outros átomos
dos compostos reagentes estarão presentes na molécula final 9.
II- 2. METODOLOGIA
II- 2.1 Procedimento Geral de Obtenção dos Aril-aldeídos Nitrados
Para obtenção dos produtos desejados duas metodologias foram utilizadas: na
primeira, a uma solução dos aril-aldeídos em CHCl3, utilizado como solvente e catalisador,
foi adicionada quantidade equimolar de
Ácido Nítrico concentrado (HNO3). A mistura
reacional foi mantida sob agitação magnética e banho de gelo por 1 hora, retirando-se então o
banho. Manteve-se a mistura em temperatura ambiente por mais um período de 4-7 horas, de
modo que foi monitorada por cromatografia em camada delgada (CCD). Ao término da
reação, realizaram-se três extrações, sendo a primeira apenas com água, e as demais com
EtOAc / H2O. Em seguida a fase orgânica foi evaporada para obtenção do produto na forma
de cristais, conteúdo esse que foi levado ao dessecador para retirada completa de qualquer
resquício de solvente.
Na outra, a uma mistura dos aril-aldeídos com ácido sulfúrico (H2SO4), utilizado como
solvente e catalisador, em banho de gelo e constante agitação magnética, foi adicionada
lentamente uma solução contendo quantidades equimolares de Ácido Nítrico concentrado
(HNO3) e ácido sulfúrico (H2SO4). Após 1 hora, retirou-se do banho, deixando-se a mistura
reacional em temperatura ambiente por 3-5 horas, também sendo monitorada por CCD. Ao
Dyego Revorêdo de Carvalho Silva
71
término da reação, adicionou-se água destilada e foi observada a formação de precipitado, o
qual foi filtrado em funil sinterizado e lavado com água vária vezes, sendo por fim levado ao
dessecador.
Composto R1
R2
1a
OH
H
1b
N(CH3)2 H
1c
OH
OCH3
1d
CH3
H
Esquema 30: Rota de Nitração dos Aril-aldeídos em presença de CHCl3.
Composto R1
R2
1e
Br
H
1f
Cl
H
1g
H
CHO
Composto X
1h
O
1i
S
Esquema 31: Rota de Nitração dos Aril-aldeídos em presença de H2SO4.
IV-
2.2 Procedimento Geral de Obtenção das Nitro-Aril tiossemicarbazonas
A uma solução etanólica da tiossemicarbazida, adicionou-se 5 gotas do catalisador
ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura ambiente por 15-30
minutos. Após esse tempo acrescentou-se então quantidades equimolares dos diferentes arilaldeídos nitrados, previamente sintetizados. A reação foi mantida à temperatura ambiente e
constante agitação magnética, por um período de 3-5 horas, de modo que foi monitorada por
Dyego Revorêdo de Carvalho Silva
72
CCD. Ao término da reação, adicionou-se água destilada e foi observada a formação de
precipitado, o qual foi filtrado em funil sinterizado e lavado com água. Para a purificação
realizou-se recristalizações em EtOH absoluto.
Composto 2a
2b
2c
R1
OH
N(CH3)2 OH
R2
H
H
R3
NH2 NH2
2d
2e
2f
2j
CH3 Br
Cl
Cl
H
H
OCH3 H
NH2
H
NH2 NH2 NH2
NHPh
Composto X
2h
O
2i
S
Esquema 32: Rota de obtenção das Nitro-Aril tiossemicarbazonas
Para obtenção das bis-tiossemicarbazonas 2g e 2l (Esquema 33), utilizaram-se dois
equivalentes da tiossemicarbazida em relação ao 1,3 isoftaldeído.
Dyego Revorêdo de Carvalho Silva
73
Composto R
2g
NH2
2l
NHPh
Esquema 33. Rota geral de síntese da bis-tiossemicarbazona 2g e 2l.
II- 3. RESULTADOS E DISCUSSÃO
Os derivados nitro-aril tiossemicarbazônicos 2a-2l (Tabela 2) foram sintetizados em
pouco tempo, através de uma metodologia simples e barata. Trata-se de uma etapa inicial de
nitração dos aril-aldeídos, com posterior condensação entre a tiossemicarbazida, ou 4-feniltiossemicarbazida, com uma série de nitro-aril aldeídos sintetizados. As reações de
condensação se procederam à temperatura ambiente, diferentemente do que se encontra
exposto na literatura, no qual a mesma acontece sob refluxo. Todos os produtos finais foram
obtidos na forma de cristais coloridos, que precipitaram quando da adição de água destilada
ao meio reacional, com rendimentos finais variando de bons a ótimos.
Dyego Revorêdo de Carvalho Silva
74
Tabela 2: Estruturas químicas dos derivados 2a-2l e suas respectivas nomenclaturas.
2a: 3-nitro-4-hidroxibenzaldeído
2b: 3-nitro-4-dimetilaminobenzaldeído
tiossemicarbazona
tiossemicarbazona
2c: 3-metoxi-4 hidroxi-5-nitro
2d: 3-nitro-4-tolualdeído
benzaldeído tiossemicarbazona
tiossemicarbazona
2e: 3-nitro-bromobenzaldeído
tiossemicarbazona
2f: 3-nitro-4-clorobenzaldeído
tiossemicarbazona
Dyego Revorêdo de Carvalho Silva
75
2g: 5-nitro- isoftaldeído
2h: 5-nitro-2-furaldeído
tiossemicarbazona
tiossemicarbazona
2i: 4-nitro-2-tiofenocarboxaldeído
2j: 3-nitro-4-clorobenzaldeído N(4)-
tiossemicarbazona
fenil-tiossemicarbazona
2l: 5-nitro-isoftaldeído-N(4)-feniltiossemicarbazona
Assim como nas nitrações usuais, a metodologia de nitração dos aril-aldeídos
Dyego Revorêdo de Carvalho Silva
76
utilizando CHCl3 como solvente e catalisador ácido, tem como primeira etapa reacional a
formação formação do eletrófilo nitrônio. Este é produzido de uma maneira mais lenta, pois
se utiliza como catalisador da reação, um ácido de Lewis fraco (CHCl3), possibilitando assim
um controle maior da reação, dificultando a formação de produtos secundários indesejado.
Esta metodologia mostrou-se útil apenas quando os aldeídos utilizados continham grupos
ativantes como substutuintes. Estes, através dos efeitos mesomérico (+M) e indutivo (+I),
aumentam a densidade eletrônica do anel aromático, proporcionando energia suficiente para
que os elétrons π do anel aromático capturem o hidrogênio do catalisador utilizado, visto que
o mesmo não apresenta-se muito ácido pelo fato de não encontrar-se ligado diretamente a um
elemento de alta eletronegatividade. Em algumas reações lançadas sem o banho de gelo,
houve um forte aquecimento inicial, e por vezes a formação do produto di-nitrado indesejado,
mostrando dessa forma a necessidade do controle inicial das condições reacionais.
Pelo fato da metodologia acima citada mostrar-se inapropriada para nitração de arilaldeídos contendo grupos desativantes como substituintes, testaram-se dois ácidos mais fortes
como catalisadores: ácido acético glacial e H2SO4 concentrado. Dentre estes, o primeiro
testado foi o ácido mais fraco, porém os resultados obtidos não se mostraram satisfatórios. O
tempo reacional longo (mais de 48 horas) e a dificuldade de extração, evaporação, purificação
para a retirada do ácido, com baixos rendimentos (30-50%), somado ao fato de alguns arilaldeídos nem sequer reagirem, inviabilizaram a sua utilização. Um dos fatores que
contribuíram bastante para os baixos rendimentos foi o baixo poder do ácido em solubilizar os
aril-aldeídos, os quais não reagiam por completo.
Por outro lado, o emprego do ácido sulfúrico possibilitou a obtenção de todos os
produtos desejados de forma rápida (± 6 horas) e altos graus de pureza. Pelo fato de se tratar
de um ácido mais forte, seus hidrogênios encontram-se mais lábeis, e, portanto, mesmo arilaldeídos com grupos desativantes fortes possuíam energia suficiente para arrancá-los. Outra
característica importante é sua capacidade em solubilizar os aldeídos utilizados em baixas
temperaturas (banho de gelo), provavelmente devido a sua alta polaridade, se assemelhando á
dos aldeídos. Isto favoreceu para o aumento dos rendimentos quando comparados ao a
metodologia anterior. Não foi necessário realizar uma extração no término da reação, pois ao
adicionar a mistura reacional a um béquer contendo água destilada, o produto precipitava na
forma de cristais coloridos e todo o resquício de ácido presente, era retirado de forma mais
simples através de várias lavagens dos cristais com água destilada.
Independente
da
metodologia
utilizada,
os
produtos
obtidos
mostraram-se
Dyego Revorêdo de Carvalho Silva
77
fotossensíveis e instáveis a temperatura ambiente, sendo necessário armazená-los em vidraria
âmbar e sob refrigeração. Em alguns casos houve degradação dos produtos após
armazenamento por muito tempo, mesmo sob essas condições acima citadas. A recristalização
em EtOH foi o processo de purificação mais eficaz utilizado.
Na etapa de condensação, foi empregada a metodologia clássica de formação de
iminas utilizando-se ácido como catalisador. A tiossemicarbazida ou a 4-feniltiossemicarbazida representam as moléculas que contém o grupo amino. O uso de ácido faz-se
necessário, pois este protona o oxigênio da carbonila do aldeído, possibilitando assim o
ataque nucleofílico do nitrogênio da tiossemicarbazida, como mostrado mais adiante no
esquema 34.
Segundo Holla et al., 2003, para este tipo de reação o catalisador ácido utilizado foi o
ácido acético em meio etanólico sob refluxo. Devido aos vários problemas já expostos quando
da utilização desse ácido, decidiu-se abrir mão do uso deste catalisador, mesmo levando em
consideração que se trata de diferentes procedimentos experimentais. Tendo-se em vista
algumas reações lançadas pelo nosso grupo de pesquisa para a síntese de aril-semicarbazonas,
onde se usou HCl como catalisador, obtendo rendimentos entre 65%-92%, decidiu-se testá-lo
para o preparo das nitro-ariltiossemicarbazonas. O resultado do teste foi útil tanto em relação
a tempo (3-5 horas) quanto em relação a rendimento, que ficou por entre 64-85%. Outra
característica que distingue esta metodologia da descrita na literatura, tornando-a mais
simples, é o fato da mesma acontecer sob temperatura ambiente. O mecanismo reacional desta
etapa encontra-se ilustrado no esquema 34.
Dyego Revorêdo de Carvalho Silva
78
S
H
O
Et O
H
H O
Ar
Ar
HO
H
H
HO
H
S
H
N
O
H
NH2
HO Et
S
N
H
N
H
NH2
NH2
+ H2O
S
N
H
N
H
H
Ar
Ar
H
N
NH2
S
H
Ar
S
H
N
NH2
HO Et
H H
N
N
H
H
Ar
Et O
N
H
H
H
H
H2N
Ar
N
H
NH2
Esquema 34: Mecanismo de condensação de compostos carbonilados com a tiossemicarbazida.
Tiossemicarbazonas sintetizadas a partir de uma amina primária podem ser obtidas nas
configurações Z ou E, o que varia de acordo com o substituinte do aldeído utilizado
70
. Na
síntese das Nitro-ariltiossemicarbazonas realizada por nosso grupo de pesquisa só foi
observada a presença de uma única mancha na CCD e, portanto, pode-se sugerir que foram
obtidas preferencialmente na configuração E, a qual é termodinamicamente mais estável.
Ao final da reação, todos os compostos foram obtidos na forma de cristais insolúveis
em água destilada. Para alguns deles, foi realizada uma purificação por recristalização em
EtOH. Estes cristais não se mostraram fotossensíveis podendo ser armazenados em vidraria
simples na geladeira.
Dyego Revorêdo de Carvalho Silva
79
A elucidação estrutural das moléculas sintetizadas foi obtida através de análises de
dados fornecidos por técnicas espectroscópicas de RMN de 1H e 13C, e de infravermelho (IV).
As principais bandas de absorção no espectro de IV dos grupamentos inerentes as moléculas
sintetizadas encontram-se listadas na tabela abaixo.
Tabela 3: As principais bandas de absorção dos grupos inerentes as moléculas sintetizadas.
Composto C=S Deformaç.
axial
NH2
C=N
NO2
Deformaç.
Deformaç.
axial
Axial Simét.
NH Hidrazínico
2a
1165
3244 e 3393 1530
1281
3150
2b
1203
3236 e 3399 1526
1372
3154
2c
1057
3256 e 3437 1541
1321
3160
2d
1107
3238 e 3422 1518
1364
3158
2e
1091
3258 e 3417 1519
1360
3156
2f
1105
3366 e 3500 1519
1351
3156
2g
1105
3246 e 3423 1524
1343
3155
2h
1057
3301 e 3462 1537
1355
3086
2i
1103
3314 e 3472 1543
1335
3158
2j
1059
3255*
1544
1332
3164
2l
1086
3225*
1527
1446
3124
* Condensação realizada com fenil-tiossemicarbazida.
De posse do conhecimento da existência dos grupamentos funcionais desejados,
evidenciado pela análise de infravermelho, a confirmação estrutural mais detalhada foi
realizada por RMN 1H e
13
C. No presente estudo não foi possível a determinação da
configuração das moléculas sintetizadas, porém, para todas as tiossemicarbazonas foi
detectado apenas um isômero na cromatografia de camada delgada, sugerindo que estas
deveriam estar na configuração E, termodinamicamente mais estável.
Através da interpretação dos espectros de IV pode-se afirmar que a metodologia de
nitração empregada foi eficaz, pois em todas as moléculas sintetizadas (2a-2l), se observa
bandas de absorção características a deformação axial simétrica do grupo NO2, situadas entre
1281-1446 cm-1 113. Como o produto di-nitrado era indesejado, foi necessário se certificar que
Dyego Revorêdo de Carvalho Silva
80
este não tinha sido sintetizado. Para isso, partiu-se para a análise dos dados de Ressonância
Magnética Nuclear.
Nos espectros de RMN 1H das moléculas 2a, 2b, e 2e nota-se em campo característico
de hidrogênios ligados a anel aromático, a presença de três hidrogênios. Um deles encontra-se
na forma de um singleto, entre 8,12 e 8,56 ppm e, e os outros dois como dubletos na região
de 7,13-7,93 ppm. Isto pode ser visto tomando como exemplo o espectro de RMN 1H do
composto 2b (Figura 32), onde nota-se a presença do singleto acima citado em 8,12 ppm
(H7; figura 32) e dos dubletos, de mesma constante de acoplamento (8,1 Hz), em 7,88 (H5 ;
figura 32) e 7,13ppm (H6 ; figura 32), sendo o mais desblindado localizado na posição orto ao
grupo azometínico. O singleto aparece sempre em campo mais baixo que os dubletos,
provavelmente devido ao efeito anisotrópico causado pela sua proximidade espacial com o
grupamento nitro, sofrendo uma acentuada desblindagem.
Figura 32: Espectro de RMN 1H do composto 2b.
Como partimos, em sua maioria, de aril-aldeídos 4-substituidos, a presença de apenas
três hidrogênios na região dos aromáticos, dois deles vicinais, somado a presença três
Dyego Revorêdo de Carvalho Silva
81
carbonos quaternários com deslocamentos químicos entre 112,9 ppm e 140,6 ppm no espectro
de RMN 13C confirma que realmente ocorreu apenas a mono-nitração, como pode ser visto no
espectro do composto 2b onde estes se encontram com deslocamento de 145,83 ppm, 137,88
ppm, 123,29 ppm (Figura 33).
DMSO
Figura 33: Espectro de RMN 13C do composto 2b.
Em alguns casos, como para compostos 2d e 2f, houve uma modificação quanto aos
tipos de acoplamentos. A análise do espectro do composto 2d (Figura 34) mostra que, o
hidrogênio que aparecia normalmente como um singleto, mostrou-se agora como um dubleto
com constante de acoplamento de 1,6 Hz (H7; figura 34), caracterizando o acoplamento J4,
por vezes presente em anéis aromáticos. Em conseqüência disto, o hidrogênio orto ao
grupamento azometínico (H5; figura 34) mostrou-se como um duplo-dubleto.
Dyego Revorêdo de Carvalho Silva
82
Figura 34: Espectro de RMN 1H do composto 2d.
Em relação ao composto 2g, oriundo de um aril-adeído 3-substituído, cujo substituinte
é outro grupo aldeído, a confirmação dá-se pela presença de dois singletos, um deles
integrando para um hidrogênio (δ 8,58ppm; H3; figura 35) e o outro integrando para dois
hidrogênios (δ 8,62ppm; H1 e H2; figura 35). Isto indica também que a substituição ocorreu
na posição 5, pois em qualquer outra posição, teríamos a presença provavelmente de dois
dubletos. Não se levou em consideração a substituição ocorrer na posição 2, devido ao grande
impedimento estérico oferecido pelos grupos presentes nas posições vizinhas.
Dyego Revorêdo de Carvalho Silva
83
Figura 35: Espectro de RMN 1H do composto 2g.
Para os heteroaromáticos, a confirmação do padrão de substituição se deu através da
presença de dois hidrogênios na região dos aromáticos. Para o composto 2h esses hidrogênios
apareceram como dois dubletos com deslocamento químico de 7,96 ppm e 7,36 ppm. Além de
confirmar a entrada de apenas um grupo nitro no anel aromático, esses dubletos indicam que a
substituição ocorreu na posição 5, posição favorecida pelo pequeno impedimento estérico e
densidade eletrônica alta durante a ressonância dos elétrons. Já para o composto 2i, têm-se a
presença de dois singletos, com integral para apenas um hidrogênio cada, em 8,05 ppm (H2;
figura 36) e 7,51 ppm ( H1; Figura 36). Estes indicam que a entrada do substituinte ocorreu na
posição 4’, menos impedida estericamente que a posição 3’.
Dyego Revorêdo de Carvalho Silva
84
Figura 36: Espectro de RMN 1H do composto 2i.
A partir da análise dos espectros de IV, pôde-se também confirmar o sucesso da
condensação com a tiossemicarbazida. Bandas fortes na região 1518-1544 cm-1 foram
atribuídas ao estiramento da ligação C=N
114
, caracterizando que realmente a metodologia
utilizada foi eficaz. Em alguns casos, encontram-se superpostas por bandas de estiramento
C=C. Com relação ao espectro de RMN 1H, também é possível corroborar o que foi dito. Isto
pode ser exemplificado no espectro de IV do composto 2b (Figura 37), onde a banda de
absorção referente a este grupo acima citado encontra-se em 1526 cm-1.
Dyego Revorêdo de Carvalho Silva
85
Figura 37: Espectro de IV do composto 2b.
Nos espectros de RMN 1H analisados, a presença de um singleto entre 7,96 ppm e 8,29
ppm, atribuído ao hidrogênio azometínico, como por exemplo para o composto 2b ( H4;
Figura 32), onde este pico encontra-se em ppm. De forma geral, mostra-se mais
desblindado que os hidrogênios do anel aromático, exceto quando estes se encontram em
posição orto ao grupo nitro. Esta maior desblindagem em relação aos hidrogênios aromáticos
deve-se ao efeito anisotrópico causado pelo movimento dos elétrons π da ligação imínica, e
pela proximidade com um átomo mais eletronegativo. Por vezes, este pico pode coincidir com
o singleto referente ao hidrogênio da amina terminal.
Duas bandas de média a fracas das deformações axiais de cada hidrogênio do NH2
podem ser visualizadas entre 3236-3472 cm-1
(113)
. Esses mesmo dois hidrogênios, como se
pode observar nos espectros obtidos, encontram-se dois singletos, integrando para apenas um
hidrogênio cada, situados entre 8,04 ppm e 8,55 ppm. Para o espectro do composto 2b (Figura
32), por exemplo, esses dois picos aparecem com deslocamentos químicos de 8,14 ppm (H2;
Figura 32) e 8,04 ppm (H1; Figura 32), corroborando com os dados do IV. Essa diferença de
Dyego Revorêdo de Carvalho Silva
86
ambientes químicos deve-se ao bloqueio da rotação livre da ligação C-N em virtude de seu
caráter parcialmente duplo, que favorece interação entre a nuvem eletrônica do enxofre da
tiocarbonila, que possui um raio atômico grande, e o hidrogênio mais próximo a ele, quando
seus orbitais encontram-se no mesmo plano. Este hidrogênio apresenta-se sempre como o
mais desblindado. Vale salientar que para as semicarbazonas esse fenômeno não é observado,
vendo-se apenas um singleto integrando para dois hidrogênios, devido a um menor raio
atômico do oxigênio em relação ao enxofre, impossibilitando sua interação com os
hidrogênios.
Para os compostos 2j e 2l, apenas uma banda na região 3225-3500 cm-1 é encontrada
(Figura 38), pois a condensação foi realizada com a 4-fenil tiossemicarbazida, onde no
produto final, ao invés de uma tioamida primária, temos uma tioamida secundária.
Figura 38: Espectro de IV do composto 2j.
Com relação ao espectro RMN 1H desses dois compostos, aparece um singleto em
campo baixo, com deslocamento químico de 10,27 ppm para o 2j e 10,27 para o 2l, este
último integrando para dois hidrogênios pois trata-se de uma bis-tiossemicarbazonas. Nota-se
Dyego Revorêdo de Carvalho Silva
87
também a presença de mais hidrogênios na região dos aromáticos, referentes ao grupo fenil.
No espectro de RMN 1H do composto 2j (Figura 39), esses aparecem como um dubleto (H1;
Figura 39) em 7,5 ppm, um duplo-dubleto (H2; Figura 39) em 7,39 ppm e um tripleto (H3;
Figura 39) em 7,24 ppm.
Figura 39: Espectro de RMN 1H do composto 2j.
A ausência da banda de S-H, observada em geral entre 2500-2600 cm-1, e a presença
de C=S em 1057-1203 cm-1(113) confirma a estrutura de todas as tiossemicarbazonas na forma
tiona116. No espectro de RMN
13
C, o carbono da tiocarbonila, pelo fato deste estar ligado a
três átomos mais eletronegativos (C,N,N) e em um sistema em constante ressonância, aparece
como o sinal mais desblindado em todos os espectros. Para o composto 2b, por exemplo, esse
aparece com deslocamento químico de 177,63 ppm (Figura 32).
Dyego Revorêdo de Carvalho Silva
88
A banda de absorção encontrada em freqüências entre 3086 e 3164 cm-1 nos espectros
de todas as tiossemicarbazonas foi atribuída ao estiramento da ligação N-H hidrazínico, pois,
de acordo com Tarasconi et al. (2000) e Ferrari et al. (2000), ela é encontrada na região de
3041 – 3178 cm-1 (75,115). Esta afirmação pode ser reforçada analisando os espectros de RMN
1
H das moléculas obtidas, onde o sinal mais desblindado, sempre um singleto na região de
11,35-12,09 ppm, se refere ao do hidrogênio do N-H hidrazínico, como por exemplo, para o
composto 2b, onde este aparece como um pico com deslocamento químico de 11,35 ppm (H3;
Figura 32).
Dyego Revorêdo de Carvalho Silva
89
CAPÍTULO III
AVALIAÇÃO DAS ATIVIDADES BIOLÓGICAS
Dyego Revorêdo de Carvalho Silva
90
III- 1. INTRODUÇÃO
A propriedade antibacteriana das tiossemicarbazonas tem sido investigada desde 1946,
quando Domagk et al. reportaram suas atividades contra o micro-orgaismo Mycobacterium
tuberculosis. De modo geral, é sabido que as tiossemicarbazonas apresentam um amplo
espectro de atividades antibacterianas e, em particular as α(N)-heterocíclicas, inibem o
crescimento de bactérias gram positivas, tais como Neisseria gonorrhoeae, Neisseria
meningitides, Staphylococcus faecalis, Streptococcus faecalis e Enterococcus, mas não são
bons inibidores de bactérias gram negativas tais como Pseudomonas, Klebsiella,
Enterobacter, Shigella, Escherichia coli e Proteus100. Alguns outros relatos na literatura
também mostram as atividades de alguns derivados tiossemicarbazônicos frente à
Staphylococcus
aureus,
Mycobacterium tuberculosis
Staphylococcus
102
pyogenes,
Salmonella
typhimurium86
e
.
Dentre os alvos biológicos considerados como mais promissores no combate a doença
de Chagas, encontram-se enzima TCC7 e a TR8. De acordo com vários relatos expostos na
literatura, tiossemicarbazonas são consideradas como grupo farmacofóricos na atividade
tripanocida, mostrando-se capazes de inibir a enzima TCC, além de possuírem uma baixa
citotoxicidade
10,68
. Nitrocompostos, como derivados nitrofurânicos, também tem sido
descritos como potentes inibidores irreversíveis da TR em condições anaeróbicas66.
III- 2. ATIVIDADE ANTIBACTERIANA
III- 2.1 Metodologia
III- 2.1.1 Método da difusão em discos de papel
A atividade antimicrobiana das nitro-aril tiossemicarbazonas 2b-2l (Figura 40) foi
verificada in vitro, pelo método de difusão em disco de papel, frente a bactérias Grampositivas e Gram-negativas (Staphylococcus aureus, Bacillus subtilis, Streptococcus faecalis,
Escherichia coli, Klebsiella pneumoniae, Mycobacterium smegmatis) da coleção de
microorganismos do Departamento de Antibióticos da UFPE.
Neste método, os discos contendo concentrações conhecidas dos compostos
Dyego Revorêdo de Carvalho Silva
91
sintetizados foram colocados na superfície de uma placa de ágar, onde uma suspensão
padronizada dos micro-organismos teste foi inoculada. As suspensões dos micro-organismos
testes foram padronizadas através da escala de McFarland com turbidez correspondente a 0,5,
equivalente a 1 a 2 x108 unidades formadoras de colônias por mililitros (UFC/mL). Discos de
papel contendo apenas o solvente dimetil-formamida (DMF) foram utilizados como controles
negativos. As placas foram levadas a estufa durante 24h e 48h à temperatura de 30°C e 37°C e
após o período de incubação mediram-se os halos de inibição em milímetros (mm). O halo de
inibição será considerado a área sem crescimento detectável a olho nu. A zona média de
inibição para amoxicilina (antibiótico) foi utilizada como valor de referência, a qual foi
medida em outro trabalho realizado por nosso grupo de pesquisa. Os experimentos foram
realizados em duplicata, e repetidos se os resultados apresentassem alguma divergência 127.
Dyego Revorêdo de Carvalho Silva
92
2a
2b
2e
2c
2f
2h
2d
2g
2i
2j
2l
Figura 40: Estrutura química dos derivados nitro-aril tiossemicarbazônicos sintetizados.
Dyego Revorêdo de Carvalho Silva
93
III- 2.1.2 Determinação da Concentração Mínima Inibitória (CMI) e Concentração
Mínima Bacteriostática (CMB).
Para os ensaios de CMI e CMB, foi utilizada a técnica de macrodiluição em meio
líquido, onde a partir de uma solução-mãe com concentração de 1mg/mL dos compostos em
análise, solubilizados em dimetilformamida, foram realizadas diluições seriadas para obtenção
das concentrações desejadas. Foram adicionados 100μL da suspensão bacteriana, previamente
padronizadas através da escala de McFarland acima citada, aos tubos de Muller-Hinton
contendo as concentrações desejadas dos compostos em análise. Os tubos foram incubados a
37ºC por 24-48 h, e, em seguida, examinados para visualização da presença ou ausência de
organismos de cultivo. Tubos contendo apenas DMF também foram avaliados. Os valores de
CMI foram obtidos a partir da menor concentração dos compostos onde não foi observado
qualquer crescimento de bactérias. Após plaqueamento, os valores da CMB foram medidos
através da inoculação dos caldos utilizados para determinação do CMI. Os valores de CMB
foram observados a partir do crescimento da diluição subseqüente. Os valores da CMI e da
CMB, foram expressos em µg/mL 128.
III- 2.2 Resultados e discussão
Neste trabalho a avaliação da atividade antibacteriana deu-se em duas etapas:
inicialmente foi realizado o teste qualitativo por meio da avaliação in vitro da atividade,
através da difusão em discos dos derivados nitro-aril tiossemicarbazônico testados, medindose a zona média de inibição (ZMI). Esta foi obtida a partir da media dos valores dos halos de
inibição. Em seguida, as substâncias que apresentaram halo de inibição superior a 14 mm,
foram submetidas à determinação da CMI. Os valores da ZMI obtidos frente às bactérias em
análise encontram-se expostos na tabela abaixo.
Dyego Revorêdo de Carvalho Silva
94
Tabela 4: Valores das ZMI dos compostos testados, em mm.
Microorganismo Compostos
Padrão
2b
2c
2d
2e
2f
2g
2h
2i
2j
2l
Amox.
S. aureus
-
-
-
-
-
-
34,5
26
-
-
18
B. subtilis
-
-
-
-
-
-
39
33,5
-
-
18.5
E. faecalis
-
15,5
-
-
-
-
20
21
-
-
32.5
E. coli
-
14,5
-
-
-
-
25,5
14
-
-
26
K. pneumoniae
-
-
-
-
-
-
-
-
-
-
-
M. smegmatis
-
22,5
-
-
-
-
25,5
24
-
-
35
- : não possui sensibilidade; NT: não testado
Através da análise da tabela acima, foi possível notar que os compostos 2c, 2h e 2i
foram os que se apresentaram ativos, apresentando em alguns casos ZMI maior que a droga
controle de escolha. Também se pode perceber que nenhum dos compostos sintetizados
mostrou-se ativo frente à bactéria K. pneumoniae, assim como a droga padrão utilizada. De
um modo geral, substâncias contendo apenas um grupo ativador (2a, 2b e 2d), ou grupos
desativadores (2e, 2f) ligado ao anel benzênico apresentaram-se inativas frente as espécies em
estudo. Grupos volumosos ligados ao nitrogênio N(4) da porção TSC também parece
interferir negativamente na potencia antimicrobiana, como pode ser visto para os compostos
2j e 2l, os quais contêm um grupo fenil ligado na posição anteriormente citada. As bistiossemicarbazonas, com ou sem o grupo fenil em N(4), 2l e 2g respectivamente, também se
mostraram inativas.
A atividade antibacteriana das tiossemicarbazonas parece envolver a coordenação de
metais presentes nas estruturas das enzimas dos microorganismos com o átomo de enxofre100.
Por isso, a presença de um substituinte que diminua, ou aumente pouco a deslocalização de
elétrons para a função azometina, ocasiona em uma menor densidade eletrônica próximo do
átomo de enxofre, interferindo na sua capacidade de complexação.
Embora Rozenski e colaboradores, em 1995, tenham conseguido relacionar a ação
antibacteriana com o potencial de redução do grupo nitro em alguns compostos, em nossos
experimentos foi possível observar que nem todos os nitrocompostos sintetizados
apresentaram atividade. Isto sugere que o grupo nitro, na ausência de grupos doadores de
elétrons ligados ao anel aromático, por si só não é capaz de exercer atividade antibacteriana.
Dyego Revorêdo de Carvalho Silva
95
Por outro, nota-se que de alguma forma o mesmo favorece a atividade quando da presença de
grupos doadores. Isto pode ser confirmado quando comparamos o composto 2i com seu
análogo, desprovido do grupo nitro, o qual mostrou mais baixa atividade, além de menor
espectro de ação.
O composto 2c, que apresenta dois grupos doadores de elétrons ligados ao anel
benzênico, mostrou-se ativo frente a uma bactéria Gram-negativa (E. coli), uma Grampositiva (E. faecalis) e uma álcool-ácido resistente (M. smegmatis). Nos três casos, os halos
de inibição foram inferiores ao da amoxicilina.
Os compostos mais ativos da série testada foram o 2h e 2i, onde chama atenção a
semelhança estrutural entre eles, diferenciando-os consideravelmente dos demais. Trata-se de
duas nitro-aril-tiossemicarbazonas heteroaromáticas, onde o heteroátomo é o O e S,
respectivamente. Estas tiveram o mesmo espectro de ação, sendo o composto 2h
consideravelmente mais ativo.
Ambos mostraram atividade frente às três bactérias Gram (+) (S. aureus, E. faecalis,
B. subtilis), além de inibir o crescimento de uma das duas gram (-) testadas e do bacilo álcoolácido resistente. Frente às espécies S. aureus e B. subtilis, a ZMI das moléculas mostrou-se
bem superior a da droga controle, sendo um dos resultados mais que o dobro do valor, como
no caso do composto 2h frente a B. subtilis. O composto 2h também foi o mais ativo frente a
E. coli.
Os compostos 2c e 2h, por apresentaram boa atividade bactericida, foram selecionados
para realização dos testes de determinação da CMI e da CMB em meio líquido, cujos
resultados encontram-se mostrados na Tabela 5. Embora tenha apresentado-se bastante ativo,
composto 2i não pôde ser testado, pois o mesmo precipitava em vários meios de culturas
testados, indicando que havia interação entre a molécula e componentes do meio de cultura
testados.
Dyego Revorêdo de Carvalho Silva
96
Tabela 5: Valores da Concentração Mínima Inibitória e Concentração Mínima Bactericida para os compostos 2c
e 2h frente às cepas avaliadas em µg/mL.
Compostos
2c
Microoganismos
2h
CMI CMB CMI
Staphylococcus
Padrão
Amoxicilina
CMB
CMI
NT
NT
Bacillus subtilis
NT
NT
500
250
64
Mycobacterium
250
125
500
250
-
Enterococcus faecalis
NT
NT
>500
-
0,39
Escherichia coli
NT
NT
125
62,5
256
31,25 15,625
16
aureus
smegmatis
NT: Não testado;
Analisando os dados da tabela, notamos que em geral, os compostos testados
mostraram uma baixa atividade, pois foi necessária uma alta dose para obtenção das
respectivas CMI e CMB em comparação às drogas padrões. Porém, quando analisamos a
atividade do composto 2h frente a bactéria E. coli, nota-se que esta mostrou-se mais ativo que
a droga controle utilizada, sendo este o composto mais promissor sintetizado.
III- 3. ATIVIDADE ANTICHAGÁSICA E AVALIAÇÃO DA CITOTOXICIDADE.
III- 3.1 Metodologia
III- 3.1.1 Ensaio de citotoxicidade dos compostos em células esplênicas
Células esplênicas foram cultivadas em placas de micropoços, contendo meio de
cultura RPMI com de soro bovino fetal. Para o ensaio de citotoxicidade, as células serão
incubadas com os compostos em sete diferentes concentrações e com timidina tritiada durante
24 h em estufa de CO2 a 37ºC. Em paralelo, foram feitos controles com células tratadas com
Dyego Revorêdo de Carvalho Silva
97
saponina, com células tratadas com DMSO, substâncias com reconhecida atividade tóxica e
um controle sem tratamento. Após incubação, as células foram coletadas em papel de fibra de
vidro e, posteriormente, a captação de timidina tritiada será determinada através do contador
beta de cintilação. O percentual de citotoxicidade foi determinado comparando-se a
percentagem de incorporação de timidina tritiada nos poços com as drogas em relação aos
poços não tratados.
III- 3.1.2 Avaliação da atividade dos compostos frente ao T. cruzi
Para determinar o efeito anti-proliferativo para T. cruzi, formas epimastigotas
crescidos em culturas axênicas, na fase log de crescimento, serão colocadas em placas de 96
poços sob condições de cultura adequadas. Os testes serão conduzidos tendo como controle o
benzonidazol (50 mg/ml) e culturas de parasitos sem tratamento. As substâncias serão
avaliadas quanto à concentração inibidora de 50% do crescimento dos parasitas (IC50%) onde
formas epimastigotas da cepa Y de T. cruzi serão cultivadas, na presença de diferentes
concentrações dos compostos, procedendo-se em seguida a contagem de parasitas viáveis. O
cálculo da IC50% será determinada por meio de uma regressão linear simples utilizando o
software Prisma 4 Graphpad.
III- 3.2 Resultados e discussão
A atividade tripanocida dos derivados nitro-aril tiossemicarbazônicos (2a-2l), foi
avaliada, em valores de IC50, frente à forma evolutiva epimastigota do T. cruzi, crescidas em
culturas axênicas. Os valores de IC50, em µg/ml, para cada composto sintetizado encontram-se
dispostos na tabela abaixo.
Dyego Revorêdo de Carvalho Silva
98
Tabela 6: Atividade anti-T. cruzi dos derivados nitro-aril tiossemicarbazônicos.
Compostos
IC50 epimastigotas
(µg/ml)
2a
15.87
2b
28.63
2c
16.39
2d
5.12
2e
1.06
2f
2.06
2g
29.90
2h
1.42
2i
1.12
2j
36.25
2l
9,6
BDZ
1.73
BZD = Benznidazol.
Segundo Du e colaboradores (2002), a interação tiossemicarbazona-TCC acontece via
ataque covalente do resíduo Cys25 da TCC em direção ao carbono da tiocarbonila e
transferência de um próton do resíduo His159, formando um derivado tetraédrico (Figura 41).
Deduz-se, portanto que grupamentos que diminuam a densidade eletrônica no enxofre da
tioarbonila, favoreçam a atividade anti-T. cruzi das TSC 9.
Nossos estudos obtiveram como composto mais ativo da série, o 2e, que apresentou
uma IC50= 1,06 µg/ml. Trata-se de uma nitro-aril tiossemicarbazona, com um substituinte
desativador, o bromo, na posição 4‘ do anel fenílico.
Dyego Revorêdo de Carvalho Silva
99
Figura 41: Mecanismo de ação das tiossemicarbazonas proposto por Du e colaboradores (2002).
Embora o bromo não influencie na ressonância, o resultado observado para este
composto está em concordância com os dados expostos no trabalho realizado por Greenbaum
et al. (2004), mesmo que os testes tenham sido realizados diretamente na enzima TCC. O
composto mais ativo sintetizado por seu grupo, trata-se de um isômero do nosso composto,
variando-se apenas a posição do átomo de bromo, agora na posição 3‘ do mesmo anel
aromático e substituindo-se o hidrogênio azometínico por um grupo metil, estando ausente o
NO2
119
. Outro trabalho que mostra a eficácia deste substituinte na atividade tripanocida é
mostrado por Siles e colaboradores (2006), onde novamente a tiossemicarbazona com
substituinte bromo na posição 3‘ foi mais ativo dá série. Isto indica que a presença de
halogênios na molécula influencie positivamente na atividade anti-T.cruzi destes compostos
111
.
Foi testado também em nosso projeto um bioisóstero do composto 2e, onde na posição
4‘temos um átomo de cloro (2f). O emprego do bioisosterismo como estratégia de
modificação molecular para a descoberta de novos agentes bioativos permite que se antecipe
uma comparável afinidade entre duas substâncias bioisostéricas por um dado sítio receptor e,
conseqüentemente, um potencial de atividade biológica similar120. No nosso caso, houve uma
redução de quase duas vezes no valor da IC50, que para este composto foi de 2,06 µg/ml.
Segundo Hernandes et al. (2010), a presença de substituintes volumosos como os átomos
halogênios ―Cl‖ e ―Br‖, geralmente permite uma interação de maneira mais adequada destes
com o sítio ativo de alguns alvos biológicos importantes, pois facilita a ligação a cavidades
mais profundas na estrutura destes receptores biomoleculares
121
, podendo este ser o fator
decisivo para uma maior atividade.
De modo geral, os compostos que possuem grupos ativantes 2a, 2b, 2c e 2d
Dyego Revorêdo de Carvalho Silva
100
mostraram-se pouco ativos quando comparados as drogas controles utilizadas, com valores de
IC50 que variaram de 5,12 a 28,63 µg/ml. Os compostos de 2a, 2b e 2c possuem grupos
ativantes que exercem efeito do tipo +M no anel aromático e em todo sistema nele acoplado.
Na tentativa de esclarecer os motivos da redução da atividade, resolveu-se analisar a
influência destes grupos no mecanismo de ação proposto por Du et al (2002) 9. Sabe-se que
nos compostos sintetizados, grupos ativantes do tipo +M, por ressonância, aumentam a
densidade eletrônica em torno do carbono da tiocarbonila. Isto parece dificultar o ataque
covalente do resíduo Cys25 da TCC em direção ao mesmo. Este efeito negativo de
substituintes ativadores presentes nas moléculas sintetizadas por nosso grupo , parece estar de
acordo com trabalhos realizados por Du et al. (2002) e Chiyanzu et al. (2003), onde ambos
comparam TSC contendo grupos ativantes em anéis aromáticos (OCH3, CH3, OH) e
desativantes, sempre com superior eficácia para estes últimos
9,109
. Outro fator que nos leva a
acreditar que a movimentação dos elétrons no sentido da tiocarbonila influencia
negativamente, é o fato de o composto mais ativo dentre esses quatro, trata-se de um ativante
que exerce efeito +I (2d), o qual não influencia na ressonância.
Dados na literatura relatam que grupos aril, principalmente o fenil, nas
tiossemicarbazonas parecem ocupar um sítio especifíco na enzima TCC, o chamado bolso S2.
Substituições realizadas por Greenbaum e colaboradores (2004) do grupo fenila por alguns
grupos volumosos como bi-fenilas, bi-arilaminas, e bi-aril éter acetofenonas, ou por
heteroaromáticos contendo nitrogênio, causou um decréscimo da atividade 119.
Contradizendo os dados acima, em nossa série, os derivados nitro-heteroaromáticos 2h
e 2i mostraram-se bastante eficazes em inibir o crescimento do parasito, possuindo IC50 igual
1,42 e 1,12 µg/ml respectivamente, sendo inclusive mais ativos que as drogas de referência.
Estes resultados corroboram com os expostos por Gerpe et al. (2009) onde foram testadas seis
derivados tiofênicos e furânicos que continham a porção tiossemicarbazonas frente a forma
evolutiva epimastigota. Em geral, estes derivados mostraram boa atividade, principalmente os
que possuíam como substituinte o grupo nitro na posição 5‘ do heteroaromático (IC50= 1,9 e
4,2 µg/ml), mostrando ainda a importância do grupo nitro nesse aspecto, o qual está presente
em todas as moléculas em estudo no nosso trabalho 122.
Nitrocompostos são moléculas bioativas utilizadas como agentes antimicrobianos,
antiparasitários e antitumorais. A maioria dos compostos nitrados apresenta o mecanismo de
biorredução enzimática do NO2, o que resulta na formação de radicais livres com toxicidade
preferencial para células bacterianas e parasitárias
123
. Du et al., 2002, sintetizou três
Dyego Revorêdo de Carvalho Silva
101
moléculas análogas as nitro-aril tiossemicarbazonas 2c, 2e e 2f, sendo diferentes apenas pela
ausência do grupo nitro9 (Figura 42). Comparando-se os valores de IC50 dos composto
sintetizado por Du et al., 2004 frente a enzima recombinante purificada, cujos valores
mostraram-se sempre superiores a 10 µg/ml, com os valores dos compostos 2e e 2f por nossso
grupo sintetizados, percebe-se um incremento de cerca de dez vezes na atividade. Logo,
nossas moléculas estão de acordo com dados literários que consideram o grupo nitro como
parasitóforo 14. Não se pôde precisar se o composto 2c foi mais ativo.
Moléculas sintetizadas
por nosso grupo de
pesquisa: 2c, 2e e 2f.
Moléculas análogas
sintetizadas
por Du e colaboradores
Figura 42: Comparação das estruturas 2c, 2e e 2f sintetizada por nosso grupo e as sintetizadas por Du et al.,
2000.
Esta comparação serve também para encorajar testes futuros de avaliação da atividade
diretamente na enzima TCC isolada, visto que os compostos 2e e 2f, mesmo tendo seus testes
anti-T.cruzi realizados frente a forma evolutiva epimastigosta, na qual a TCC encontra-se
localizada dentro de vesículas lisossomais, necessitando, portanto que haja uma penetração
dos compostos no parasito para uma melhor atividade, mostraram-se mais ativos.
No geral, as nitro-aril tiossemicarbazonas 2g, 2j e 2l exibiram uma baixa atividade,
possuindo uma IC50 igual a 29,90 µg/ml; 36,52 µg/ml e 9,6 µg/ml, respectivamente, sendo os
dois primeiros valores os mais baixos da série. O composto 2j é um análogo do composto 2f
onde, a única diferença entre eles é a presença, no primeiro, de um substituinte fenil no grupo
amino da função tioamida terminal. A presença desse grupo volumoso nessa posição resultou
numa diminuição de cerca de doze vezes na atividade anti-T.cruzi. Pode-se dizer que o
resultado obtido por este composto está de acordo com relatos presentes na literatura, como
Dyego Revorêdo de Carvalho Silva
102
por exemplo, o trabalho realizado por Pérez-Rebolledo et al. (2008), onde testaram-se três
TSCs variando-se os substituintes na posição em questão e, o derivado que obteve menor
atividade foi o que possuía como substituinte um grupo piperidil
124
. Em 2004, Greenbaum e
colaboradores também mostraram a influência negativa dessa substituição, onde os compostos
que a sofreram tiveram uma queda na atividade na magnitude de duas ordens (de 0,06 μM a
20 μM), quando comparados ao seu melhor composto 119.
Por outro lado, ao se comparar as bis-tiossemicarbazonas 2g e 2l, cuja única diferença
também é a mesma anteriormente citada, notou-se uma melhora na atividade, contradizendo o
que se encontra descrito acima. Alguns dados na literatura mostram que compostos
volumosos, como o itraconazol, cetoconazol e posoconazol, mesmo sem possuírem
semelhança estrutural, exibem certa atividade frente a T. cruzi, sendo este último o de maior
massa molecular e mais potente que os demais na inibição da forma evolutiva epimastigota
125,126
. Extrapolando-se esses dados, pode-se pensar que, aumentando-se a massa molecular de
alguns derivados, outros alvos biológicos possam ser ocupados, principalmente quando
grupos volumosos estão presentes na molécula, visto que a molécula que contém os dois
grupos fenil como substituinte em N-4, mostrou-se mais ativa.
A terapia atual da doença de chagas encontra na incidência dos efeitos colaterais um
dos principais obstáculos para ser considerada ideal. Estes, como descrito na literatura, têm
sido atribuídos ao efeito citotóxico inerente ao grupo nitro presente nas drogas disponíveis no
tratamento anti- T.cruzi, sendo, portanto, os nitrocompostos como o benznidazol e nifurtimox,
alvos de inúmeras discussões visando o esclarecimento de sua toxicidade
123
. Neste contexto,
no intuito de se obter uma nova droga na terapêutica da Doença de chagas, a avaliação da
citotoxicidade é de suma importância para considerá-la um protótipo no tratamento antiT.cruzi.
Neste trabalho, a avaliação da citotoxicidade dos compostos 2a-2l foi realizada frente
a células esplênicas conforme metodologia anteriormente descrita. Os resultados foram
obtidos em μg/mL, que representa a maior concentração atóxica testada. A tabela dos
compostos e seus respectivos valores encontram-se expostos abaixo.
Dyego Revorêdo de Carvalho Silva
103
Tabela 7: Citotoxicidade dos derivados nitro-aril tiossemicarbazônicos.
a
Composto
Citotoxicidade
s
(µg/ml)a
2a
>100
2b
10
2c
>100
2d
25
2e
1
2f
10
2g
5
2h
25
2i
1
2j
50
2l
<1
BDZ
25
NFX
1
= maior concentração atóxica em células esplênicas de camundongos BALB/c;
Analisando os
dados
da tabela acima,
nota-se que das
onze nitro-aril
tiossemicarbazonas sintetizadas e testadas, cinco (2a, 2c, 2d, 2h e 2j) mostraram menor ou
igual citotoxicidade em relação a droga menos tóxica utilizada no tratamento da Doença de
chagas, o Bdz. Alguns relatos na literatura corroboram com o fato de alguns nitrocompostos
possuírem baixa citotoxicidade, como o trabalho publicado por Pérez-Rebolledo et al.(2008),
o qual avaliou a citotoxicidade em macrófagos humanos de três derivados nitrotiossemicarbazônicos
124
. Destes, dois mostraram-se menos tóxicos que as drogas Bdz e Nfx
utilizadas como padrão.
Os compostos menos tóxicos da série foram os derivados 2a e 2c. Em outro projeto
desenvolvido em nosso laboratório, sintetizamos e avaliamos a citotoxicidade, utilizando a
mesma metodologia de diversos derivados arilsemicarbazônicos. Dentre estes, dois análogos
dos compostos 2a e 2c, desprovidos do grupamento nitro, obtiveram valores de citotoxicidade
> 100 µg/ml, mostrando que para essas duas estruturas a presença do grupo nitro parece não
Dyego Revorêdo de Carvalho Silva
104
interferir tanto nas suas propriedades tóxicas.
Comparando-se os resultados dos compostos 2f e 2j, percebe-se que houve uma
diminuição da citotoxicidade em cinco vezes do composto 2f, passando de 10 µg/ml para 50
µg/ml, mostrando que a estratégia de inserção do grupo fenil no grupo amino da função
tioamida terminal embora não tenha melhorado a atividade, foi útil nesse aspecto. Por outro
lado, para os compostos 2g e 2l, essa mesma estratégia de modificação molecular causou uma
aumento de mais cinco vezes no poder tóxico do composto 2g, passando de uma concentração
atóxica de 5 µg/ml para uma menor que 1 µg/ml. Este último dado corrobora com o trabalho
realizado por Greenbaum et al (2004), onde mostra-se que a inserção de alguns grupos
volumosos, seja em N-4, seja no anel aromático das tiossemicarbazonas aumentam
significativamente a citotoxicidade
119
. Por fim, pode-se então dizer que nossos dados estão
em concordância com o trabalho publicado por Paula e colaboradores (2009), onde é dito que
a toxicidade dos nitrocompostos é dependente de fatores como a estrutura química e a posição
do grupo nitro, sendo a primeira mais importante para nossa discussão 123.
Os compostos 2e, 2i e 2l mostraram-se os mais tóxicos da série analisada, sendo este
último mais tóxico que o Nfx, droga mais tóxica para o tratamento da Doença de chagas. Este
fator pode estar relacionado à sua estrutura, como já comentado anteriormente. O composto
2e, considerado mais ativo da nossa série frente a formas epimastigotas do T. Cruzi,
apresentou-se com uma citotixicidade de 1 µg/ml, a mesma do Nfx. Esse valor parece está de
acordo com o trabalho de Du et al. (2002), onde um isômero de posição do composto 2e, cujo
substituinte bromo encontra-se na posição meta em relação a função azometínica, também
mostrou-se um dos mais citotóxicos da sua série.
Analisando os valores da tabela para os compostos 2h (derivado nitrofurânico) e 2i
(derivado nitro-tiofênico), nota-se que o último apresentou uma citotoxicidade 25 vezes
menor que a do primeiro. Esses dados corroboram com o trabalho de Gerpe et al. (2009),
onde analisou-se a citotoxicidade de algumas tiossemicarbazonas, tendo duas destas a mesma
diferença apresentadas pelos compostos 2h e 2i. Nesse estudo, o derivado nitrofurânico
obteve ID50 = 200 µM, e seu análogo ID50 <100 µM 122.
Analisado de forma conjunta os valores obtidos de IC50 e citotoxicidade (Tabela 8)
dos compostos sintetizados, que reflete o risco-benefício no tratamento da doença de Chagas,
podemos considerar que os resultados obtidos para o derivado nitro-ariltiossemicarbazônico
2h, o qual apresentou IC50=1.42 μM/ e citotoxicidade= 25 µg/ml, foram os mais promissores
da série, visto que se mostrou mais ativo e com mesmo poder citotóxico da droga de
Dyego Revorêdo de Carvalho Silva
105
referência, encorajando-nos a dar continuidade a este projeto. Os compostos 2a, 2c e 2j,
embora tenham se mostrado pouco tóxicos, apresentaram IC50 muito baixa em relação ao Bdz,
sendo necessário testar algumas modificações moleculares para melhoria da atividade. Os
compostos 2e e 2i., os mais ativos da série, mostraram-se também como os mais tóxicos,
sendo portanto sempre necessário avaliar essas duas características para eleição de um
possível protótipo a fármaco anti- T. Cruzi.
Tabela 8: Relação IC50 X Citotoxicidade
Comp.
IC50 epimastigotas Citotoxicidade
(µg/ml)
(µg/ml)
2a
15.87
>100
2b
28.63
10
2c
16.39
>100
2d
5.12
25
2e
1.06
1
2f
2.06
10
2g
29.90
5
2h
1.42
25
2i
1.12
1
2j
36.25
50
2l
9,6
<1
BDZ
1.73
25
Dyego Revorêdo de Carvalho Silva
106
Capítulo IV
CONCLUSÕES E PERPESCTIVAS
Dyego Revorêdo de Carvalho Silva
107
VI- 1. CONCLUSÕES
Os compostos em estudo foram obtidos partindo-se de metodologia simples,
econômica, rápida, e apresentando rendimentos que variaram de 68-85%. A
confirmação estrutural deu-se através da análise de dados espectroscópicos de IV,
RMN 1H e RMN
13
C. Nesse trabalho não foi possível determinar a configuração
absoluta das nitro-ariltiossemicarbazonas.
Quanto à atividade antibacteriana desses deriavados, os compostos 2c,2h e 2i
obtiveram os melhores resultados, merecendo maior destaque o composto 2h, que
mostrou-se mais ativo que a droga controle utilizada.
As nitro-ariltiossemicarbazonas também foram avaliadas frente a atividade anti-T.cruzi
contra a forma evolutiva epimastigota, sendo os compostos 2e, 2h e 2i os que
apresentaram melhores resultados. Dentre estes, o composto 2e apresentou relevância,
mostrando-se cerca de 40% mais ativo que o Bdz.
No ensaio de citotoxicidade frente a células esplênicas de camundongo, todos os
compostos mostraram maior concentração atóxica igual ou inferior ao Bdz (25µg/ml),
excetuando-se os compostos 2a, 2c e 2j, com valores de maior concentração atóxica
igual ou superior a 50µg/ml.
Levando em conta o risco-benefício no tratamento da doença de Chagas, que é
representado pela relação citotoxidade X atividade anti-T. cruzi, podemos considerar
que os resultados obtidos para o derivado nitro-ariltiossemicarbazônico 2h, o qual
apresentou IC50=1.42 μM/ ml e citotoxicidade= 25 µg/ml, foram os mais promissores
da série, visto que se mostrou mais ativo e com mesmo poder citotóxico da droga de
referência, encorajando-nos a dar continuidade a este projeto.
Dyego Revorêdo de Carvalho Silva
108
IV- 2. PERPESCTIVAS
Realizar estudos de ―docking‖ com os compostos sintetizados
Realizar testes de avaliação da atividade frente às formas evolutivas tripomastigota e
amastigota do T. cruzi, assim como frente a enzima recombinante TCC.
Sintetizar um número maior de moléculas para realizar estudos de QSAR relativas as
atividades biológicas expostas neste trabalho.
Ciclização,
complexação
com
metais
e
alquilação
dos
derivados
nitro-
ariltiossemicarbazônicos obtidos, com posterior avalização de suas atividades.
Dyego Revorêdo de Carvalho Silva
109
Capítulo V
PARTE EXPERIMENTAL
Dyego Revorêdo de Carvalho Silva
110
V- 1. PARTE EXPERIMENTAL
V- 1.1 Materiais e Métodos
V- 1.1.1 Cromatografias
As cromatografias em camada delgada (CCD) foram conduzidas em placas de Sílica
Gel 60 F254 da MERCK de 0,25 mm de espessura. A leitura das mesmas foi realizada através
de radiação de ultravioleta (UV) no comprimento de onda (λ) de 254 nm.
V- 1.1.2 Pontos de Fusão
Os pontos de fusão foram medidos no equipamento QUILMES Q.340.23, em tubos
capilares imersos em banho de silicone.
V- 1.1.3 Espectroscopias de IV, RMN 1H e RMN 13C
Os espectros de IV moram obtidos em espectrofotômetro BRUKER IFS-66, em discos
de KBr. Os espectros de RMN 1H foram obtidos em um equipamento UNITYplus-300 MHzVARIAN, utilizando-se DMSO-d6 como solvente. Os deslocamentos químicos (d) foram
reportados em ppm, utilizando tetrametilsilano como referência interna. As constantes de
acoplamento foram indicadas em Hz, e as multiplicidades dos sinais foram designadas da
seguinte forma: s – singleto, d – dubleto, dd – duplo dubleto, t – tripleto, m – multipleto.
V- 1.1.4 Equipamentos
Bomba de vácuo TECNAL TE
058
Placas de agitação e aquecimento FISOTON
752A
Estufa;
Vidraria geral;
Evaporador rotativo;
Capela com exaustão;
Dyego Revorêdo de Carvalho Silva
111
Balança analítica BEL 220;
Freezer;
Balança semi-analítica BEL
Espátulas e pinças metálicas
Marc 500 C
Espectrofotômetro (Biorad
3550)
V- 1.1.5 Reagentes e solventes
Tiossemicarbazida
N(4)-fenil tiossemicarbazida
Aril-aldeídos substituídos.
Ácido Clorídrico conc.
Ácido Sulfúrico conc.
Ácido Nítrico
Ácido acético glacial
Etanol e Metanol
Saponina
Dimetil-formamida (DMF)
Hexano
Acetato de etila
Água destilada
Meio de cultura Muller-Hinton
Amoxicilina
Timidina Tritiada
Isopropanol
Duodecil sulfato de sódio
Dimetil-sulfóxido (DMSO)
Soro Bovino Fetal
V- 1.2 Procedimentos Experimentais
V- 1.2.1 Síntese e Caracterização estrutural
V- 1.2.1.1 Composto 2a: 3-nitro-4-hidroxibenzaldeído tiossemicarbazona
Dyego Revorêdo de Carvalho Silva
112
Em um balão de fundo redondo com capacidade para 100mL, em banho de gelo,
adicionou-se 20 mL de clorofórmio (CHCl3). Em seguida acrescentou-se 5 mmol (0,61g) do
reagente 4-hidroxibenzaldeído, adquirido comercialmente. A esta mistura, quantidade
equimolar de ácido Nítrico (0,32g) foi adicionada, deixando-se sob agitação e banho de gelo
por uma hora. Após esse tempo, retirou-se o banho e esperou-se o fim da reação, que
aconteceu cinco horas mais tarde. Ao término da reação, realizaram-se três extrações, sendo a
primeira apenas com água (30mL), e as demais com Acetato de etila/ água. Em seguida a fase
orgânica foi evaporada para obtenção do produto na forma de cristais amarelos, os quais
foram levados ao dessecador por 24 horas para retirada completa de qualquer resquício de
solvente.
Os cristais formados foram pesados e utilizados para a condensação. Nesta etapa, a
solução etanólica da tiossemicarbazida, adicionou-se 5 gotas do catalisador ácido clorídrico
(HCl), deixando-se sob agitação magnética e temperatura ambiente por 15 minutos. Após esse
tempo acrescentou-se então quantidades equimolares do 3-nitro-4-hidroxibenzaldeído,
previamente sintetizado. A reação foi mantida à temperatura ambiente e constante agitação
magnética por um período de cinco horas, de modo que foi monitorada por CCD. Ao término
da reação, adicionou-se água destilada (20 mL) e foi observada a formação de precipitado, o
qual foi filtrado em funil sinterizado e lavado com água.
V- 1.2.1.1.1 Caracterização
F.M: C8H8N4O3S
P.M: 240,23g/mol
Sólido amarelo escuro; Rendimento: 74%; Rf: 0,5 (Acetona/Cicloexano 5:5); P.F:
241-243 ºC.
Dyego Revorêdo de Carvalho Silva
113
RMN 1H (300 MHz, ppm, DMSO-d6): 11.40 (s, 1H, NH); 8.26 (s, 1H, Ar-H);
8.16 (s, 1H, NH2); 8.07 (s, 1H, NH2); 7.98 (s, 1H, CH=N), 7.93 (d, J = 8.10
Hz, 1H, Ar-H); 7.06 (d, J = 8,10 Hz, 1H, Ar); 3.48 (s, 1H, OH).
IV (ν cm-1 KBr): 3244 e 3393 (NH2), 3150 (NH
hidrazínico),
1530 (C=N), 1281(NO2),
1165 (C=S).
V- 1.2.1.2 Composto 2b (3-nitro-4-dimetil-aminobenzaldeído tiossemicarbazona)
Em um balão de fundo redondo com capacidade para 100mL, em banho de gelo,
adicionou-se 20 mL de clorofórmio (CHCl3). Em seguida acrescentou-se 5 mmol (0,74g) do
reagente 4-dimetilaminobenzaldeído, adquirido comercialmente. A esta mistura, quantidade
equimolar de ácido Nítrico (0,32g) foi adicionada, deixando-se sob agitação e banho de gelo
por uma hora. Após esse tempo, retirou-se o banho e esperou-se o fim da reação, que
aconteceu 4,5 horas mais tarde. Ao término da reação, realizaram-se três extrações, sendo a
primeira apenas com água (30mL), e as demais com Acetato de etila/ água. Em seguida a fase
orgânica foi evaporada para obtenção do produto na forma de cristais laranja-escuro, os quais
foram levados ao dessecador por 24 horas para retirada completa de qualquer resquício de
solvente.
Os cristais formados foram pesados e utilizados para a condensação. Nesta etapa, a
solução etanólica da tiossemicarbazida, em quantidade equimolar ao aldeído, adicionou-se 5
gotas do catalisador ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura
ambiente por 20 minutos. Após esse tempo acrescentou-se então o 3-nitro-4-dimetilaminobenzaldeído, previamente sintetizado. A reação foi mantida à temperatura ambiente e
Dyego Revorêdo de Carvalho Silva
114
constante agitação magnética por um período de três horas, de modo que foi monitorada por
CCD. Ao término da reação, adicionou-se água destilada (20 mL) e foi observada a formação
de precipitado, o qual foi filtrado em funil sinterizado e lavado com água. Foi necessário após
alguns dias do produto armazenado na geladeira, realizar uma recristalização em EtOH.
V- 1.2.1.2.1 Caracterização
Fórmula Molecular: C10H13N5O2S
Peso Molecular: 267,22g/mol
Sólido laranja; Rendimento: 73%; Rf: 0,4 (Cicloexano/Acetona 6:4); P.F: 218-220ºC.
RMN 1H (300 MHz, ppm, DMSO-d6): δ 11,35 (s, 1H, NH); δ 8,14 (s, 1H, NH2); δ
8,12 (s,1H, Ar-H); δ 8,04 (s, 1H, NH2); δ 7,96 (s, 1H, CH=N); δ 7,88 (d, J= 8 Hz, 1H,
Ar-H); δ 7,13 (d, J= 8 Hz, 1H, Ar-H); 2,86 [s, 6H, N(CH3)2].
RMN
13
C (100 MHz, ppm, DMSO-d6): δ 177,63 (C=S); δ 145,83 (Cq Ar); δ 140,62
(CH=N); δ 137,88 (Cq Ar); δ 131,52 ( CH Ar); δ 125,08 (CH Ar); δ 123,29 ( Cq Ar); δ
118,02 (CH Ar); δ 41,83 (CH3-N)
IV (ν cm-1 KBr): 3236 e 3399 (NH2), 3154 (NH hidrazínico), 1526 (C=N), 1372 (NO2),
1203 (C=S).
V- 1.2.1.3 Composto 2c (3-metoxi-4 hidroxi-5-nitro-benzaldeído tiossemicarbazona)
Em um balão de fundo redondo com capacidade para 100mL, em banho de gelo,
adicionou-se 20 mL de clorofórmio (CHCl3). Em seguida acrescentou-se 5 mmol (0,76g) do
reagente 3-metoxi-4 hidroxibenzaldeído, adquirido comercialmente. A esta mistura,
Dyego Revorêdo de Carvalho Silva
115
quantidade equimolar de ácido Nítrico (0,32g) foi adicionada, deixando-se sob agitação e
banho de gelo por uma hora. Após esse tempo, retirou-se o banho e esperou-se o fim da
reação, que aconteceu duas horas mais tarde. Ao término da reação, realizaram-se quatro
extrações, sendo a primeira apenas com água (30mL), e as demais com Acetato de etila/ água.
Em seguida a fase orgânica foi evaporada para obtenção do produto na forma de cristais
laranja-claros, os quais foram levados ao dessecador por 24 horas para retirada completa de
qualquer resquício de solvente.
Os cristais formados foram pesados e utilizados para a condensação. Nesta etapa, a
solução etanólica da tiossemicarbazida, em quantidade equimolar ao aldeído, adicionou-se 5
gotas do catalisador ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura
ambiente por 15 minutos. Após esse tempo acrescentou-se então o 3-metoxi-4 hidroxi-5-nitrobenzaldeído tiossemicarbazona, previamente sintetizado. A reação foi mantida à temperatura
ambiente e constante agitação magnética por um período de três horas, de modo que foi
monitorada por CCD. Ao término da reação, adicionou-se água destilada (20 mL) e foi
observada a formação de precipitado, o qual foi filtrado em funil sinterizado e lavado com
água.
V- 1.2.1.3.1. Caracterização
F.M: C9H10N4O4S
P.M: 270,26g/mol
Sólido laranja-claro; Rendimento: 85%; Rf: 0,5 (Acetona/Cicloexano 5:5); P.F: 239241ºC.
RMN 1H (300 MHz, ppm, DMSO-d6): δ 11.48 (s, 1H, NH); δ 10.85 (s, 1H, OH); δ
8.27 (s, 1H, NH2); δ 8.20 (s, 1H, NH2); δ 7.97 (s, 1H, Ar); δ 7.75 (s, 1H, Ar); δ 7.75 (s,
1H, CH=N); δ 3.94 (s, 3H, O-CH3).
IV (ν cm-1 KBr): 3256 e 3437 (NH2), 3160 (NH hidrazínico), 1541 (C=N), 1321 (NO2),
1057 (C=S).
V- 1.2.1.4 Composto 2d: 3-nitro-4-tolualdeído tiossemicarbazona.
Dyego Revorêdo de Carvalho Silva
116
Em um balão de fundo redondo com capacidade para 100 mL, em banho de gelo,
adicionou-se 20 mL de clorofórmio (CHCl3). Em seguida acrescentou-se 5 mmol (0,60g) do
reagente 4-tolualdeído, adquirido comercialmente. A esta mistura, quantidade equimolar de
ácido Nítrico (0,32g) foi adicionada, deixando-se sob agitação e banho de gelo por uma hora.
Após esse tempo, retirou-se o banho e esperou-se o fim da reação, que aconteceu 6 horas mais
tarde. Ao término da reação, realizaram-se quatro extrações, sendo a primeira apenas com
água (30mL), e as demais com Acetato de etila/ água. Em seguida a fase orgânica foi
evaporada para obtenção do produto na forma de cristais amarelos claros, os quais foram
levados ao dessecador por 24 horas para retirada completa de qualquer resquício de solvente.
Os cristais formados foram pesados e utilizados para a condensação. Nesta etapa, a
solução etanólica da tiossemicarbazida, em quantidade equimolar ao aldeído, adicionou-se 5
gotas do catalisador ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura
ambiente por 15 minutos. Após esse tempo acrescentou-se então o 3-nitro-4-tolualdeído,
previamente sintetizado. A reação foi mantida à temperatura ambiente e constante agitação
magnética por um período de cinco horas, de modo que foi monitorada por CCD. Ao término
da reação, adicionou-se água destilada (20 mL) e foi observada a formação de precipitado, o
qual foi filtrado em funil sinterizado e lavado com água.
V- 1.2.1.4.1. Caracterização
F.M: C9H10N4O2S
P.M: 238,27g/mol
Sólido amarelo-claro; Rendimento: 68%; Rf: 0,48 (Cicloexano/Acetona 6:4); P.F:
226-228ºC.
Dyego Revorêdo de Carvalho Silva
117
RMN 1H (300 MHz, ppm, DMSO-d6): δ 11,545 (s, 1H, NH); δ 8,40 (d, J = 1,6 Hz, 1H,
Ar-H); δ 8,26 (s, 1H, NH2); δ 8,20 (s, 1H, NH2); δ 8,06 (s, 1H, CH=N); δ 8,01 (dd, J=
8 Hz e J = 1,6 Hz, 1H, Ar-H); δ 7,13 (d, J= 8 Hz, 1H, Ar-H) ; 2,49 (s, 3H, Ar-CH3).
IV (ν cm-1 KBr): 3238 e 3422 (NH2), 3158 (NH hidrazínico), 1518 (C=N), 1364 (NO2),
1107 (C=S).
V- 1.2.1.5 Composto 2e (3-nitro-4-bromobenzaldeído tiossemicarbazona).
Em um balão de fundo redondo com capacidade para 100mL, em banho de gelo,
adicionou-se 10 mL de H2SO4. Em seguida acrescentou-se 5 mmol (0,70g) do reagente 4bromobenzaldeído, adquirido comercialmente. Ao conteúdo do balão, adicionou-se
lentamente uma mistura de Ácido Nítrico concentrado e ácido sulfúrico em quantidades
equimolares (0,32g e 0,49 respectivamente) em relação ao aldeído, deixando-se sob agitação e
banho de gelo por uma hora. Após esse tempo, retirou-se o banho e esperou-se o fim da
reação, que aconteceu 4,5 horas mais tarde. Ao término da reação, verteu-se o conteúdo do
balão em um béquer com 50 mL de água destilada havendo precipitação do produto na forma
de cristais esbranquiçados. Estes foram filtrados em funil sinterizado e lavados com água
vária vezes, sendo por fim levado ao dessecador por um período de 24 horas para retirada
completa de qualquer resquício de solvente.
Os cristais formados foram pesados e utilizados para a condensação Nesta etapa, a
solução etanólica da tiossemicarbazida, em quantidade equimolar ao aldeído, adicionou-se 5
gotas do catalisador ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura
ambiente por 20 minutos. Após esse tempo acrescentou-se então o 3-nitro-4bromobenzaldeído, previamente sintetizado. A reação foi mantida à temperatura ambiente e
Dyego Revorêdo de Carvalho Silva
118
constante agitação magnética por um período de cinco horas, de modo que foi monitorada por
CCD. Ao término da reação, adicionou-se água destilada (20 mL) e foi observada a formação
de precipitado, o qual foi filtrado em funil sinterizado e lavado com água.
V- 1.2.1.5.1. Caracterização
F.M: C8H7BrN4O2S
P.M: 303,13g/mol
Sólido amarelo-claro; Rendimento: 83%; Rf: 0,63 (Cicloexano/Acetona 6:4); P.F:
238-240ºC.
RMN 1H (300 MHz, ppm, DMSO-d6): δ 11,65 (s, 1H, NH); δ 8,56 (s,1H, Ar-H); δ
8,34 (s, 1H, NH2); δ 8,28 (s, 1H, NH2); δ 8,04 (s, 1H, CH=N); δ 7,93 (d, J= 8 Hz, 1H,
Ar-H); δ 7,91 (d, J= 8 Hz, 1H, Ar-H).
RMN
13
C (100 MHz, ppm, DMSO-d6): δ 178,40( C=S); δ 150,49 (Cq Ar); 138,53
(CH=N); 135,63 (Cq Ar); 134,68 ( CH Ar); 131,96 (CH Ar); 122,43 (CH Ar); 112,924
( Cq Ar).
IV (ν cm-1 KBr): 3417 e 3258 (NH2), 3156 (NH hidrazínico), 1519 (C=N), 1360 (NO2),
1091 (C=S).
V- 1.2.1.6 Composto 2f (3-nitro-4-clorobenzaldeído tiossemicarbazona).
Em um balão de fundo redondo com capacidade para 100 mL, em banho de gelo,
adicionou-se 10 mL de H2SO4. Em seguida acrescentou-se 5 mmol (0,92g) do reagente 4clorobenzaldeído, adquirido comercialmente. Ao conteúdo do balão, adicionou-se lentamente
uma mistura de Ácido Nítrico concentrado e ácido sulfúrico em quantidades equimolares
(0,32g e 0,49 respectivamente) em relação ao aldeído, deixando-se sob agitação e banho de
Dyego Revorêdo de Carvalho Silva
119
gelo por uma hora. Após esse tempo, retirou-se o banho e esperou-se o fim da reação, que
aconteceu três horas mais tarde. Ao término da reação, verteu-se o conteúdo do balão em um
béquer com 50 mL de água destilada havendo precipitação do produto na forma de cristais
amarelos claros. Estes foram filtrados em funil sinterizado e lavados com água vária vezes,
sendo por fim levado ao dessecador por um período de 24 horas para retirada completa de
qualquer resquício de solvente.
Os cristais formados foram pesados e utilizados para a condensação Nesta etapa, a
solução etanólica da tiossemicarbazida, em quantidade equimolar ao aldeído, adicionou-se 5
gotas do catalisador ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura
ambiente por 20 minutos. Após esse tempo acrescentou-se então o 3-nitro-4-clorobenzaldeído,
previamente sintetizado. A reação foi mantida à temperatura ambiente e constante agitação
magnética por um período de quatro horas, de modo que foi monitorada por cromatografia em
camada delgada (CCD). Ao término da reação, adicionou-se água destilada (20 mL) e foi
observada a formação de precipitado, o qual foi filtrado em funil sinterizado e lavado com
água.
V- 1.2.1.6.1. Caracterização
F.M: C8H7ClN4O2S
P.M: 258,69g/mol
Sólido amarelo-claro; Rendimento: 67%; Rf: 0,69 (Cicloexano/Acetona 6:4); Ponto de
Fusão (P.F): 236-237ºC.
RMN 1H (300 MHz, ppm, DMSO-d6): δ 11,65 (s, 1H, NH); δ 8,60 (d, J = 1,6 Hz, 1H,
Ar-H); δ 8,34 (s, 1H, NH2); δ 8,26 (s, 1H, NH2); δ 8,05 (s, 1H, CH=N); δ 8,04 (dd, J=
8,4 Hz e J = 1,6 Hz, 1H, Ar-H); δ 7,7 (d, J= 8,4 Hz, 1H, Ar-H).
IV (ν cm-1 KBr): 3366 e 3500 (NH2), 3156 (NH hidrazínico), 1519 (C=N), 1351 (NO2),
1105 (C=S).
V- 1.2.1.7 Composto 2g: 5-nitro- isoftaldeído tiossemicarbazona
Dyego Revorêdo de Carvalho Silva
120
Em um balão de fundo redondo com capacidade para 100mL adicionou-se 10 mL de
H2SO4. Em seguida acrescentou-se 5 mmol (0,67g) do reagente 1,3-isoftaldeído, adquirido
comercialmente. Ao conteúdo do balão, adicionou-se lentamente uma mistura de Ácido
Nítrico concentrado e ácido sulfúrico em quantidades equimolares (0,32g e 0,49
respectivamente) em relação ao aldeído, deixando-se sob agitação e esperou-se o fim da
reação, que aconteceu sete horas mais tarde. Ao término da reação, verteu-se o conteúdo do
balão em um béquer com 50 mL de água destilada havendo precipitação do produto na forma
de cristais amarelo-palha. Estes foram filtrados em funil sinterizado e lavados com água vária
vezes, sendo por fim levado ao dessecador por um período de 24 horas para retirada completa
de qualquer resquício de solvente.
Os cristais formados foram pesados e utilizados para a condensação. Nesta etapa, a
uma solução etanólica de 2 equivalentes de tiossemicarbazida, em relação aldeído, adicionouse 5 gotas do catalisador ácido clorídrico (HCl), deixando-se sob agitação magnética e
temperatura ambiente por 20 minutos. Após esse tempo acrescentou-se o 5-nitro- isoftaldeído,
previamente sintetizado. A reação foi mantida à temperatura ambiente e constante agitação
magnética por um período de cinco horas, de modo que foi monitorada por CCD. Ao término
da reação, adicionou-se água destilada (20 mL) e foi observada a formação de precipitado, o
qual foi filtrado em funil sinterizado e lavado com água.
V- 1.2.1.7.1 Caracterização
F.M.: C10H11N7O2S2
P.M.: 325,37g/mol
Sólido amarelo-claro; Rendimento: 65%; Rf: 0,39 (Cicloexano/Acetona 6:4); P.F:
256-258ºC.
Dyego Revorêdo de Carvalho Silva
121
RMN 1H (300 MHz, ppm, DMSO-d6): 11.69 (s, 2H, NH); 8.62 (s, 2H, Ar-H); 8.58
(s, 1H, Ar-H); 8.35 (s, 4H, NH2); 8.15 (s, 2H, CH=N).
IV (ν cm-1 KBr): 3246 e 3423 (NH2), 3155 (NH hidrazínico), 1524 (C=N), 1343 (NO2),
1105 (C=S).
V- 1.2.1.8 Composto 2h: 5-nitro-2-furaldeído tiossemicarbazona.
Em um balão de fundo redondo com capacidade para 100mL, em banho de gelo,
adicionou-se 10 mL de H2SO4. Em seguida acrescentou-se 5 mmol (0,48g) do reagente 2furaldeído, adquirido comercialmente. Ao conteúdo do balão, adicionou-se lentamente uma
mistura de Ácido Nítrico concentrado e ácido sulfúrico em quantidades equimolares (0,32g e
0,49 respectivamente) em relação ao aldeído, deixando-se sob agitação e banho de gelo por
uma hora. Após esse tempo, retirou-se o banho e esperou-se o fim da reação, que aconteceu
três horas mais tarde. Ao término da reação, verteu-se o conteúdo do balão em um béquer com
50 mL de água destilada havendo precipitação do produto na forma de cristais amarelos. Estes
foram filtrados em funil sinterizado e lavados com água vária vezes, sendo por fim levado ao
dessecador por um período de 24 horas para retirada completa de qualquer resquício de
solvente.
Os cristais formados foram pesados e utilizados para a condensação Nesta etapa, a
solução etanólica da tiossemicarbazida, em quantidade equimolar ao aldeído, adicionou-se 5
gotas do catalisador ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura
ambiente por 20 minutos. Após esse tempo acrescentou-se então o 5-nitro-2furfurilcarboxaldeído, previamente sintetizado. A reação foi mantida à temperatura ambiente e
constante agitação magnética por um período de 3 horas, de modo que foi monitorada por
CCD. Ao término da reação, adicionou-se água destilada (20 mL) e foi observada a formação
de precipitado, o qual foi filtrado em funil sinterizado e lavado com água.
Dyego Revorêdo de Carvalho Silva
122
V- 1.2.1.8.1. Caracterização
Fórmula Molecular: C6H6N4O3S
Peso Molecular: 214,24g/mol
Sólido amarelo-claro; Rendimento: 81%; Rf: 0,58 (Acetona/Cicloexano 6:4); Ponto de
Fusão (P.F): 234-235ºC.
RMN 1H (300 MHz, ppm, DMSO-d6): δ 11,86 (s, 1H, NH); δ 8,55 (s, 1H, NH2); δ
8,06 (s, 1H, NH2); δ 7,96 (s, 1H, CH=N); δ 7,96 (d, J = 3,9 Hz, 1H, Ar-H); δ 7,36 (d, J
= 3,9 Hz, 1H, Ar-H).
RMN
13
C (100 MHz, ppm, DMSO-d6): δ 178,37 (C=S); δ 152,58 (Cq Ar); δ 151,55
(Cq Ar); δ 129,97 (CH=N); δ 115,02 ( CH Ar); δ 113,08 (CH Ar).
IV (ν cm-1 KBr): 3301 e 3462 (NH2), 3086 (NH hidrazínico), 1537 (C=N), 1355 (NO2),
1057 (C=S).
V- 1.2.1.9 Composto 2i: 4-nitro-2-tiofenocarboxaldeído tiossemicarbazona.
Em um balão de fundo redondo com capacidade para 100mL, em banho de gelo,
adicionou-se 10 mL de H2SO4. Em seguida acrescentou-se 5 mmol (0,56g) do reagente 2tiofenocarboxaldeído, adquirido comercialmente. Ao conteúdo do balão, adicionou-se
lentamente uma mistura de Ácido Nítrico concentrado e ácido sulfúrico em quantidades
equimolares (0,32g e 0,49 respectivamente) em relação ao aldeído, deixando-se sob agitação e
banho de gelo por uma hora. Após esse tempo, retirou-se o banho e esperou-se o fim da
reação, que aconteceu 4,5 horas mais tarde. Ao término da reação, verteu-se o conteúdo do
balão em um béquer com 50 mL de água destilada havendo precipitação do produto na forma
Dyego Revorêdo de Carvalho Silva
123
de cristais amarelos. Estes foram filtrados em funil sinterizado e lavados com água vária
vezes, sendo por fim levado ao dessecador por um período de 24 horas para retirada completa
de qualquer resquício de solvente.
Os cristais formados foram pesados e utilizados para a condensação Nesta etapa, a
solução etanólica da tiossemicarbazida, em quantidade equimolar ao aldeído, adicionou-se 5
gotas do catalisador ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura
ambiente por 20 minutos. Após esse tempo acrescentou-se então o 5-nitro-2tiofenocarboxaldeído, previamente sintetizado. A reação foi mantida à temperatura ambiente e
constante agitação magnética por um período de 3 horas, de modo que foi monitorada por
CCD. Ao término da reação, adicionou-se água destilada (20 mL) e foi observada a formação
de precipitado, o qual foi filtrado em funil sinterizado e lavado com água.
V- 1.2.1.9.1. Caracterização
F.M.: C6H6N4O2S2
P. M.: 230,17g/mol
Sólido amarelo; Rendimento: 76%; Rf: 0,44 (Cicloexano/Acetona 6:4); P.F: 249251ºC.
RMN 1H (300 MHz, ppm, DMSO-d6): δ 11,79 (s, 1H, NH); δ 8,42 (s, 1H, NH2); δ
8,18 (s, 1H, CH=N); δ 8,05 (s, 1H, Ar-H); δ 8,00 (s, 1H, NH2); δ 7,51 (s, 1H, Ar-H).
RMN
13
C (100 MHz, ppm, DMSO-d6): δ 178,19 (C=S); δ 150,71 (Cq Ar); δ 146,68
(Cq Ar); δ 135,23 (CH=N); δ 130,34 ( CH Ar); δ 129,11 (CH Ar);
IV (ν cm-1 KBr): 3314 e 3472 (NH2), 3158 (NH hidrazínico), 1543 (C=N), 1335 (NO2),
1103 (C=S).
V- 1.2.1.10 Composto 2j: 3-nitro-4-clorobenzaldeído N(4)-fenil-tiossemicarbazona.
Dyego Revorêdo de Carvalho Silva
124
A solução etanólica da tiossemicarbazida, em quantidade equimolar ao previamente
nitrado conforme procedimento descrito no item V- 2.1.6, adicionou-se 5 gotas do catalisador
ácido clorídrico (HCl), deixando-se sob agitação magnética e temperatura ambiente por 20
minutos. Após esse tempo acrescentou-se então o 3-nitro-4-clorobenzaldeído, previamente
sintetizado. A reação foi mantida à temperatura ambiente e constante agitação magnética por
um período de 5 horas, de modo que foi monitorada por CCD. Ao término da reação,
adicionou-se água destilada (20 mL) e foi observada a formação de precipitado, o qual foi
filtrado em funil sinterizado e lavado com água.
V- 1.2.1.10.1 Caracterização
F.M.: C14H11ClN4O2S
P. M.: 334,78 g/mol
Sólido amarelo-claro; Rendimento: 70%; Rf: 0,55 (Cicloexano/Acetona 7:3); P.F:
215-216ºC.
RMN 1H (300 MHz, ppm, DMSO-d6): δ 12,04 (s, 1H, NH); δ 10,275 (s, 1H, NH); δ
8,67 (s, 1H, Ar-H); δ 8,17 (s, 1H, CH=N); δ 8,15 (d, J= 8,8 Hz, 1H, Ar-H); δ 7,81 (d,
J= 8,8 Hz, 1H, Ar-H); δ 7,50 (d, J= 7,6 Hz, 2H, Ar-H); δ 7,39 (dd, J= 7,2 Hz e J = 7,6
Hz, 2H, Ar-H); δ 7,50 (t, J= 7,2 Hz, 1H, Ar-H).
IV (ν cm-1 KBr): 3255* (NH2), 3164 (NH hidrazínico), 1544 (C=N), 1332 (NO2), 1059
(C=S).
Dyego Revorêdo de Carvalho Silva
125
V- 1.2.2 Avaliação da Atividade Antibacteriana
V- 1.2.2.1 Metodologia
Os ensaios preliminares de atividade antibacteriana foram realizados em triplicata,
utilizando-se a metodologia de Difusão em Disco em meio sólido127. Soluções na
concentração de 10 mg/mL foram preparadas para cada molécula analisada. Discos de papel
foram impregnados com 30 μL das soluções recém-preparadas, resultando numa concentração
final de 300 μg/disco. Os mesmos foram depositados sobre placas de Petri contendo os meios
de cultura previamente semeados com os microrganismos testados, e inoculados a 37 ºC por
24-48 h. Discos previamente umedecidos com DMF foram utilizados como controle negativo.
Os resultados foram analisados através das médias aritméticas dos halos de inibição,
expressas em milímetros, sendo designadas como Zonas Médias de Inibição (ZMI).
Os compostos 2c e 2h, por apresentaram melhor ação em relação aos demais, foram
selecionados determinação das concentrações mínima inibitória (CMI) e mínima bactericida
(CMB), em meio líquido. O composto 2i não pôde ser testado, pois o mesmo precipitava em
vários meios de culturas testados, indicando que havia interação entre a molécula e
componentes do meio de cultura.
Para os ensaios em meio líquido, a partir da solução estoque (10 mg/mL) para cada
composto selecionado, diluições seriadas foram preparadas, obtendo-se concentrações que
variaram entre 500 e 7,8125 μg/mL para os derivados 2h e 2i, e entre 1000 e 15,625 μg/mL
para 2c. Estas concentrações foram adicionadas aos tubos teste contendo os meios de cultura,
e posteriormente as suspensões dos microrganismos foram inoculadas. Para o controle
positivo, foram preparados tubos contendo apenas o meio de cultura e a suspensão do microorganismo. Tubos contendo o meio de cultura, a suspensão do microrganismo e o solvente
DMF foram utilizados como controle negativo.
Os tubos foram incubados a 37ºC por 24-48 h, e, em seguida, examinados e
plaqueados para visualização ou não de crescimento. Os valores de CMI foram obtidos a
partir da maior concentração dos compostos onde não se observou crescimento, e os valores
de CMB, observados a partir do crescimento da diluição subseqüente, sempre plaqueando-os
para uma melhor visualização e confirmação.
Dyego Revorêdo de Carvalho Silva
126
V- 1.2.3 Avalização da atividade anti- T.cruzi.
V- 1.2.3.1 Metodologia
Para determinar o efeito anti-proliferativo para T. cruzi, formas epimastigotas (106/ml)
crescidos em culturas axênicas, na fase log de crescimento, serão colocadas em placas de 96
poços no volume de 100 ml, sob condições de cultura adequadas (26°C). Os testes serão
conduzidos tendo como controle o benzonidazol (50 mg/ml) e culturas de parasitos sem
tratamento. As substâncias serão avaliadas quanto a concentração inibidora de 50% do
crescimento dos parasitas (IC50%) onde formas epimastigotas da cepa Y de T. cruzi serão
cultivadas durante 24 horas, respectivamente, na presença de diferentes concentrações dos
compostos, procedendo-se em seguida a contagem de parasitas viáveis. O cálculo da IC50%
será determinada por meio de uma regressão linear simples utilizando o software Prisma 4
Graphpad.
V- 1.2.4 Obtenção de células esplênicas de camundongos isogênicos e Ensaio de
Citotoxicidade
V- 1.2.4.1 Metodologia
Células esplênicas foram obtidas de acordo com metodologia descrita na literatura117.
Após sacrifício do animal por asfixia em CO2, o baço de cada camundongo foi removido em
condições assépticas e, em fluxo vertical, macerado em placa de Petri contendo meio de
cultura RPMI. As suspensões celulares obtidas serão centrifugadas a 4ºC, durante 5 minutos.
Após descarte do sobrenadante, adiciona-se água destilada ao sedimento promovendo lise das
hemácias. Marca-se cinco minutos, coleta-se o sobrenadante e centrifuga-se novamente a 4ºC,
200 rpm por cinco minutos. O sedimento (contendo as células esplênicas) foi ressuspendido
em meio RPMI 1640 e uma alíquota de cada suspensão celular removida, diluída 1:10 em
azul de trypan e quantificada em câmara de Neubauer para se verificar as células viáveis.
Células esplênicas (6x105 células/poço) foram cultivadas em placas de 96 poços de
fundo plano, contendo meio de cultura RPMI com 10% de soro bovino fetal. Para o ensaio de
citotoxicidade, as células serão incubadas com os compostos em sete diferentes concentrações
Dyego Revorêdo de Carvalho Silva
127
(faixa de 200 a 0,1 µg/mL) e com 1 µM de timidina tritiada/poço durante 24 h em estufa de
CO2 a 37ºC. Em paralelo, foram feitos controles com células tratadas com saponina (0,05%),
com células tratadas com DMSO (0,05%), substâncias com reconhecida atividade tóxica e um
controle sem tratamento. Após 24 h de incubação, as células foram coletadas em papel de
fibra de vidro e, posteriormente, a captação de timidina tritiada será determinada através do
contador beta de cintilação. O percentual de citotoxicidade foi determinado comparando-se a
percentagem de incorporação de timidina tritiada nos poços com as drogas em relação aos
poços não tratados.
Dyego Revorêdo de Carvalho Silva
128
Referências Bibliográficas
1- DRUGS FOR NEGLECTED DISEASES INIATIATIVE. Situações da P&D. Disponivel em:
http://www.dndi.org.br/pt/sobre-a-dndi/modelo-administrativo/situacao-da-pad.html. Acesso em Maio,
2010.
2- RASSI, A.; TRANCHESI, J.; TRANCHESI, B. Doença de Chagas. In: VERONESI, R. Doenças
infecciosas e parasitárias. 8 ed. Rio de Janeiro: Guanabara Koogan, p.665, 667, 675, 678, 680, 1991.
3- TEIXEIRA, R. Amebicidas. Tricomonicidas. Giardicidas. Tripanosomicidas. Leishmanicidas. Em:
PENILDON, S. Farmacologia. 6ªed. Rio de Janeiro: Guanabara Koogan,. p.1146, 2002.
4- DÍAZ, E.G.T. DE.; CASTRO, J.A.; DE CAZZULO, F.B.M.; CAZZULO, J.J.; Experientia, v.44,
p.880. 1988.
5- COURA, J.R.; CASTRO, S.L. A Critical Review on Chagas Disease Chemotherapy. Mem. Inst.
Oswaldo Cruz, v.97, p.3-24, 2002.
6- DRUGS FOR NEGLECTED DISEASE INITIATIVE. DNDi Newsletter, n. 14, Nov, 2006.
7- TRAWICK, M.L.; CHEN, S.E.; ARISPE, M.; SILES, R.; ZHOU, M.; PINNEY, K.G. Inhibitors of
cruzipain and cathepsin L., Federation Amer Soc Exp Biol, v.20, p. A51-A51, 2006.
8- AUGUSTYNS, K.; AMSSOMS, K.; YAMANI, A.; RAJAN, P.K.;, HAEMERS, A. Trypanothione as a
target in the design of antitrypanosomal and antileishmanial agents. Curr Pharm Des, v.7, p.1171141. 2001.
9- DU, X.; GUO, C.; HANSELL, E.; DOYLE, P. S.; CAFFREY, C. R.; HOLLER, T. P.; MCKERROW,
J. H.; COHEN, F. E.Synthesis and structure-activity Relatioship Study of potent Trypanocidal Thio
semicarbazone inhibitors of the Trypanosomal Cysteine protease Cruzain
J. Med. Chem.,v.45,
p.2695–2707, 2002.
10- AGUIRRE, G.; CERECETTO, H.; GONZÁLEZ, M.; GAMBINO, D.; OTERO, L.; OLEA-AZAR, C.;
RIGOL, C.; DENICOLA., In vitro activity and mechanism of action against the protozoan parasite
Trypanosoma cruzi of 5-nitrofuryl containing thiosemicarbazones. Bioorg. Med. Chem., v. 12, n. 18,
p. 4885 – 4893, 2004.
Dyego Revorêdo de Carvalho Silva
129
11- STEVERDING, CAFFREY & SAJID. Cysteine proteinase inhibitors as therapy for parasitic diseases:
advances in inhibitor design. Mini-Rev. Med. Chem., v. 6, n. 9, p. 1025 – 1032, 2006.
12- REY, L. Parasitologia: Parasitos e doenças parasitárias do homem nas Américas e na África. 3ªed. Rio
de Janeiro: Guanabara Koogan, p.151- 171, 2001.
13- CERECETTO, H.; GONZÁLEZ, M. Anti-T. cruzi agents: our experience in the evaluation of more
than five hundred compounds. Mini Rev. Med. Chem. v.8, p. 1355-1383. 2008.
14- DIAS, L. C.; DESSOY, M.A.; SILVA, J.J. N.; THIEMANN, O. H.; OLIVA, G.; ANDRICOPULO,
A.D. Quimioterapia da doença de chagas: estado da arte e perspectivas no desenvolvimento de novos
fármacos. Quim. Nova. v. 32, p. 2444-2457, 2009.
15- KROPF, S.P. História da doença de Chagas: ciência, saúde e sociedade. Disponível em:
http://www.fiocruz.br/chagas/cgi/cgilua.exe/sys/start.htm?sid=171). Acesso em: Maio, 2010.
16- DIAS, J.C.P.; COURA, J. R. Epidemiologia. Em: DIAS, J.C.P., COURA, J. R. Clínica e terapêutica da
doença de Chagas. Uma abordagem prática para o clínico geral. Rio de janeiro: FIOCRUZ editora,
1997, p.33-66.
17- RASSI, A.; TRANCHESI, J.; TRANCHESI, B. Doença de Chagas. In: VERONESI, R. Doenças
infecciosas e parasitárias. 8 ed. Rio de Janeiro: Guanabara Koogan, p.665, 667, 675, 678, 680, 1991.
18- DIAS, J.C.P., VINHAES M.C. Doença de Chagas no Brasil. Caderno Saúde Pública, v.16, supl.2, p.
7-12, 2000.
19- CERECETTO, H.; GONZÁLEZ, M. Anti-T. cruzi agents: our experience in the evaluation of more
than five hundred compounds. Mini Rev. Med. Chem. v.8, p. 1355-1383. 2008.
20- HOTEZ, P.J.; BOTTAZZI, M.E.; FRANCO-PAREDES, C.; AULT, S.K.; PERIAGO, M.R. The
neglected tropical diseases of Latin America and the Caribbean: a review of disease burden and
distribution and a roadmap for control and elimination. PLoS. Negl. Trop. Dis. v.2, 2008.
21- LINDOSO, J.A.L.; LINDOSO, A.A.B.P. Neglected tropical diseases in Brazil. Rev. Inst. Med. trop.
v.51, n.5, p. 5247-253, São Paulo, 2009.
22- MSF- Informativo Médicos Sem Fronteiras, Ano 12, Nº24, 2009.
Dyego Revorêdo de Carvalho Silva
130
23- MINISTÉRIO DA SAÚDE. Guia de Vigilância Epidemiológica, 7ª. Edição, Brasília, 2009.
24- SCHMUNIS G.A. Epidemiology of Chagas disease in non-endemic countries: the role of international
migration. Mem. Inst. Oswaldo Cruz, v.102 Suppl. 1, p. 75–85, 2007.
25- DRUGS FOR NEGLECTED DISEASES INIATIATIVE, Research on neglected disease. Disponível
em http://www.treatchagas.org/cp_chagas_globalview.aspx. Acesso em Maio de 2010.
26- TARLETON, R.L.; REITHINGER, R.; URBINA, J.A.; KITRON, U.; GÜRTLER, R.E. The
Challenges of Chagas Disease— Grim Outlook or Glimmer of Hope?, PLoS. Med., v.4 n.12, 2007.
27- BERN, C.; MONTGOMERY S.P.; An Estimate of the Burden of Chagas Disease in the United States,
CID, v.49, p.52-54 ,2009.
28- MUNOZ J.; GOMEZ i PRAT, J.; GALLEGO, M.; GIMENO, F.; TREVINO, B. Clinical profile of
Trypanosoma cruzi infection in a non-endemic setting: immigration and Chagas disease in Barcelona
(Spain), Acta. Trop. v.111: 51–55, 2009.
29- MILEI, J.; GUERRI-GUTTENBERG, R.A.; GRANA, D.R.; STORINO, R. Prognostic impact of
Chagas disease in the United States. Am. Heart. J. v.157, p. 22–29, 2009.
30- JACKSON, Y.; MYERS, C.; DIANA, A.; MARTI, H.P.; WOLFF, H., et al., Congenital transmission
of chagas disease in latin american immigrants in Switzerland. Emerg. Infect. Dis. v.15, p.601–603,
2009.
31- CASTRO, E. Chagas disease: lessons from routine donation testing, Transfus. Med. v.19, p.16–23,
2009.
32- NEVES, D. P.; De Melo, A.L.; LINARD, P.M.; VITOR, R.W.A. Parasitologia Humana. 11ª. Edição,
Ed. São Paulo: Atheneu, 2005.
33- LEÃO, R.N.Q.; VALENTE, S.A.S.; NETO, H.F.; MILES, M.A. Doenças Infecciosas e Parasitárias:
Enfoque Amazônico, Instituto Evandro Chagas, Belém, 1997.
34- PRATA, A. Clinical and epidemiological aspects of Chagas Disease. Infect. Dis. v.1, p.92-100, 2001.
35- BRENER, Z.; CANÇADO, J.R. Terapêutica. In: BRENER, Z.; ANDRADE, Z. A. Trypanososma
Dyego Revorêdo de Carvalho Silva
131
cruzi e Doença de Chagas. Rio de Janeiro: Guanabara Koogan, 1979.
36- DIAS, J.C. Doença de Chagas: clínica e terapêutica. Ministério da Saúde Brasília-DF: SUCAM,
1990.
37- SOUZA, W. O parasita e sua interação com os hospesdeiros. In: BRENER, Z. et al. Trypanosoma
cruzi e doença de Chagas. Rio de Janeiro: Guanabara Koogan, 1999, p. 88-123.
38- CRISANTE, G.; ROJAS A.; TEIXEIRA, M.M.G.; AÑEZ, N. Infected dogs as a risk factor in the
transmission of human Trypanosoma cruzi infection in western Venezuela. Acta. Trop. v.98, p.247254, 2006.
39- SIGMAN, L.; SÁNCHEZ, V.M.; TURJANSKI, A.G. Characterization of the farnesyl pyrophosphate
synthase of Trypanosoma cruzi by homology modeling and molecular dynamics, J. Mol. Graph.
Model. v.25, p.345- 352, 2006.
40- DIAS, J.C.; SILVEIRA, A.C.; SCHOFIELD, C.J. The impact of Chagas disease control in Latin
America: a review, Mem Inst Oswaldo Cruz v.97, p.603–612, 2002.
41- DIAS, J.C. Southern Cone Initiative for the elimination of domestic populations of Triatoma infestans
and the interruption of transfusional Chagas disease. Historical aspects, present situation, and
perspectives. Mem Inst Oswaldo Cruz v.102 Supp.l 1, p.11–18, 2006.
42- LAMARTINE, J. S.; MEDEIROS, F.P.M.; LA ROCA.; SILVA, K.E.R.; LIMA, L.N.A.; ROLIM,
P.J.N. Delineamento de alternativas terapêuticas para o tratamento da doença de Chagas, Revista de
Patologia Tropical, Vol. 36, n.2, p.103-118, 2007.
43- SCHOFIELD, C.J.; JANNIN, J.; SALVATELLA, R. The future of chagas disease control. Trends
Parasitol. v.22, p.583- 588, 2006.
44- DAUBY, N.; ALONSO-VEGA, C.; SUAREZ, E.; FLORES, A.; HERMANN, E.; CÓRDOVA M.;
TELLEZ, T.; TORRICO, F.; TRUYENS, C.; CARLIER, Y. Maternal Infection with Trypanosoma
cruzi and Congenital Chagas Disease Induce a Trend to a Type 1 Polarization of Infant Immune
Responses to Vaccines, Neglected Tropical Diseases, v.3, n.12, 2009.
45- BUEKENS, P.; ALMENDARES, O.; CARLIER, Y.; DUMONTEIL, E.; EBERHARD, M. Mother-to-
Dyego Revorêdo de Carvalho Silva
132
child transmission of Chagas‘ disease in North America: why don‘t we do more? Matern Child
Health J., v.12, p.283–286.
46- PIRON, M.; VERGES, M.; MUNOZ, J.; CASAMITJANA, N.; SANZ, S. Seroprevalence of
Trypanosoma cruzi infection in at-risk blood donors in Catalonia (Spain). Transfusion, v.48, p.1862–
1868.
47- GONTIJO, E.D.; SANTOS, S.E. Mecanismos principais e atípicos de transmissão da doença de
Chagas. Disponível em http://www.fiocruz.br/chagas/cgi/cgilua.exe/sys/start.htm?sid=25. Acesso em
Junho de 2010.
48- ANVISA. Gerenciamento do Risco Sanitário na Transmissão de Doença de Chagas Aguda por
Alimentos. Agência Nacional de Vigilância Sanitária. Informe técnico, n. 35, 2008.
49- ALMEIDA-LEITE, C.M.; GALVÃO, L.M.C.; AFONSO, L.C.C.; CUNHA, F.Q.; ARANTES, R.M.E.
Interferon-γ induced nitric oxide mediates in vitro neuronal damage by Trypanosoma cruzi-infected
macrophages. Neurobiol. Dis. v. 25, p. 170-178, 2007.
50- CÁRDENAS, R.C.; GÓMEZ, F.E.; RODRÍGUEZ, A.M.; LÓPEZ, P.A.R.; VIERA, M.H.; LARIOS,
F.R. Active Transmission of Human Chagas Disease in Colima México. Mem. Inst. Oswaldo Cruz,
v.9, p.363-368, 2004.
51- RASSI, J.A.; MARIN-NETO, J.A. Cardiopatia chagásica crônica: estado da arte. Rev Soc Cardiol,
SãoPaulo, v.10, 2000.
52- BLACK, J.G. Microbiologia: fundamentos e perspectivas. 4ªed. Rio de Janeiro: Guanabara Koogan,
p. 657, 2002.
53- SZAJNMAN, S.H.; YAN, W.; BAILEY, B. N.; DO CAMPO, R.; ELHALEM, E.; RODRÍGUEZ, J.B.
Design and Synthesis of Aryloxythyl Thiocyanate Derivatives as Potent Inhibitors os trypanosoma
cruzi Proliferation. J. Med Chem., v. 43, p. 1826-1840, 2000.
54- MONCAYO, A. Chagas disease: current epidemiological trends after the interruption of vectorial and
transfusional transmission in the Southern Cone Countries. Memórias do Instituto Oswaldo Cruz, v.
98, n. 5, p. 577-591, jul. 2003.
Dyego Revorêdo de Carvalho Silva
133
55- CAZZULO, J. J.; STOKA, V.; TURK, V. The major cysteine proteinase of Trypanosoma cruzi: a valid
target for chemoterapy of Chagas Disease. Current Pharmaceutical Design, v. 7, p. 1143-1156,
2001.
56- WENDEL, S. Historical aspects. In: WENDEL, S.; BRENER, Z.; CAMARGO, M. E.; RASSI. A
Chagas disease (American Trypanosomiasis): its impact on transfusion and clinical medicine.
Sociedade Brasileira de Hematologia e Hemoterapia. Rio de Janeiro, 1992.
57- CROFT, S.L. Pharmacological Approaches to Antitrypanosomal Chemotherapy. Mem. Inst. Oswaldo
Cruz. v.94, p.215-220, 1999.
58- BRENER, Z. Terapêutica experimental da doença de Chagas. In: Cançado J.R. Doença de Chagas.
Imprensa Oficial de Minas Gerais, Belo Horizonte, p.510-16, 1968.
59- HORROCKS, S. M.; JUNG, Y. S.; HUWE, J. K.; HARVEY, R. B.; RICKE, S. C.; CARSTENS, G. E.;
CALLAWAY, T. R.; ANDERSON, R. C.; RAMLACHAN, N.; NISBET, D. J., Effects of short-chain
nitrocompounds against campylobacter jejuni and campylobacter coli in vitro J. Food sci., 2007, 72,
M50-M55.
60- COURA, J.R.; CANÇADO, J.R. A história da terapêutica da doença de Chagas. Disponível em
http://www.fiocruz.br/chagas/cgi/cgilua.exe/sys/start.htm?sid=124. Acesso em Junho, 2010.
61- BERNARDES, L.SC.; KATO, M.J.; ALBUQUERQUE, S.; CARVALHO, I. Synthesis and
trypanocidal
activity
of
1,4-
bis(3,4,5-trimethoxy-phenyl)-1,4-butanediol
and
1,4-bis-(3,4-
dimethoxyphenyl)-1,4-butanediol. Bioorg. Med. Chem., v.14, p.7075-7082, 2006.
62- ANANDAN, J. V. Parasitic disease. In: DIPIRO, J. T. (Ed.). Pharmacotherapy: a pathophysiologic
approach. 3rd ed. London: Appleton & Lange,. p. 2161-2172, 1997.
63- OTERO, L.; AGUIRRE, G.; BOIANI, L.; DENICOLA, A.; RIGOL, C.; OLEA-AZAR, C.; MAYA, J.
D.; MORELLO, A.; GONZÁLEZ, M.; GAMBINO, D.; CERECETTO, H. Nitrofurylsemicarbazone
rhenium and ruthenium complexes as anti-trypanosomal agents. European Journal of Medicinal
Chemistry, v. 41, n. 11, p. 1231-1239, 2006.
64- RODRIGUES, C.J.; DE CASTRO.; A critical review on Chagas disease chemotherapy. Mem. Inst.
Dyego Revorêdo de Carvalho Silva
134
Oswaldo Cruz, v.97, p.3-24, 2002.
65- BOIANI, L.; DAVIES, C.; ARREDONDO,C.; PORCALl, W.; MERLINO, A.; GERPE, A.; BOIANI,
M.; PACHECO, J.P.; BASOMBRÍO, M. A.; CERECETTO, H.; GONZÁLES, M. In vivo studies of 5arylethenylbenzofuroxans in acute murine models of Chagas‘ disease. European Journal of
Medicinal Chemistry, v. 43, p. 2229-2237, 2008.
66- CHUNG, M. C.; GUIDO, R. V. C.; MARTINELLI, T. F.; GONC¸ALVES, M. F.; POLLI, M. C.;
BOTELHO, K. C. A.; VARANDA, E. A.; COLLI, W.; MIRANDA, M. T.; FERREIRA, E. I.
Synthesis and in vitro evaluation of potential antichagasic hydroxymethyinitrofurazone (NFOH-121):
A new nitrofurazone prodrug. Bioorg. Med.Chem.,v.11,p.4779–4783.2003.
67- URBINA, J.A. Specific treatment of Chagas disease: current status and new developments. Curr
Opin Infect Dis v.14, p.733–741, 2001.
68- LEITE, A. C. L.; SANTOS, L.M.F.; MOREIRA, D.R.M.; BRONDANI, D.J. Synthesis and
characterization of new acyl-4-thiazolidones. Quim. Nova, v. 30, n. 2, p. 284 - 286, 2007.
69- BRAK, K.; DOYLE, P. S.; MCKERROW, J. H.; ELLMAN, J. A. Identification of a New Class of
Nonpeptidic Inhibitors of Cruzain. J. Am. Chem. Soc. v. 130, p. 6404–6410, 2008.
70- TENÓRIO, R. P.; Góes, A. J. S.; LIMA, J. G.; FARIA, A. R.; ALVES, A. J.;AQUINO, T. M.
Tiossemicarbazonas: Métodos de Obtenção, Aplicações Sintéticas Importância Biológica. Química
Nova, v. 28, p. 1030-1037, 2005.
71- KARABATSOS, G. J.; VANE, F.M.; TALLER, R.A.; HIS, N. Structural studies by nuclear magnetic
resonance VIII. Ring-substituted phenylhydrazones, semicarbazones, and thiosemicarbazones. J. Am.
Chem. Soc., v. 86, n. 16, p. 3351 – 3357, 1964.
72- CASTIÑEIRAS, A.; BERMEJO, E.; ACKERMAN, L.J.; BERALDO, H.; WEST, D.X. Structural and
spectral characterization of two bis{N(4)-alkylthiosemicarbazones} of 1-phenylglyoxal, Journal of
Molecular Structure , v.477, p.1–6, 1999.
73- PANDEYA, S.N.; SRIRAM, D.; NATH, G.; DECLERCQ, E. Synthesis, antibacterial, antifungal and
anti-HIV activities of Schiff and Mannich bases derived from isatin derivatives and N-[4-(49chlorophenyl)thiazol-2-yl] thiosemicarbazide., European Journal of Pharmaceutical Sciences, v.9,
Dyego Revorêdo de Carvalho Silva
135
p. 25–31, 1999
74- GUPTA, R.P.; NARAYANA, N.L. Synthesis of some Mannich bases of l- cyclohexylidene-N-( 1,2dihydro-2-oxo-3H-indol-3-ylidene) thiosemicarbazones and their antibacterial activity, Pharmaceutics
Acta Helvetiae, v. 72, p. 43-45, 1999.
75- TARASCONI, P.; CAPACCHI, S.; PELOSI, G.; CORNIA, M.; ALBERTINI, R.; BONATI, A.;
DALL'AGLIO, P.P.; LUNGHI, P.; PINELLI, S. Synthesis, Spectroscopic Characterization and
Biological Properties of New Natural Aldehydes Thiosemicarbazones., Bioorganic & Medicinal
Chemistry, v.8, p.157-162, 2000.
76- KLIMOVA, T.; KLIMOVA, E.I.; MARTÍNEZ GARCÍA, M.; MÉNDEZ STIVALET, J.M.; RUÍZ
RAMÍREZ, L. The reactions of semicarbazide and thiosemicarbazide with ferrocenyl-substituted α-βenones., Journal of Organometallic Chemistry, v.633, p.137–142, 2001.
77- FERRARI, M.M.; BISCEGLIE, F.; PELOSI, G.; TARASCONI, P.; ALBERTINI, R.; PINELLI, S.
New methyl pyruvate thiosemicarbazones and their copper and zinc complexes: synthesis,
characterization, X-ray structures and biological activity., Journal of Inorganic Biochemistry, v. 87,
p.137–147, 2001.
78- LABISBAL, E.; SOUSA-PEDRARES, A.; CASTIÑEIRAS, A.; SWEARINGEN, J.K.; WEST, D.X.
Structural studies of pyrazineformamide N-4-methylthiosemicarbazone and its zinc(II) and
cadmium(II) complexes formed by electrochemical oxidation., Polyhedron, v.2, p.1553_/1559, 2002.
79- CHAI, H.; LIU, G.; LIU, L.; JIA, D. Synthesis and spectroscopic study on photochromism of a new
thiosemicarbazone compound containing pyrazolone., Spectrochimica Acta, Part A, v.61, p.2590–
2594, 2005.
80- BOLM, C.; KASYAN, A.; SALADIN, S. Synthesis of novel silylated 1,2,4-triazin-5-ones.,
Tetrahedron Letters., v.46, p.4049–4051, 2005.
81- BALASUBRAMANIAN, S.; RAMALINGAN, C.; ARIDOSS, G.; KABILAN, S., Synthesis and study
of antibacterial and antifungal activities of novel 8-methyl-7,9-diaryl-1,2,4,8-tetraazaspiro[4.5]decan3-thiones., Eur. J. Med. Chem. v.40, p.694, 2005.
82- KARATAS, F.; KOCA, M.; KARA, H.; SERVI, S. Synthesis and oxidant properties of novel (5-
Dyego Revorêdo de Carvalho Silva
136
bromobenzofuran-2-yl) (3-methyl-3-mesitylcyclobutyl) ketone thiosemicarbazone., Eur. J. Med.
Chem. v.41, p.664, 2006.
83- CUKUROVALI, A.; YILMAZ, I.; GUR, S.; KAZAZ, C. Synthesis, antibacterial and antifungal
activity of some new thiazolylhydrazone derivatives containing 3-substituted cyclobutane ring., Eur.
J. Med. Chem. v.41, p.201–207, 2006.
84- BONDOCK, S.; KHALIFA, W.; FADDA, A. A. Synthesis and antimicrobial evaluation of some new
thiazole, thiazolidinone and thiazoline derivatives starting from 1-chloro-3,4-dihydronaphthalene-2carboxaldehyde., Eur. J. Med. Chem. v.42, p.948–954, 2007.
85- MATESANZ, A.I.; PASTOR, C.; SOUZA, P. Synthesis and structural characterization of a disulphidebridged tetranuclear palladium(II) complex derived from 3,5-diacetyl 1,2,4-triazole bis(4ethylthiosemicarbazone)., Inorganic Chemistry Communications., v.10, p.97–100, 2007.
86- KHAN, S.A.; KUMAR, P.; JOSHI, R.; IQBAL, P.F.; SALEEM, K. Synthesis and in vitro antibacterial
activity of new steroidal thiosemicarbazone derivatives, European Journal of Medicinal Chemistry,
v.43, p.2029-2034, 2008.
87- NÚÑEZ-MONTENEGRO, A.; CARBALLO, R.; VÁZQUEZ-LÓPEZ, E.M. Synthesis and
characterization of thiosemicarbazone derivatives of 2-ethoxy-3-methoxy-benzaldehyde and their
rhenium(I) complexes, Polyhedron, v.27, p.2867–2876, 2008.
88- FINKIELSZTEIN, L.M.; CASTRO, E.F.; FABÍAN, L.E.; MOLTRASIO, G.Y.; CAMPOS, R.H.;
CAVALLARO, L.V.; MOGLIONI, A.G. New 1-indanone thiosemicarbazone derivatives active against
BVDV., Eur. J. Med. Chem. v.43, p.1767, 2008.
89- YILDIZ, M.; UNVER, H.; ERDENER, D.; KIRAZ, A.; ISKELELI, N.O. Synthesis, spectroscopic
studies and crystal structure of (E)-2-(2,4 dihydroxybenzylidene) thiosemicarbazone and (E)-2-[(1Hindol-3-yl)methylene]thiosemicarbazone, Journal of Molecular Structure, v.919,p. 227–234, 2009.
90- RAMACHANDRAN, R.; RANI, M.; KABILAN, S. Synthesis, structure and conformational analysis
of 2,4-diaryl-3- azabicyclo[3.3.1]nonan-9-one thiosemicarbazones and semicarbazones, Journal of
Molecular Structure, v.970, p.42–50, 2010.
91- KURUP, M.R.P.; JOSEPH, M. Transition Metal Complexes of Furan-2-aldehyde Thiosemicarbazone,
Dyego Revorêdo de Carvalho Silva
137
Synth. React. Inorg. Met. Org. Chem., v.33, p.1275, 2003.
92- CASAS, J. S.; TASENDE, M. S. G.; SORDO, J.; Main group metal complexes of semicarbazones and
thiosemicarbazones. A structural review Coord. Chem. Rev., v.209,p.197. 2000.
93- HORTON, D.; VARELA, O. Cu, Pt, and Pd complexes of the 3-deoxy-1,2 bis (thiosemicarbazone)
derived from D-glucose, Carbohydrate Research, v.328, p.425–429, 2000.
94- GANGADHARMATH, U.B.; ANNIGERI, S.M.; NAIK, A.D.; REVANKAR, V.K.; MAHALE, V.B.
Synthesis, characterisation and evaluation of molecular-orbital, spin-orbit, dipolar and fermi-contact
terms od VO2+ íon in thiosemicarbazone complexes. Journal of Molecular Structure, v. 572, p. 6171, 2001.
95- CARBALLO, R.; CASAS, J.S.; GARCÍA-MARTÍNEZ, E.; PEREIRAS-GABIÁN, G.; SÁNCHEZ,
A.; SORDO, J.; VÁZQUEZ-LÓPEZ, E.M. Reaction of bromopentacarbonylrhenium(I) with
ferrocenylcarbaldehyde thiosemicarbazones: the first X-ray diffraction studies of metal carbonyl
complexes containing bidentate thiosemicarbazone ligands Inorg. Chem. v.42, p.6395, 2003.
96- SHAILENDRA, BHARTI, N.; NAQVI, F.; AZAM, A. Synthesis, Spectral Studies and Screening for
Amoebicidal Activity of New Palladium(II) Complexes Derived from Thiophene-2-carboxaldehyde
Thiosemicarbazones, Bioorg. Med. Chem. Lett. v.13, p.689-692, 2003.
97- PRABHAKARAN, R.; KARVEMBU, R.; HASHIMOTO, T.; SHIMIZU, K.; NATARAJAN, K.
Formation of structurally different solvated and non-solvated [Ni(PTSC)(PPh3)] (PTSC =
salicylaldehyde-Nphenylthiosemicarbazide anion) crystals from single pot, Inorg. Chim. Acta, v.358,
p.6093-6097, 2005.
98- KOSTAS, I.D.; HEROPOULOS, G.A.; KOVALA-DEMERTZI, D.; YADAV, P.N.; JASINSKI, J.P.;
DEMERTZIS, M.A.; ANDREADAKI, F.J.; VO-THANH, G.; PETIT, A.; LOUPY, A. Microwavepromoted Suzuki–Miyaura cross-coupling of aryl halides with phenylboronic acid under aerobic
conditions catalyzed by a new palladium complex with a thiosemicarbazone ligand, Tetrahedron
Letters, v.47, p.4403–4407, 2006.
99- VRDOLJAK, V.; ÐILOVIC´, I.; RUBČIC´, M.; PAVELIC´, S.K.; KRALJ, M.;D.; MATKOVIC´–
ČALOGOVIC´.; PIANTANIDA, I.; NOVAK, P.; ROŽMAN, A.; CINDRIC´, M. Novel
Dyego Revorêdo de Carvalho Silva
138
dioxomolybdenum(VI) and oxomolybdenum(V) complexes with pyridoxal thiosemicarbazone ligands:
Synthesis and structural characterisation, Inorganica Chimica Acta, v.362, p.4059–4064, 2009.
100-
BERALDO, H. Semicarbazonas E Tiossemicarbazonas: O Amplo Perfil Farmacológico E
Usos Clínicos. Quim. Nova, V. 27, No. 3, p. 461-471, 2004.
101-
TEITZ, Y.; RONEN, D.; VANSOVER, A.; STEMATSKY, T.; RIGGS, J. L.; Inhibition of
human immunodeficiency virus by N-methylisatin- diethylthiosemicarbazone and N-allyl isatin-β4′:4′ diallylthiosemicarbazone Antiviral Res., v.24, p.305, 1994.
102-
GUZEL, O.; KARALI, N.; SALMAN, A. Synthesis and antituberculosis activity of 5-
methyl/trifluoromethoxy- 1H-indole-2,3-dione 3-thiosemicarbazone derivatives
, Bioorg. Med.
Chem.v.16, p.8976. 2008.
103-
OPLETALOVÁ, V,; KALINOWSKI, D.S.; VEJSOVÁ, M.; KUNEŠ, J.; POUR, M.;
JAMPÍLEK, J.; BUCHTA, V.; RICHARDSON,
D.R. Identification and Characterization of
Thiosemicarbazones with Antifungal and Antitumor Effects: Cellular Iron Chelation Mediating
Cytotoxic Activity, Chem. Res. Toxicol., v.21, p.1878–1889, 2008.
104-
LI, J.; LUO, X.; WANG, Q.; ZHENG, L.; KING, I.; DOYLE, T. W.; CHEN, S. Synthesis And
Biological Evaluation Of A Water Soluble Phosphate Prodrug Of 3-Aminopyridine-2-Carboxaldehyde
Thiosemicarbazone (3-Ap). Bioorg. Med. Chem. Lett. v.8, p.3159, 1998.
ÐILOVIC´, I.; RUBČIC´, M.; VRDOLJAK, V.; PAVELIC´ S.K.;, KRALJ, M.; PIANTANIDA,
105-
I.; CINDRIC´, M. Novel thiosemicarbazone derivatives as potential antitumor agents: Synthesis,
physicochemical and structural properties, DNA interactions and antiproliferative activity, Bioorg.
Med. Chem. v.16, p.5189–5198, 2008.
106-
BHARTI, N.; HUSAIN, K.; GARZA, M. T. G.; VEGA, D. E. C.; GARZA, J. C.;
CARDENAS, B. D. M.; NAQVI, F.; Synthesis and in vitro antiprotozoal activity of 5-nitrothiophene2-carboxaldehyde thiosemicarbazone derivatives.Bioorg. Med. Chem. Lett., v.12, p.3475-78, 2002.
107-
ABID, M.; AGARWAL, S.M.; AZAM, A. Synthesis and antiamoebic activity of metronidazole
thiosemicarbazone analogues., European Journal of Medicinal Chemistry., v.43, p.2035-2039,
2008.
Dyego Revorêdo de Carvalho Silva
139
108-
DUAN, L.P.; ZHANG, H.B. Novel thiosemicarbazones derivatives bearing aromatic iodine
moiety: Design, synthesis and anti-malarial activity., Arabian Journal of Chemistry, 2010.
109-
CHIYANZU, I.; HANSELL, E.; GUT, J.; ROSENTHAL, P.J.; MCKERROW, J.H.;
CHIBALE, K. Synthesis and Evaluation of Isatins and Thiosemicarbazone Derivatives against
Cruzain, Falcipain-2 and Rhodesain, Bioorg. Med. Chem. Lett. v.13, p.3527, 2003.
110-
FUJII, N.; MALLARI, J. P.; HANSELL, E. J.; MACKEY, Z.; DOYLE, P.; ZHOU, Y. M.;
GUT, J.; ROSENTHAL, P. J.; MCKERROW, J. H.; GUY, R. K. Discovery of potent
thiosemicarbazone inhibitors of rhodesain and cruzain, Bioorg. Med. Chem. Lett., v.15, p.121, 2005.
111-
SILES, R.; CHEN, S. E.; ZHOU, M.; PINNEY, K.G.; TRAWICK, M. L. Design, synthesis,
and biochemical evaluation of novel cruzain inhibitors with potential application in the treatment of
Chagas‘ disease., Bioorg. Med. Chem. Lett., v.16, p.4405–4409. 2006.
112-
PALENIK, G. J.; RENDLE, D. F.; CARTER, W. S.; The crystal and molecular structures of
thiosemicarbazones; an antitumor agent 5-hydroxy-2-formylpyridine thiosemicarbazone
sesquihydrate and the inactive acetone thiosemicarbazone. Acta Crystallogr., Sect. B: Struct.
Sci., v.30, p.2390. 1974.
113-
BOSQUESI, P.L. Avaliação da presença do grupo nitro na atividade antichagásica e
mutagênica do candidato a fármaco hidroximetilnitrofural (NFOH). 123f. Dissertação (Mestrado)
– Universidade Estadual Paulista. ―Júlio de Mesquita Filho‖. Faculdade de Ciências
Farmacêuticas, Araraquara.
114-
BHARTI, N. ATHAR, F.; MAURYA, M.R.; AZAM, A. Synthesis, characterization and in
vitro anti-amoebic activity of new palladium(II) complexes with 5-nitrothiophene-2-carboxaldehyde
N(4)-substituted thiosemicarbazones. Bioorganic & Medicinal Chemistry, v.12, p.4679–4684, 2004.
115-
FERRARI, M.B.; CAPACCHU, S.; REFFO, G.; PELOSI, G.; TARASCONI, P.;
ALBERTINI, R.; PINELLI, S.; LUNGHI, P. Synthesis, structural characterization and biological
activity of p-fluorobenzaldehyde thiosemicarbazone ando f nickel complex. J. Inorg. Biochem. v.81,
p. 89-97, 2000.
Dyego Revorêdo de Carvalho Silva
140
116-
BHARTI, N.; SHAILENDRA; SHARMA, S.; NAQVI, F.; AZAM, A.; New Palladium(II)
complexes of
5-nitro-2-thiophene-carboxaldehyde thiosemicarbazone: Synthesis, spectral studies
and in vitro anti-amoebic activity. Bioorg. Med. Chem. v.11, 2923-29, 2003.
117-
PEREIRA, V.R.A.; LORENA, V.M.B.; NAKAZAWA, M.; LUNA, C.F.; SILVA, E.D.;
FERREIRA, A.G.P.; KRIEGER, M.A.; GOLDENBERG, S.; SOARES, M.B.P.; COUTINHO, E.M.;
CORREA-OLIVEIRA, R.; GOMES,Y.M. Humoral and cellular immune responses in BALB/c and
C57BL/6 mice immunized with cytoplasmic (CRA) and flagellar (FRA) recombinant repetitive
antigens, in acute experimental Trypanosoma cruzi infection. Parasitology Research. v. 96, p. 154–
161, 2005.
118-
MOSMANN, T. Rapid colorimetric assay for cellular growth and survival: application to
proliferation and cytotoxicity assays. J Immunol Methods v.65, p.55-63. 1983.
119-
GREENBAUM, D. C.; MACKEY, Z.; HANSELL, E.; DOYLE, P.; GUT, J.; CAFFREY, C.
R.; LEHRMAN, J.; ROSENTHAL, P. J.; MCKERROW, J. H.; CHIBALE, K. Synthesis and structureactivity relationships of parasiticidal thiosemicarbazone cysteine protease inhibitors against
Plasmodium falciparum, Trypanosoma brucei, and Trypanosoma cruzi, J. Med. Chem., v.47, p.3212,
2004.
120-
BARREIRO, E. J.; FRAGA, C.A.M. Química Medicinal: as bases moleculares da ação dos
fármacos. 2ª ed. Porto Alegre: Artmed, 2008.
121-
HERNANDES, M.Z.; CAVALCANTI, S.M. T.; MOREIRA, D.R. M.; JUNIOR, W.F.A.;
LEITE, A.C.L. Halogen Atoms in the Modern Medicinal Chemistry: Hints for the Drug Design.
Current Drug Targets, v 11. 2010.
122-
GERPE, A.; Álvarez, G.; BENÍTEZ, D.; BOIANI, L.; QUIROGA, M.; HERNÁNDEZ, P.;
SORTINO, M.; ZACCHINO, S.; GONZÁLEZ, M.; CERECETTO, H. 5-Nitrofuranes and 5nitrothiophenes with anti-T. cruzi activity and ability to accumulate squalene. Bioorganic &
Medicinal Chemistry, v.: 17, p.: 7500 - 7509, 2009.
123-
PAULA, F.R.; SERRANO, S.H.P.; TAVARES, L.C. Aspectos mecanísticos dabioatividade e
toxicidade de nitrocompostos. Quim. Nova, v. 32, No. 4, p.1013-1020, 2009.
Dyego Revorêdo de Carvalho Silva
141
124-
A. PEREZ-REBOLLEDO, L.R. TEIXEIRA, A.A. BATISTA, A.S. MANGRICH, G.
AGUIRRE, H. CERECETTO, M. GONZÁLEZ, PAOLA HERNÁNDEZ, A.M. FERREIRA, N.L.
SPEZIALI AND H. BERALDO. 4-Nitroacetophenone-derived thiosemicarbazones and their
copper(II) complexes with significant in vitro anti-trypanosomal activity Eur. J. Med. Chem. v.43,p.
939–948, 2008.
125-
CERECETTO, H.; GONZÁLES, M. Synthetic Medicinal Chemistry in Chagas‘ Disease:
Compounds at The Final Stage of ―Hit-To-Lead‖ Phase. Pharmaceuticals, v.3, p810-838, 2010.
126-
URBINA, J. A., PAYARES, G., CONTRERAS, L. M., LIENDO, A., SANOJA, C.,
MOLINA, J. ET AL. Antiproliferative effects and mechanism of action of SCH 56592 against
Trypanosoma (Schizotrypanum) cruzi: in vitro and in vivo studies. Antimicrobial Agents and
Chemotherapy v.42, p.1771–7. 1998.
127-
BAUER AW, KIRBY WMM, SHERRIS JC, TURCK M. Antibiotic susceptibility testing by a
standardized single disk method. Am J Clin Pathol. 1966;45:493-496.
128-
CLINICAL AND LABORATORY STANDARDS INSTITUTE. Methods For Dilution
Antimicrobial Susceptibility Tests For Bacteria That Grow Aerobically. Approved Standard. 6.ed.
Wayne: NCCLS, 2003. p.53. (NCCLS document M7-A6).
Dyego Revorêdo de Carvalho Silva
142
ANEXOS
Dyego Revorêdo de Carvalho Silva
143
ANEXO A: Espectros de IV dos derivados obtidos
Composto 2a: 3-nitro-4-hidroxibenzaldeído tiossemicarbazona
Composto 2b: 3-nitro-4-dimetil-aminobenzaldeído tiossemicarbazona.
Dyego Revorêdo de Carvalho Silva
144
Composto 2c: 3-metoxi-4 hidróxi-5-nitro-benzaldeído tiossemicarbazona.
Composto 2d: 3-nitro-4-tolualdeído tiossemicarbazona.
Dyego Revorêdo de Carvalho Silva
145
Composto 2e: 3-nitro-4-bromobenzaldeído tiossemicarbazona.
Composto 2f: 3-nitro-4-clorobenzaldeído tiossemicarbazona.
Dyego Revorêdo de Carvalho Silva
146
Composto 2g: 5-nitro- isoftaldeído tiossemicarbazona.
Composto 2h: 5-nitro-2-furaldeído tiossemicarbazona.
Dyego Revorêdo de Carvalho Silva
147
Composto 2i: 4-nitro-2-tiofenocarboxaldeído tiossemicarbazona.
Composto 2j: 3-nitro-4-clorobenzaldeído-N(4)-fenil-tiossemicarbazona.
Dyego Revorêdo de Carvalho Silva
148
Molécula
2l:
5-nitro-isoftaldeído-N(4)-fenil-
tiossemicarbazona.
Dyego Revorêdo de Carvalho Silva
149
ANEXO B: Espectros RMN 1H
Composto 2a
Dyego Revorêdo de Carvalho Silva
150
Composto 2b
Dyego Revorêdo de Carvalho Silva
151
Composto 2c
Dyego Revorêdo de Carvalho Silva
152
Composto 2d
Dyego Revorêdo de Carvalho Silva
153
Composto 2e
Dyego Revorêdo de Carvalho Silva
154
Composto 2f
Dyego Revorêdo de Carvalho Silva
155
Composto 2g
Dyego Revorêdo de Carvalho Silva
156
Composto 2h
Dyego Revorêdo de Carvalho Silva
157
Composto 2i
Dyego Revorêdo de Carvalho Silva
158
Composto 2j
Dyego Revorêdo de Carvalho Silva
159
Composto 2l
Dyego Revorêdo de Carvalho Silva
Download