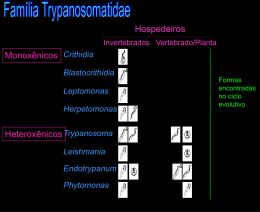
Perguntas malaria / Take home message Qual forma infecta naturalmente o hospedeiro intermediário e por qual via? esporozoita Como o parasita (merozoita) consegue sair da célula hepática infectada sem ser fagocitado por células Kupffer (macrófagos)? Formação de merossomos (vesiculas de membrana da célula hepática com merozoitas dentro) Por que não podemos ver formas maduras do parasita sanguíneo em sangue de pessoas infectadas com P. falciparum ? Porque eles estão citoaderidas em vasos profundos Por que é necessário tomar primaquina ou tafenoquina quando infectado com P. vivax ? Para matar os hipnozoitas para não ter recaida O que é necessário para desencadear uma epidemia de malaria? Anopheles, fonte de gametócitos (ex.:assintomáticos), pessoas não imunes Perguntas Amebas etc / Take home message O que é uma Zoonose, e o que seria então uma antroponose? Zoonose é infecção do homem como hospedeiro quando o principal hospedeiro seria um outro animal. Antroponose é uma infecção que ocorre predominantemente entre seres humanos Qual é a forma infecciosa de Entamoeba histolítica? Cisto Qual seria uma forma diagnóstica de Entamoeba histolítica? Cisto com 4 nucleos (microscopista!) ou trofozoita com hemácia ingerida Em qual pequeno detalhe importante no ciclo de vida se distinguem Isospora belli e Cryptosporidium parvum? Cryptosporidium infecta qq célula epitelial e possui cisto que autoinfecta no intestino Em qual forma sobrevive Trichomonas vaginalis fora do corpo humano? E Giardia? T.v. não sobrevive e Giardia em forma de cisto Tripanossomíase americana ou Doença de Chagas (Trypanosoma cruzi ) Histórico Oswaldo Cruz Instituto Soroterápico Federal, 1900 Carlos Justiniano Ribeiro Chagas Estrada de Ferro Central do Brasil Hospital em Lassance Carlos Chagas atendendo pacientes Formas do parasita e o inseto vetor encontrados por Chagas, denominado “Schizotrypanum cruzi“ Panstrongylus megistus Epimastigota Tripomastigota Filogenia do gêneroTrypanosoma Filo Sarcomastigophora, subfilo Mastigophora Classe Zoomastigophora Ordem Kinetoplastida Família Trypanosomatidae Gênero Trypanosoma Trypanosomas de mamíferos Secção Stercoraria Salivaria Desenvolvimento vetor tubo digestivo tubo digestivo e glândula salivária Transmissão contaminativa inoculativa pelo vetor fezes saliva subgênero Schizotrypanum - T. cruzi Trypanozoon - T. brucei Herpetosoma - T. rangeli Megatrypanum - T. theileri Dutonella - T. vivax Nannomonas - T.congolense Picnomonas - T. suis Detalhes notáveis de T. cruzi Kinetoplastídeo Acidocalcissomo Superfície da célula: Mucinas Genoma do parasita: 6 “distinct type units (DTUs)“, ~50 MB, em 35 pares de cromossomos, “pseudodiploidia“ Genoma sequenciado em 2005, altamente rico em sequências repetitivas. Tritryp.org Ciclo de vida 1. Passo: a infecção Dipetalogaster maximus: repasto sanguíneo Rhodnius prolixus Sinal de Romaña Aguda - Sintomática - Sinais de entrada Sinal de Romaña Vetores de T. cruzi : Hemíptera – espécies hematófagas: – Reduviidae - Triatominae (barbeiros) – hemimetábolos – Diferente dos pernilongos: todos os estágios e ambos os sexos são hematófagos Triatomíneos mais importantes na transmissão da doença de Chagas Triatoma infestans Panstrongylus megistus Rhodnius prolixus Triatoma dimidiata Triatoma pallidipennis Triatoma sordida Triatoma brasiliensis Discriminação morfológica de Triatomíneos hematófago fitófago predador 2. Passo: A invasão de células (inicialmente macrófagos) célula fagocítica célula não fagocítica Fatores importantes: Parasita: • gp82, fosforilação de p175, Ca2+ via IP3 • pH baixo • hemolisina para escape do lisossomo Célula hospedeira: •Remodelamento do citoesqueleto, “sequestro” de lisossomos para superfície • Dynamina, Rab5, Rab7 http://www.hindawi.com/journals/ijcb/2010/295394.fig.0010.jpg Ca2+ TGF (M não se ativa via TLR4 e tGPI-Mucina) TcTox, Trans-sialidase 3. Passo: a disseminação no hospedeiro vertebrado Infecção local Nódulos linfáticos Sistema nervoso central Coração Aparelho digestivo 4. Passo: a contaminação do vetor invertebrado Tripomastigota sangüíneo Outras vias de infecção - transfusional! - congênita (0,5-3,5% risco) - acidentes de laboratório - Oral (ingestão de fezes frescas de Triatomineos infectados ou Triatomineos macerados) Patogenia e sintomas da infecção com T. cruzi - período de incubação: 5 a 60 dias Fase aguda - Maior parte assintomática ou inaparente - infecção local (sintomas: Chagoma/Sinal de Romaña) - infecção disseminada, alvos preferenciais: Células Kupffer, macrófagos do baço e células do miocârdio (sintomas: febre, astenia, cefaléia, mialgia, adenite, morte em 10% dos casos por meningoencefalite ou miocardite aguda) Fase crônica (sintomas em 30% dos casos, 70% sem sintomas): - Infecção crônica com baixas parasitemias - Aumento do coração, dilatação dos ventrículos, e/ou miosite no esôfago, côlon ou intestino delgado - destruição dos gânglios é compensado por aumento da massa muscular levando a megaesôfago, megacôlon (sintomas: inabilidade física, disfagia, constipação, morte) - Cura espontânea é possivel em cada estágio - Pacientes em muitos casos estão incapacitados de exercer atividades profissionais Frequência e natureza de patologias observadas em pacientes crônicos da doença de Chagas: As “megas“ Fase crônica: Cardiomegalia e aneurisma de ponta Fase crônica: Miocardite chagasica Fase crônica: Megacôlon Aspectos da relação patógeno-hospedeiro • Porque a patologia em um paciente é tão diferente de um paciente ao outro (assintomático/cura/crônico/patologia de orgãos diferentes)? • Como é causada uma patologia extensa com muito pouco parasita? Qual motivo pela diferença no desenvolvimento da doença? - fatores genéticos do hospedeiro? (subclasses HLA, responsividade da produção de citocinas, etc.?) - Virulência diferente entre várias cepas de T. cruzi em circulação? - Cepas com diferente tropismo Doença autoimune versus ativação “bystander“ Células T reativas contra auto-antígenos podem atacar células não infectadas Autoantígenos são liberados por lise da célula infectada e promovem a expansão de celulas T efetores contra outras células apresentando Prot.A do hospedeiro T MHC1 Prot.A M Prot.A Prot.A Prot.A Prot.A célula infectada Tolerização contra antigenos do miocârdio previne miocardite in infecções crônicos experimentais de camundongos Antígenos de T. cruzi causam a formação de anticorpos que reagem cruzado contra proteínas do hospedeiro Exemplo: anticorpos contra proteinas ribossomais de T. cruzi reconhecem o receptor beta-adrenêrgico, antígeno Cha do miocârdio é outro candidato importante Células infectadas (cardiomiócitos) e macrófagos após fagocitose secretam quimocinas que recrutam leucócitos para o tecido infectado Quimiocinas e patologia da doença de Chagas •GPI-Mucinas estimulam macrófago a produzir CC e CXC quimiocinas, cardiomiócitos também produzem estas quimiocinas • Quimiocinas (RANTES, MIG, IP10, MIP) recrutam linfocitos para o lugar de produção, produção depende de níveis de IFNgama •Linfocitos são predominantemente do tipo CD8+ (effector cells) •Sem IFNgama (camundongos knockout) não há produção de quimiocinas, já na ausência de TNFalpha receptor (camundongos knockout): aumento de linfócitos recrutados e quimiocinas Dutra & Gollob, 2008, Current Op. Inf Dis Marin-Neto, J. A. et al. Circulation 2007;115:1109-1123 Diagnóstico Imprescindível: Detecção de formas do parasita - Esfregaços de sangue na fase aguda (dificil em adultos) - Métodos imunológicos: Elisa, detecção de anticorpos - Xenodiagnóstico - PCR (permite também a discriminação de cepas e exclusão de infecção com T. rangeli ) Xenodiagnóstico Epidemiologia - T. cruzi é transmitido em ciclos domésticos ou paradomésticos A distribuição de vetores de T. cruzi Existem poucos estudos sobre a capacidade vetorial de triatomineos nesta área, mas tem casos! Área de risco de infecção com T . cruzi Onde há presença de vetores existe a possibilidade de infecção - Área endêmica Brasil: 1/4 território - 8 milhões de pessoas infectadas (MG,RS,GO,SE,BA) - 25 milhões de pessoas expostas ao risco de infecção Região amazônica: enzootia emergente? Programas de controle da Doença de Chagas Primeiras tentativas de controle de vetor - Depois da descoberta (anos 10 e 20 do seculo passado) por Chagas, tentativas frustradas de eliminação do vetor Panstrongylus megistus usando querosene, água fervente e até lança-chamas em casas pau-a-pique - Chagas, Pellegrino e Dias perceberam que a melhoria das moradias mostrou grande efeito - Nos anos 40: introdução de DDT ineficiente contra Triatomineos - Outros organoclorados, dieldrina e HCH (Lindan): eficientes • A primeira campanha em solo brasileiro foi incentivada pelo sucesso obtido na Venezuela, apesar de ter utilizado DDT (anos 70) • No começo dos anos 80: Introdução dos piretróides sintéticos • Primeira campanha nacional (1984), objetivo: Erradicação de Triatoma infestans • Mapeamento dos lugares infestados por Triatomíneos • borrifação das moradias • follow-up do reaparecimento de Triatomineos por postos decentralizados que coletaram informações sobre reaparecimento de Triatomineos Internações Revés: O programa ficou suspenso, quando o combate à reintrodução de Aedes aegypti foi declarado prioritário em 1986 Dias et al. 2002 MIOC A reintrodução dos vetores também ocorreu, exigindo um esforço multilateral para sucesso do controle A Iniciativa Cone Sur 1991-2000 Objetivos: - Erradicação de Triatoma infestans - Controle dos bancos de sangue para contenção do risco de infecção transfusional - Diminuir o impacto económico e social da doença de Chagas O Futuro do controle da Tripanossomiase americana - Manter a vigilância (Bolivia ainda continua a fonte de Triatoma infestans, tem regiões onde 90% da população é portadora! - Manter os orçamentos e programas para monitoramento de potencias áreas de risco, independente do partido do ministro de saude e outros desafios no setor de saude - Reação rápida dos orgãos de saude a novos desafios: - reintrodução dos vetores - domesticação de vetores silvestres (Amazônia!!!) Os beneficios pós-campanha geral sao mantidos apenas com contínuos investimentos, mesmo pequenos Dias et al. 2002 MIOC Tratamento Benzonidazole (“Rochagan“) - em uso para tratamento nas fases aguda e crônica 5-6 mg/kg peso corporal (30-60 dias) - eficiência: fase aguda:>90% fase crônica:>60% Desvantagens: - efeitos colaterais - tratamento demorado - controle de cura necessária - já existem cepas de laboratório que são resistentes contra Benzonidazol - Apenas existe um empresa que produzia o remedio e nao existe mais interesse comercial em continuar Nova terapia: Células Tronco autólogos Obtenção de células tronco da medula óssea do paciente (teste para T. cruzi) Injeção via cateter perto do miocárdio inflamado/debilitado Vacinas? - Contra formas infectantes: formas tripomastigotas (na base de resposta humoral ou celular) - Alvo ideal seriam antígenos da fase amastigota (resposta celular -> Amastigote surface protein 2) Vários tipos de vacinas utilizando diferentes estruturas do parasita estão em teste em camundongos, a resposta celular do tipo Th1 é essencial Informações e links relevantes: http://tcruziDB.org http://www.dbbm.fiocruz.br/TcruziDB/index.html http://www.hhmi.ucla.edu/parasite_course/Default.htm http://www.prossiga.br/chagas/ Literatura: L. Rey: Parasitologia Markell´s and Voge´s Medical Parasitology
Baixar