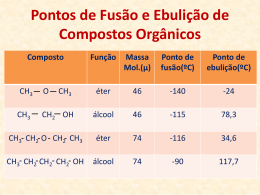
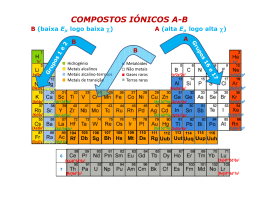
Cristais Covalentes - Diamante C E=0 estado fundamental C estado de valência Cn diamante … s* 2sp3 4n/2 orbitais antiligantes 2p Localizadas E 2sp3 2s 4 orbitais por átomo … 4n/2 orbitais ligantes CFC ½ tetra ocupados s 2sp3 Cristais Covalentes - Grafite C E=0 estado fundamental C estado de valência Cn grafite 3n/2 orbitais antiligantes 1 orbital por átomo … 2pz 2p E p2pz 2sp2 2s s* 2sp2 p*2pz Localizadas Deslocalizadas n orbitais p com n electrões 3 orbitais por átomo … s2sp2 Localizadas 3n/2 orbitais ligantes com 3n electrões 1 AULA – INTERACÇÕES MOLECULARES ______________________________________________________________ Polarizabilidade e número de electrões 2He 10Ne 18Ar 36Kr 54Xe 86Rn nº electrões 2 10 18 36 54 86 α (10–24 cm3) 0.20 0.39 1.63 2.46 4.00 5.42 Átomo Momento dipolar, µ, da molécula e ponto de ebulição. Número de electrões µ (Debye) Temp. ebulição (°C) Isobutano (CH3)3CH Isobutileno (CH3)2C=CH2 Trimetilamina (CH3)3 N 34 32 34 0 0.049 0.67 -10 -6 5 Temperatura de ebulição e momento dipolar, µ, em moléculas de pequenas dimensões. Propano Dimetiléter Óxido de etileno CH3 CH2 CH3 CH3 O CH3 O α 1024 (cm3) 6.4 6.0 5.2 µ (D) T ebulição (K) 0 231 1.30 248 1.90 284 2 Temperatura de ebulição e momento dipolar, µ, em moléculas de grandes dimensões. Para Cl Meta Cl Orto Cl Cl Cl Cl α 1024 (cm3) µ (D) T ebulição (K) 19 19 19 0 1.72 2.50 446 445 453 Tensão superficial γ (10–3 N m–1) 20 ºC H2O 72.8 CH3OH 22.6 n-C2H5OH 22.8 n-C4H9OH 24.6 3 Viscosidade η (10–3 kg m–1 s–1) 20 ºC H2O 1.002 CH3OH 0.597 CH3CH2OH 1.200 CH3CH2CH2OH 2.256 CH3CH2CH2CH2OH 2.948 CH3(CH2)6CH3 0.542 CH3(CH2)7CH3 0.711 CH3(CH2)14CH3 3.34 CH3(CH2)4CH3 (C6H14) 0.313 3-metilpentano (C6H14) 0.307 2,3-dimetilpentano (C6H14) 0.295 4 Acido Bórico H3BO3 H O O H O B H H B O H O O H H O H H B O O O H O O H O O O O O O O O H B O H O H H H H B H H O H B B O H O H Hélice alfa O H O O B H H H H O H B O H B B H O H O H O H H H O O B O H H H B O O O H 1 AULA – COMPOSTOS IÓNICOS ______________________________________________________________ Fracções de carácter iónico Halogenetos e Óxidos dos Metais Alcalinos e Alcalino-Terrosos Compostos X+Y- Compostos X2+Y2- Li Na K Rb Mg Ca Sr F 0.915 0.946 0.955 0.960 O 0.841 0.913 0.926 Cl 0.903 0.935 0.953 0.955 S 0.786 0.902 0.914 Br 0.899 0.934 0.952 0.957 Se 0.790 0.900 0.917 I 0.890 0.927 0.950 0.951 Te - 0.894 0.903 Estruturas de Compostos Iónicos Preenchimento dos Interstícios Tetraédricos ou Octaédricos, de Estruturas CFC ou HC Composto Estrutura 2 Tipo de interstício Fracção de interstícios preenchido preenchida CaF2 (Fluorite) CFC Tetraédrico 1 NaCl CFC Octaédrico 1 NiAs HC Octaédrico 1 ZnS (blenda) CFC Tetraédrico 1/2 Wurtzite HC Tetraédrico 1/2 CdCl2 CFC Octaédrico 1/2 CdI2 HC Octaédrico 1/2 CrCl3 CFC Octaédrico 1/3 BiI3 HC Octaédrico 1/3 Al2O3 CFC Octaédrico 2/3 3 Energia de rede Constante de Rede, A (constante de Madelung) Estrutura Nº Coord. Iões A Cloreto de sódio 6:6 A+,B- ou A2+,B2- 1,748 Cloreto de césio 8:8 A+,B- 1,763 Blenda 4:4 A+,B- 1,638 Wurtzite 4:4 A+,B- 1,641 Fluorite 8:4 A2+,2B- 2.519 Rútilo 6:3 A2+,2B- 2.408 Corundo 6:4 2A3+,3B2- 4.172 4 Raios Iónicos e Cargas dos Iões -U/kJ mol-1 Composto -U/kJ mol-1 LiF 1034 - - LiCl 833 - - LiBr 787 - - NaF 914 MgO 3850 NaCl 766 - - NaBr 728 - - KF 812 CaO 3477 KCl 690 - - KBr 663 - - KI 632 - - RbF 780 SrO 3205 Composto A energia de rede: - aumenta com as cargas dos iões - diminui com o aumento dos raios iónicos 5 Temperaturas de Fusão e Ebulição (ºC) Temp. de Ebulição Temp. de Fusão Compostos X+Y- Compostos X2+Y2- F- Cl- Br- I- O2- Li+ 845 605 550 449 Be2+ 2530 Na+ 993 801 747 661 Mg2+ 2852 K+ 858 770 734 681 Ca2+ 2614 Rb+ 795 718 693 647 Sr2+ 2420 Cs+ 682 645 636 626 Ba2+ 1918 Li+ 1676 1325 1265 1180 Be2+ 3900 Na+ 1695 1413 1390 1304 Mg2+ 3600 K+ 1505 1500* 1435 1330 Ca2+ 2850 Rb+ 1410 1390 1340 1300 Sr2+ 3000 Cs+ 1251 1290 1300 1280 Ba2+ Solubilidade em Água (mol dm-3) Ião F- Cl- Br- I- Li+ 0.10 15.03 16.70 12.33 Na+ 1.00 6.11 11.27 12.28 K+ 15.89 4.65 4.49 7.68 Rb+ 12.50 6.37 5.93 7.16 Cs+ 24.16 9.64 5.84 1.69 S2- >2000 6 Dureza R U Dureza 10-10 m kJ mol-1 esc. Mohs -2, +2 2.10 3929 6.5 CaO -2, +2 2.40 3477 4.5 SrO -2, +2 2.57 3205 3.5 BaO -2, +2 2.77 3042 3.3 NaBr -1, +1 2.75 728 2.5 Composto Cargas MgO Estrutura tipo Cloreto de Sódio (NaCl) Na+ _ Cl Estrutura tipo Blenda (ZnS) Zn 2+ S 2_ Na+ _ Cl Estrutura tipo Fluorite (CaF2 ) Ca2+ F _ Estrutura tipo Cloreto de Césio (CsCl) Cl _ Cs + Cl Cs + _ Cl Cs + _
Baixar