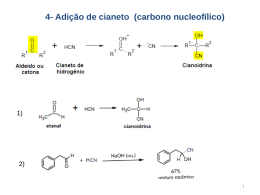
Todas as reações dos Compostos de Grignard Primeiramente vamos relembrar os compostos de Gringnard. Compostos de Grignard são os principais compostos organometálicos da química orgânica, onde o metal é o magnésio. Descobertos por Victor Grignard que recebeu, por isso, o prêmio Nobel em 1912. São compostos de fórmula geral RMgX ou ArMgX onde R é um radical alquil, Ar é um radical aromático e X é um halogênio (F, Cl, Br, I). São também conhecidos com haletos de alquil magnésio ou reagentes de Grignard. Exemplos: CH3MgCl MgBr cloreto de metil magnésio CH3-CH2MgBr brometo de etil magnésio brometo de fenil magnésio Importância: são utilizados como matéria-prima na obtenção de um grande número de compostos orgânicos de outras funções. Segue uma tabela resumida com as principais reações dos compostos de Grignard de ensino médio. Formação dos compostos de Grignard: R−X + Mg(pó) RMgX Haleto Reações de Zerewitinoff: teste para H ativos. Substituição eletrofílica. + H2O RH + Mg(OH)X. água alcano + HX RH + MgX2. ácidos alcano + R1–COOH R1–COOMgX + RH. ácido carboxílico alcano + Ar–OH Ar–OMgX + RH. fenol alcano + R1–OH R1–OMgX + RH. álcool alcano A reação com haletos não é de Zerewitinoff porque não tem H ativos, mas segue a mesma lógica da substituição: + R1X R–R1 + MgX2. haleto alceno alílico RMgX Reações de adição nucleofílica ou adição à carbonila: R | + R1–CO–R2 (H2O) R1–C–R2 + MgOHX. | OH aldeído ou cetona álcool 1º, 2º, 3º + CO2 (HX) R–COOH + MgX2. ácido carboxílico + R1–COO–R2 R1–CO–R + MgOR2X. éster cetona + R1–COX R1–CO–R + MgX2. haleto de acila cetona + R1–C ≡ N (2H2O) R1–CO–R + NH3 + MgOHX. nitrila cetona + R1–NC (2H2O) R1–NH2 + R–CHO + MgOHX. isonitrila amina aldeído CH2CH2O (H2O) R–CH2–CH2–OH óxido de etileno álcool Tabela elaborada pelo prof. Rossoni + + MgOHX. Haletos Os haletos são importante matéria-prima para obtenção de compostos de Grignard. A formação ocorre com a adição de metais, no caso magnésio, em haletos. CH3–Br + Mg (éter/seco) CH3MgBr. CH3−CH2–Cl + Mg (éter/seco) CH3−CH2MgCl. Os compostos organometálicos (especialmente Grignard) são muito reativos e se prestam a inúmeras sínteses orgânicas. A reatividade dos compostos de Grignard é explicada pela polaridade da molécula, que possibilita uma fraca dissociação: – + RMgX R + MgX. Onde forma-se um íon orgânico contendo carbono negativo (íon de carbânio) que irá atacar regiões positivas de outras moléculas (ataque nucleofílico). Os haletos reagem com compostos de Grignard para formação de hidrocarbonetos: RX + R1MgX R–R1 + MgX2. Éter Os éteres tem caráter básico. Devido ao seu caráter básico, reagem com os ácidos de Lewis dando complexos denominados eteratos. C2H5–O–C2H5 + BF3 C2H5–O–C2H5. BF3 eterato de fluoreto de boro 2 C2H5–O–C2H5 + RMgX C2H5–O–C2H5 . R–Mg–X C2H5–O–C2H5 . eterato de compostos de Grignard Por isso, os compostos de Grignard são sempre preparados e usados em solução etérica. Alcanos + Os compostos de Grignard tratados com um ácido (H ) ou água produzem alcanos, desde que o radical seja saturado e alifático. CH3MgBr + H + CH4 + Mg +2 + Br. Obs: trata-se de uma substituição eletrofílica. Alcenos Os haletos do tipo alílicos são capazes de reagir com os compostos de alquil-magnésio e produzirem alcenos. CH3CH2MBr + BrCH=CH2 (éter) CH3CH2CH=CH2 + MgBr2. Obs: A reação não pode ser feita na água, pois hidrolisa o composto de Grignard O haleto deve ser do grupo alílico, pois assim a reação será bem mais fácil, devido a formação do carbocátion. + + CH2=CHCH2Br CH2=CHCH2 CH2CH=CH2. (íon carbocátion) Aromáticos Transformação do Ar-X em composto de Grignard: CH 3 CH 3 Cl + MgCl éter Mg(p ó) Hidrólise do composto de Grignard: CH 3 CH 3 MgCl + + H 2O Mg(O H)C l obs: Para aumentar os átomos de carbono no aromático, podemos reagir um composto de Grignard com um derivado de preferência alílico: MgBr + Br CH 2 CH 2 CH CH 2 + MgBr2 CH CH 2 Ácidos carboxílicos Os compostos de Grignard são usados na preparação de ácidos carboxílicos. RMgX + CO2 R–COOMgX (HCl) R–COOH + MgXCl por exemplo: CH3–CH2MgCl + CO2 CH3–CH2–COOMgCl (HCl) CH3–CH2–COOH + MgCl2. E também ocorre substituição do H com compostos de Grignard: CH3–COOH + CH3MgX CH3–COOMgX + CH4. Essa é a reação de Zerewitinoff e serve para medir os H ativos. Fenol Substituição do H do fenol Ar–OH + RMgX Ar–O–MgX + RH é a Reação de Zerewitinoff, teste para H ativos. Como os fenóis são muito mais ácidos que os álcoois é interessante notar que os fenóis reagem com bases, enquanto os álcoois não reagem (só reagem com os próprios metais alcalinos e alcalinos terrosos). Pelo contrario, enquanto os álcoois reagem com ácidos dando ésteres, os fenóis não conseguem fazê-lo (os fenóis só reagem com cloretos de acila ou anidridos). Álcool Substituição do H do álcool R–OH + RMgX R–O–MgX + RH haleto de alcoxi magnésio (por exemplo, CH3–OMgBr: brometo de metoxi magnésio) Essa reação é conhecida como Reação de Zerewitinoff – usada para dosar H ativos como é o caso do R–OH; mede-se então o volume do RH gasoso que é produzido. Mecanismo geral de adição à carbonila: Aldeídos, Cetonas e Álcoois As reações de com compostos de Grignard com aldeídos e cetonas são importantes para produção de vários tipos de alcoóis. São reações de adição nucleofílica que ocorre na carbonila. Analise o esquema do prof. Rossoni abaixo: O R1 C R 2 + R 3MgX OMgX R1 C R2 H 2O OH R1 R3 C R 2 + Mg(O H)X R3 Assim: aldeído fórmico ––––––––––––––––––> álcool primário aldeído qualquer –––––––––––––––––> álcool secundário cetona qualquer –––––––––––––––––-> álcool terciário Analisando de outra maneira, podemos escrever a reação assim: Um exemplo importante deste tipo de reação é a produção industrial do Tamoxifeno (é um Modulador Seletivo do Receptor de Estrógeno oral que é utilizado no tratamento do câncer de mama, e é atualmente o tratamento mais vendido para este tipo de câncer). Éster Os compostos de Grignard, reagem com a carbonila do éster: Reação lenta: R1 C OMgX O + R 2MgX OR R1 C R2 R1 OR C R 2 + MgORX O Reação rápida: O OMgX C R 2 + R 3MgX R1 R1 C R2 H 2O OH C R 2 + Mg(O H)X R1 R3 R3 Nesta seqüência de reações nós não podemos “parar” na cetona pois ela é muito mais reativa que o próprio éster de partida. Cloreto de acila Os cloretos de acila reagem com compostos de Grignard produzindo cetonas que imediatamente reagem com excesso de Grignard chegando a álcoois terciários. R1 C OMgX O Cl + R 2MgCl R1 C R2 R1 Cl C R 2 + MgCl2 O Nitrilas As nitrilas reagem com compostos de Grignard formando cetonas: R2 R 1 CN + R 2MgX R1 C NMgX 2 H 2O R1 C R 2 + NH 3 + MgOHX O Isonitrilas As isonitrilas reagem com compostos de Grignard formando aldeídos e aminas: R2 R1 N C + R 2MgX R1 N CMgX 2 H2 O R2 C O H + R1 NH 2 + MgOHX Óxido de etileno Uma reação semelhante é do óxido de etileno com compostos de Grignard: CH2 CH2 + RMgX R CH2 CH2OMgX H 2O R CH2 CH2OH O óxido de etileno ––––––––––––––––––> álcool primário Outros álcoois mais complicados poderão ser obtidos a partir de óxidos de etileno substituídos: CR 2 O CR 2 O reagente de Grignard poderá reagir com uma variedade de compostos carbonilados: Outras reações com compostos de Grignard: Fonte: http://en.wikipedia.org/wiki/Grignard_reaction (e tem mais reações por lá, vale a pena dar uma olhada).
Baixar