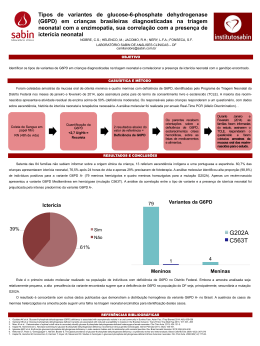
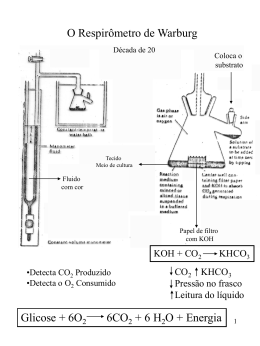
A UTILIZAÇÃO DO LABORATÓRIO CLÍNICO NA INVESTIGAÇÃO DAS ERITROENZIMOPATIAS Fernando L. A. Fonseca*, Patrícia R. Barbosa#, Daniela Raguer#, Jorge Luiz Freire Pinto**, Roseli Corazzini*** e Roberto Carlos Sallai**** * Resumo Abstract As eritroenzimopatias são distúrbios do metabolismo eritrocitário que causam encurtamento da vida dessas células compremetendo a sua forma e a sua função. Exames de rotina podem ser usados para o auxílio diagnóstico dessas patologias , porém exames mais elaborados tecnicamente são poucos utilizados. O artigo destina-se a informar as principais alterações vistas nos exames de rotina e ainda reúne os métodos descritos na literatura para a investigação de enzimas do metabolismo eritrocitário. The red blood cells patologies are diseases of the metabolism that cause shortening of the life from these cells and can impaire the shape and function. Routine examinations from clinical analyses can be used to diagnostic of these diseases, however elaborated methods are little used. In this report we proposed to inform the main alterations in the routine examinations and to organize the described methods for searching the enzymes from red blood cell metabolism. Palavras-chave: Eritrócitos. Doenças do sangue - Anemia hemolítica. Distúrbios do metabolismo - Glicose-6-fosfato desidrogenase. Distúrbios do metabolismo - Piruvatoquinase. Keywords: Red blood cell. Hematological diseases - Hemolytic anemia. Metabolic disturbance Glucose-6-fhosfhate desidroghenase. Metabolic disturbance - Piruvato kinase. Dr. em Hematologia pela FMUSP, Chefe do Lab. de An. Clínicas da FMABC, Prof. de Hematologia do Curso de Ciências Farmacêuticas da FMABC. #Serviço de Pós Graduação USP. **Farmacêutico-Bioquímico do Lab. An. Clínicas da FMABC. ***Me. Em Patologia Geral pela FMVZ-USP, Profa. Do Curso de Ciências Biológicas do CUFSA, Autora Coleção Biologia-Projeto Escola Cidadania, Editora do Brasil. ****Me. em Biologia Molecular – UNIFESP, Prof. do Curso de Ciências Biológicas do CUFSA. As eritroenzimopatias são conhecidas por provocarem hemólise a partir da alteração do metabolismo energético no interior das hemácias. Os distúrbios metabólicos mais conhecidos ocorrem na via glicolítica de Embden-Meyerhof (deficiência da enzima piruvato-quinase) e no shunt do monofosfato de hexose (deficiência da glicose–6–fosfato–desidrogenase - G6PD). Dentre as enzimas eritrocitárias reclamadas pela clínica , destacam-se as seguintes: hexoquinase (HK), glicerofosfoisomerase, gliceraldeído-3 fosfatoisomerase, fosfofrutoquinase, pirivatoquinase (PK), glicose-6–fosfato-desidrogenase fosfogliceratoquinase, glutation peroxidase, (G6PD), glutation adenilatoquinase, redutase, triose fosfato isomerase, desidrogenase lática. O encurtamento da vida do eritrócito pode ocorrer por defeito intra ou extra corpuscular. Assim, dentre as anemias hemolíticas que ocorrem por anormalidades intracorpusculares, estão as do grupo das anemias hereditárias não esferocíticas, cujos defeitos se localizam em lesões bioquímicas ligadas à síntese deficiente de enzimas da via glicolítica Embden-Meyerhor ou da vias das pentoses-fosfatos (via de Warburg-Dickens-Lipman) envolvendo não só os níveis eritrocitários de enzimas como também os níveis de metabólitos intermediários, coenzimas ou substâncias indiretamente ligadas ao metabolismo da glicose, como é o caso do glutation. A glicose-6-fosfato-desidrogenase é regulada por um gene situado no cromossomo X. Além de ser ligado ao sexo, o defeito é incompletamente dominante: expressa-se completamente nos homens e nas mulheres homozigotas e em grau variável nas mulheres heterozigotas. São variáveis os efeitos da G-6PD, dependendo não só do grau de expressão do defeito como também da variante enzimática e da raça do indivíduo afetado. Há casos onde não há presença de doença hemolítica ou apresentam hemólise crônica de grau leve independente da ingestão de drogas ou a ocorrência de hemólise relaciona-se com a ingestão de drogas (Quadro 1) ou de sementes de Vicia fava (favismo). Tipo Medicamento Cloranfenicol, Antimicrobianos furacina, furadantina Sulfanilamida, Sulfonas/Sulfonamidas gantrisin, dapsona. Ácido Analgésicos acetilsalicílico, acetaminofeno. Antimaláricos Primaquina, atabrina. Naftalina, Miscelânea vitamina K, ácido ascórbico. Quadro 1 - Lista Parcial de algumas substâncias que podem provocar crise hemolítica aguda em pacientes com deficiência de G-6PD A deficiência da G-6PD afeta mais de 200 milhões de pessoas no mundo, mas felizmente apenas uma parcela delas tem manifestações clínicas. A doença foi inicialmente descrita em negros norte-americanos que tomavam primaquina para o tratamento ou profilaxia de malária. Embora a ocorrência esporádica deste defeito tenha sido descrita em grande número de populações das mais diversas regiões do mundo, a deficiência tem prevalência elevada e maior interesse populacional entre negros e em certas regiões do Mediterrâneo. Sua prevalência em negros norteamericanos é de 12-15 %, entre italianos é de 1.3-2 % (mas atinge 14-48 % na Sardenha). Como conseqüência desta distribuição, a doença ocorre no Brasil em descendentes de mediterrâneo (especialmente italianos) e entre negros e pardos. Distinguem-se três principais variantes clínicas da doença. O tipo “negro” foi o primeiro descrito, sendo observado em soldados americanos de raça negra que apresentavam anemia hemolítica de intensidade variável ao ingerirem primaquina ou outras drogas antimaláricas. Observou-se depois que a deficiência de G-6PD, atingia também outras raças e exibia larga distribuição geográfica (tipo “não negro”). Uma terceira variante clínica é observada em lactentes homozigotos ou heterozigotos para a deficiência de G-6PD, sob a forma de icterícia neonatal não relacionada com ingestão de drogas. Além da hemólise induzida por drogas, os indivíduos susceptíveis podem sofrer hemólise aguda por infecções viróticas ou por acidose grave, clinicamente as causas mais comuns. A investigação laboratorial das anormalidades enzimáticas em geral compreende a avaliação qualitativa (testes de Brewer, imunoflurorescência e ascorbato-cianeto) e quantitativa da G-6PD (teste de Beutler). Além disso, deve ser feita a eletroforese da G6PD em acetato de celulose e, nos casos que revelarem alteração, pode ser realizado o estudo molecular desta enzima. Nos casos sem alteração, devem ser avaliadas as demais enzimas eritrocitárias. Quando a avaliação da atividade enzimática é realizada, quer seja quanti ou qualitativamente, é necessário lembrar que os reticulócitos são mais ricos em enzima; deste modo, se a avaliação for realizada após uma crise hemolítica, o indivíduo pode apresentar reticulocitose, o resultado pode ser “normal”; da mesma forma, em paciente com anemia hemolítica crônica, o resultado tem que ser considerado em relação ao número de reticulócitos encontrados na circulação. Finalmente é preciso enfatizar que a transfusão com hemácias normais pode elevar artificialmente o resultado da dosagem de G-6PD de um indivíduo deficiente. Avaliação Laboratorial : Hemograma: As hemácias podem estar normais ou ligeiramente aumentadas de tamanho. Reticulocitose pronunciada, mesmo em presença de anemia moderada. Leucócitos e plaquetas normais. Muitas vezes podemos encontrar no sangue periférico hemácias “mordidas” (bite cells), ou seja, que exibem uma ou mais falhas em sua periferia. Estas células são possivelmente resultantes da remoção dos corpúsculos de Heinz pelo baço. Fragilidade Globular Osmótica: Normal. Eletroforese da Hemoglobina: Normal. Prova de Coombs: Normal. Mielograma: Acentuadíssima hiperplasia da série eritróide. Prova para Corpúsculos de Heinz: São grumos de hemoglobinas desnaturadas que se precipitam dentro da hemácia, sendo facilmente demonstráveis com corantes vitais (p.ex., violeta de metila). São vistos em muito maior número nos pacientes esplenectomizados, pois são removidos do sangue pelas células macrofágicas do baço. Técnica: Reativos: Cristal violeta........................2.0 g Água destilada ..................100 mL Cloreto de sódio ..................0.73 g Água destilada ..................100 mL Para uso, mistura-se pequenas porções das soluções, em partes iguais. Procedimento: • Mistura-se uma gota de sangue (0.1 mL), sobre uma lâmina, com 0.025 mL de cristal violeta. • A mistura é feita com os cantos de uma lamínula, que cobrirá a preparação. • A leitura pode ser realizada após 5 minutos. Interpretação: Os corpúsculos de Heinz aparecem como pequenas inclusões purpúricas na margem das células vermelhas, não corando os reticulócitos. Certas drogas e a presença de hemoglobinas instáveis são responsáveis pelo aparecimento dos corpúsculos de Heinz. Testes de Triagem para Deficiência de G6PD 1 Teste do Ponto Fluorescente (BEUTLER, 1979). Reagentes: D-glicose-6-fosfato (G6P), 10 mmol/L. Dissolva 305 mg do sal dissódico, ou a quantidade equivalente ao sal potássico em 100 mL de água. NADP +, 7.5 mmol/L; Saponina, 750 mmol/L Tampão Tris-HCl, pH 7.8; Glutationa oxidada (GSSG), 8mmol/L. Dissolva 49 mg de GSSG em 10 mL de água. Sangue total (EDTA), 10 mL. Mistura-se os reagentes na seguinte proporção: 2 volumes de G6P; 1 volume de NADP +; 1 volume de saponina; 3 volumes de tampão; 1 volume de GSSG; 2 volumes de água. A solução é estável a –20ºC por ± 2 anos e por 2 meses se conservado a 4ºC. Aliquotar a solução (100 µL) em tubos e manter a –20ºC. Princípio: A formação de NADPH no sangue, em presença deG6PD pode ser visível sob luz UV. Método: Adiciona-se 10 µL do sangue total a uma alíquota (100 µL) da solução de G6P e NADP e homogeneíza-se. Aplica-se uma gota desta solução num papel de filtro (Whatman Nº 1) logo após a mistura e após 5-10 minutos. Colocar sob luz UltraVioleta (UV). Se houver presença de G6PD, o NADP é convertido a NADPH. Este é fluorescente sob luz UV, enquanto que o NADP não. Interpretação: Ponto fluorescente – Presença de G6PD. Ponto não fluorescente – ausência ou pouca G6PD. 2 Teste da Redução da Metahemoglobina (BREWER, 1962) – Teste qualitativo para deficiência de G6PD. Reagentes: Nitrito de Sódio, 180 mmol/L; Dextrose, 280 mmol/L. Dissolva 5 g de dextrose e 1.25 g de NaNO2 em 100 mL de água. Azul de Metileno, 0.4 mmol/L. Dissolva 150 mg de cloridrato de metiltionina em 1 litro de água. Sangue total (EDTA), 0.5 mL. Princípio: O nitrito de sódio converte a hemoglobina a metahemoglobina. Quando o azul de metileno é adicionado à reação e incubado, este estimula a via da pentose fosfato em indivíduos que apresentam níveis normais de G6PD, reconvertendo a metahemoglobina a hemoglobina. Método: Marca-se 3 tubos de ensaio grandes como positivo, negativo e teste. Procede-se da seguinte forma: Solução de Nitrito/Glicose Solução de Azul de Metileno Sangue em EDTA Positivo Negativo Teste 10 mL ------- 10 mL ------- 10 mL 10 mL 100 mL 100 mL 100 mL Incuba-se a 37ºC por 3 horas. Adicionar 10 mL de água destilada. Fazer a leitura entre 5 e 10 minutos comparando o tubo teste com os demais. O tubo positivo apresentará coloração acastanhada pela formação de metahemoglobina. O tubo negativo apresenta coloração avermelhada (vermelho vivo), uma vez que o azul de metileno reconverteu a metahemoglobina a hemoglobina novamente. Interpretação: Amostra normal – coloração vermelha; Amostra deficiente em G6PD – coloração castanha. 3 Teste do Ascorbato-Cianeto (JACOB, 1966). Reagentes: Ascorbato de Sódio, 10 mg. Dispense 10 mg de ascorbato de sódio e 5 mg de glicose num determinado número de tubos. Os tubos devem ser tampados e estocados por tempo indeterminado a –20ºC. Cianeto de Sódio, 500 mg pH 7.0. Dissolve-se 500 mg de NaCN em 50 mL de água e adicione 20 mL de tampão fosfato iso-osmótico, pH 7.4. Neutralize-se a solução (para pH 7.0) com 2 ml/L HCl e o volume é acertado para 100 mL. Esta solução é estável indefinidamente a 20ºC. Sangue total (EDTA), 5 mL. Princípio: Quando o cianeto de sódio e o ascorbato de sódio são adicionados à amostra de sangue, a catalase é inibida pelo cianeto e há a formação de peróxido de hidrogênio pela oxidação do ascorbato e da oxihemoglobina. O peróxido gerado, converterá a oxihemoglobina a hemicromo e metahemoglobina, a menos que este seja reduzido pela glutationa peroxidase. A reação requer a glutationa como doador de prótons. Em deficientes de G6PD há diminuição da glutationa. Método: Em um tubo de ensaio contendo o ascorbato, coloca-se 2,0 mL de sangue e adiciona-se 2 gotas da solução de cianeto. Mistura-se por inversão e incuba-se a 37ºC por 4 horas. O tubo é Invertido e observa-se a coloração na parede do tubo. A cor escura do sangue está relacionada à deficiência de G6PD. Amostras normais, mantém sua coloração avermelhada. *OBS.: Método não específico para G6PD. Testes para Detecção de Deficiência de G6PD 1 Teste Quantitativo de G6PD (BEUTLER, 1984). Reagentes: Tampão TRIS-HCl 1M, EDTA 5mM, pH 8.0; MgCl2, 0.1 M; NADP2 mM; Hemolisado 1:20; G6P 6 mM; Água bi-destilada. Método: Prepara-se o hemolisado utilizando-se 3 mL de sangue colhido em 1 mL de ACD. Determina-se a concentração da hemoglobina no hemolisado. A amostra é preparada da seguinte forma: Incuba-se a 37ºC por 10 minutos. Acrescenta-se 100 mL de G6P 6mM ao tubo de amostra, para desencadear a reação. A variação da densidade óptica (DO) por minuto é acompanhada em espectrofotômetro, em 340 nm a 37ºC. Branco Amostra TRIS-HCl 1M, EDTA 5mM, ph 8.0 100 µL 100 µL MgCl2, 0.1 M 100 µL 100 µL NADP 2 mM 100 µL 100 µL Hemolisado 1:20 100 µL 100 µL Água bidestilada 680 µL 580 µL Incuba-se a 37ºC por 10 minutos. Acrescenta-se 100 mL de G6P 6 mM ao tubo de amostra, para desencadear a reação. A variação da densidade óptica (DO) por minuto é acompanhada em espectrofotômetro, em 340 nm a 37ºC. Cálculo: AE = D DO/min x 10 5 > UI/gHb/min. a 37ºC E x V x Hb Onde: AE – Atividade Enzimática DO/min – Variação da densidade óptica por minuto; Hb – concentração da hemoglobina no hemolisado em g/dL; E – coeficiente de extinção molar da coenzima NADP+ (6.22); V – volume de hemolisado em mL, utilizado no sistema; 5 10 – correção da hemoglobina no hemolisado em gramas por 100 mL de sangue. VALORES DE REFERÊNCIA: 12.1 ± 2.09 UI/gHb/min. a 37ºC. Teste de Triagem para Piruvato Quinase (PK) 1 Teste do Ponto Fluorescente (BEUTLER, 1984). Princípio: A piruvato quinase catalisa a fosforilação do ADP em ATP pela fosfoenolpiruvato (PEP) com a formação do piruvato. Este reduz o NADPH presente a NAD com a formação de lactato. A diminuição da fluorescência sob UV indica a presença de PK. Teste para Detecção de Deficiência de Piruvato Quinase (PK) 1 Teste Quantitativo de PK (BEUTLER, 1984) Reagentes: Tampão TRIS-HCl 1M, EDTA 5mM, pH 8.0; KCl, 1M MgCl2, 0.1 M; NADH 2 mM; ADP 30mM; LDH 60U/mL; PEP 50 mM; Hemolisado 1:20; Água bi-destilada. Princípio: A PK catalisa a fosforilação da adenosina difosfato (ADP) a adenosina trifosfato (ATP) pelo fosfoenolpiruvato (PEP). A velocidade de formação do piruvato é medida pela oxidação do NADH na reação da lactato desidrogenase. Método: Prepara-se o hemolisado utilizando-se 3 mL de sangue colhido em 1 mL de ACD. Determina-se a concentração da hemoglobina no hemolisado. Procede-se à amostra da seguinte forma: Branco Amostra TRIS-HCl 1M, EDTA 5mM, ph 8,0 100 µL 100 µL KCl, 1 M 100 µL 100 µL MgCl2 , 0.1 M 100 µL 100 µL NADH, 2 mM 100 µL 100 µL ADP neutralizado, 30mM ------ 50 µL LDH 60U/mL 100 µL 100 µL Hemolisado 1:20 20 µL 20 µL Água bidestilada 380 µL 330 µL Incuba-se a 37ºC por 10 minutos. Acrescenta-se 100 mL de PEP 50mM a ambos os tubos. A variação da densidade óptica (DO) por minuto é acompanhada em espectrofotômetro, em 340 nm a 37ºC. Cálculo: AE = D DO/min x 10 5 > UI/gHb/min E x V x Hb 37ºC Onde: DO/min – Variação da densidade óptica por minuto; Hb – concentração da hemoglobina no hemolisado em g/dL; E – coeficiente de extinção molar da coenzima NADH (6.22); V – volume de hemolisado em mL, utilizado no sistema; 10 5 – correção da hemoglobina no hemolisado em gramas por 100 mL de sangue. VALORES DE REFERÊNCIA: 15.1 ± 1.96 UI/gHb/min. a 37ºC. Detecção Molecular para G6PD e PK O material utilizado para este tipo de detecção é o DNA genômico isolado de leucócitos do sangue periférico por procedimento padrão. Inicialmente são pesquisadas as principais mutações, já que a nossa população possui um alto índice de miscigenação tornando praticamente impossível determinar a origem dos pacientes. Já foram descritas aproximadamente 78 variantes relacionadas diretamente relacionadas com as mutações da G6PD. As principais variantes são: Variante Mediterrâneo O principal estudo da variante mediterrâneo se dá através da análise da substituição de uma citosina por uma timina (CÆT) levando à substituição de uma serina (Ser) por uma fenilalanina (Phe) na posição 188. Variante AO principal estudo da variante A se dá através da análise de duas substituições uma guanina por uma adenina e uma adeninda por uma guanina, nas posições 202 e 68 respectivamente. Para a Piruvato Quinase foram detectadas cerca de 47 mutações e a análise é baseada pricipalmente em deleções de bases ou mutações por splicing. A principal mutação encontrada está relacionada com a deleção de uma citosina (C) na isoenzima L da piruvato quinase. Além da análise do DNA genôminco diretamente por PCR (reação em cadeia da polimerase), as mutações podem ser estudadas por clonagem de cDNA, sequenciamento e SSCP. De acordo com a necessidade de diagnóstico será empregado uma ou mais técnicas. REFERÊNCIAS BEUTLER, E. G6PD deficiency. Blood, New York, v. 84, n. 11, p. 3613-3636, Dec. 1994. DACIE, J. V.; LEWIS, S. M. Investigation of the hereditary haemolytic anemias. In: PRACTICAL haematology. 6. ed. New York: Churchill Livingstone, 1984, p. 159-168. LUKENS, J.N. Anemias hemolíticas hereditárias associadas a anormalidades da glicólise anaeróbica dos eritrócitos e metabolismo dos nucleotídeos. In: Lee, G.R. et al. Wintrobe hematologia clínica. São Paulo: Manole, 1998, v. 1. p. 1084-1100. ___________ . Deficiências de glicose-6-fosfato desidrogenase e deficiências relacionadas que envolvem a via da pentose fosfato e metabolismo da glutationa. In: Lee, G.R. et al. Wintrobe hematologia clínica. São Paulo: Manole, 1998, v. 1. p. 1101-1119. LORENZI, T. F. et al. Manual de hematologia: propedêutica e clínica. 3. ed. Rio de Janeiro: Medsi, 2003. MIWA, S.; FUJII, H. Molecular basis of erythroenzymopathies associated with hereditary hemolytic anemia: tabulation of mutation enzymes. American journal of hematology, v. 151, p. 122-132, 1996.
Baixar