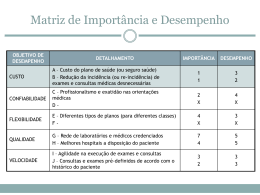
Professora Mirian Maya Sakuno Introdução a Química Analítica Química Analítica ou Química Quantitativa QUÍMICA ANALÍTICA: É a parte da química que estuda os princípios teóricos e práticos das análises químicas. Tem como objetivo prático a determinação da composição química de substâncias puras ou de suas misturas. Química Analítica Qualitativa O que tem ? Química Analítica Quantitativa O quanto tem ? Procedimento analítico Qualitativo Objetivo Envolve a identificação de um ou mais componentes de uma amostra Este procedimento não Informa a quantidade dos analitos Quantitativo É utilizada para determinar a quantidade de um componente na amostra A presença do analito deve ser confirmada antes da análise Análise Análise é um processo que fornece informações químicas ou físicas sobre os constituintes de uma amostra ou sobre a própria amostra. Ex: Análise de glicose em uma amostra de sangue Analito Analitos são os constituintes de interesse na amostra. Ex: Análise de glicose em uma amostra de sangue, o analito é a glicose. Matriz Todos os constituintes da amostra com exceção dos analitos. Medida Determinação experimental de uma propriedade química ou física do analito. Técnicas & métodos Técnica: uma técnica é um princípio químico ou físico que pode ser usado para analisar uma amostra. Exemplo: Titulometria de neutralização, espectrofotometria de absorção molecular, fotometria de chama, etc. Método: é a aplicação de uma técnica para a determinação de um analito específico em uma matriz específica. Exemplo: Determinação do teor de vitamina C em suplementos vitamínicos por titulometria de oxi-redução. Procedimento & Protocolo Procedimento: é um conjunto de diretivas escritas, que detalham como aplicar um método para uma amostra particular, incluindo informações sobre amostragem adequada, eliminação de interferências e validação de resultados. Exemplo: determinação de vitamina C segundo procedimento do Instituto Adolfo Lutz Protocolo: é um conjunto escrito de orientações estritas, que detalham um procedimento que deve ser seguido para a aceitação da análise pelo organismo oficial que estabeleceu o protocolo. Exemplo: Determinação de um medicamento segundo procedimento da farmacopéia brasileira. Processo Analítico Processo Analítico 1. Problematizarão 2.Elaboração de um procedimento 2.1. Amostragem 2.2. Exatidão 2.3. Seleção de métodos 2.4. Análise de resultados e validação 2.5. Conclusão Processo Analítico 1. Formulando a questão: Traduzir questões gerais em questões específicas acessíveis para serem respondidas por meio de medidas químicas. 2. Selecionando procedimentos analíticos: Procurar na literatura para encontrar procedimentos apropriados, ou desenvolver procedimentos originais. 3. Obter uma amostra bruta representativa do lote. 4. Preparação da amostra: 1)extrair da amostra bruta uma amostra laboratorial homogênea. 2) Converter a amostra laboratorial em uma forma apropriada para análise. 5. Análise: medir a concentração do constituinte em análise em várias alíquotas. A incerteza da medida é tão importante quanto a medida em si. 6. Análise: medir a concentração do constituinte em análise em várias alíquotas. A incerteza da medida é tão importante quanto a medida em si. 7. Análise dos dados: analisar os resultados obtidos, comparar com outros dados da literatura. Fazer o estudo estatístico. 8. Conclusão Amostragem Amostragem: é o processo de seleção do material representativo para análise. Lote Amostragem Amostra bruta representativa Preparo da amostra Amostra homogênea de laboratório Alíquota Alíquota Alíquota Critérios usados na seleção de um método analítico Na escolha de um método analítico devemos considerar os seguintes critérios: exatidão, precisão, sensibilidade escala de operação tempo de análise, disponibilidade de equipamento custo. Exemplo: Quanto de cafeína possui uma barra de chocolate? ??? cafeína I. Pesquisa bibliográfica II. Procedimento analítico Procedimento Analítico *Sólido sem gordura Extração da cafeína em água Pesar e anotar a massa Solvente orgânico centrifugação Solução aquosa Resíduo insolúvel filtração Agitação Resíduo (filtro) Solução contendo os constituintes. centrifugação Solvente + gordura Sólido sem gordura* Análise cromatográfica Erros experimentais Toda medida possui uma incerteza, a qual é chamada de erro experimental. Conclusões podem ser expressa com um alto ou baixo grau de confiança, mas nunca com completa certeza . O erro experimental é classificado em: Sistemático Erro Aleatório Erros sistemáticos: Um erro sistemático, também chamado de erro determinado, aparece de uma falha no projeto de um experimento ou em uma falha de equipamento. O erro é reprodutível se conduzir o experimento várias vezes exatamente da mesma maneira. A princípio o erro pode ser descoberto e corrigido, embora isso não possa ser muito fácil. Por exemplo, uma balança que não está zerada (tarada). Vamos supor que o ponteiro esteja no 0,5kg, todas as medidas estarão 0,5kg maiores que na realidade. Podemos então corrigir esse erro fazendo a subtração de 0,5kg de todas medidas para assim chegar no valor real. Uma característica-chave do erro sistemático é que ele reprodutível. Com cuidado e habilidade, pode ser detectado e corrigido. Erros aleatórios: Um erro sistemático, também chamado de erro indeterminado e resulta dos efeitos variáveis descontroladas (e possivelmente incontroláveis). Ele está sempre presente, não é corrigido. Um tipo de erro aleatório está relacionado com à leitura de escala. Outro tipo de erro indeterminado pode resultar do ruído de um instrumento elétrico. A princípio o erro pode ser descoberto e corrigido, embora isso não possa ser muito fácil. Exatidão e Precisão Exatidão: se refere a quão próximo um valor de uma medida está do valor “verdadeiro” (padrão, valor teórico). Pode ser descrita pelo erro relativo. % erro = resultado obtido – resultado esperado x 100 resultado esperado % erro < 1 % alta exatidão % erro ≤5% exatidão moderada % erro > 5% baixa exatidão Precisão: é uma medida de reprodutibilidade de um resultado. As medida é considerada precisa quando medimos várias vezes e obtemos resultados próximos. A precisão pode ser estimada pelo desvio padrão. (a) Exato porém sem precisão (b) Preciso e Exato! (c) Nem Precisão e nem exatidão; (d) Preciso mas não exato; Algarismo Significativos O número de algarismos significativos é o número de dígitos necessários para escrever um dado valor em notação científica sem perda da exatidão. Ex1: o número 142,7 possui quatro algarismo significativos, porque pode ser escrito 1,427 x 102. Ex2: o número 6,302x10-6possui quatro algarismos significativos , porque todos os quatro dígitos são necessários. O algarismo zero é significativo quando : 1. No meio do número (ex: 105, 2.01x102) Zero 2. No final de um número do lado direito (ex: 230, 5,50x10-6) Algarismo Significativos O último (o mais afastado a direita) algarismo significativo numa quantidade medida terá sempre uma incerteza. A incerteza mínima deverá ser de ± 1no último dígito. Há incertezas em qualquer quantidade de medida, mesmo que o instrumento possua uma leitora digital. Ex: Quando um medidor de pH indica um pH de 3,51, há incerteza pelo menos no dígito 1. Por contraste, alguns número são exatos. Ex: cálculo de média da altura de 4 pessoas, você irá dividir a soma das alturas por 4 e não por 4,00. Incerteza Absoluta e Relativa Incerteza Absoluta expressa a margem de incerteza associada a uma medida . Ex: Se a incerteza de uma bureta é de ± 0,02 mL , isso significa que, quando a leitura é 13,33mL, o valor verdadeiro pode estar em qualquer lugar da faixa 13,31 a 13,35. Incerteza Relativa é a expressão que compara tamanho da incerteza absoluta com tamanho de suas medidas associadas. A incerteza relativa é um quociente adimensional. Incerteza relativa = incerteza basoluta magnitude da medida Ex: A incerteza relativa de 12,35± 0,02mL = 0,02mL = 0,002 12,35mL ou Incerteza relatica %= 100 x 0,002= 0,2% Estatística A estatística nos fornece ferramentas que são capazes de interpretar resultados com grande probabilidade de correção e de rejeitar resultados não confiáveis. Vamos discutir alguns conceitos estatísticos muito usados na química analítica: 1)Distribuição Gaussiana 2) Média 3) Desvio-padrão 4) Intervalo de confiança 5) Teste Q para descarte de dadosincorretos Distribuição Gaussiana Se um experimento é repetido várias vezes, e se os erros são puramente aleatórios, então os resultados tendem a se agrupar simetricamente sobre o valor médio. Quanto mais vezes o experimento for repetido, mais perto os resultados se aproximam de um curva ideal chamada distribuição gaussiana Média Aritmética (x) Soma dos valores medidos dividida por número de medidas (n). Média = Exemplo: Suponha que foram feitas quatro medidas :821, 783, 834 e 855. Calcule a média aritmética . Média= (821 + 783+ 834+ 855) = 823 4 Desvio-Padrão (s) Mede a proximidade dos dados agrupados em torno da média. Quanto menor o desvio padrão, mais perto os dados estarão agrupados em torno da média. Exemplo: Suponha que foram feitas quatro medidas :821, 783, 834 e 855. Calcule a média aritmética . Desvio padrão = 30 Intervalo de confiança O test t de Student é uma ferramenta estatística para representar intervalos de confiança. Ex: O teor de carboidrato de uma glicoproteina está determinado como 12.6, 11,9 , 13 , 12,7 e 12,5 g por 100g de proteína. Calcule o intervalo de 90% e 50%. Sabendo que a média= 12,5 e s= 0,4 Para intervalo de 50%: 12,9 12,5 ± 0,1 Para intervalo de 90%: 12,6 12,5 12,4 12,5 ± 0,3 12,1 50% de chance de que o valor verdadei ro fique nesse intervalo 90% de chance de que o valor verdadei ro fique nesse intervalo Teste Q para dados incorretos O teste ajuda a decidir se descartamos ou não um dado. a. Colocar os valores obtidos em ordem crescente. b. Determinar a diferença entre o maior valor e o menor valor da série (faixa) c. Determinar a diferença entre o menor valor da séries e o resultado mais próximo (em módulo) d. Dividir esta diferença (em módulo) pela faixa, obtendo o valor Q. e. Se Q > Q 90%(tabela 1.4) valor rejeitado f. Se o menor valor é rejeitado, determinar a faixa para os valores restantes. g. Repetir o processo até que o menor e o maior valores sejam aceitos. Teste Q para dados incorretos a. Colocar os valores obtidos em ordem crescente. b. Determinar a diferença entre o maior valor e o menor valor da série (faixa) c. Determinar a diferença entre o menor valor da séries e o resultado mais próximo (em módulo) d. Dividir esta diferença (em módulo) pela faixa, obtendo o valor Q. e. Se Q > Q 90%(tabela 1.4) valor rejeitado f. Se o menor valor é rejeitado, determinar a faixa para os valores restantes. g. Repetir o processo até que o menor e o maior valores sejam aceitos. Fazer o teste Q para o seguintes resultados : % Cu: 15,42; 15,51; 15,52; 15,53;15,68;15,52;15,56;15,53; 15,54; 15,56.
Download