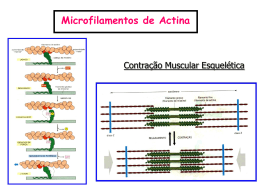
Função protéica (ou nanobiotecnologia sem criador) Prof. Dr. Francisco Prosdócimi • Aula baseada no livro do Lehninger (Nelson e Cox) • Capítulo 5 • The cell – Cap 11 Hormônios protéicos • Hormônios que são proteínas – – – – – – – Prolactina Hormônio de crescimento (GH, HGH) Hormônio adenocorticotrófico (ACTH) Vasopressina Oxitocina Insulina Somatostatina, etc. • Todos esses hormônios viajam no sangue e precisam ser reconhecidos e incorporados em células específicas que são identificadas e reconhecidas através de receptores protéicos ligados às membranas celular Cascatas de regulação • Proteínas viajam no sangue até encontrar receptor de membrana • Interações proteínaproteína e proteína-ligante regulam o metabolismo celular • Acionadas por proteínas de membrana • Reconhecem modificações no meio externo e modificam o ambiente intracelular em resposta A estrutura dinâmica das proteínas • Ligação reversível a outras moléculas: ligantes – Permite resposta rápida a modificações ambientais e condições metabólicas • Sítio de ligação: interage com o ligante – Complementar em tamanho, forma, carga e afinidade à água • A estrutura definida da proteína é como uma foto, na realidade a proteína opera de forma dinâmica O Ligante e o encaixe induzido • O sítio de ligação discrimina entre diferentes moléculas, ou seja, a interação é específica • Uma proteína pode ter sítio de ligação para diversas moléculas • Proteínas são flexíveis, vibram, “respiram” • Mudanças conformacionais (alostéricas) são essenciais para a função protéica • Encaixe induzido: adaptação estrutural da proteína que se liga firmemente a ele Teoria do caos e estrutura de proteínas • Novas teorias dizem que o modelo chave-e-fechadura está refutado • A proteína fica em um estado de movimentação dinâmica razoavelmente caótico – É o substrato induz a mudança conformacional na proteína • Complementaridade interativa: é como se a chave moldasse a fechadura ao encontrar com ela – ou vice-versa Modificações conformacionais • Em uma proteína contendo várias subunidades, uma mudança conformacional em uma delas normalmente afeta a conformação das demais • As ligações com os ligantes podem ser reguladas por meio de interações específicas (fosforilação, glicosilação, etc.) ou por ligação a outros ligantes • Nas enzimas, os ligantes são chamados substratos e o sítio de ligação é chamado sítio catalítico ou sítio ativo • Palavras-chave: ligação, especificidade e mudança conformacional Proteínas de ligação ao O2 • A mioglobina e a hemoglobina são provavelmente as proteínas mais estudadas do mundo – Primeiras a terem estrutura 3D conhecida – Reação reversível de ligação ao O2 • Por que uma proteína? – O2 é pouco solúvel em solução aquosa (sangue) Como ligar e transportar O2 • O problema: nenhuma cadeia lateral de aminoácido é adaptada a ligar uma molécula de oxigênio – Sabe-se que metais de transição (Ferro e cobre) ligam-se bem ao O2, mas... – Ferro livre gera espécies reativas de oxigênio • Grupo prostético: composto associado permanentemente a uma proteína e que contribui para sua função • O grupo heme: anel de protoporfirina, seis ligações A mioglobina • 154 aa; 16700 Kda • Encontrada no tecido muscular de mamíferos – Em focas e baleias guarda O2 para mergulhos longos • Globina (prot. globular) – 8 α-hélices – 78% dos resíduos • Ligações proteína-ligantes são descritas por expressões de equilíbrio P+L PL >gi|44955888|ref|NP_976312.1| myoglobin [Homo sapiens] MGLSDGEWQLVLNVWGKVEADIPGHGQEVLIR LFKGHPETLEKFDKFKHLKSEDEMKASEDLKK HGATVLTALGGILKKKGHHEAEIKPLAQSHAT KHKIPVKYLEFISECIIQVLQSKHPGDFGADA QGAMNKALELFR KDMASNYKELGFQG Hemoglobina • Proteína tetramérica quase esférica com 4 grupos heme – 2 cadeias alfa – 2 cadeias beta • <50% de similaridade na cadeia primária!! – Estrutura 3D muito similar Eritrócitos • Eritrócitos são células altamente especializadas em transportar O2 – Perderam núcleo, mito, retículo – Vivem 120 dias – 34% de seu peso total é de hemoglobina • Hemoglobina está 96% saturada no sangue arterial e 64% no sangue venoso • o CO tem mais afinidade à hemoglobina do que o O2 Proteínas alostéricas • Hemoglobina possui 2 tipos de estados conformacionais: T(enso) e R(elaxado) • A ligação do O2 à subunidade da hmb no estado T desencadeia mudança para o estado R • Em proteínas alostéricas, como a Hmb, a interação com um ligante altera as propriedades de ligação a outros sítios da mesma proteína A hemoglobina também carrega o CO2 • Liga CO2 de forma inversamente proporcional quando relacionado à ligação com o oxigênio • CO2 liga-se como grupo carbamato ao grupo amino do aminoácido que está no Nterminal • Os carbamatos formam pontes salinas adicionais que auxiliam na estabilização do estado T e provem liberação do O2 A ligação do O2 à hmg é regulada por BPG • 2,3 bisfosfoglicerato • Presente em alta concentração nos eritrócitos • Uma molécula ligada para cada hemoglobina – estabiliza o estado T – Dificulta a ligação do O2 à hmg • Quantidade de O2 liberada nos tecidos é ~40% da quantidade máxima transportada no sangue – regulado com altitude • Excesso de BPG => hipoxia Funcionamento inadequado do pulmão • Feto tem hemoblogina que é mais afim de O2 do que a da mãe Anemia falciforme • A mutação homozigota (aa) de um único nucleotídeo que codifica para a cadeia B da hemoglobina faz com que a forma da hemácea seja modificada – Não há cura, transporte ineficiente de O2 • Por outro lado, o heterozigoto (Aa) possui maior resistência à malária já que o Plasmodium não consegue infectar tão bem as hemáceas falciformes – Qual o tipo de tratamento que se dá à doenças genéticas? Interações protéicas moduladas por energia química (ATP) Prof. Dr. Francisco Prosdocimi Citoesqueleto • Rede de filamentos protéicos que se prolongam no citoplasma • Rede estrutural da célula – Define formato e organização geral do citoplasma • Responsável pelos movimentos celulares – Transporte interno de organelas – Transporte de cromossomos na mitose • Estrutura dinâmica – Organizado e desorganizado (divisão celular) Composição do citoesqueleto • Formados por três tipos principais de filamentos arranjados em conjunto e associados a organelas e à membrana por proteínas acessórias – Filamentos de Actina – Filamentos intermediários – Microtúbulos • Funções – Motilidade celular, transporte de organelas, divisão celular e outros tipos de transporte celular FA FI MT Filamentos do citoesqueleto • Cada tipo de filamento do citoesqueleto é um polímero construído a partir de subunidades menores (monômeros) • Podem difundir-se rapidamente pelo citoplasma • Proteínas acessórias associam-se ao citoesqueleto • Os polímeros do citoesqueleto são mantidos por ligações fracas (não covalentes) Actina • Proteína globular, principal proteína do citoesqueleto – 20% das proteínas totais de uma célula – Leveduras: um gene; Mamíferos: 6 genes • Uma das proteínas mais conservadas sendo 90% idêntica desde os fungos até os mamíferos • Usada frequentemente como controle negativo • Quando polimerizada forma filamentos do citoesqueleto • Participa da contração muscular, mobilidade celular, divisão celular, citocinese, movimentação de vesículas e organelas, sinalização celular, estabilização e manutenção das junções celulares, formato celular • Interage com as membranas celulares Filamentos de Actina • Microfilamentos formam feixes ou redes tridimensionais com propriedades de géis semi-sólidos • O arranjo e a organização dos filamentos, as ligações entre feixes e redes e estruturas celulares são regulados pela ligação com uma variedade de proteínas de associação com a actina • Os filamentos são particularmente abundantes junto à membrana plasmática – Suporte mecânico e forma celular – Movimento da superfície celular Microfilamentos de actina • Cada monômero de actina faz uma rotação no filamento, que apresenta estrutura de hélice de dupla cadeia • Possui uma polaridade que será importante para a definição do movimento da miosina • Polimeriza espontaneamente em condições fisiológicas – Polimerização reversível (dinâmica) • Extremidade positiva cresce de 5 a 10 vezes mais rápido do que a negativa Organização dos filamentos • Feixes de actina – Filamentos ligados em agrupamentos paralelos – Proteínas empacotadoras de actina • Redes de actina – Arranjo ortogonal Feixes paralelos • Responsáveis pelas microvilosidades das membranas Redes de actina • Filamentos de actina ligados por proteínas filaminas • Ligações ortogonais – Malha tridimensional frouxa • Sustentação da superfície da célula Adesão celular • Responsáveis pelo contato com células adjacentes • Fibras de estresse – Fibras de actina que promovem adesão celular • Fibras de alfa-actinina ligam cateninas e caderinas • Contato célula-célula – Junções de adesão Projeções de membrana • Microvilosidades intestinais • Estruturas de resposta a estímulo – Formadas por formação e retração de feixes de actina • Pseudópodos • Microespículas Resumo: filamentos de actina • • • • A: Microvilosidades B: feixes contráteis citoplasmáticos C: Protrusões em forma de lâmina e em forma de dedo D: Anel contrátil durante a divisão celular Actina, miosina e o movimento celular • Filamentos de actina estão associados a proteínas miosinas, responsável por movimentos celulares • A miosina é motor molecular – Converte ATP em energia mecânica – Gera força e movimento • Responsável pela contração muscular, divisão celular, movimentações celulares Miosinas • Reconhecidas originalmente como ATPases presentes em músculos lisos e estriados • Conservadas na cabeça (liga actina e hidrolisa ATP), mas variáveis na cauda (interação com moléculas) • Genoma humano possui aproximadamente 40 genes diferentes para miosinas • Forma define a velocidade com a qual se deslocam nos feixes de actina Contração muscular • Especialização das células musculares • Músculo como modelo para o estudo do movimento em nível celular e molecular • Músculos – Estriado esquelético: movimentos voluntários – Estriado cardíaco: bombeia sangue do coração – Liso: movimentos involuntários do estômago, intestino, útero e vasos sanguíneos Músculo esquelético • São feixes de fibras musculares • Citoplasma composto de miofibrilas – Filamento espessos de miosina – Filamentos finos de actina • Sarcômeros – Cadeia de unidades contráteis Sarcômeros • Proteínas titinas – Ligam miosina da linha M até o disco Z • Modelo do filamento deslizante (1954) – – – – – Contração do sarcômero Aproximação dos discos Z Banda A não sofre alteração Bandas I e H desaparecem Deslizamento dos filamentos de actina Linha M O modelo do filamento deslizante • As cabeças globulares da miosina ligam-se à actina – Ligação entre filamentos finos e espessos • A miosina movimenta seus domínios globulares sobre os filamentos de actina em direção ao terminal positivo Modelo da ponte pênsil • Além de ligar-se à actina, as regiões globulares da miosina ligam-se e hidrolisam o ATP, que fornece a energia para a realização do deslizamento • Deslizamento dos feixes de miosina sob os feixes de actina Miosinas não-convencionais • Não formam filamentos • Envolvidas em outros tipos de movimentos celulares – Transporte de vesículas e organelas – Fagocitose, emissão de pseudópodos • Caudas se ligam a organelas • Movimentação sob o esqueleto de actina Microtúbulos • Cilindros ocos de 25nm de diâmetro • Estruturas dinâmicas em constante processo de organização e desorganização • Definem a forma da célula • Promovem locomoção, transporte intracelular de organelas e separação dos cromossomos durante a mitose Tubulina • Proteína globular • Arranjos das formas alfa e beta formam os microtúbulos Estrutura dos microtúbulos • Formado por dímeros de tubulinas alfa e beta • Formados por 13 filamentos lineares organizados em volta do centro do túbulo • Assim como os filamentos de actina são estruturas polares – Extremidade positiva: crescimento rápido – Extremidade negativa: crescimento lento • A polaridade interfere na direção do movimento ao longo do microtúbulo Instabilidade dinâmica • Tubulina ligada a GTP é incorporada ao microtúbulo • A adição de tubulina-GTP ocorre mais rápido do que a hidrólise do GTP -> formação de cap GTP • Na falta de moléculas de GTP ligadas a tubulina, a hidrólise ocorre de forma mais rápida e o complexo é despolimerizado • Remodelamento dos microtúbulos é importante na mitose Microtúbulos, drogas e câncer • Drogas que se ligam à tubulina, como a colchicina e a colcemida inibem a polimerização de microtúbulos • Inibem assim a divisão celular (mitose) • Outras drogas que se ligam aos microtúbulos são também utilizadas no tratamento de câncer, como vincristina e vimblastina Centríolo, centrossomo e organização dos microtúbulos • Microtúbulos se estendem a partir de um centro organizador de microtúbulos – O centrossomo se localiza junto ao núcleo • Durante a mitose os centrossomos formam os fusos mitóticos, responsáveis pela separação dos cromossomos nas células filhas Centrossomos • Formados por um par de centríolos organizados perpendicularmente, circundados pelo material pericentriolar • Centríolo: estrutura cilíndrica formada por 9 tripletes de microtúbulos • Funções de organização dos microtúbulos pelo centrossomo Organização dos microtúbulos na mitose • Organização do fuso mitótico: responsável pela separação dos cromossomos homólogos • Centríolo e componentes do centrossomo são inicialmente duplicados • Os dois centrossomos são então localizados em cada um dos lados do núcleo • Na mitose ocorre despolimerização e retração geral dos microtúbulos Microtúbulos motores e movimentos • Responsáveis por movimentos celulares, transporte intracelular, posicionamento de vesículas e organelas, separação dos cromossomos, batimento de cílios e flagelos • Assim como no caso da actina a movimentação é realizada por proteínas motoras que usam a energia do ATP • Cinesinas e dineínas fazem aqui o papel da miosina Cinesinas e dineínas • Movem-se em direções opostas ao longo dos microtúbulos – Cinesina: move-se para a extremidade positiva – Dineína: extremidade negativa • Cerca de 100 diferentes cinesinas em humanos Transporte de organelas • Neurônios com metros de comprimento precisam ter moléculas transportadas para o axônio • Vesículas secretoras vindas do Golgi são transportadas ao longo dos microtúbulos aos axônios Separação dos cromossomos mitóticos • Ocorre durante a anáfase • Anáfase A – Movimento dos cromossomos em direção ao polo do fuso • Anáfase B Separação dos polos do fuso Cílios e Flagelos • Projeções de membrana formadas por microtúbulos e responsáveis pelo movimento de células eucarióticas • Flagelos de bactérias são protéicos (não tubulina) • Estrutura em axonema (9+2) Sistema imunológico Prof. Dr. Francisco Prosdocimi Proteínas e imunologia • A maioria das interações proteína-ligante não envolve grupo prostético • Discriminação efetiva do ligante é na forma de sítio de ligação proteína-proteína • Resposta imunológica – A distinção molecular entre “próprio” e “não-próprio” – Teoria de rede – O sistema homeostático bioquímica é altamente sensível e desenvolvido através das reações entre ligantes e proteínas Sistemas imunológicos • Imunidade celular – Células hospedeiras infectadas por vírus, parasitas e tecidos estranhos – Linfócitos T • Parasitas possuem receptores de células Tc • Células T auxiliares produzem proteínas sinalizadoras (citocinas) • Imunidade humoral – Infecções bacterianas e virais, proteínas estranhas – Anticorpos ou imunoglobulinas (Ig) – 20% das proteínas do sangue são Igs produzidas pelos linfócitos B Proteínas imunológicas • Proteínas de reconhecimento altamente específicas (humanos teem 108 anticorpos com especificidades diferentes) – Receptor de célula T – Anticorpo produzido por célula B • Antígeno: molécula que induz resposta imunológica – Epitopo: determinante antigênico, região da molécula reconhecida • Imunoglobulinas (ig’s): formadas por 4 cadeias polipeptídicas, sendo 2 pesadas e 2 leves Imunoglobulinas • Ligação específica entre antígeno e anticorpo • Imunoglobulinas podem ser encontradas em monômeros, dímeros, trímeros, multímeros • Marcação do patógeno para engolfamento por macrófagos Ligação antígeno-anticorpo • Firme e específica • É a base para procedimen-tos analíticos importantes • Anticorpo – policlonal: reconhecido por várias células B diferentes – Monoclonal: reconhecidos pela mesma população de células B • Anticorpo pode ser ligado a uma resina cromatográfica para separação de uma proteína específica • Exames sorológicos: detecta presença e quantidade do antígeno • Immunoblot Conclusões • • • • As proteínas teem inúmeras funções celulares A estrutura da proteína é altamente relevante para que ela tenha uma função celular O contato proteína-proteína regula muitas funções intra e intercelulares (receptores de membrana) As proteínas mudam de conformação quando encaixadas a um ligante – A ligação reversível da proteína ao ligante é importante na regulação do metabolismo – Sítios de ligação podem ligar diferentes moléculas, algumas com mais afinidade do que o ligante desejado • • • • Proteínas interagem para a formação do citoesqueleto e contração muscular, gastando energia química Polimeração e despolimerização de complexos poliméricos acontecem em todo o instante nas células Proteínas podem ligar moléculas indiretamente -- através de grupos prostéticos Há um controle dos ligantes mais comuns dentro de um organismo e a presença de novas moléculas desconhecidas aciona o sistema imune • Aula baseada no livro do Lehninger (Nelson e Cox) • Capítulo 5 • The cell – Cap 11
Baixar