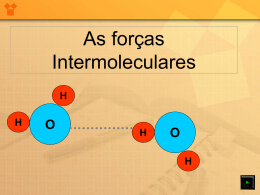
O que você deve saber sobre LIGAÇÕES QUÍMICAS Uma ligação química ocorre quando há atração entre os átomos. Em cada ligação, as partículas positivas são atraídas pelas partículas negativas. Se um dos átomos perde elétrons, o outro deve ganhar elétrons para que os átomos possam adquirir cargas elétricas opostas e se atrair, estabelecendo uma ligação entre eles. I. Ligação metálica Metais, em geral: Conduzem corrente elétrica. São brilhantes e maleáveis. Têm alta condutibilidade térmica. E elevada temperatura de fusão Representação da ligação metálica da prata LIGAÇÕES QUÍMICAS II. Ligação iônica Compostos iônicos: Sólidos Conduzem corrente elétrica em solução aquosa e no estado líquido (quando fundidos). Elevados pontos de fusão e de ebulição LIGAÇÕES QUÍMICAS II. Ligação iônica Retículo cristalino iônico LIGAÇÕES QUÍMICAS III. Ligação covalente Apolar: ligação entre átomos de elementos iguais Polar: ligação entre átomos de elementos diferentes Compostos moleculares: Sólidos, líquidos ou gasosos Não conduzem corrente elétrica nos estados sólido e líquido. Em geral apresentam baixos pontos de fusão e de ebulição LIGAÇÕES QUÍMICAS Tipos de ligação química e interatômica Clique na imagem abaixo para ver a animação. LIGAÇÕES QUÍMICAS IV. Forças intermoleculares O conjunto das forças intermoleculares é chamado de forças de Van der Waals. LIGAÇÕES QUÍMICAS IV. Forças intermoleculares Intensidade das forças intermoleculares Dipolo instantâneo-dipolo induzido Dipolo permanente-dipolo permanente AUMENTA A INTENSIDADE DAS FORÇAS INTERMOLECULARES LIGAÇÕES QUÍMICAS Ligações de hidrogênio IV. Forças intermoleculares Moléculas polares Ligações de hidrogênio na água LIGAÇÕES QUÍMICAS IV. Forças intermoleculares Moléculas polares Apresentam momentos de dipolo de zero. O átomo mais eletronegativo atrai os elétrons, surge uma carga elétrica parcial negativa e, ao redor do átomo menos eletronegativo, surge uma carga elétrica parcial positiva. LIGAÇÕES QUÍMICAS IV. Forças intermoleculares Moléculas apolares Apresentam momento de dipolo = a zero. Em substâncias simples, apresentam cargas elétricas distribuídas homogeneamente em sua extensão. LIGAÇÕES QUÍMICAS IV. Forças intermoleculares Forças intermoleculares e ponto de ebulição Mesmo tipo de interação Massas moleculares próximas LIGAÇÕES QUÍMICAS Mesmo tamanho da molécula Maior P.E. Forças intermoleculares mais intensas Maior P.E. IV. Forças intermoleculares Forças intermoleculares e ponto de ebulição Ponto de ebulição dos hidretos das famílias 14, 15, 16 e 17 LIGAÇÕES QUÍMICAS EXERCÍCIOS ESSENCIAIS 1 (UFRJ) Um professor decidiu decorar seu laboratório com um “relógio de Química” no qual, no lugar das horas, estivessem alguns elementos, dispostos de acordo com seus respectivos números atômicos, como mostra a figura. Indique a fórmula mínima e o tipo de ligação do composto eletricamente neutro que é formado quando o relógio do professor marca: a) nove horas. RESPOSTA: MgF2: ligação iônica b) sete horas e cinco minutos. RESPOSTA: NH3: ligação covalente LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 3 (Unicamp-SP) Observe as seguintes fórmulas eletrônicas (fórmulas de Lewis): Consulte a Classificação Periódica dos Elementos e escreva as fórmulas eletrônicas das moléculas formadas pelos seguintes elementos: a) fósforo e hidrogênio. RESPOSTA: LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 3 b) enxofre e hidrogênio. RESPOSTA: c) flúor e carbono. RESPOSTA: LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 4 (UFC-CE) As forças intermoleculares são responsáveis por várias propriedades físicas e químicas das moléculas, como, por exemplo, a temperatura de fusão. Considere as moléculas de F2, Cl2 e Br2. a) Quais as principais forças intermoleculares presentes nessas espécies? RESPOSTA: As forças intermoleculares presentes são do tipo interações de Van der Waals (dipolo instantâneo-dipolo induzido). b) Ordene essas espécies em ordem crescente de temperatura de fusão. RESPOSTA: F2, Cl2 e Br2 LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 5 (PUC-RJ) Observe a Tabela 1. Desta tabela faça um gráfico relacionando os pontos de ebulição dos compostos listados com suas respectivas massas molares. Do gráfico, deduza o valor esperado para o ponto de ebulição da água (massa molar igual a 18) e complete a Tabela 2 com o valor encontrado. Explique, então, a diferença observada entre o valor deduzido do gráfico e o assinalado como valor real (100 °C). Tabela 1 Tabela 2 LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 5 RESPOSTA: LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 5 Tabela 2 RESPOSTA: O valor esperado para o ponto de ebulição da água é -72 °C (ver no gráfico). Dada a grande diferença de eletronegatividade entre o hidrogênio e o oxigênio, a ligação H–O na água é fortemente polar. Isso faz com que moléculas de água se liguem umas às outras através das pontes (ligações) de hidrogênio, que são interações muito fortes, fazendo com que o ponto de ebulição da água seja elevado. LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 14 (PUC-Minas) Analise o gráfico, que apresenta as temperaturas de ebulição de compostos binários do hidrogênio com elementos do grupo 16 (coluna 6A), à pressão de 1 atm. LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 14 A partir das informações apresentadas, é incorreto afirmar que: a) a substância mais volátil é o H2S, pois apresenta a menor temperatura de ebulição. b) a água apresenta maior temperatura de ebulição, pois apresenta ligações de hidrogênio. c) todos os hidretos são gases à temperatura ambiente, exceto a água, que é líquida. d) a 100 °C, a água ferve, rompendo as ligações covalentes antes das intermoleculares. RESPOSTA: D LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 15 (UFSCar-SP) A tabela apresenta os valores de ponto de ebulição (P.E.) de alguns compostos de hidrogênio com elementos dos grupos 14, 15 e 16 da Tabela Periódica. LIGAÇÕES QUÍMICAS — NO VESTIBULAR EXERCÍCIOS ESSENCIAIS 15 Os compostos do grupo 14 são formados por moléculas apolares, enquanto os compostos dos grupos 15 e 16 são formados por moléculas polares. Considerando as forças intermoleculares existentes nestes compostos, as faixas estimadas para os valores de X, Y e Z são, respectivamente: a) >-111,>-88 e > -60. b) >-111,>-88 e < -60. c) <-111,<-88 e > -60. d) <-111,<-88 e < -60. e) <-111,>-88 e > -60. RESPOSTA: E LIGAÇÕES QUÍMICAS — NO VESTIBULAR
Baixar