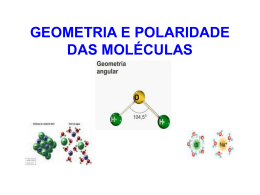
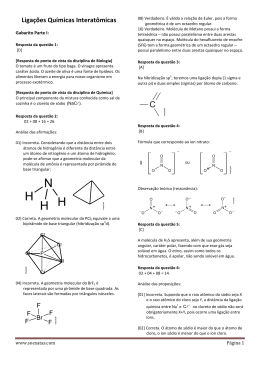
Prof. Willame Bezerra GEOMETRIA MOLECULAR A geometria da molécula diz respeito à posição dos núcleos dos átomos ligantes em relação ao átomo central. É possível encontrar facilmente a geometria de uma série de moléculas, tendo como base apenas o número de átomos que as compõem e a estrutura do átomo central. Consideramos os seguintes exemplos: Molécula formada por 2 átomos A geometria será sempre _____________ independentemente dos átomos envolvidos. Exemplo: Substância H2 I2 HCl HBr CO Fórmula estrutural www.clubedequimica.com.br Prof. Willame Bezerra Molécula formada por 3 átomos a) A geometria será _______________ se o átomo central não possuir par de elétrons não ligantes disponíveis. Exemplo: Substância CO2 CS2 BeH2 HCN Fórmula estrutural b) A geometria será ________________ se o ligantes disponíveis. Exemplo: Substância H2O átomo central possuir par de elétrons não H2S O3 SO2 Fórmula estrutural www.clubedequimica.com.br Prof. Willame Bezerra Molécula formada por 4 átomos, com presença de um átomo central: a) A geometria será _______________plana (triangular), se o átomo central não possuir par de elétrons não ligantes disponíveis. Exemplo: Substância SO3 CH2O COCl2 BH3 Fórmula estrutural b) A geometria será ________________ (pirâmide trigonal), se o átomo central possuir par de elétrons não ligantes disponíveis. Exemplo: Substância NH3 PCl3 SOCl2 SbH3 Fórmula estrutural www.clubedequimica.com.br Prof. Willame Bezerra Molécula formada por 5 átomos, com presença de um átomo central. A geometria será sempre ___________________ independentemente dos átomos envolvidos. Exemplo: Substância CH4 CCl4 SiH4 POCl3 Fórmula estrutural www.clubedequimica.com.br Prof. Willame Bezerra Molécula formada por 6 átomos, com presença de um átomo central: A geometria será ____________________ triangular ou bipirâmide trigonal. Exemplo: Substância PCl5 Fórmula estrutural www.clubedequimica.com.br Prof. Willame Bezerra Molécula formada por 7 átomos, com presença de um átomo central: A geometria será ________________________________________________. Exemplo: Substância SF6 Fórmula estrutural www.clubedequimica.com.br Prof. Willame Bezerra POLARIDADE DE MOLÉCULAS As moléculas podem ser classificadas quanto à sua polaridade em dois grupos: polares ou apolares. A diferença de eletronegatividade entre os átomos provoca na molécula a formação de um dipolo ou momento dipolar , ao qual é atribuído um vetor momento dipolar μ que, por convenção, aponta para o elemento mais eletronegativo. Somando-se todos os vetores momento dipolar de uma molécula, obtêm-se um vetor resultante μ R , que irá definir se a molécula é ou não polar. Se μ R for igual a zero, a molécula é apolar apesar de possuir ligações polares. Se μ R for diferente de zero, a molécula é polar. www.clubedequimica.com.br Prof. Willame Bezerra ALGUMAS EXCEÇÕES AO OCTETO Estudos mostram que existem moléculas estáveis com estabilidade sem atender à regra do octeto. A principal teoria que explica esse fenômeno é a hibridação. Veja as principais exceções ao octeto. www.clubedequimica.com.br Prof. Willame Bezerra Importante Três exceções ainda mais interessantes à regra do octeto são os compostos NO, NO 2 e ClO2, em cujas moléculas aparecem átomos com número ímpar de elétrons na camada de valência. Esses três compostos apresentam alta tendência a reagir quimicamente transformando-se em compostos mais estáveis. Note que, nestas estruturas, nitrogênio e cloro estão com elétrons desemparelhados, ou seja são substâncias paramagnéticas com sete elétrons na última camada. O elétron desemparelhado funciona como um pequeno magneto, que interage com um campo magnético. Em outras palavras, as moléculas ímpares serão atraídas por um campo magnético intenso. www.clubedequimica.com.br Prof. Willame Bezerra EXERCÍCIOS 1- Dar as estruturas de Lewis e descrever a geometria das espécies SO 2, SO3 e SO42-. Para a resolução da questão, considerar a carga do íon localizada no seu átomo central. 2- Quanto a geometria das moléculas, coloque V ou F nas opções abaixo: ( ) N2 Linear ( ) PCl5 Plana trigonal ( ) CO2 Linear ( ) CCl4 Tetraédrica ( ) H2O angular ( ) BF3 Pirâmide trigonal 3- Para as moléculas dadas, coloque P para polares e AP para apolares: ( ) H2 ( ) CH4 ( ) PBr3 ( ) O2 ( ) CO ( ) O3 ( ) NH3 ( ) CO2 ( ) H2O ( ) SO2 ( ) SF6 ( ) S8 www.clubedequimica.com.br
Baixar