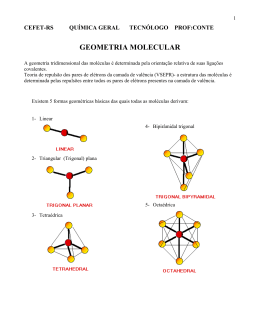
PROFA. JANA MODULAR – GEOMETRIA MOLECULAR 1. UFRGS. Considere as afirmações abaixo, a respeito da estrutura eletrônica e da geometria do íon carbonato, CO32-. I – Este íon apresenta 24 elétrons de valência. II- Sua geometria é trigonal plana. III – Seu átomo central apresenta um par de elétrons não –ligante. Quais estão corretas, de acordo com a Teoria da repulsão dos pares de elétrons da camada de valência? a) Apenas I b) Apenas II c) Apenas III d) Apenas I e II e) Apenas II e III. 02. A molécula de SiH4 tem ângulos de ligação de 90°. 03. A molécula PCl5 tem geometria bipiramidal triangular. 04. A geometria da molécula de SF6 é hexagonal. 4 .Marque a alternative verdadeira em relação a geometria molecular dos compostos : 2. A coluna da esquerda, abaixo, apresenta cinco espécies moleculares que têm o elemento enxofre como átomo central, a da direita, tipos de geometria molecular que correspondem a quatro dessas espécies. Associe corretamente a coluna da direita à da esquerda. 1. SO2 2. SOC 2 3. H2SO4 a) em moléculas formadas por três átomos, sua geometria sera angular se o átomo central não possuir par de elétrons emparelhados disponíveis. Ex. HCN. b)o ângulo entre as ligações na molécula do metano CH4, de 1050, porque sua geometria é tetraédrica. c) no SOCl2, a geometria é piramidal (pirâmide trigonal porque o átomo de enxofre possui, além dos pares de electrons ligantes, um par disponível de electrons. d) em moléculas formadas por cinco átomos, sendo um deles central, a geometria é de bipirâmide trigonal. ( ) trigonal-plana ( ) tetraédrica ( ) piramidal 4. SO3 ( ) angular 5. H2S A sequência correta de preenchimento dos parênteses, de cima para baixo, é 5. (UFC CE) Selecione as alternativas em que há exata correspondência entre a molécula e sua forma geométrica. 01. N2 – linear 02. CO2 – linear 04. H2O – angular 08. PCl5 – plana trigonal 16. CCl4 – tetraédrica 32. BF3 – pirâmide trigonal a) 2 – 3 – 1 – 4. b) 2 – 4 – 3 – 1. c) 3 – 2 – 1 – 5. d) 4 – 3 – 2 – 1. e) 4 – 2 – 3 – 5. 6. Escreva a estrutura de Lewis para cada uma das moléculas abaixo, prevendo a geometria molecular (incluindo os ângulos de ligação) e os orbitais híbridos no átomo central. 3. Analisando as estruturas eletrônicas das moléculas representadas e usando a teoria da repulsão entre os pares de elétrons da camada de valência, assinale as respostas corretas: a) XeOF4 b) XeF4 00. A molécula BeH2 tem geometria idêntica à da água (geometria angular). 01. A molécula BF3 é trigonal planar. Química 1 PROFA. JANA MODULAR – GEOMETRIA MOLECULAR b) A estrutura de Lewis para a molécula de BrF 3 é 7. A teoria da repulsão dos pares eletrônicos sustenta: ao redor do átomo central, pares eletrônicos ligantes e não ligantes se repelem, tendendo a ficar tão afastados quanto possível. De acordo com essa teoria, quais estruturas podem ser previstas para as moléculas de SF 6, PCl5, CH4, respectivamente? a) b) c) d) e) representada pela fórmula F F. F c) Os pares de elétrons ligantes de BrF 3 devem estar o mais próximo possível um do outro para diminuir a repulsão entre eles. d) Os pares de elétrons não ligantes devem formar, no máximo, um ângulo de 45º entre eles para que a repulsão seja mínima. e) A forma geométrica da molécula BrF 3 é uma bipirâmide tetraédrica, bipirâmide trigonal e octaédrica octaédrica, bipirâmide trigonal e tetraédrica bipirâmide trigonal, tetraédrica e tetraédrica tetraédrica, tetraédrica e octaédrica octaédrica, tetraédrica e bipirâmide trigonal 8. (UEM PR) Para se fazer uma previsão sobre a geometria das moléculas, podem-se utilizar várias teorias. Considerando a molécula SF 6, em que a menor distância entre os átomos de flúor mede aproximadamente 1,8 Å e considerando que 6,48 2,54 e que 2 1,4 , assinale o que for correto. trigonal representada pela fórmula estrutural 01.Nessa molécula, o átomo de enxofre obedece à regra do octeto. 02.A forma espacial que representa a molécula SF6 é a de um octaedro regular. 04.A distância do átomo de enxofre a qualquer átomo de flúor nessa molécula mede aproximadamente 1,7 Å. 08.Desconsiderando as dimensões dos átomos na molécula, a área total da superfície do SF 6 mede mais do 2 que 10 Å . 16.Desconsiderando as dimensões dos átomos na molécula, o volume da forma espacial do SF 6 mede menos do que 4 Å3. 9.UEM Assinale a alternativa correta. A) A molécula CCl4 é apolar e formada por ligações apolares. B) Toda molécula polar é formada por ligações apolares. C) A molécula BCl3 possui geometria piramidal e é polar. D) A molécula CCl3H tem a forma de um tetraedro irregular e é polar. E) As moléculas H2S e H2O são angulares e possuem o mesmo valor de momento dipolar. 10. Para desenhar a estrutura molecular de BrF 3, pelo modelo de repulsão dos pares eletrônicos da camada de valência, é preciso escrever a estrutura de Lewis e, em seguida, identificar o número de pares de elétrons ligantes e não ligantes. A partir dessas informações, é correto afirmar: a) O átomo central de BrF3 possui três pares de elétrons não ligantes. Química Br 2 .
Baixar