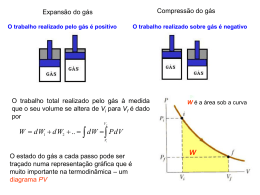
Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 5.1 1º Ano INTRODUÇÃO: 1 ª Lei da Termodinâmica Conservação de Energia durante um processo. 2 ª Lei da Termodinâmica: Sentido dos processos Qualidade da energia Um processo só ocorre se se respeitarem a 1ª Lei e 2ª Lei. Sentido dos processos Ti > T0. −Diminuição de energia interna do corpo aumento de energia interna da vizinhança. −O processo inverso nunca ocorre espontaneamente. Processo inverso: −Diminuição da energia interna aquecimento do corpo de To até Ti da vizinhança para Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.2 pi > p0 −O ar escoa-se espontaneamente das pressões mais altas para as mais baixas. −O processo inverso nunca ocorre espontaneamente. Processo inverso: −O ar não se escoa espontaneamente da vizinhança à pressão po para o reservatório à pressão pi •zi > 0. −A massa suspensa a uma cota zi cai quando o cabo é cortado −O processo inverso nunca ocorre espontaneamente. •Processo inverso: −A massa não se eleva espontaneamente para a cota zi Termodinâmica Eng. Automação e Controlo Industrial 1º Ano Capítulo 5 - Segunda Lei 5.3 Os processos inversos necessitam de um dispositivo para voltar ao estado inicial. objecto reaquecido até à temperatura inicial ar pode voltar ao depósito inicial. massa pode ser levantada até à sua posição inicial. Em nenhum dos casos houve violação da 1ª Lei da Termodinâmica. Os processos espontâneos ocorrem sempre num dado sentido. SENTIDO ÚNICO A 2ª Lei da Termodinâmica permite definir o sentido dos processos. Um processo só ocorre se forem respeitadas a 1ª Lei e 2ª Lei. Quando abandonamos um sistema ele tende espontaneamente para o equilíbrio com a vizinhança. rapidamente como em algumas reacções químicas. em alguns minutos (água com gelo) em anos: barra de ferro para se desfazer pelo efeito da ferrugem. A 2ª Lei não está limitada à identificação do sentido dos processos A 2ª Lei estabelece que a energia contêm qualidade e quantidade. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.4 Reservatórios de energia térmica Capacidade térmica de um corpo = calor específico x massa = kJ/kg ºC x kg = kJ/ºC Capacidade térmica elevada pode receber grandes quantidades de calor sem aumentar a sua temperatura Pode ser conseguido de três modos: Massa elevada: grandes volumes: oceanos, lagos, rios e atmosfera. Calor específico elevado: substância em mudança de fase: sub. em fusão; água condensação/evaporação Caldeira: porque tem temperatura constante Reservatório que fornece energia sob a forma de Calor : FONTE ou FONTE QUENTE. Reservatório que recebe energia sob a forma de Calor : POÇO ou FONTE FRIA. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.5 Máquinas térmicas O trabalho pode ser facilmente convertido em calor mas o inverso é difícil. O trabalho pode ser convertido em calor directamente. O calor só pode ser convertido em trabalho utilizando uma Máquina Térmica Caracterização de uma Máquina Térmica - Recebe calor de uma fonte a uma temperatura elevada - Convertem calor em trabalho – geralmente num veio. - Rejeitam calor para uma fonte fria. - Funcionam em ciclo - Fluido para o qual é transferido calor – fluido operante. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.6 Central térmica a vapor O termo Máquina Térmica é por vezes utilizado em sentido lato em dispositivos que produzem trabalho a partir de calor – Turbina a gás e Motor de Automóvel. Não funcionam num ciclo termodinâmico. Funcionam num ciclo mecânico. Máquina Térmica por excelência : Central Térmica a Vapor Caracterização de uma Central Térmica a Vapor. •Qadm= quantidade de energia transferida na caldeira, sob a forma de calor, para o fluido operante. •Qsai= quantidade de energia transferida, sob a forma de calor, do fluido operante para uma fonte a baixa temperatura •Wadm= quantidade de energia fornecida pelo fluido, sob a forma de trabalho, na turbina. •Wsai= quantidade de energia fornecida ao fluido, sob a forma de trabalho, na bomba Qadm Qsai Wadm Wsai são tudo quantidades positivas. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.7 Cada um dos quatro componentes é um sistema aberto. Todos os componentes são atravessados pelo mesmo caudal mássico. Wlíquido= Wsai –Wentra= Wout–Win Qlíquido= Qentra– Qsai =Qin–Qout O conjunto de todos os componentes é um sistema fechado. U = Qlíquido –Wlíquido = 0 Qlíquido=Wlíquido Wlíquido = Qentra– Qsai Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 5.8 1º Ano Rendimento térmico Wlíquido = Qentra– Qsai Qsai > 0 Wlíquido < Qentra A fracção de calor admitido que é convertido em trabalho útil é a media do desempenho de uma máquina térmica. Rendimento Q QF Q t Q 1 F QQ QQ Débito desejado Entrada necessária Rendimento t Exemplos: Motor a gasolina -25% Motor a gasóleo -35% Central combinada Gás-Vapor-50% Wlíquido Qadmitido Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.9 O que acontece à energia que sai? As Centrais Térmicas desperdiçam, no condensador, grandes quantidades de calor para os lagos, rios, etc. Será possível reaproveitar essa energia? A resposta é clara: NÃO Exemplo: Máquina Térmica para elevar pesos Ti=30 ºC, QIN=100 kJ; TQ=100 ºC Wliq= 15 kJ = Ep; Tfinal= 90 ºC Será possível transferir, novamente, 85 KJ para a fonte a 100 ºC ? A resposta é: NÃO Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.10 Segunda lei da termodinâmica Enunciado de Kelvin-Planck “É impossível a qualquer sistema que funcione num ciclo termodinâmico fornecer uma quantidade líquida de trabalho à vizinhança recebendo energia apenas de um simples reservatório. “ Todas as máquinas térmicas desperdiçam energia. Uma máquina térmica nunca tem um rendimento de 100%. Para uma central térmica funcionar tem que trocar calor com o meio ambiente e uma fornalha. Rendimento < 100% nada tem a ver com atrito ou dissipação. O rendimento depende apenas da temperaturas da fonte fria e da fonte quente. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.11 Rendimento de Conversão de Energia Rendimento térmico: capacidade de conversão de energia térmica em trabalho. Aquecedor eléctrico: 90%. Caldeira a gás : 55% Rendimento de combustão = quantidade de calor libertado massa de combustível queimado x poder calorífico do comb. Poder calorífico do combustível: Quantidade de calor libertada quando uma dada quantidade de combustível, (geralmente a unidade de massa) à temperatura ambiente é completamente queimada e os produtos são arrefecidos à temperatura ambiente. = 47300 kJ/kg PCS – a água dos gases de combustão está no estado líquido. PCI – a água dos gases de combustão está no estado de vapor. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 5.12 1º Ano Trabalho/potência útil: Motor térmico : potência desenvolvido pela cambota. Centrais térmicas : potência mecânica à saída da turbina. potência eléctrica à saída do gerador ηgerador ηtérmica Q Potência eléctrica debitada Potência mecânica fornecida Potência mecânica na turbina Potência calorífica fornecida ao fluido ηcombustão Q ηtérmico ηglobal ηgerador W W ηglobal ηcombustãoηtérmicoηgerador W bal elétrico PCS x m Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.13 Frigoríficos e Bombas de Calor O Calor flui espontaneamente das altas para as baixas temperaturas Para transferir energia das baixas para as altas temperaturas é necessário um equipamento auxiliar Frigorífico (funciona em ciclos) O fluido operante chama-se fluido frigorigéneo. Ciclo Frigorífico de Compressão de Vapor compressor condensado r 4 componente s válvula de expansão (tubo capilar) evaporador Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.14 Ciclo frigorífico Temperatura de condensação Temperatura de evaporação > < Temperatura ambiente. Temperatura do espaço a refrigerar. QF energia rejeitada no condensador. QQ energia absorvida no condensador. Coeficiente de desempenho (“performance”) - COP QF Q F 1 COPF Wlíquido Wlíquido QQ QF 1 Nota: COP pode ser maior que a unidade Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.15 Ciclo bomba de calor Igual ao ciclo de refrigeração mas com objectivos diferentes Ciclo frigorífico : manter um espaço a temperatura baixa Ciclo de bomba de calor : manter um espaço a temperatura elevada. Coeficiente de desempenho (“performance”) - COP QQ Q 1 Q COPBC 1 COPF Wlíquido Wlíquido 1 - QF Q1 A bomba de calor, no pior dos casos, fornecerá a energia que consome. 2< COPBC <3 Só funciona bem em climas não muito frios. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.16 Enunciado de Clausius (1º Corolário) “É impossível a qualquer sistema funcionar de tal modo que o único resultado seja a transferência de energia de um corpo frio para um corpo quente.” é mais intuitivo que o de Kelvin-Planck. A energia, sob a forma de calor, nunca flúi espontaneamente das temperaturas mais baixas para as mais altas. É necessário um equipamento para o calor fluir das baixas para as altas temperaturas. compressor no ciclo frigorífico de compressão. adição de calor no ciclo de absorção. Os enunciados de Kelvin-Planck e de Clausuis são postulados. Os enunciados de Kelvin-Planck e de Clausius são equivalentes. Qualquer dispositivo que viola um deles viola o outro. Demonstração: Hipótese: viola o enunciado de KelvinPlanck Tese: Viola o enunciado de Clausius Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.17 Máquina de movimento perpétuo de 2ª espécie Exemplo: Central Térmica sem condensador Todo o calor produzido é transformado em trabalho. Existem perdas e o rendimento é de 80%. Saldo de energia para o exterior : Qadm > Wbalanço. Respeita a 1ª Lei Viola a 2ª Lei da Termodinâmica (Ausência de Fonte Fria) Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.18 Processos reversíveis e irreversíveis. Qual o rendimento máximo possível para uma máquina térmica? Processo irreversível : o sistema e todas as partes da vizinhança não podem voltar exactamente ao estado inicial, depois de o processo ter ocorrido. Processo reversível : o sistema e a sua vizinhança podem voltar ao estado inicial. Importância dos processos reversíveis: referenciais – limites teóricos - dos processos reais. mais fáceis de analisar. Os sistemas que estão sujeitos a processos reversíveis: produzem o máximo de trabalho. consomem o mínimo de trabalho. Quanto melhor o projecto menor será a irreversibilidade. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 5.19 1º Ano Factores que provocam irreversibilidades: Atrito Expansão brusca Transferência temperaturas. de calor com diferença finita de Resistência eléctrica. Deformação plástica dos corpos. Reacções químicas Atrito Tem origem no movimento relativo de dois corpos. A força de atrito desenvolve-se na interface de contacto. A energia fornecida sob a forma de trabalho é convertida em calor. Quando a direcção do movimento inverte os corpos irão retomar a sua posição. A interface não irá arrefecer. Irá ser convertido mais trabalho em calor O calor gerado não irá ser convertido em trabalho. O processo é irreversível. O sistema e a vizinhança não podem voltar ao estado inicial. Pode haver atrito entre dois sólidos, um fluido e um sólido ou até mesmo entre dois fluidos (jacto livre) Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.20 Compressão e expansão sem quase-equilíbrio. Expansão em quase-equilíbrio: conjunto cilindro-êmbolo adiabático, p e T uniformes se a velocidade de deslocamento do êmbolo for pequena. Compressão sem quase-equilíbrio: as moléculas ficam amontoadas perto da superfície do êmbolo. Pressão na superfície do êmbolo é superior à restante região do cilindro. Compressão rápida Wirrev Wsem quaseequílibrio pinterfacedV Wreversível Expansão sem quase-equilíbrio: as moléculas do interior não terão tempo para acompanhar o movimento do êmbolo. Pressão na superfície do êmbolo é inferior à restante região do cilindro. Expansão rápida Wirrev Wsem quaseequílibrio pinterfacedV Wreversível O gás terá um excesso de energia interna = ao défice de trabalho da vizinhança: Wirrev Wsem quaseequílibrio pinterfacedV Wreversível Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.21 Compressão e expansão sem quase-equilíbrio O sistema pode voltar ao estado inicial através da troca de calor com a vizinhança. A 2ª Lei da Termodinâmica diz que não é possível trocar todo esse calor em trabalho Transferência de calor. diferença finita de temperaturas. sistema a temperatura inferior: o calor vai do ambiente (vizinhança) para o sistema (lata) mais frio. inversão do sistema: implica a utilização de um sistema de refrigeração. sistema volta ao estado inicial. A vizinhança não: tem um défice de trabalho fornecido para arrefecimento. restituição da vizinhança ao estado inicial implica a conversão de toda o calor em trabalho o que viola a 2ª Lei da Termodinâmica Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 5.22 1º Ano Processos reversíveis internos e externos Um processo reversível não pode ter irreversibilidades. Processo internamente reversível: não ocorrem irreversibilidades no interior da fronteira do sistema durante o processo. Sucessão de estados de equilíbrio. Na inversão do processo o sistema passa exactamente pelos mesmos estados. Os caminhos de ida e retorno são coincidentes. Processo externamente reversível: irreversibilidades fora do sistema não existem Processo reversível = Processo internamente reversível + Processo externamente reversível Não tem diferenças finitas de temperaturas Nenhuma variação finita de pressão. Nenhum atrito. Nenhum efeito dissipativo Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.23 Princípios de Carnot. A 2ª Lei permite concluir que: Uma máquina térmica não pode funcionar através da troca de calor com um só reservatório. Um frigorífico ou uma bomba de calor não podem funcionar sem fornecimento de trabalho. “O rendimento de uma máquina térmica irreversível é sempre inferior a uma máquina reversível que funciona entre as mesmas fontes.” (2º Corolário) Dem: Se fosse possível, ao se por a funcionar uma máquina térmica reversível como bomba de calor obter-se-ia, a partir da fonte fria, uma quantidade de trabalho, o que violaria a segunda lei. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.24 “Os rendimentos de todas as máquinas térmicas reversíveis funcionando entre as mesmas duas fontes são iguais. “ (3º Corolário) Dem: Caso contrário haveria um rendimento maior que o de uma máquina térmica reversível, o que contaria o 2º Corolário da 2ª Lei “Pode definir-se uma escala de temperaturas termodinâmica (independente de qualquer substância termométrica) e que fornece um zero absoluto (inatingível)” (4º Corolário) Para máquinas térmicas reversíveis a funcionar entre 2 reservatórios às temperaturas TH e TL i.e., QH QL Q 1 L QH QH TL TH TL TH TH QL T L QH REV TH 1 Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.25 Esta escala de temperaturas é a Escala Kelvin e as temperaturas nesta escala são denominadas temperaturas absolutas. T (º C ) T (K ) 273.15 Para um dado valor de TL, o rendimento aumenta com o aumento de TH. Como o reservatório prático de tempeartura mais baixa é a atmosfera ou o mar, uma certa quantidade de calor é tanto mais apta para produzir trabalho quanto maior for a temperatuta do reservatório que a fornece. Para qualquer máquina térmica reversível Q1 T1 Q2 T2 , para uma máquina irreversível, com rendimento necessariamente inferior. QHirrev QLirrev T1 T2 Máquinas térmicas operando entre mais do que 2 reservatórios: ciclos práticos em que há uma variação continua da temperatura do fluído, podem ainda considerar-se reversíveis se se considerar que existe uma infinidade de reservatórios a temperaturas infiniteseimais próximas. “O rendimento de qualquer máquina térmica reversível, operando entre mais de 2 reservatórios, será inferior ao que se verfificaria com apenas 2 reservatórios a temperaturas extremas” (5º Corolário) Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 5.26 1º Ano Desigualdade de Clausius “Quando um sistema realiza um ciclo dQ T 0 Nota: a igualdade só é válida reversíveis” (6º Corolário) para ciclos Consequências da 2ª lei para sistemas fechados “Existe uma propriedade de um sistema fechado, tal que a sua variação, em qualquer processo reversível, vem 2 dQ T (7º Corolário) 1 Demonstração: Caso contrário, teríamos quando sabemos que ambos são nulos. 2 dQ T S2 S1 Será então 1 rev . ou dQ T rev . dS dQ dQ T AC BC T Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 5.27 1º Ano “A entropia de um sistema fechado e termicamente isolado ou aumenta ou, se o processo for reversível, permanece constante.” (8º Corolário) Demonstração: Processo adiabático reversível (isentrópico). dQ dS T rev . dS 0 dQ 0 Processo adiabático irreversível 2 dQ 0 T A 1 dQ 0 proc. reverssível B Ou S1 S2 o dQ 1 dQ 0 1 T T B dQ 2 S S 1 2 T 2 B ou S2 S1 Características da entropia: i) Determinação de valores de entropia. Tal como a energia interna, interessam normalmente conhecer as variações de entropia; por isso, pode escolher-se arbitrariamente um estado de referência. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.28 Não se consegue determinar experimentalmente a entropia a partir de dQ/T, pois não existem processos reversíveis. Mas como é uma propriedade, depende só dos estados inicial e final, e não do processo seguido; por isso, estabelecidas relações com outras propriedades, calcula-se a entropia a partir destas: Tds dQrev . du pdv dh vdp du 1 p S1 S2 dv T T 0 0 1 ii) A entropia como critério de reversibilidade Se o processo é adiabático, aplica-se directamente o 8 corolário. Se não for, considera-se o sistema e a vizinhança como constituindo um “universo” e, pela variação ou não da entropia deste “universo”, conclui-se da irreversibilidade ou não do processo. A variação da entropia dum reservatório é simplesmente Q/T. Condução de calor através de um mau condutor: Aumenta a entropia do “universo” porque Q/T1 < Q/T2 . A “irreversibilidade” é “exterior” ao sistema. Termodinâmica Eng. Automação e Controlo Industrial Capítulo 5 - Segunda Lei 1º Ano 5.29 Consequências da 2ª Lei para sistemas abertos em regime estacionário: - Processo adiabático S1 S2 (= sse for reversível) i.e., um processo adiabático reversível é isentrópico. - O sentido de um processo real é o de aumento de s; - Numa expansão adiabática numa turbina, por ex, sabendo p1,v1 e p2 , podemos saber s1 = s2 e e temos assim o estado final determinado; pode então calcular-se W / m h2 h1 Na realidade, tem-se depois em conta turb . W , w 1 onde o índice superior ( ‘ ) é relativo ao processo isentrópico - Processo com transferência de calor 2 dQ Q T (s1 s2 ). s1 s2 T const . T m 1
Download