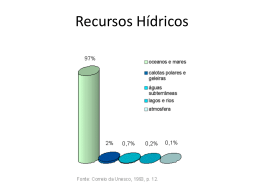
Fernanda Águas 1. INTRODUÇÃO Por volta dos 50 anos, um órgão fundamental para a mulher, o ovário, deixa de funcionar e a produção de hormonas que, por natureza, lhe está atribuída, é abruptamente reduzida provocando na maioria das mulheres o aparecimento de alterações físicas e psíquicas, fenómeno conhecido como síndrome climatérico. O aumento da esperança de vida em geral, nos países ocidentais, tem por efeito que as mulheres possam viver mais de 30 anos após a menopausa, ou seja, 1/3 da sua vida. No final de 2007, a população estimada para Portugal, com base nos números do último recenseamento, era de 10.617.575 habitantes1, dos quais 51,6% eram mulheres. A proporção da população com idade superior a 65 anos em relação à população total também tem vindo a aumentar, representando em 2007, cerca de 17,4%1. Os dados permitem concluir por uma maior longevidade feminina, com uma esperança de vida ao nascer de 81 anos, em relação ao sexo masculino para o qual essa esperança de vida se situa nos 74 anos. O fenómeno do envelhecimento é, portanto, mais sentido no sexo feminino. Daí decorre a necessidade de protecção da saúde na mulher na fase da vida após os 50 anos, em que o seu papel na sociedade se desdobra entre o exercício de uma profissão a tempo inteiro, as funções de esposa e de mãe, enfrentando muitas vezes, os problemas de primeiro emprego dos filhos que sentem dificuldades em conseguir um modo de vida independente. Os médicos que acompanham a mulher nesta etapa da vida têm todas as vantagens em dispor de elementos de compreensão da fisiologia das mudanças ocorridas e adquirir a sensibilidade necessária para enquadrá-las numa perspectiva abrangente de medicina preventiva. 2. ESPECIFICAÇÕES TERMINOLÓGICAS Menopausa é o termo que designa a última menstruação, confirmada após 12 meses sucessivos de amenorreia, resultante da cessação definitiva da actividade folicular ovárica. Perimenopausa ou climatério é um termo utilizado para descrever o período em que se manifestam os primeiros sintomas ou indicadores da proximidade da menopausa e que termina 12 meses após a última menstruação. Este período de transição tem duração variável de mulher para mulher, caracterizando-se por alterações dos níveis das hormonas esteróides ováricas que se exprimem, por um lado, por alterações do ciclo menstrual2,3 e, por outro, pelo aparecimento de sintomatologia típica, sobretudo vasomotora. Pós-menopausa é o termo que designa o conjunto dos anos que se seguem à menopausa. Pré-menopausa, termo ambíguo e gerador de alguma confusão, designa mais propriamente, todo o período de vida fértil da mulher anterior à menopausa. É, por vezes, utilizado como sinónimo da fase imediatamente anterior a menopausa, daí que possa ser confundido com a perimenopausa. 295 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 18 Menopausa 3. FISIOLOGIA ALTERAÇÕES HORMONAIS A falência ovárica é um processo que se inicia muitos anos antes da menopausa e está directamente relacionada com a redução do capital folicular dos ovários, que começa com o nascimento. O número de folículos primordiais, que atinge o seu máximo durante a 296 vida fetal, vai progressivamente diminuindo ao longo dos anos, independentemente da idade da menarca, do número de gestações ou do tipo de contracepção utilizado. Foi demonstrada uma relação entre o número de folículos primordiais e a regularidade do ciclo menstrual, tendo-se concluído que um declínio marcado no número de folículos ováricos constitui a base morfológica que explica as alterações ocorridas no climatério. A menopausa dá-se quando o número de folículos se situa abaixo dum limiar crítico, cerca de 1.000, independentemente da idade5. No que se refere à fisiologia do aparelho reprodutor feminino, é útil recordar que o ciclo menstrual da mulher resulta da interacção cíclica da hormona hipotalâmica GnRH com os péptidos hipofisários FSH e LH e os esteróides ováricos, estradiol e progesterona. Todo o processo de alterações hormonais do climatério tem a sua origem no ovário. Assim, do ponto de vista histológico, há alterações a nível folicular, entre as quais a diminuição do número de células da teca interna e da granulosa e um aumento do número de células intersticiais, local de produção dos androgénios. O primeiro sinal biológico de falência ovárica é o aumento de FSH, reflexo da diminuição da qualidade folicular que tem por consequência a redução da síntese e secreção do estradiol. Ao contrário do que anteriormente se dizia, os níveis de estradiol diminuem progressivamente nos anos que precedem a menopausa, permanecendo, no entanto, mais ou menos estáveis até aproximadamente ao ano anterior à cessação do desenvolvimento folicular5. Por outro lado, as células da granulosa sintetizam cada vez menos inibina, glicoproteína que, tal como o estradiol, exerce um efeito inibidor sobre a secreção de FSH pela hipófise. É possível que tanto a inibina-A como a B estejam envolvidas6, a primeira na fase luteínica, e a segunda na fase folicular. Os valores de FSH doseados no sangue são geralmente superiores a 30 mUI/ml. Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 Há vários tipos de menopausa, apresentando cada um desses tipos particularidades e questões próprias com reflexos na escolha das orientações terapêuticas. Assim, a expressão menopausa espontânea ou natural utiliza-se sempre que a falência ovárica ocorre de forma gradual e sem intervenção médica ou de qualquer outro agente externo. Ao contrário do que acontece com a idade da menarca, apesar da melhoria das condições de vida e de saúde das populações, a idade média a que ocorre a menopausa não se tem alterado. Nos países ocidentais, na maioria das mulheres a menopausa ocorre entre os 45 e os 56 anos de idade, situando-se a média nos 51 anos4. Menopausa cirúrgica é a expressão que designa a situação decorrente de uma intervenção cirúrgica em que são removidos ambos os ovários, habitualmente em conjunto com o útero. Nas mulheres com idade inferior a 50 anos é frequente realizar-se a histerectomia isolada, com conservação dos ovários e sem que daí resulte um estado de menopausa. Ao contrário da menopausa espontânea, a menopausa cirúrgica acontece de forma inesperada e habitualmente associa-se a um quadro sintomático mais exuberante. Menopausa precoce é a expressão utilizada para designar a situação de ocorrência da menopausa, segundo a maioria dos autores, antes dos 40 anos. Importa contudo salientar que, sempre que a menopausa ocorre antes dos 45 anos, as suas consequências para a saúde da mulher levam a considerá-la como precoce em termos de intervenção terapêutica. poral dado que o tecido adiposo é o grande responsável por aquela actividade. Na mulher ooforectomizada, para além da privação em estrogénios, verifica-se igualmente a ausência dos androgénios produzidos pelo ovário. 4. CLÍNICA Durante o período do climatério, um número significativo de mulheres experimenta múltiplos e intensos sintomas, enquanto outras apenas dão conta de perturbações mínimas ou nem sequer apresentam qualquer tipo de queixa. As diferenças socioculturais têm reconhecidamente influência sobre a expressão clínica das alterações biológicas e podem explicar algumas das diferenças encontradas entre as mulheres ocidentais e as orientais, ou entre outros grupos étnicos, no que respeita à vivência da menopausa. A tradução da clínica associada à falência ovárica é em termos didácticos descrita numa série de acontecimentos que se manifestam por etapas, conforme se pode verificar no quadro 1. Quadro 1. Consequências da falência ovárica Duração Sistema Sintoma/doença Agudos Neuroendócrino Afrontamentos Suores nocturnos Insónia Ansiedade/irritabilidade Alterações da memória Perturbações da concentração Intermédios Tracto urogenital Tecido conjuntivo Atrofia urogenital Incontinência urinária/prolapso Dispareunia/síndrome uretral Diminuição da libido Atrofia da pele Esquelético Arterial Osteoporose Doença cardiovascular Crónicos Menopausa 297 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 Numa fase posterior, assiste-se a um aumento da LH, em média, três vezes superior aos valores da pré-menopausa. A produção de LH está sujeita ao controlo hipotalâmico, através da GnRH que é segregada de forma pulsátil, e também ao efeito de feedback negativo do estradiol e da progesterona, cujos níveis estão francamente reduzidos devido à diminuição do número e da actividade dos folículos. A relação FSH/LH, quase sempre superior à unidade, mantém-se elevada ao longo de todo o período pós-menopausa, atingindo o máximo nos primeiros três anos. Com o desaparecimento dos folículos, os níveis elevados de gonadotrofinas levam o tecido ovárico remanescente a produzir androgénios, essencialmente, androstenediona e testosterona. Apesar desta situação, os níveis séricos de testosterona são inferiores aos encontrados na pré-menopausa. Como foi anteriormente referido, a produção de estrogénios pelos ovários cessa com a menopausa. Contudo os níveis desta hormona podem, nalgumas mulheres, ser significativos graças à aromatização extraglandular da androstenediona e testosterona. O grau de conversão está directamente relacionado com a percentagem de gordura cor- 298 guns casos, apresentam-se mesmo quadros de humor depressivo, embora não existam provas científicas de que a menopausa, por si só, origine depressões severas ou mesmo alterações significativas do comportamento. No estudo SWAN (Study of Women’s Health Across the Nation), a prevalência de alterações do humor aumentou da fase da pré para a fase de perimenopausa de 10 para 16,5%10,11. Tanto a memória como as capacidades cognitivas vão-se modificando ao longo da vida. O avanço na idade é geralmente associado a um desempenho intelectual mais fraco. Os efeitos dos estrogénios são especialmente notórios na memória verbal. Embora nem todos os estudos consigam demonstrá-lo, há que observar que as dificuldades cognitivas e de concentração bem como as perturbações de memória são comuns após a menopausa, podendo mesmo, nalguns casos, constituir o primeiro sinal de um processo de demência. A doença de Alzheimer é o quadro de demência mais frequente e atinge preferencialmente o sexo feminino12. Não se conhece com exactidão a dimensão dos efeitos dos estrogénios sobre o sistema nervoso central, embora lhe sejam atribuídos efeitos anti-oxidantes contra a toxicidade neuronal, a redução dos depósitos celulares do componente P amilóide, que mais não é que a proteína acumulada na doença de Alzheimer, o aumento das sinapses e do crescimento neuronal com especial incidência na densidade das dendrites espinais. O estado de hipoestrogenismo é causa de alterações tróficas dos tecidos de revestimento do aparelho urogenital que consistem em diminuição da espessura do epitélio, dos tecidos de suporte e do colagénio, bem como redução da vascularização local13. A falta de lubrificação vaginal é indicada habitualmente pela mulher após a menopausa e associa-se à perda da elasticidade da vagina. Como consequência destas alterações, surgem as queixas de dispareunia a que muitas vezes se juntam uma sensação de prurido e um ardor vulvovaginal. Estas consequências constituem um Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 Os sintomas vasomotores são a imagem da menopausa que cerca de 70 a 80% das mulheres experimentam e cuja intensidade e duração variam de mulher para mulher. Em muitos casos, os sintomas iniciam-se precocemente na perimenopausa, ao mesmo tempo que começam a manifestar-se as primeiras irregularidades do ciclo menstrual. Os afrontamentos são descritos como uma súbita sensação de calor da extremidade superior do corpo, associada à vermelhidão da face, pescoço e tórax, que podem ser seguidos de sudorese. A sua duração pode variar de segundos a longos minutos, podendo tratarse de episódios esporádicos ou de múltiplos episódios por dia, agravados por situações de stress. Habitualmente os afrontamentos manifestam-se também durante a noite e estão associados a suores nocturnos que perturbam o sono e, naturalmente, o repouso nocturno7. Na maioria das mulheres, estes sintomas persistem por períodos de um a dois anos, havendo embora casos em que as queixas existem durante cinco ou mais anos. Aproximadamente 3% das mulheres descrevem afrontamentos muito frequentes 15 anos depois da menopausa, 12% dos quais são de intensidade moderada a severa8. No estudo PEPI (Postmenopausal Estrogen/ Progestin Interventions Trial), a percentagem de mulheres do grupo de placebo que apresentava sintomas vasomotores diminuiu de 56% na avaliação basal para 30% após três anos9. O alívio rápido da sintomatologia vasomotora pela terapêutica hormonal (TH) foi também comprovado por este estudo9. Na fase de flutuações hormonais da perimenopausa, com impacto em neuromediadores cerebrais, catecolaminas e B-endorfinas, surgem alterações do humor com níveis mais elevados de ansiedade e irritabilidade, diminuindo a capacidade de lidar com os problemas diários. Estas perturbações psicológicas associam-se normalmente aos sintomas vasomotores, afectando a qualidade do sono e causando instabilidade emocional, quadro clínico conhecido como «efeito dominó». Nal- Menopausa nível dos sistemas esquelético e arterial, traduzidas na clínica por complicações importantes para a saúde da mulher: osteoporose e doenças cardiovasculares. 4.1. OSTEOPOROSE Osteoporose, palavra derivada do grego «osteo» (osso) e «poros» (buraco), designa uma doença esquelética caracterizada por uma diminuição da massa óssea que compromete a resistência desse tecido e predispõe para um aumento do risco de fracturas16,17. Desde 1940, com Fuller Albright, que esta situação foi associada à carência estrogénica, embora inicialmente fosse considerada como uma consequência natural do envelhecimento. Só em 1994 foi reconhecida como doença pela Organização Mundial da Saúde (OMS)16. A osteoporose pode ocorrer em ambos os sexos mas é mais frequente na mulher após a menopausa, atingindo, nesta fase da vida, 50% das mulheres. O pico de massa óssea é alcançado por volta dos 35 anos, havendo autores que afirmam não existir ganhos de massa óssea a partir dos 20 anos18, e é determinado por uma combinação de factores, sendo os principais os genéticos, os hormonais e os ambientais. A perda de massa óssea na mulher inicia-se após os 40 anos e acentua-se cerca de 1,5 anos antes da última menstruação. A taxa de reabsorção aumenta para 2 a 3% após a menopausa e mantém-se constante durante aproximadamente 8 a 10 anos, resultando numa perda de massa óssea total que pode atingir os 40% nos casos mais graves. Fisiologicamente, a massa óssea mantém-se constante, devido ao fenómeno cíclico da remodelação que mais não é que uma sucessão de fases de reabsorção e formação, a cargo de unidades estruturais que funcionam em sincronismo, influenciadas por citocinas e esteróides sexuais19. Os osteoclastos são as células responsáveis pela reabsorção óssea e os osteoblastos são células que asseguram a síntese dos diferentes constituintes da matriz 299 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 obstáculo, entre outros, a uma sexualidade satisfatória. A disfunção sexual pode afectar os dois membros do casal e está associada sobretudo ao estado geral de saúde de ambos, com especial relevância para as terapêuticas utilizadas no tratamento de doenças crónicas. Também a uretra e a bexiga são afectadas pela fragilidade dos tecidos, epitelial, conjuntivo e muscular. A disúria, a polaquiúria e a urgência miccional surgem em consequência da atrofia da mucosa urogenital. O facto de o pH da vagina se tornar mais alcalino13 poderá impedir o normal desenvolvimento dos lactobacilos e aumentar a susceptibilidade às infecções por agentes patogénicos fecais. Estes microrganismos podem causar infecções urinárias, cistite e uretrite, difundidas por via ascendente. A incontinência urinária agravase com a idade e as alterações anteriormente descritas criam condições propícias para que falhem os mecanismos de contenção. Os estudos relativos aos efeitos dos estrogénios na incontinência urinária não são esclarecedores, havendo autores que chegam a conclusões diametralmente opostas. Foram publicadas metanálises que descrevem melhoria daqueles sintomas14 e estudos randomizados em que não foram encontrados benefícios, pelo contrário, concluem pelo agravamento da sintomatologia15. Os efeitos da redução dos estrogénios fazem-se sentir também na pele que perde colagénio e elasticidade, alterando o seu aspecto e tornando-se mais espessa, seca e enrugada. Estas alterações podem ser agravadas por factores ambientais tais como, por exemplo, a exposição solar e o consumo de tabaco. As marcadas alterações dos níveis séricos de estrogénios e de androgénios e do respectivo coeficiente, agravado pela redução da proteína transportadora (SHBG), provocam também o aumento do desenvolvimento piloso, que pode atingir um grau de hirsutismo moderado. Na etapa mais tardia da pós-menopausa, manifestam-se as consequências mais graves decorrentes da carência estrogénica a trica e maior dinamismo metabólico, que as consequências mais se fazem sentir, havendo um aumento do risco de fracturas ao mínimo traumatismo a nível das vértebras e extremidades distais dos ossos longos. A importância da osteoporose está directamente relacionada com a gravidade dos seus efeitos: fracturas osteoporóticas, suas consequências a nível de mortalidade, morbilidade e os custos directos e indirectos inerentes ao respectivo tratamento20. Um milhão e seiscentas e seis mil fracturas da anca ocorreram em todo o mundo em 1990, calculando-se que este número aumente exponencialmente e atinja os seis milhões em 205021. A mortalidade associada às fracturas da anca pode aproximar-se dos 20%, sendo ainda relevante que 50% das mulheres que sobrevivem ao episódio inicial ficam com incapacidades que as tornam funcionalmente dependentes. Prevenir a osteoporose através de medidas higienodietéticas aplicadas à população desde as fases mais precoces da vida será a fórmula mais eficaz. Nas mulheres após a menopausa, importa identificar os grupos de risco e seleccionar criteriosamente as situações que requerem intervenção farmacológica (Quadro 2). Quadro 2. Factores de risco de osteoporose Major Idade > 65 anos Fractura vertebral por compressão Antecedentes familiares de fractura osteoporótica Tratamento com corticóides sistémicos com duração— > 3 meses Síndrome de má absorção Hiperparatiroidismo primário Tendência para quedas Osteopenia aparente em Rx Hipogonadismo Menopausa precoce (< 45 anos) 300 Minor Artrite reumatóide Hipertiroidismo Tratamento crónico com anticonvulsivantes Baixo aporte de cálcio Tabagismo Consumo excessivo de álcool Consumo excessivo de cafeína Peso < 57 kg Perda de peso > 10% do peso aos 25 anos Tratamento crónico com heparina Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 óssea, cuja mineralização controlam. Numerosos factores intervêm na regulação do metabolismo ósseo, discutindo-se ainda os seus exactos mecanismos de funcionamento e a importância relativa de cada um deles no decurso do processo. A perda de massa óssea associada à menopausa e ao envelhecimento é devida a um excesso de actividade dos osteoclastos, prevalecendo a reabsorção sobre a formação. Pensa-se que os mecanismos de acção dos estrogénios sobre o osso podem ter uma acção genómica mediada por receptores e não genómica que inibe a apoptose. A sua redução afecta também indirectamente o tecido ósseo, através de uma diminuição da absorção intestinal do cálcio e aumento da sua excreção urinária. Os níveis séricos dos metabolitos da vitamina D também diminuem com a idade. A isto acresce ainda o fraco consumo de cálcio na alimentação das mulheres após a menopausa, sendo normalmente insuficiente para suprir as suas necessidades. A redução da calcemia estimula a hormona paratiroideia que mobiliza cálcio do osso, agravando a perda de massa óssea. Embora a aceleração da perda de massa óssea afecte todo o esqueleto, é sobre o osso trabecular, com maior exposição volumé- tação, revelou uma redução global de fracturas osteoporóticas de 24%, correspondente a 35% de fracturas vertebrais e 33% de fracturas da anca24. O facto mais notável é que estes resultados foram obtidos numa população de mulheres não seleccionadas em função desta doença e, portanto, com baixo risco de fractura. Contudo, quando o tratamento é suspenso nota-se rapidamente perda dos efeitos benéficos dos estrogénios no osso, como pode ser comprovado pelo aumento de incidência de fracturas que se seguiu ao decréscimo de utilização da TH na pós-menopausa, em consequência dos resultados do WHI25. 4.1.1. TERAPÊUTICA DA OSTEOPOROSE Bisfosfonatos Os bisfosfonatos são quimicamente análogos ao pirofosfato (P-O-P) em que a substituição do átomo de oxigénio por um átomo de carbono conduz a um aumento da ligação óssea e da resistência à hidrólise enzimática. Os seus efeitos na prevenção da reabsorção óssea traduzem-se pela redução da actividade dos osteoclastos e o aumento da respectiva apoptose. A retenção no esqueleto é prolongada, o que pode favorecer a longa duração dos efeitos ósseos. O etidronato foi o primeiro fármaco do grupo a ser utilizado na osteoporose, seguiram-se-lhe o alendronato e risedronato e, mais recentemente, o ibandronato e o zoledronato. Diferem na estrutura, o que modifica a ligação aos receptores e condiciona a sua potência de acção. As alternativas posológicas são variadas: diárias, semanais, mensais e até anuais. Quadro 3. Critérios de diagnóstico da osteoporose * Classificação Valor de DMO – T Score* Normal >a – 1 DP Osteopenia –1 a –2,5 DP Osteoporose < –2,5 DP O T Score representa o número de desvios-padrão (DP) relativamente ao osso do adulto jovem. Menopausa 301 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 Estes factores têm um papel importante na avaliação e orientação da população que está exposta ao risco de fractura16,17. Contudo, a determinação da densidade mineral óssea (DMO) através da densitometria bifotónica por Rx continua a ser o exame complementar considerado como gold standard para o diagnóstico da osteoporose. Nela se baseiam os critérios da OMS16 (Quadro 3). O risco de fractura duplica por cada descida de um desvio-padrão no valor da DMO, sendo o valor preditivo da medição efectuada no colo do fémur o mais exacto. Apesar disso, não se provou que este exame complementar seja aplicável para rastreio generalizado de osteoporose em mulheres pós-menopausa com menos de 65 anos de idade. Em 2008, um grupo de trabalho da OMS utilizou a conjugação dos factores de risco clínico, que pode ser acrescido ao valor obtido pela medição da DMO do colo do fémur, para construir um modelo de cálculo de probabilidade de fractura num horizonte temporal de 10 anos22. Este algoritmo denominado FRAX (Fracture Risk Assessment Tool)23, encontra-se disponível online e apresenta opções de cálculo adaptadas à realidade de cada população, constituindo uma importante ajuda na decisão terapêutica, permitindo maximizar a relação custo-eficácia dos tratamentos20. Em conformidade com os conhecimentos existentes acerca da fisiopatologia da doença, a TH tem comprovado em todos os estudos, tanto observacionais como randomizados, aumentar a densidade mineral óssea e reduzir o risco de fracturas. O WHI (Women’s Health Initiative), estudo de grandes dimensões, prospectivo, randomizado e com dupla ocul- 302 com duração de 15 minutos com um seguimento de três anos, o grupo submetido a terapêutica activa registou uma redução de 70% de fracturas vertebrais e de 41% de fracturas da anca32. Cálcio e vitamina D Um equilíbrio na ingestão de cálcio é fundamental para complementar os efeitos de qualquer das terapêuticas utilizadas para a osteoporose. A ingestão diária de cálcio da maioria das mulheres pós-menopausa não ultrapassa os 500 mg, pelo que para atingir a dose diária recomendada de 1.500 mg é necessário administrar cerca de 1.000 mg. Em mulheres mais velhas, o suplemento de cálcio pode ter, por si só, efeitos benéficos no osso. Também com a idade surgem alterações no metabolismo da vitamina D devido à progressiva perda da capacidade da pele e do rim de sintetizarem a sua forma activa. A tudo isto acresce o facto de a absorção intestinal da vitamina D diminuir com a idade e ainda a redução do tempo de exposição solar e a utilização de protectores solares. É, portanto, recomendável que as mulheres com risco de deficiência, sejam igualmente suplementadas com vitamina D, na dose diária de 800 UI. Calcitonina A calcitonina é uma hormona peptídica que actua contrariando os efeitos osteolíticos da hormona paratiroideia, vitamina D e outras substâncias. Funciona também como inibidor da reabsorção óssea, reduzindo a actividade e o número de osteoclastos. Os seus efeitos são mais marcados no osso trabecular das vértebras onde previne a perda de massa óssea e reduz o risco de fracturas. Num estudo clínico randomizado, em que foi administrada calcitonina, 200 UI diárias por via intranasal durante cinco anos, verificou-se a redução apenas de fracturas vertebrais33. Têm-lhe sido atribuídos efeitos analgésicos por diminuição central da sensação de dor, devido ao aumento das endorfinas, inibição Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 Os bisfosfonatos administrados via oral requerem que o estômago esteja vazio e que a toma se faça com um copo cheio de água pelo menos 30 minutos antes da ingestão de alimentos. Os efeitos adversos mais comuns com eles relacionados são as erosões gastroesofágicas. Estão descritos raros casos de osteonecrose da mandíbula26, sobretudo em doentes oncológicos, e também existem estudos que associam o uso de bisfosfonatos a um aumento de risco de incidência de fibrilhação auricular27. A eficácia destes fármacos na redução do risco de fracturas osteoporóticas foi comprovada em múltiplos ensaios clínicos randomizados. No estudo FIT (Fracture Intervention Trial), o alendronato administrado diariamente na dose de 5 mg nos primeiros dois anos seguido de 10 mg durante o terceiro ano, reduziu em 50% o risco de fracturas vertebrais, do punho e da anca em comparação com o placebo28. O risedronato reduziu, no estudo VERT (Vertebral Efficacy with Risedronate Therapy), o risco cumulativo de novas fracturas vertebrais em 45% ao fim de três anos, em 65% ao fim do primeiro ano29. Num grupo de mulheres mais velhas, o risedronato reduziu a incidência de fractura da anca em 40%; nos casos com prevalência de fracturas vertebrais, essa redução aumentou para 60%30. A eficácia do ibandronato administrado por via oral de modo contínuo ou intermitente foi verificada no estudo BONE (Bonviva Osteoporosis Trial in North America and Europe) e foi da ordem dos 52% nas fracturas vertebrais morfométricas, ao fim de cinco anos de avaliação31. A incidência de fracturas não-vertebrais foi semelhante à do placebo na população global do estudo, tendo-se verificado redução dessa incidência apenas numa análise post hoc de um grupo de doentes de alto risco. O zoledronato foi tratado no estudo HORIZON (Health Outcomes and Reduced Incidence With Zoledronic Acid Once Yearly) para uma administração endovenosa anual Ranelato de estrôncio O ranelato de estrôncio é um produto para administração oral constituído por dois átomos de estrôncio e uma molécula de ácido ranélico. O seu mecanismo de acção dissocia as fases de formação e reabsorção óssea, via osteoproteogina, estimulando a primeira e inibindo a segunda. Os ensaios laboratoriais demonstraram que o ranelato de estrôncio melhora as propriedades biomecânicas do osso e aumenta a sua resistência. A sua eficácia a nível de risco de fracturas foi comprovada em estudos randomizados que testaram um grupo de mulheres pós-menopausa com osteoporose a tomar o medicamento na dose diária de 2 g. O estudo SOTI34 (Spinal Osteoporosis Therapeutic Intervention) teve como principal objectivo a avaliação da eficácia a nível de fracturas vertebrais e o estudo TROPOS35 (Treatment of Peripheral Osteoporosis) foi direccionado para as fracturas não-vertebrais. Após três anos de terapêutica, verificou-se uma redução do risco de novas fracturas vertebrais de 41% e uma redução de fractura do colo de fémur de 36%, num subgrupo de mulheres considerado de alto risco. Uma extensão dos estudos até cinco anos comprovou a sustentabilidade dos resultados obtidos, com reduções de fracturas de 31 e 27%, para fracturas vertebrais e não-vertebrais respectivamente. Ambos os estudos revelaram aumentos da DMO correlacionados com a redução do risco de fractura. Na interpretação da densitometria em mulheres a tomar ranelato de estrôncio, importa ter presente que cerca de 50% do aumento da DMO se deve à retenção da radiação emitida, pelo estrôncio. A absorção do medicamento é prejudicada pelos alimentos, especialmente leite e seus derivados, pelo que se recomenda um intervalo de duas horas entre a toma e as refeições. Os efeitos adversos mais comuns foram a Menopausa diarreia, náuseas e irritação cutânea. Por precaução, não deve ser administrado a mulheres com antecedentes de tromboembolismo, embora não tenha sido provado que cause alterações na coagulação. Teriparatide Foi demonstrado por experiências laboratoriais e estudos de investigação clínica que a paratormona tem acções anabólicas sobre o esqueleto. O teriparatide é um fragmento recombinante da paratormona que aumenta a massa óssea e melhora a sua microestrutura. O seu efeito sobre a prevenção de fracturas foi testado no FTP (Fracture Prevention Trial)36 com dosagens de 20 e 40 μg administradas diariamente por via subcutânea. Verificou-se, ao fim de 18 meses, uma redução do risco de fracturas vertebrais de cerca de 70% e de fracturas não-vertebrais de 60%. Os ensaios clínicos foram posteriormente suspensos devido à ocorrência, em ratos, de osteossarcoma associados à administração de altas doses do medicamento. Tal efeito nunca se verificou em seres humanos. O teriparatide é bem tolerado e estão descritas reacções adversas minor que incluem náuseas e vómitos. As indicações para o seu uso limitam-se a situações de osteoporose grave com alto risco de fractura e por períodos de tempo que não devem ultrapassar os 18 a 24 meses. 4.2. DOENÇA CARDIOVASCULAR As doenças cardiovasculares são a principal causa de mortalidade em ambos os sexos, como é bem expresso no relatório da OMS para a Europa em 2004, em que lhe são atribuídas 43 e 55% das mortes ocorridas, respectivamente nos sexos masculino e feminino. Desde 1984 que o número de mortes por doença cardiovascular nas mulheres ultrapassa o dos homens e é cerca de 10 vezes superior ao número de mortes causadas por cancro da mama. Constata-se que existe um atraso, em média de 10 anos, entre a idade a 303 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 da síntese de prostaglandinas e ainda por interferência nos fluxos de cálcio. 304 reactiva pode funcionar, nesta fase, como marcador não-específico da resposta inflamatória vascular. Os estrogénios, no início de todo o processo, são susceptíveis de prevenir a formação da placa de ateroma, promover a vasodilatação e desempenhar um papel protector a nível vascular. Mais tarde, a vasoconstrição e os fenómenos de trombose levam à instabilidade da placa de ateroma. Neste processo, intervêm as enzimas metaloproteinases de matriz, produzidas pelas células inflamatórias e induzidas pelos estrogénios, que, nesta fase, apresentam efeitos pró-trombóticos41. A maioria das doenças cardiovasculares surge em consequência da aterosclerose e os principais factores de risco são a hipertensão arterial, o tabagismo, a diabetes mellitus, a obesidade e as dislipidemias. Muitos desses factores podem ser neutralizados pelos hábitos de vida, nomeadamente pela dieta e pelo exercício físico. As alterações do perfil lipídico consequentes à menopausa podem ser revertidas com a estrogenioterapia42,43. A presença da mulher nas consultas de ginecologia deve ser encarada como uma oportunidade para associar aos rastreios oncológicos dos cancros da mama e colo do útero, a avaliação da pressão arterial e do perfil lipídico, com vista à adopção das respectivas medidas correctivas. Quanto à influência da TH da pós-menopausa no risco de doença cardiovascular, nas últimas décadas, tem-se assistido a uma mudança nas correntes de opinião e nas recomendações emanadas de diversos organismos oficiais perante os resultados dos estudos randomizados publicados a partir de 1998. Com efeito, nos anos 80-90 os estudos observacionais como, por exemplo, o NHS (Nurses’s Health Study)44 revelavam uma redução do risco de doença coronária, situado entre 30-50%, nas mulheres que utilizavam TH, quer com estrogénios isolados, quer com a associação de estrogénios e progestativos. Alguns estudos chegaram Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 que se manifesta a doença coronária na mulher comparativamente ao que se passa no homem. Depois dos 50 anos, idade em que habitualmente ocorre a menopausa, uma mulher tem 65% de probabilidade de vir a desenvolver hipertensão arterial, 46% de hipóteses de vir a sofrer de doença coronária e 31% de probabilidades de morrer de doença cardiovascular37. Existem numerosos estudos epidemiológicos que demonstram claramente que, na mulher, o risco de doença cardiovascular aumenta, não só com a idade, mas também com a menopausa37,38. Ainda recentemente foi concluído num estudo de corte, com grandes dimensões e follow-up de longa duração, que a ooforectomia bilateral antes dos 45 anos de idade estava associada a aumento da mortalidade cardiovascular39. Na verdade, os efeitos das hormonas esteróides não se limitam ao aparelho reprodutor e estendem-se a quase todos os outros órgãos e sistemas. Assim, no que respeita ao aparelho cardiovascular, o papel dos estrogénios sente-se sobretudo a dois níveis: o perfil lipídico e a acção directa a nível da parede vascular. Após a menopausa, o colesterol total aumenta cerca de 6%, o colesterol das LDL 11% e os triglicerídeos 9%. Concomitantemente, verifica-se um decréscimo de 6% do colesterol das HDL40. Por outro lado, há um aumento da oxidação da LDL, produzindo uma LDL modificada que causa os primeiros depósitos de gordura no endotélio. Essa alteração origina disfunção endotelial e afecta a produção de óxido nítrico e de prostaciclinas, elementos importantes que intervêm nos mecanismos de vasodilatação. A proliferação e migração de células musculares lisas, também influenciada por factores de crescimento e citocinas, dá início à lesão aterosclerótica formando uma placa fibrosa. Contribuem ainda para danificar o endotélio, alterações inflamatórias e deposição de células de monócitos circulantes, que posteriormente se convertem em macrófagos41. A proteína C Menopausa Com a finalidade de conseguir explicações para os resultados obtidos, o estudo WHI foi alvo de várias reanálises. No que respeita à doença cardiovascular, os autores verificaram que não existia qualquer aumento de risco associado à TH, no subgrupo de mulheres com idades compreendidas entre os 50-59 anos (HR (hazard ratio) – 0,70) 48,49. Contudo, esse risco aumentava progressivamente nos subgrupos de 60-69 anos (HR – 1,05) e 70-79 anos (HR – 1,14)48,49. Verificou-se ainda que, à data do início da terapêutica, o facto de ter decorrido um maior número de anos a partir da menopausa estava associado à ocorrência de um aumento de eventos cardiovasculares48,49. Com base nestes elementos e de acordo com a fisiopatologia da doença, aventou-se a hipótese de os estrogénios poderem prevenir o desenvolvimento da placa ateromatosa em mulheres com menopausa recente ou pelo contrário agravar lesões vasculares presentes em mulheres mais velhas. À luz dos conhecimentos actuais, continua a não ser recomendada a utilização da TH na prevenção, primária ou secundária, da doença cardiovascular. Admite-se porém que existe uma «janela de oportunidade» para o uso desta terapêutica em mulheres com menopausa recente e idade inferior a 60 anos50, sendo provável que nestes anos possa proteger quanto à morbilidade e mortalidade decorrentes de doenças cardiovasculares. 5. TERAPÊUTICA HORMONAL A TH foi, a partir dos anos 60, utilizada com sucesso para tratar os sintomas associados ao estado de deficiência em estrogénios, sendo os mais representativos os vasomotores e urogenitais. Nos anos 90, a filosofia de prescrição da TH alterou-se e, a partir de um mero tratamento sintomático, criaram-se grandes expectativas quanto à prevenção de complicações tardias da menopausa que 305 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 a apontar para uma protecção do cardiovascular superior nas mulheres com doença coronária já diagnosticada. No sentido de confirmar estes resultados e justificar a prescrição da TH na prevenção primária e secundária da doença cardiovascular, surgiram os ensaios clínicos randomizados. Em 1998, o HERS (The Heart and Estrogen/ progestin Replacement Study)45, estudo de prevenção secundária, encontrou um inesperado aumento de eventos cardiovasculares no grupo da TH em comparação com o grupo placebo. Quatro anos mais tarde, são divulgados os primeiros resultados do WHI, estudo que foi concebido com o objectivo principal de avaliar o efeito da terapêutica hormonal na prevenção primária da doença cardiovascular. Ao fim de 5,2 anos de administração da associação de estrogénios e progestativos, o risco de eventos cardiovasculares foi de 1,29, o que em números absolutos significa mais sete casos por cada 10.000 mulheres que durante um ano utilizaram a TH24. Posteriormente, foram conhecidos os resultados do braço do WHI referente a mulheres histerectomizadas a fazer estrogénios isolados e, neste caso, o efeito foi neutro, com um risco relativo (RR) de doença cardiovascular de 0,91 para o grupo de tratamento46. É importante salientar as discrepâncias entre estes dois tipos de estudos47, observacionais e randomizados, pois se atendermos as estas diferenças, conclui-se que os resultados de ambos não são tão díspares como à primeira vista poderia parecer. Assim, nos estudos observacionais, as hormonas foram prescritas de forma individualizada a mulheres na fase do climatério, a maioria apresentando sintomatologia vasomotora, com idades que variavam entre os 50 e 55 anos, quando iniciaram o tratamento. Pelo contrário, nos estudos randomizados, uma TH padrão foi administrada a mulheres assintomáticas, na sua maioria com idades superiores a 60 anos e decorridos vários anos sobre a data da última menstruação. 5.1. INDICAÇÕES E CONTRAINDICAÇÕES Os benefícios da TH são os decorrentes da acção dos estrogénios nos órgãos e sistemas onde se faz sentir a sua privação. A decisão de iniciar a terapêutica deve ser individualizada e partilhada, tendo sempre em consideração o binómio risco/benefício, não perdendo de vista que a sua principal finalidade é tratar os sintomas do climatério, e contribuir para a melhoria da qualidade de vida da mulher. Para atingir este objectivo, é recomendado o uso da menor dose de medicamento necessária para obter os efeitos pretendidos durante um espaço temporal limitado. No entanto, a persistência da sintomatologia poderá exigir o prolongamento do seu uso. As alternativas não-hormonais preconizadas para o tratamento dos sintomas vasomotores apresentam uma eficácia claramente inferior à da TH (Quadro 4). Ainda que não constituam indicações específicas para iniciar ou manter um tratamento hormonal, afigura-se como um dado adquirido que, enquanto a mulher o faz, previne a perda de massa óssea e reduz o risco de fracturas. Também há indícios de que o tratamento hormonal pode proporcionar à mulher protecção contra as doenças cardiovasculares, se iniciado nos primeiros anos após a menopausa. As contra-indicações absolutas para TH resumem-se a situações graves como cancros hormonodependentes, doenças tromboembólicas, cardiovasculares e hepáticas. Por seu lado, as contra-indicações relativas são representadas por situações clínicas que requerem uma rigorosa selecção de entre as várias opções terapêuticas e um cuidadoso acompanhamento (Quadro 5). Quadro 4. Terapêuticas não-hormonais dos sintomas vasomotores 306 Fármaco Dose Eficácia Fluoxetina51 20 mg m 50% Paroxetina52 12,5 mg 25 mg m 62% m 65% Venlafaxina53 37,5 mg 75 mg 150 mg m 37% m 61% m 61% Gabapentina54 900 mg m 50% Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 implicavam tratamentos de longa duração. Com a sua crescente utilização, por parte das mulheres, começaram a surgir estudos científicos que permitiram alargar os conhecimentos acerca destas terapêuticas. Concomitantemente, os temas da menopausa e da TH passaram a ser alvo de interesse da comunicação social e a Internet abriu janelas para informação fácil, mas por vezes de qualidade duvidosa. Os médicos e as mulheres ficaram então expostos a opiniões completamente diferentes sobre assuntos complexos e controversos, factos que tornaram extremamente difícil tomar decisões. É, pois, fundamental que, com base numa interpretação séria e actualizada de toda a informação divulgada nos últimos anos, se estabeleçam normas de actuação transversais e se melhore a comunicação entre os profissionais e entre estes e as mulheres na pós-menopausa. Indicações Contra-indicações Confirmadas Absolutas Sintomas vasomotores Tumores hormonodependentes Atrofia urogenital Doença tromboembólica Prevenção e tratamento da osteoporose Doença cardiovascular grave Acidente cerebrovascular Doença hepática grave Porfiria Meningioma (apenas ao progestativo) Hemorragia uterina de causa desconhecida Potenciais Relativas Prevenção da doença cardiovascular Prolactinoma Prevenção da doença de Alzheimer Litíase biliar Prevenção do cancro colorrectal Adenoma hepático Tromboflebite superficial Endometriose Mioma uterino 5.2. HORMONAS ESTERÓIDES E REGIMES DE ADMINISTRAÇÃO Para efectuar a TH, existem diversos tipos de compostos que se podem subdividir em dois grandes grupos: estrogénios e progesterona ou seus derivados sintéticos. Enquanto os primeiros são responsáveis pela supressão dos sintomas decorrentes da falência ovárica, os segundos apenas são importantes na medida em que asseguram a protecção do endométrio face à estimulação estrogénica. Daí decorre que, salvo raríssimas excepções, os progestativos não devem fazer parte da TH das mulheres histerectomizadas, situação em que está indicada a estrogenioterapia isolada. Os estrogénios55 são fundamentalmente de dois tipos: os naturais e os sintéticos, dos quais o principal representante é o etinilesMenopausa tradiol, de que não é conhecida nenhuma utilização em TH. Dos naturais há a considerar os humanos (estradiol, estriol, estrona), os ésteres (valerianato de estradiol) e os equinoconjugados. O 17-β estradiol é o princípio activo natural e o valerianato de estradiol é uma pró-hormona, que depois de hidrolisado se transforma em estradiol. Os estrogénios equinoconjugados são compostos essencialmente por estrona e equilina, embora contenham ainda outras substâncias com actividade estrogénica. O estriol é um metabolito com fraca afinidade para o receptor de estrogénio e rapidamente eliminado da célula o que limita a sua actividade sistémica. Os progestativos56,57 são moléculas que têm a capacidade de transformar um endométrio estimulado por estrogénios numa fase secretora; actuam por diminuição dos receptores 307 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 Quadro 5. Indicações e contra-indicações da TH 308 ção via transdérmica59. Ao evitar o efeito de primeira passagem hepática, a via transdérmica origina uma relação estrona/estradiol mais fisiológica e apresenta menor impacto metabólico. Por estas razões esta deverá ser a via preferencial em situações de patologia hepatobiliar e de hipertrigliceridemia, bem como quando se pretende evitar as alterações no sistema de coagulação e nos mecanismos de controlo da pressão arterial ligados ao sistema renina-angiotensina. A aplicação de estrogénios por via vaginal é especialmente útil no tratamento da atrofia urogenital, há, no entanto, que não menosprezar a absorção sistémica especialmente quando se utiliza o estradiol numa vagina com epitélio atrófico. O dispositivo intra-uterino com libertação de levonorgestrel tem sido utilizado de forma eficaz na protecção local do endométrio contra a estimulação causada pela estrogenioterapia isolada, minimizando os efeitos sistémicos dos progestativos60. A dose convencional de administração oral de estrogénios é de 2 mg de estradiol ou do seu éster e de 0,625 mg para os estrogénios conjugados equinos. Seguindo a recomendação de utilizar a menor dose possível de estrogénios para obter os efeitos pretendidos, foram disponibilizadas as baixas dosagens, 1 mg de estradiol e 0,375 mg de estrogénios conjugados equinos, e prevê-se que no futuro se possa caminhar em direcção às dosagens ultrabaixas. Na via transdérmica a dose padrão é de 50 μg e a baixa dosagem é 25 μg de 17β estradiol. Os regimes terapêuticos combinados variam sobretudo devido às diferentes dosagens e duração de administração do progestativo56,57,61. Quando o progestativo é utilizado durante 10 a 14 dias por mês, o regime posológico é combinado sequencial, havendo lugar a uma hemorragia de privação cíclica. Se o progestativo for administrado diariamente em conjunto com o estrogénio, então trata-se de um esquema combinado contínuo (Quadro 6). Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 de estrogénios e da actividade mitótica celular. A maioria dos progestativos sintéticos disponíveis para uso clínico é derivada da progesterona natural ou da testosterona. A progesterona natural possui uma biodisponibilidade oral fraca que aumenta quando metabolizada em 17-β hidroxiprogesterona ou nos derivados em 19-norprogesterona. A testosterona e os seus análogos possuem propriedades androgénicas e anabólicas; a remoção dos constituintes na posição C19 da testosterona origina a 19-nortestosterona que pode ser utilizada como um progestativo. Consoante o seu perfil específico, os progestativos interagem com outros receptores de esteróides como os de androgénios, estrogénios, mineralocorticóides e glucocorticóides. Destas diferenças resulta que os progestativos derivados da progesterona natural têm um perfil mais favorável ao aparelho cardiovascular e os derivados da testosterona têm efeitos mais marcados no sistema esquelético. Para além dos estrogénios e da progesterona, a testosterona e seus análogos podem ter indicações muito específicas no decurso de uma TH, especialmente se houver uma predominância de sintomas relacionados com humor depressivo e desejo sexual hipoactivo. Como estes produtos nem sempre se encontram disponíveis em formulações adequadas para a mulher, a solução é adaptá-los, através da redução da dose, como por exemplo, no caso do gel para aplicação transdérmica de testosterona58. Também é aconselhável nestes casos monitorizar a testosterona total sérica e manter os seus níveis entre os 20 e os 80 ng/dl. Os medicamentos utilizados em TH podem ser administrados por diferentes vias e segundo vários esquemas posológicos. A via oral é a mais utilizada quer para os estrogénios quer para os progestativos. As vias percutânea e transdérmica podem ser utilizadas para o estradiol, enquanto para os progestativos apenas os compostos derivados da noretisterona são passíveis de administra- Progestativo Dose Sequencial Combinado contínuo 200 mg 100 mg Dihidrogesterona 10 mg 5 mg Medroxiprogesterona 10 mg 5 mg Acetato noretisterona 1 mg 0,5 mg Acetato ciproterona 1 mg Progesterona natural Acetato Levonorgestrel 0,075 mg Gestodeno 0,02 mg Dienogeste 2,0 mg Drospirenona 2,0 mg Estrogénios e progestativos são susceptíveis de causarem efeitos secundários, muitos dos quais podem ser atribuídos apenas a um dos tipos de hormonas em questão. Sabe-se, no entanto, que a maior parte dos problemas de tolerância são originados pelo progestativo e se traduzem por queixas de retenção hídrica, deterioração do humor e mastalgia. Relativamente aos estrogénios estão descritas reacções de hipersensibilidade mamária, náuseas, cefaleias, cãibras musculares e edemas. Saliente-se que, na sua maioria, estas reacções indesejáveis regridem espontaneamente com a continuação do tratamento. Podem ainda ser adoptadas medidas simples, tais como: diminuir a dose, administrar o medicamento ao deitar, alterar a via de administração ou o tipo de progestativo. 5.3. RISCO ONCOLÓGICO Um dos maiores obstáculos ao uso da TH é a preocupação tanto do médico como da mulher de que as hormonas possam causar Menopausa cancro. As mulheres que se submetem à TH não têm um risco acrescido de desenvolver cancros em órgãos que não pertençam ao aparelho genital. Há inclusivamente estudos que revelam uma redução da incidência e da mortalidade do cancro colorrectal nas mulheres que utilizam este tipo de terapêuticas24,62. Quanto aos cancros ginecológicos, sabe-se que representam perto de metade dos cancros femininos e surgem na sua maioria em mulheres menopáusicas. O adenocarcinoma do endométrio é o cancro genital mais frequente, sendo, antes da menopausa, uma doença rara; só 7,5% dos casos são diagnosticados antes dos 50 anos. A partir dos 40 e até aos 65 anos, a incidência aumenta rapidamente para, a partir daí, se manter constante. Com base em estudos experimentais e clínicos pôde concluir-se que os estrogénios endógenos e exógenos estão associados a um aumento do risco de hiperplasia e cancro do endométrio. O aumento de incidência de cancro do endométrio aconteceu nos anos 70 e coincidiu com a 309 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 Quadro 6. Doses de progestativos segundo o esquema de administração 310 dade, menopausa tardia, consumo de álcool, dieta com excesso de gorduras e obesidade. Muitos destes factores de risco sugerem uma relação entre as hormonas esteróides ováricas e o risco de cancro da mama, já que são situações que apresentam uma exposição prolongada aos estrogénios. Apesar duma experiência de mais de seis décadas com a TH, e não obstante a falta de prova directa, nem tudo está esclarecido sobre o papel que este tipo de terapêutica pode desempenhar na génese e evolução do cancro da mama. Desde há muitos anos que os estudos observacionais apontavam para um aumento do risco de cancro da mama associado à utilização da TH, sobretudo em tratamentos com duração superior a cinco anos. De todos eles o mais representativo foi efectuado pelo Grupo Colaborativo sobre Factores Hormonais no Cancro da Mama, uma metanálise de 51 estudos, publicada em 199766. Os autores apuraram que o risco de cancro da mama estava relacionado com a duração terapêutica e só era significativo a partir dos cinco anos de uso (RR 1,19). Em números absolutos, o uso de TH levaria a um acréscimo de dois casos aos cinco anos, seis aos 10 anos e 12 aos 15 anos, em cada 1.000 mulheres que durante um ano a utilizaram. O aumento anual, de 2,3%, no risco de cancro da mama com TH seria idêntico ao adiar um ano a data da menopausa. Não se verificaram diferenças entre os estrogénios isolados e associados ao progestativo, nem entre os diversos regimes terapêuticos. Após a suspensão da TH o risco diminuiu gradualmente regressando aos valores basais passados cinco anos. No anteriormente mencionado estudo WHI, foi encontrado, no braço referente à associação de estrogénios e progestativos, um aumento do risco de cancro invasivo da mama de 26% após 5,2 anos de tratamento, o que, em números absolutos, corresponde a um acréscimo de oito casos por 10.000 mulheres/ano a efectuar terapêutica24. Este ensaio incluía mulheres que tinham feito TH vários anos a seguir à menopausa previamente Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 utilização de estrogénios isolados em TH63. O RR de contrair cancro do endométrio devido ao uso de estrogénios isolados varia de 2,8 a 8,0. Esse risco está relacionado com a duração do tratamento, a dose utilizada e o esquema de administração. Doses mais elevadas e tratamentos prolongados com estrogénios isolados estão associados a um aumento do risco de adenocarcinoma do endométrio, que pode persistir durante 10 anos após a suspensão da terapêutica. Contudo, os cancros que ocorrem devido aos estrogénios têm habitualmente uma maior diferenciação celular e são diagnosticados em estádios mais precoces, verificando-se menor grau de invasão do miométrio e consequentemente uma maior sobrevivência aos cinco anos. Demonstrouse que, a associação de um progestativo ao estrogénio utilizado na TH reduz o risco de neoplasia para valores semelhantes aos encontrados na população em geral, ou mesmo, para valores ainda mais baixos64. Quando o progestativo é administrado ciclicamente no intuito de prevenir o aparecimento de patologia endometrial, a duração do tratamento é mais importante do que a dose utilizada. Preconiza-se um período mínimo de 10 a 14 dias de progestativo por cada ciclo mensal de TH, ao qual os autores atribuíram um RR de cancro do endométrio de 0,964. O cancro da mama é a neoplasia mais frequente na mulher nos países industrializados. Aproximadamente uma em cada 12 mulheres vai ter um cancro da mama durante a sua vida. Em 2005, nos EUA, foram diagnosticados 186.467 novos casos de cancro da mama, a taxa de incidência foi de 117,7/100.000 mulheres por ano; morreram nesse ano 41.116 mulheres devido à doença65. O cancro da mama difere do cancro do endométrio no que se refere à sua etiologia multifactorial e ao seu tempo de latência que se situa na ordem dos 10 a 20 anos. Têm sido referidos muitos factores de risco de cancro da mama entre os quais: idade superior a 50 anos, menarca precoce, primeira gravidez a termo depois dos 30 anos de idade, nulipari- Menopausa estabelecer correlação entre o uso de TH e o risco de desenvolver cancro do ovário, porque os estudos, ainda que detalhados quanto ao tipo de estrogénios usados, associação com progestativos e análise dos subtipos histológicos, limitam-se a um escasso número de casos. A maioria dos estudos observacionais aponta para um aumento do risco destes tumores associados ao uso de TH, sobretudo aos estrogénios isolados, em casos de administração prolongada70. Pelo contrário, na maioria dos estudos caso-controlo não se apurou aumento de risco de cancro do ovário, independentemente do tipo de terapêutica utilizado71. Até à publicação do WHI não estava determinado o risco da associação de estrogénios e progestativos com o cancro do ovário. No entanto, neste estudo esse risco foi de 1,58, que correspondeu a 20 casos diagnosticados no grupo de tratamento e 12 casos no grupo placebo72. Atendendo à raridade desta patologia, podemos concluir que não existe prova suficiente para que estes resultados demovam do uso de TH. 6. OUTRAS TERAPÊUTICAS COM MEDIAÇÃO HORMONAL 6.1. FITOESTROGÉNIOS Os fitoestrogénios são componentes vegetais estruturais e funcionalmente similares aos estrogénios ováricos e placentários e também aos seus metabolitos activos. Estão classificados em três grandes grupos: isoflavonas, linhanos e coumestranos. Os mais conhecidos e estudados são as isoflavonas de soja cujos principais componentes são a genisteína e a daidzeína. Ambos são biologicamente inactivos necessitando de serem transformados no seu metabolito bacteriológico, o equol, pela flora intestinal. Estes compostos actuam através de ligação aos receptores de estrogénios α e B, com predominância dos últimos, embora a sua capacidade de ligação seja mais fraca do que as das hormonas naturais. 311 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 à sua inclusão nos grupos de estudo. Na reanálise dos dados, verificou-se que o aumento de risco de cancro da mama aos 5,2 anos não se aplicava às mulheres que estavam a fazer TH pela primeira vez em toda a sua vida, mas precisamente às que já anteriormente o tinham feito67. Com alguma surpresa, no braço do estudo que avaliava a terapêutica com estrogénios isolados em mulheres histerectomizadas, verificou-se uma redução do risco de cancro da mama nas mulheres, menos sete casos por 10.000 mulheres tratadas por ano, o que corresponde a um RR de 0,7746. A situação de menopausa cirúrgica pode no entanto introduzir um factor de enviesamento no estudo, dado que a influência da ooforectomia não é possível completamente determinar. Na análise de publicações sobre o assunto, devemos ter em conta que os autores são unânimes em referir que estas mulheres, a fazer TH, realizam mais 31% de mamografias do que os grupos sem terapêuticas e que os cancros diagnosticados quase sempre se detectam em fase mais precoce, com uma percentagem significativamente inferior de invasão ganglionar68. Foi recentemente relatada a redução da incidência de cancro da mama, nos EUA, que segundo alguns autores é paralela à diminuição de utilização de TH pela população feminina verificada após a publicação do WHI, facto que naturalmente leva a que se tente estabelecer uma relação causa-efeito69. Esta situação carece, no entanto, de uma análise mais profunda uma vez que a incidência de cancro da mama nos EUA já revelava uma tendência para a diminuição antes de 2002, data da publicação do WHI, e por outro lado o mesmo fenómeno não ter sido verificado noutros países onde também foram registados decréscimos significativos de utilização de TH na pós-menopausa. O cancro do ovário representa 4 a 5% dos cancros da mulher, e embora corresponda a 28% de todos os cancros genitais, causa mais mortes do que todas as outras doenças pélvicas malignas em conjunto. Tem sido difícil 6.2. MODULADORES SELECTIVOS DOS RECEPTORES DE ESTROGÉNIOS Os moduladores selectivos dos receptores de estrogénios (SERMs) actuam de modo selectivo nos receptores de estrogénios distribuídos pelos diversos tecidos, com efeitos agonistas ou antagonistas. Na actualidade 312 o fármaco mais representativo desta família é o raloxifeno que tem efeitos semelhantes aos estrogénios no osso e lípidos, mas não estimula o endométrio nem tem efeitos proliferativos na mama. O aumento da densidade mineral óssea e a redução de fracturas vertebrais foram descritos na publicação do estudo MORE (Multiple Outcomes of Raloxifene Evaluation), em que um grupo de mulheres a tomar raloxifeno durante quatro anos foi comparado com um grupo de placebo77. Foi verificada uma redução de 49% no risco de fracturas vertebrais com o raloxifeno, em mulheres com osteoporose, ao passo que, no grupo em que existiam fracturas prévias, essa redução foi de 34%. A redução de fracturas vertebrais foi equivalente à encontrada com a TH ou com os bisfosfonatos apesar dos aumentos de massa óssea terem sido inferiores, 2,6 e 2,1% para a coluna lombar e colo do fémur, respectivamente. Não foi comprovada redução de fracturas periféricas, quer do colo do fémur quer do rádio distal. O efeito adverso mais importante neste estudo foi um aumento de risco de tromboembolismo venoso de magnitude comparável ao que acontece durante a terapêutica com estrogénios. Também se registou um aumento dos afrontamentos sem significado estatístico relativamente ao grupo de placebo e que não motivou abandonos da terapêutica. O raloxifeno demonstrou ainda reduzir o risco de cancro da mama. Segundo o estudo MORE, ao fim de quatro anos, houve uma redução de 72% na incidência de cancro da mama invasivo, e de 84% na incidência dos tumores com receptores de estrogénio positivos77. Quando comparado com o tamoxifeno na prevenção do cancro da mama invasivo em mulheres de risco, o raloxifeno revelou eficácia idêntica à daquele fármaco78. Apesar do impacto positivo nos lípidos com redução das LDL, aumento das HDL, o estudo RUTH (Raloxifene Use for The Heart) não conseguiu demonstrar benefícios na redução do risco de doença cardiovascular79. Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 A sua utilização expandiu-se, nos últimos anos, no mundo ocidental onde são habitualmente prescritos para o tratamento dos sintomas vasomotores73. Os estudos que defendem a sua aplicação clínica não são consistentes, por um lado, porque as casuísticas não são representativas e, por outro, têm curta duração. Na sua maioria, aqueles estudos revelaram uma diminuição da sintomatologia vasomotora que estatisticamente não é significativa relativamente ao placebo (45 versus 30%). Embora alguns dados sugiram que as isoflavonas possam ter um efeito benéfico a nível da perda de massa óssea, escasseiam os estudos nos seres humanos e os que existem, mais uma vez têm por base números pouco significativos e períodos de avaliação insuficiente74. Contrariamente ao que acontece com os alimentos ricos em soja, não foi demonstrada redução nos níveis séricos de colesterol com a utilização de isoflavonas75. Alguns suplementos de fitoestrogénios são susceptíveis de causar aumento das HDL-C (high density lipoprotein cholesterol) e da distensibilidade arterial. Assim, não existe base científica que suporte a utilização dos fitoestrogénios na prevenção de doença cardiovascular. Também não há provas de que as isoflavonas confiram algum grau de protecção contra o cancro da mama. Estudos observacionais realizados em mulheres orientais mostram que, para a baixa prevalência da doença naquelas regiões, é necessária a exposição prépubertal à soja e respectivos componentes76. Também não há estudos que garantam a segurança da sua utilização nas mulheres operadas a cancro da mama ou outros tumores hormonodependentes. 6.3. TIBOLONA A tibolona é uma molécula semi-sintética de estrutura química relacionada com os progestativos noresteróides cuja actividade depende dos seus metabolitos (3 α-OH, 3 β-OH, Δ-4 isómero) e da respectiva ligação aos receptores de estrogénios, progesterona e testosterona. A tibolona tem efeitos semelhantes aos dos estrogénios relativamente aos afrontamentos e à atrofia vaginal. Tem ainda a vantagem de melhorar a libido e outros aspectos da resposta sexual. Relativamente à prevenção da perda de massa óssea os seus efeitos são semelhantes aos dos estrogénios, conseguindo obter ganhos significativos de massa óssea tanto na coluna vertebral como no colo do fémur, tendo sido já comprovados efeitos de redução no risco de fracturas vertebrais e não-vertebrais80. As suas acções no aparelho cardiovascular são neutras no que concerne à doença coronária e tromboembólica, contudo foi descrito um aumento do risco de acidente cerebrovascular80. O endométrio não é estimulado pela tibolona81, embora já tenham sido publicados estudos sobre casos de patologia maligna em mulheres a fazer esta terapêutica82, pelo que se aconselha a investigação sempre que se registe a ocorrência de metrorragias persistentes. Na mama, os efeitos da tibolona são complexos e envolvem enzimas com interferência no metabolismo local dos estrogénios, predominando a inibição da sulfatase e a diminuição das concentrações mamárias de estradiol. Com base nestes conhecimentos, a tibolona foi a opção terapêutica preferencial em mulheres com patologia mamária ou com alto risco para cancro da mama. Os resultados do Million Women Study83 provocaMenopausa ram dúvidas quanto à neutralidade da tibolona em relação ao risco de cancro da mama. Os resultados publicados recentemente de um estudo de não-inferioridade em que a tibolona foi utilizada durante 3,1 anos em doentes tratadas por cancro da mama demonstraram um aumento de 40% do risco de recorrência da doença, em comparação com as doentes que receberam placebo84. 7. CONCLUSÃO A compreensão da menopausa e da sua orientação passa não só pela competência do médico, mas também pela dedicação de todos os outros profissionais com responsabilidades na área da saúde da mulher. O envolvimento da mulher num modelo preventivo em que sejam identificados factores de risco susceptíveis de ser contornados por hábitos de vida saudáveis pode contribuir positivamente para melhorar a qualidade de vida após a menopausa. A todas as mulheres deve ser aconselhada uma dieta que mantenha o balanço calórico e pobre em gorduras; adequado consumo de cálcio e vitamina D; actividade física regular; não fumar e não ingerir bebidas alcoólicas em excesso. A decisão de realizar ou não TH deve ser individual, de acordo com as recomendações vigentes e periodicamente reavaliada. Bibliografia 1. Instituto Nacional de Estatística – INE. Disponível em: www.ine.pt 2. Taffe JR, Dennerstein L. Menstrual patterns leading to the final menstrual period. Menopause. 2002;9:32-40. 3. Astrup K, Olivarius N, Moller S, Gottschau A, Karslund W. Menstrual bleeding patterns in pré- and perimenopausal women: a population prospective diary study. A Obstet Gynec Scand. 2004;83:197-202. 4. Meshia M, Pansini F, Modena AB, de Aloysio D, Gambacciani M, et al., on the behalf of the ICARUS Study Group. Determinants of age at menopause in Italy: results from a large cross-sectional study. Maturitas. 2000;34:119-25. 5. Rannevik G, Jeppsson S, Johnell O, Bjerre B, YaurellBorulf Y, Svanberg L. A longitudinal study of the perimenopausal transition: altered profiles of steroid and pituitary hormones. Maturitas. 1995;21:103-13. 313 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 Actualmente são objecto de investigação novas moléculas de SERM, de actividade mais selectiva, e que, no futuro, poderão trazer novas avaliações no binómio risco/benefício do tratamento da mulher pós-menopausa. 314 26. Silverman SL, Landesberg R. Osteonecrosis of the jaw and the role of bisphosphonates: a critical review. Am J Med. 2009;123:S33-45. 27. Heckbert SR, Li G, Cummings SR, Smith NL, Psaty BM. Use of alendronate and risk of incident atrial fibrillation in women. Arch Intern Med. 2008;168:826-31. 28. Black DM, Cummings SR, Karpf DB, et al., for the Fracture Intervention Trial Research Group. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet. 1996;348:1535-41. 29. Harris ST, Watts NB, Genant HK, et al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Osteoporos Int. 2000;11:83-91. 30. McClung MR, Geusens P, Miller PD, et al. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med. 2001;344:333-40. 31. Delmas PD, Recker RR, Chesnut CH, et al. Daily and intermittent oral ibandronate normalize bone turnover and provide significant reduction in vertebral fractures risk. Results from the BONE study. Osteoporos Int. 2004;15:792-8. 32. Black DM, Boonen S, Cauley JA, et al. Effects of onceyearly infusion of zoledronic acid 5 mg on spine and hip fracture reduction in postmenopaussal women with osteoporosis. The HORIZON Pivotal Fracture Trial. J Bone Miner Res. 2006;21:S16. 33. Chesnut CH, Silverman S, Andriano K, et al. A randomised trial of nasal spray salmon calcitonin in postmenopausal women with established osteoporosis: the prevent recurrence of osteoporotic fractures study. PROOF Study Group. Am J Med. 2000;109:267-76. 34. Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med. 2004;350:459-68. 35. Reginster JY, Seeman E, De Vernejoul M, et al. Strontium ranelate reduces the risk of non-vertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab. 2005;90:2816-22. 36. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001;344:1434-41. 37. Mosca L, Manson JA, Sutherland S, Langer, R, Manolio T, Barret-Connor E. Cardiovascular disease in women. Circulation. 1997;96:2468-82. 38. Rosano GM, Vitale C, Marazzi G, Volterrani M. Menopause and cardiovascular disease: the evidence. Climacteric. 2007;10 Suppl 1:19-24. Review. 39. Rivera CM, Grossardt BR, Rhodes DJ, et al. Increased cardiovascular mortality after early bilateral oophorectomy. Menopause. 2009;16:15-23. 40. Jensen J, Nilas L, Christiansen C. Influence of menopause on serum lipids and lipoproteins. Maturitas. 1990;12:321. 41. Clarkson TB, Prichard RW, Morgan TM, Petrick GS, Klein KP. Remodeling of coronary arteries in human and nonhuman primates. JAMA. 1994;271:289-94. 42. WalshBW, et al. Effects of postmenopausal estrogen replacement on concentrations and metabolism of plasma lipoproteins. N Engl J Med. 1991;325:196-204. 43. Godsland IF. Effects of postmenopausal hormone replacement therapy on lipid, lipoprotein, and apolipoprotein (a) concentrations: analysis of studies from 1974-2000. Fert Sterility. 2001;75:898-915. 44. Grodstein F, Manson JA, Graham A, et al. A prospective, observational study of postmenopausal hormone Capítulo 18 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 6. Burger HG, Dudley E, Manners P, Groome N, Robertson DM. Early follicular phase serum FSH as a function of age: the roles of inhibin B, inhibin A and estradiol. Climacteric. 2000;3:17-24. 7. Thurston R, Bromberger J, Joffe H, et al. Beyond frequency: who is most bothered by vasomotor symptoms? Menopause. 2008;15:841-7. 8. Barnabei VM, Grady D, Stovall DW, et al. Menopausal symptoms in older women and the effects of treatment with hormone therapy. Obstet Gynecol. 2002;100:1209-18. 9. Greendale GA, Reboussin BA, Hogan P, et al. Symptom relief and side effects of postmenopausal hormones: results from the Postmenopausal Estrogen/Progestin Interventions Trial.Obstet Gynecol. 1998;92:982-8. 10. Bromberger JT, Assmann SF, Avis NE, Schocken M, Kravitzl M, Cordal A. Persistent mood symptoms in a multiethnic community cohort of pre- and perimenopausal women. Am J Epidemiol. 2003;158:347-56. 11. Bromberg JT, Matthew KA, Schott LL, et al. Depressive symptoms during the menopausal transition: the Study of Women’s Health Across the Nation (SWAN). J Affect Disord. 2007;103:267-72. 12. Paganini-Hill A, Henderson VW. Estrogen replacement therapy and risk of Alzheimer disease. Arch Intern Med. 1996;156:2213-7. 13. Roy S, Cailouette JC, Roy T, Faden JS.Vaginal pH is similar to FSA for menopause diagnosis. Am J Obstet Gynecol. 2004;190:1272-7. 14. Fantl JA, Bump RC, Robinson D, McLish DK, Wyman JF. Efficacy of estrogen supplementation in the treatment of urinary incontinence. Obstet Gynecol. 1996;88:745-9. 15. Grady D, Brown JS, Vittinghoff E, Applegate W, Varner E, Snyder T; HERS Research Group. Postmenopausal hormones and incontinence: the Heart and Estrogen/Progestin Replacement Study. Obstet Gynecol. 2001;97:116-20. 16. World Health Organization Study Group. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. WHO Technical report series n.o 843. Genebra: WHO; 1994. 17. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. JAMA. 2001;285:785-95.NIH 18. Recker RR, Davies KM, Hinders SM, Heaney RP, Stegman MR, Kimmel DB. Bone Gain in young adult women. JAMA. 1992;268:2403-8. 19. Seeman E, Delmas P. Bone Quality - The Material and Structural Basis of Bone Strength and Fragility. N Engl J Med. 2006;354:2250-61. 20. Torteson ANA, Melton LJ, Dawson-Hughes B, et al. Costeffective osteoporosis treatment thresholds: The US perspective from the National Osteoporosis Foundation Guide Committee. Osteoporos Int. 2008;19:437-47. 21. Gullberg B, Johnell O, Kanis J. World-wide projections for hip fracture. Osteoporos Int. 1997;7:407-13. 22. Kanis JA, on behalf of the World Health Organization Scientific Group. Assessment of Osteoporosis at the primary health care level. Technical Report. University of Sheffield. Reino Unido: WHO Collaborating Center; 2008. 23. FRAX - Fracture Risk Assessment Tool. Disponível em: www.shef.ac.uk/FRAX 24. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. Principal results from the Women’s Health Initiative randomized controlled trial. JAMA. 2002;288:321-33. 25. Islam S, Liu Q, Chines A, Helzner E. Trend in incidence of osteoporosis-related fractures among 40 to 69 yearold women: analysis of a large insurance claims database, 2000-2005. Menopause. 2009;16:77-83. 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. 57. 58. 59. 60. 61. 62. 63. 64. 65. Menopausa 66. Collaborative Group on Hormonal Factors for Breast Cancer. Breast cancer and hormone replacement therapy: collaborative reanalysis from 51 individual epidemiological studies. Lancet. 1997;350:1047-60. 67. Chlebowski RT, Hendrix SL, Lander RD, et al., for the Women’s Health Initiative Randomized Trial. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women. JAMA. 2003;289:3243-53. 68. Glass AG, Lacey JV Jr, Carreon JD, Hoover RN. Breast cancer incidence, 1980-2006: combined roles of menopausal hormone therapy, screening mammography, and estrogen receptor status. J Natl Cancer Inst. 2007;99:1152-61. 69. Chlebowski R, Kuller L, Prentice R, et al., for the WHI Investigators. Breast Cancer after Use of Estrogen plus Progestin in Postmenopausal Women. N Engl J Med. 2009;360:573-85. 70. Lacey JV, Mink PJ, Lubin JH, et al. Menopausal hormone replacement therapy and risk of ovarian cancer. JAMA. 2002;288:334-41. 71. Hempling RE, Wong C, Piver MS, Natarajan N, Mettlin CJ. Hormone replacement therapy as a risk factor for epithelial ovarian cancer: results of a case-control study. Obstet Gynecol. 1997;89:1012-6. 72. Anderson G, Howard J, Kaunitz A, et al., for the Women’s Health Initiative Randomized Trial. Effects of estrogen plus progestin on gynecologic cancers and associated diagnostic procedures. JAMA. 2003;290:1739-48. 73. Albertazzi P. Non-estrogenic approaches for the treatment of climacteric symptoms. Climateric. 2007;10:115-20. 74. Atmaca A, Kleerekoper M, Bayraktar M, Kucuk O. Soy isoflavones in the management of postmenopausal osteoporosis. Menopause. 2008;15:748-57. 75. Cassidy A, Hooper L. Phytoestrogens and cardiovascular disease. J Br Menopause Soc. 2006;12:49-56. 76. Limer JL, Speirs V. Phyto-oestrogens and breast cancer chemoprevention. Breast Cancer Res. 2004;6:119-27. 77. Cummings SR, Eckert S, Krueger KA, et al. The effect of raloxifene on risk of breast cancer in postmenopausal women. Results from the MORE randomized trial. Multiple Outcomes of Raloxifene Evaluation. JAMA. 1999;281:2189-97. 78. Vogel V, Costantino J, Wickerham L, et al., for the National Surgical Adjuvant Breast and Bowel Project (NSABP). Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes. JAMA. 2006;295:97. 79. Barret-Connor E, Mosca L, Collins P, et al.; Raloxifene Use for The Heart (RUTH) Trial Investigators. Effects of raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Engl J Med. 2006;355:127-35. 80. Cummings SR, Ettinger B, Delmas PD, et al.; LIFT Trial Investigators. The effects of tibolone in older postmenopausal women. N Engl J Med. 2008;359:697-707. 81. Langer RD, Landgren BM, Rymer J, Helmond FA; OPAL Investigators. Effects of tibolone ad continuous combined conjugated equine estrogen/medroxyprogesterone acetate on the endometrium and vaginal bleeding: results of the OPAL study. Am J Obstet Gynecol. 2006;195:1320-7. 82. Yazigi R, Sahid S, Contreras L, Rodriguez T. Carcinoma of the endometrium in patients treated with tibolone. Gynecol Oncol. 2004;93:568-70. 83. Beral V; Million Women Study Collaborators. Breast cancer and hormone replacement therapy in the Million Women Study. Lancet. 2003;362:419-27. 84. Kenemas P, Bundred N, Foidart JM, et al., on the behalf of the LIBERATE Study Group. Safety and efficacy of tibolone in breast-cancer patients with vasomotor symptoms: a double-blind, randomised, non-inferiority trial. The Lancet Oncol. 2009;10:135-46. 315 Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011 45. therapy and primary prevention of cardiovascular disease. Ann Intern Med. 2000;133:933-41. Hulley S, Grady D, Bush T, et al., for the HERS Research Group. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. JAMA. 1998;280:605-13. Women’s Health Initiative Steering Committee. Effects of Conjugated Equine Estrogen in Postmenopausal Women with Hysterectomy: Women’s Health Initiative randomized controlled trial. JAMA. 2004;291:1701-12. Col NF, Pauker SG. The discrepancy between observational studies and randomized trials of menopausal hormone therapy: did expectations shape experience? Ann Intern Med. 2003;139:923-9. Grodstein F, Manson J, Stampfer M. Hormone Therapy and Coronary Disease: the role of time since menopause and Age at Hormone Initiation. Journal Wom Health. 2006;15:35-44. Rossouw J, Prentice R, Manson JA, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297:1465-77. Pines A, Sturdee D, MacLennan AH, Schneider H, Burger H, Fenton A. The heart of the WHI study: time for hormone therapy policies to be revised. Climateric. 2007;10:267-9. Loprinzi CL, Kugler JW, Sloan JA, et al. Venlafaxine in management of hot flashes in survivors of breast cancer: a randomised controlled trial. Lancet. 2000;356:2059-63. Loprinzi CL, Sloan JA, Perez EA, et al. Phase III evaluation of fluoxetine for treatment of hot flashes. J Clin Oncol. 2002;94:1578-80. Stearns V, Beebe LL, Iyengar M, Dube E. Paroxetine controlled release in the treatment of menopausal hot flashes. A randomised controlled trial. JAMA. 2003;289:2827-34. Guttuso T, Kurlan R, McDermott MP, Kiebutz K. Gabapentin’s effects on hot flashes in postmenopausal women: a randomized controlled trial. Obstet Gynecol. 2003;101:337-45. Herjan JT, Coelingh B. Are all estrogens the same? Maturitas. 2004;47:269-75. Schindler A, Campagnoli C, Druckmann R, et al. Classification and pharmacology of progestins. Maturitas. 2003;46 Suppl 1:S7-16. Sitruk-Ware R. Pharmacological profile of progestins. Maturitas. 2004;47:277-83. Hameed A, Brothwood T, Bouloux P. Delivery of testosterone replacement therapy. Curr Opin Investig Drugs. 2003;4:1213-9. L’Hermite M, Simoncini T, Fuller S, Genazzani AR. Could transdermal estradiol + progesterone be a safer postmenopausal HRT? A review. Maturitas. 2008;60:185-201. Varila E, Wahlstrom T, Rauramo I. A 5-year follow-up study on the use of a levonorgestrel intra uterine system in women receiving hormone replacement therapy. Fertil Steril. 2001;76:969-73. Sitruk-Ware R. Progestogens in hormonal replacement therapy: new molecules, risks and benefits. Menopause. 2002;9:6-15. Grostein F, Newcomb PA, Stampfer MJ. Postmenopausal hormone therapy and the risk of colorectal cancer: a review and meta-analysis. Am J Med. 1999;106:574-82. Smith DC, Prentice R, Thompson DC, et al. Association of exogenous estrogens and endometrial cancer. N Engl J Med. 1975;293:1164-7. Beresford SA, Weiss NS, Voigt LT. Risk of endometrial cancer in relation to use of estrogen combined with cyclic progestogen therapy in postmenopausal women. Lancet. 1997;349:458-61. United States Cancer Statistics (USCS-NPCR). Disponível em: www.cdc.gov/cancer/npcr/uscs Sem o consentimento prévio por escrito do editor, não se pode reproduzir nem fotocopiar nenhuma parte desta publicação © Permanyer Portugal 2011
Download