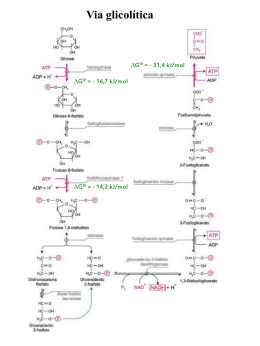
Aula 3 Glicólise O que acontece com a glicose que ingerimos? Glicólise Glico (açúcar) + lise (quebra) = quebra de glicose (via catabólica, libera energia) 1 molécula de glicose (6C) é degrada por uma cascata de 10 reações enzimáticas para gerar 2 moléculas de piruvato (3C). Energia liberada é conservada na forma de ATP a NADH. São 10 etapas enzimáticas catalisadas por enzimas livres no citosol divididas em duas fases: 1ª fase = preparatória (gasto de ATP); 2ª fase = pagamento (ganho energético e formação de ATP) Visão geral da glicólise Fase de pagamento Fase preparatória 1ª Fase: Etapa preparatória 1ª etapa – Fase preparatória: Dupla fosforilação da glicose à custa de 2 moléculas de ATP (gasto energético) 1) Hexoquinase G0’ = - 16,7 kJ/mol 2) Fosfoglicose isomerase G0’ = + 1,7 kJ/mol 3) Fosfofrutoquinase-1 G0’ = - 14,2 kJ/mol 4) Aldolase G0’ = + 23,8 kJ/mol 5) Triose fosfato isomerase G0’ = + 7,5 kJ/mol 1ª Reação: Fosforilação da glicose Enzima Hexoquinase Exergônica. Irreversível nas condições celulares!! 2ª Reação: Isomerização da glicose6P (aldose) em frutose6P (cetose) Enzima Fosfohexose isomerase Mg2+ Fosfohexose isomerase 3ª Reação: Fosforilação da frutose6P em frutose1,6BP Enzima Fosfofrutoquinase-1 (PFK-1) Exergônica. Irreversível nas condições celulares!! 4ª Reação: Quebra da frutose1,6BP em duas trioses: diidroxicetonaP (DHAP) e gliceraldeído3P (GAP) Enzima Aldolase Enzima Aldolase Ligação C-N 5ª Reação: Isomerização da DHAP a GAP Enzima Triose fosfato isomerase Fim da fase preparatória! O que aconteceu até aqui?? Glicose (6C) GAP (3C) GAP (3C) 2ª Fase: Etapa de pagamento 2ª etapa – Fase de pagamento: Geração líquida de 2 moléculas de ATP (Ganho energético) 6) Gliceraldeído 3-fosfato desidrogenase G0’ = + 6,3 kJ/mol 7) Fosfoglicerato quinase G0’ = - 18,8 kJ/mol 8) Fosfoglicerato mutase G0’ = + 4,4 kJ/mol 9) Enolase G0’ = + 7,5 kJ/mol 10) Piruvato quinase G0’ = - 31,4 kJ/mol 6ª Reação: Oxidação da GAP em 1,3BPglicerato gerando NADH Enzima GAP desidrogenase Coenzima NAD+ é reduzida a NADH fosforólise Oxidação pelo NAD+ (hemiacetal = Aldeido + álcool) Inibição de GAP desidrogenase carboximetilcisteina 7ª Reação: Defosforilação do 1,3BPG e produção da 1ª molécula de ATP Enzima: Fosofogliceratoquinase Fosforilação ao nível do substrato!! Exergônica. Irreversível nas condições celulares!! Lembrando que partimos de 2 GAP, então temos nesse momento 2 NADH e 2 ATP. Reações 6 e 7 são acopladoras de energia. Resumindo Acoplamento das reações GAPDH e PGK: GAP + Pi + NAD+ 1,3-BPG + ADP 1,3-BPG + NADH 3PG + ATP ΔG 0’ = +6.3 kJ/mol ΔG 0’ = -18.5 kJ/mol ΔG 0’ = -12.2 kJ/mol Transferência dos grupos fosfato para ADP, formando 4 ATP e 2 piruvato. 8ª Reação: Conversão do 3Pglicerato em 2Pglicerato Enzima Fosfoglicerato mutase 9ª Reação: Desidratação do 2Pglicerato a Fosfoenolpiruvato (PEP) Enzima Enolase 10ª Reação: Produção da 2ª molécula de ATP Enzima: Piruvato quinase (PK) Exergônica. Irreversível nas condições celulares!! Fim da fase de pagamento, fim da glicólise! O que aconteceu nessa fase? GAP Piruvato GAP GAP Piruvato Resumindo A glicólise é uma via quase que universal, onde 1 molécula de glicose é oxidada a 2 moléculas de piruvato sendo a energia liberada conservada em 2 moléculas de ATP e 2 moléculas de NADH Todas as enzimas da via glicolítica são citoplasmáticas e seus intermediários são moléculas fosforiladas de 3 ou 6 átomos de carbono Na fase preparatória da glicólise, 2 moléculas de ATP são consumidas Na fase de pagamento da glicólise, há produção de 1 molécula de NADH e 2 moléculas ATP para cada triose. Balanço final da via glicolítica: Fase preparatória – gasto de duas moléculas de ATP Fase de pagamento – formação de quatro moléculas de ATP formação de duas moléculas de NADH formação de duas moléculas de piruvato 2 Glicose + 2ATP + 2NAD+ + 4ADP + 2Pi Glicose + 2NAD+ + 2ADP + 2Pi 2 2Piruvatos + 2ADP + 2NADH + H+ + 4ATP + H2O 2Piruvatos + 2NADH + H+ + 2ATP + H2O Como os açúcares entram na célula? Como a glicose entra na célula? TRANSPORTADOR Km par a glicose (mM) Dist r ibuição Car act er íst icas GLUT 1 1-2 am pla, com alt a con cent r ação no cér ebr o, er it r ócit os e en dot élio t r an sp or t ador con st it u t ivo de glicose GLUT 2 15 - 20 r in s, int est in o delgado, fígado e pân cr eas e cél ulas b t r an sp or t ador de baixa af inidade, fu ncion a como sensor de glicose GLUT 3 10 n eu r ônios, placen t a t r an spor t ador de alt a afin idade GLUT 4 5 m úsculos esquelét ico e car díaco, t ecido adip oso t r an sp or t ador dep en dent e de in su lin a GLUT 5 6- 11 in t est in o delgado, esper ma, r im, cér ebr o, adipócit os e m úsculo t r an spor t ador de fr u t ose, afin idade mu it o baixa p ar a glicose Como os açúcares que ingerimos na alimentação entram na via glicolítica? Polissacarídeos derivados da alimentação Hidrolisados no meio extracelular antes de serem absorvidos: Ex: Amido Amido Oligossacarídeo Amilase salivar Dissacarídeos: Dissacarídeo Monossacarídeo Amilase panceática Monossacarídeos: Monossacarídeo Polissacarídeos intracelulares Ex: Glicogênio (presente em tecido hepático, músculos, etc.) Glicogênio fosforilase: • Catalisa o ataque do fosfato inorgânico ao resíduo glicosil nãoreduzido do glicogênio, liberando glicose 1-fosfato que entra na via glicolítica; • Ativada em momentos de jejum ou de necessidade energética (ex: exercícios físicos). VIA GLICOLÍTICA Monossacarídeos: Frutose • A frutose livre presente em frutos ou formada pela hidrólise da sacarose é fosofrilada pela hexoquinase. Frutose + ATP → frutose-6-P + ADP • No fígado, a frutose entra na via glicolítica através da frutoquinase que catalisa a fosforilação do C1 da frutose. Frutose + ATP → frutose-1-P + ADP • A frutose-1-fosfato é clivada em gliceraldeído e diidroxicetona-fosfato pela frutose 1-fosfato aldolase. A diidroxicetona-fosfato é convertida em gliceraldeído-3fosfato e o gliceraldeído é fosforilado. Portanto os produtos frutose-1-fosfato entram na via glicolítca como gliceraldeído3-fosfato. Frutose-1Frutose-1-fosfato fosfato-aldolase gliceraldeído + DHAP Frutose-1fosfato-aldolase Triose quinase GAP Monossacarídeos: Galactose • Galactose é um monossacarídeo resultante da hidrólise da lactose (açúcar presente no leite e seus derivados) Uridina-difosfato glicose (UDP-glicose) Resumindo: Fermentação Metabolismo do piruvato: Mecanismos de regeneração do NAD+ Condições anaeróbicas Condições anaeróbicas Condições aeróbicas Histórico Louis Pasteur 1861: crescimento de leveduras, por grama de glicose, maior na presença do que na ausência de ar. Glicose consumida mais lentamente na presença de ar do que na ausência (Efeito Pasteur) Eduard Buchner 1907: Prêmio Nobel. A fermentação ocorre sem vida organizada (fragmentos celulares). Harden e Young 1909: Isolamento do primeiro intermediário da via glicolítica. 1929: Arthur Harden - Prêmio Nobel; Descoberta de um procedimento para acelerar a fermentação: adição de Pi ao meio. Via glicolítica: Destinos do piruvato em anaerobiose Lática Fermentação Alcóolica Fermentação lática Fermentação alcoólica • A redução do piruvato é catalizada pela lactato desidrogenase. • O equilíbrio da reação é favorecido em direção a formação do lactato devido ao G negativo da reação. • Acontece em bactérias anaeróbias, tecidos de plantas (submersos); eritrócitos (ausência de mitocôndria para o Ciclo de Krebs); músculo esquelético em exercício físico intenso; células tumorais; células da retina. Fermentação alcóolica • Leveduras e outros organismos fermentam a glicose com formação de etanol e CO2. • O piruvato é convertido em etanol e CO2 através de duas etapas. Na primeira o piruvato é descarboxilado irreversivelmente pela piruvato descarboxilase. Na segunda etapa o acetaldeído formado é reduzido à etanol através da álcool desidrogenase ocorrendo a regeneração do NAD+. 2 Ethanol Metabolismo do etanol no fígado: ADH Álcool desidrogenase ALDH Acetaldeído desidrogenase Pausa para respirar... Gliconeogênese • A glicose tem um papel central no metabolismo pois é considerada um combustível universal. • Alguns tecidos dependem exclusivamente da glicose como fonte de energia. E se não tem GLICOSE? • É necessário resintetizá-la a partir de substratos não-carboidratos. Esta via é chamada de gliconeogênese (glico = açúcar; neo = de novo; gênese = síntese) • A gliconeogênese ocorre majoritariamente no fígado, mas também pode ocorrer no cortex renal. • A glicose produzida entra na circulação sanguínea e supre os tecidos que necessitam de glicose. • O músculo e o cérebro não fazem gliconeogenese pois não têm as enzimas frutose-1,6bifosfatase e glicose-6-fosfatase. Glicose TAG Glicerol + Àc. Graxos GLICOSE Piruvato Lactato Glicogênio PRECURSORES DA GLICOSE → GLICEROL, LACTATO, AMINOÁCIDOS Proteínas aas Regulação da Via Glicolítica Regulação da entrada de glicose na célula GLUT 4: Regulação da via glicolítica Fluxo de metabólitos de uma via metabólica pode ser modulado por: 1. Número de enzimas (por controles transcricionais/traducionais; Ocorre em minutos ou até horas). 2. Mudança da atividade enzimática (ocorre em segundos) por: Modificação covalente ou ligação a proteína reguladora Regulação alostérica Seqüestro da enzima ou do substrato em compartimentos diferentes HK PFK1 Pontos de regulação: Reações Irreversíveis PK Regulação da glicólise • O fluxo da via glicolítica precisa se regulado em respostas às condições dentro e fora da célula. • Duas demandas principais: – Produção de ATP – Fornecimento de blocos para biossíntese. • 3 enzimas-chave: – Hexoquinase – Fosfofrutoquinase-1 – Piruvato quinase 1. Hexoquinase Fígado x Outros órgãos Fígado: GLUT-2 -> Km= 15-20 mM Glicoquinase -> Km= 10 mM Músculo: GLUT-4 -> Km= 5 mM Hexoquinase 1 -> Km= 0,1 mM Relative transport activity GLUT-4 GLUT-2 0 15 30 45 60 Hexoquinase muscular Hexoquinase I: • Km = 0,1mM • [Glicose] plasmática 5 a 8 mM • Enzima funciona sempre em Vmáx • É inibida pelo produto (Glicose 6P) Glicose + ATP HK Glicose6P + ADP + H+ Hexoquinase hepática Hexoquinase IV (glicoquinase) : • Km > 10 mM • Não é inibida pelo produto (Glicose 6P) • Pode ser inibida pela ligação a uma proteína reguladora • Quando a glicose está escassa, garante que tecidos como cérebro e músculo tenham prioridade no uso! Como estará a atividade da hexoquinase? Órgão Hipoglicemia (< 3,5 mM) Normoglicemia (5 mM) Hiperglicemia (10mM) Músculo Fígado Fígado: GLUT-2 -> Km= 15-20 mM Glicoquinase -> Km=10 mM Músculo: GLUT-4 -> Km= 5 mM Hexoquinase I -> Km=0,1 mM Como estará a atividade da hexoquinase? Insulina Órgão Hipoglicemia (< 3,5 mM) Normoglicemia (5 mM) Hiperglicemia (10mM) Músculo + + + Fígado - - + Fígado: GLUT-2 -> Km= 15-20 mM Glicoquinase -> Km=10 mM Músculo: GLUT-4 -> Km= 5 mM Hexoquinase I -> Km=0,1 mM Hexoquinase hepática Hexoquinase IV (glicoquinase) : • Transportada para o núcleo da célula quando a concentração de glicose no sangue é baixa ou se há acúmulo de frutose 6P. • Presente no citosol quando a concentração de glicose aumenta. Hepatócito Após refeição Durante jejum 2. Fosfofrutoquinase (PFK1) • Baixa de energia: AMP, ADP estímulo da glicólise • Alta de energia: ATP desaceleração da glicólise Regulação por alosteria: 2. Fosfofrutoquinase (PFK1) Regulação alostérica por frutose 2,6-bifosfato: • Em 1980, foi observado por Van Schaftingen e colaboradores que frutose 2,6-bisfosfato ativava a PFK-1 aumentando sua afinidade pelo substrato frutose 6-fosfato. • Frutose 2,6-bisfosfato é um ativador alostérico que desloca o equilíbrio conformocional da enzima para sua forma ativa. • É produzido pela enzima fosfofrutoquinase-2 (PFK-2). Mas... Glicólise Gliconeogênese A regulação de glicólise e gliconeogênese ocorre de maneira simultânea! 2. Fosfofrutoquinase (PFK1) Regulação alostérica por frutose 2,6-bifosfato: Glicólise Glicólise Gliconeogênese Gliconeogênese PFK 1 F6P + ATP F1,6BPase F1,6BP + ADP F1,6P PFK 2 F6P + ATP Enzima ativa PFK-1 F1,6BPase PFK-2 F2,6BPase F6P + Pi F2,6BPase F2,6BP + ADP F2,6BP F2,6P Glicólise F6P + Pi Gliconeogênese Regulador Regulador • Em 1981: Foi descoberta a enzima capaz de fazer a reação inversa, gerando F6P. Glicneogênese Glicólise • Em 1980: A enzima capaz de produzir F2,6BP foi nomeada como PFK-2. F6P + ATP F1,6BP + ADP F1,6BPase F1,6BP F6P + Pi F2,6BP + ADP F2,6BPase F2,6BP F6P + Pi PFK 2 F6P + ATP Enzima ativa PFK-1 F1,6BPase PFK-2 F2,6BPase F2,6BP Glicólise Gliconeogênese Regulador Regulador PFK 1 • Em 1981: Foi descoberta a enzima capaz de fazer a reação inversa, gerando F6P. Glicneogênese Glicólise • Em 1980: A enzima capaz de produzir F2,6BP foi nomeada como PFK-2. PFK 1 F6P + ATP F1,6BP + ADP F1,6BPase F1,6BP F6P + Pi F2,6BP + ADP F2,6BPase F2,6BP F6P + Pi PFK 2 F6P + ATP Enzima ativa F2,6BP PFK-1 Glicólise Gliconeogênese + F1,6BPase + PFK-2 + + - F2,6BPase - - + Regulador Regulador • Em 1981: Foi descoberta a enzima capaz de fazer a reação inversa, gerando F6P. Glicneogênese Glicólise • Em 1980: A enzima capaz de produzir F2,6BP foi nomeada como PFK-2. • Por muitos anos, tentou-se isolar a PFK-2 e a F2,6BPase… Até descobrirem que elas eram uma única enzima, com duas porções reguladas de maneira antagônica! • A fosforilação da enzima bifuncional PFK-2/F2,6BPase estimula a atividade F2,6BPase: ↓ F2,6 BP ↓ Glicólise ↑ Gliconeogênese 2. Fosfofrutoquinase (PFK1) Regulação covalente por fosforilação: Hepatócito: • No fígado, a fosforilação da enzima PFK-2/F2,6BPase ocorre no jejum e estimula a atividade F2,6BPase: ↓ [Glicose] Jejum: ↓ F2,6 BP ↓ Glicólise ↑ Gliconeogênese ↑ Glucagon P Frutose 6P ↑ P ↑ cAMP ↑ PKA – PFK-2 + FBPase-2 X Frutose 2,6BP ↓ – PFK-1 + FBPase-1 ↓Glicólise ↑ Gliconeogênese • O mesmo acontece em outros momentos de demanda energética: ↓ F2,6 BP ↑ Glucagon ou Adrenalina ↓ Glicólise ↑ Gliconeogênese Hepatócito: P Frutose 6P ↑ P ↑ cAMP ↑ PKA – PFK-2 + FBPase-2 X Frutose 2,6BP ↓ – PFK-1 + FBPase-1 ↓Glicólise ↑ Gliconeogênese • Mas… faria sentido diminuir a glicólise em vários órgãos em momentos de demanda energética (por exemplo, ao correr para fugir de uma situação de perigo)? ↑ Glucagon ou Adrenalina Hepatócito: P Frutose 6P ↑ P ↑ cAMP – PFK-2 ↑ PKA X + FBPase-2 Frutose 2,6BP ↓ – PFK-1 + FBPase-1 ↓Glicólise ↑ Gliconeogênese Músculo: ↑ Adrenalina P Frutose 6P ↓ P ↑ cAMP ↑ PKA + PFK-2 – FBPase-2 Frutose 2,6BP ↑ + PFK-1 – FBPase-1 ↑ Glicólise ↓ Gliconeogênese 3. Piruvato quinase (PK) Último passo da via glicolítica. Fluxo de saída. Produz ATP e Piruvato. Apresenta diferentes isoformas em diferentes tecidos: Isoforma L (Liver = fígado) e isoforma M (Muscle = músculo). Regulações alostéricas: - Frutose 1,6-bisfosfato: ativa - ATP: inibe alostericamente - Alanina: produzida a partir de piruvato, inibe a PK. • Diferença: regulação por modificação covalente: fosforilação. • Isoforma L (hepática): inativada ao ser fosforilada (estímulo glucagon: ↓ Glicólise) Hepatócito: Outros órgãos: Hexoquiinase Glicose-6-fosfatase Aspectos clínicos 1) Isquemia (Infarto do miocárdio): Isquemia: • Falta de suprimento sangüíneo para um tecido orgânico; • Necrose do tecido por isquemia 2) Células tumorais: Otto Warburg – 1920 • Células tumorais Ascites convertem glicose equivalente a 30% do peso seco em lactato/h (Músculo esquelético humano = 6% do peso seco em lactato/h) • Em muitos tumores, a taxa de entrada de glicose e a glicólise aumentam por um fator 10. Transformação de uma célula normal para tumoral: • Mudança para um metabolismo glicolitico; • Tolerância a baixo pH; • Mais o tumor é agressivo maior é a sua taxa de fluxo glicolítico (superxpressão de enzimas glicolíticas e dos transportadores)
Baixar