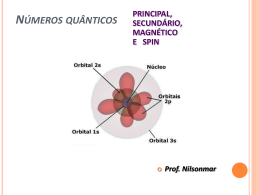
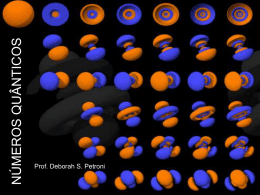
UNIDADE 1 - DAS ESTRELAS AO ÁTOMO 3.2. ORBITAIS E NÚMEROS QUÂNTICOS 3.3. CONFIGURAÇÕES ELECTRÓNICAS Escola Secundária Maria Lamas – Torres Novas Física e Química A – 10º Ano Nelson Alves Correia OBJECTIVOS Referir os contributos de vários cientistas e das suas propostas de modelo atómico, para a criação do modelo atómico actual; Descrever o modelo quântico do átomo em termos de números quânticos (n, l, ml e ms), orbitais e níveis de energia; Escrever as configurações electrónicas dos átomos dos elementos (Z ≤ 23), atendendo ao Princípio da Energia Mínima, ao Princípio de Exclusão de Pauli, e à Regra de Hund. CONTEÚDOS Modelos Atómicos Números Quânticos Orbitais Configurações Electrónicas Espectroscopia Fotoelectrónica MODELOS ATÓMICOS Dalton (séc. XIX) – 0s átomos eram indivisíveis (não tinham outras partículas no seu interior). Thomson – Descobriu o electrão em 1897. O átomo era uma esfera com carga positiva e com electrões (com carga negativa) no seu interior, espalhados como passas num bolo. MODELOS ATÓMICOS Rutherford – O átomo era constituído por um núcleo, com protões com carga positiva, e por electrões que se moviam à volta do núcleo, como um planeta à volta do Sol (modelo planetário). A maior parte do átomo era espaço vazio. MODELOS ATÓMICOS Bohr – O núcleo do átomo era constituído por protões e neutrões. Os electrões encontravam-se à volta do núcleo, em órbitas bem definidas, com certos níveis de energia (quantificação da energia dos electrões). MODELOS ATÓMICOS Heisenberg – A posição e a energia do electrão não podem ser conhecidas, ao mesmo tempo, com exactidão (Princípio da Incerteza de Heisenberg). Schrödinger – A posição e a energia do electrão são calculadas por uma equação matemática (equação de onda). MODELOS ATÓMICOS Modelo da nuvem electrónica ou modelo quântico: É o modelo actual do átomo; É um modelo matemático, baseado na Mecânica Quântica; Os electrões encontram-se à volta do núcleo, em orbitais, com certos níveis de energia, mas sem uma posição exacta (sem uma trajectória definida - um electrão pode estar mais perto do núcleo ou mais afastado); Uma orbital é uma região do espaço onde o electrão, com uma certa energia, tem probabilidade de se encontrar. Representa-se por um conjunto de pontos que formam uma nuvem à volta do núcleo. MODELOS ATÓMICOS MODELOS ATÓMICOS Quando se descobrem novos factos científicos que não podem ser explicados por um modelo ou teoria, estes têm de ser alterados. Assim aconteceu com o modelo atómico de Bohr e assim poderá acontecer com o modelo atómico actual. NÚMEROS QUÂNTICOS As orbitais atómicas são identificadas por três números quânticos: n – número quântico principal; l – número quântico de momento angular, secundário ou azimutal; ml – número quântico magnético. O electrão possui um movimento de rotação que é identificado pelo número quântico de spin (ms). NÚMEROS QUÂNTICOS O número quântico principal (n) indica a energia e o tamanho da orbital (distância média do electrão ao núcleo). Só pode ter valores inteiros: n = 1, n = 2, n = 3… Quando o valor de n é maior, a energia e o tamanho da orbital serão maiores. Orbitais com o mesmo valor de n pertencem ao mesmo nível de energia. NÚMEROS QUÂNTICOS O número quântico de momento angular (l) indica a forma da orbital (tipo de orbital): Só pode ter valores inteiros entre 0 e n - 1: Se n = 1, então l = 0; Se n = 2, então pode ser l = 0 ou l = 1; Se n = 3, então pode ser l = 0, l = 1 ou l = 2. NÚMEROS QUÂNTICOS O número quântico magnético (ml) indica a orientação da orbital no espaço. As orbitais podem estar orientadas segundo os eixos x, y ou z (ex: px, py ou pz). Só pode ter valores inteiros entre – l e + l : Se l = 0, então ml = 0; Se l = 1, então pode ser ml = -1, ml = 0 ou ml = +1 NÚMEROS QUÂNTICOS Para cada n há n2 orbitais. NÚMEROS QUÂNTICOS Quando os átomos de hidrogénio, atravessam um campo magnético provocado por um íman, desviam-se em sentidos opostos. Isto acontece porque os electrões têm um movimento de rotação e comportam-se como ímanes. NÚMEROS QUÂNTICOS O número quântico de spin (ms) indica o sentido do movimento de rotação do electrão (no sentido dos ponteiros do relógio ou no sentido contrário) e explica o facto dos electrões se comportarem como pequenos ímanes. Só pode ter os valores ms = +1/2 ou ms = -1/2 NÚMEROS QUÂNTICOS Para identificar uma orbital são necessários três números quânticos (n, l e ml). Para identificar um electrão no átomo são necessários quatro números quânticos (n, l, ml e ms). A orbital 3s é identificada por três números quânticos: n = 3, l = 0 e ml = 0 ou (3, 0, 0). Os electrões que se podem encontrar numa orbital 3s são identificados por quatro números quânticos: n = 3, l = 0, ml = 0 e ms = +1/2 ou (3, 0, 0, +1/2); n = 3, l = 0, ml = 0 e ms = -1/2 ou (3, 0, 0, -1/2). NÚMEROS QUÂNTICOS Diagrama de caixas – Representação duma orbital com 2 electrões: A seta para cima representa ms = +1/2 e a seta para baixo representa o ms = -1/2 Uma orbital 3s com dois electrões representa-se por 3s2. Cada orbital só pode ter, no máximo, 2 electrões. Para cada n há n2 orbitais e, no máximo, 2n2 electrões. ORBITAIS As orbitais s têm uma forma esférica. ORBITAIS As orbitais p têm uma forma de dois lóbulos simétricos, orientados segundo cada um dos eixos x, y ou z. ORBITAIS A energia das orbitais é maior quando n é maior. Em átomos monoelectrónicos (só com um electrão), as orbitais com o mesmo valor de n têm a mesma energia. ORBITAIS Em átomos polielectrónicos, as orbitais com o mesmo valor de n e com maior valor de l têm mais energia (ex: E2p > E2s). As orbitais com o mesmo valor de n e de l (ex: 2px, 2py e 2pz) têm a mesma energia. ORBITAIS O tamanho e a energia do mesmo tipo de orbital são diferentes quando os átomos são diferentes. Por exemplo, a orbital 1s do potássio (19K) é menor e tem menos energia do que a orbital 1s do sódio (11Na). Isto acontece porque o núcleo do potássio tem mais protões e atrai mais os electrões (ficam mais perto do núcleo e a sua energia é menor). CONFIGURAÇÕES ELECTRÓNICAS Configuração electrónica – Maneira como os electrões se distribuem nas orbitais. Princípio da Energia Mínima – Os electrões estão distribuídos nas orbitais de menor energia, de modo a que a energia do átomo seja mínima (o átomo está no estado fundamental e é mais estável). Se os átomos estiverem excitados, têm electrões que estão em níveis de energia superiores, quando podiam estar em orbitais com menor energia. CONFIGURAÇÕES ELECTRÓNICAS Princípio de Exclusão de Pauli – Numa orbital só podem existir, no máximo, dois electrões com spins opostos (não pode existir mais do que um electrão com os mesmos números quânticos). CONFIGURAÇÕES ELECTRÓNICAS Diagramas de caixas: CONFIGURAÇÕES ELECTRÓNICAS Regra de Hund – Nas orbitais com a mesma energia (ex: 2px, 2py e 2pz ), coloca-se primeiro um electrão em cada orbital (electrão desemparelhado), de modo a ficarem com o mesmo spin, e só depois se completam as orbitais com um electrão de spin oposto. CONFIGURAÇÕES ELECTRÓNICAS Diagrama de Linus Pauling – Diagrama de preenchimento das orbitais, que facilita a escrita das configurações electrónicas dos átomos, de acordo com o Princípio da Energia Mínima. CONFIGURAÇÕES ELECTRÓNICAS Configurações electrónicas de átomos no estado fundamental (os electrões estão todos nas orbitais de menor energia): CONFIGURAÇÕES ELECTRÓNICAS Cerne – Conjunto do núcleo com os electrões mais internos. Os electrões do cerne de um elemento representam-se através da configuração electrónica do gás nobre que é anterior a esse elemento. Neste tipo de representação, aparecem apenas as orbitais de valência (orbitais do último nível que têm mais energia), com os respectivos electrões de valência, e as orbitais d dos elementos de transição. CONFIGURAÇÕES ELECTRÓNICAS Configurações electrónicas de átomos no estado excitado (existem electrões em orbitais de maior energia, com lugares livres em orbitais de energia inferior): 1s2 2s2 2p6 3s1 3p1 1s2 2s2 2p3 3s1 1s2 2s2 2p6 4s1 BIBLIOGRAFIA Dantas, M., & Ramalho, M. (2008). Jogo de Partículas A Física e Química A - Química - Bloco 1 - 10º/11º Ano. Lisboa: Texto Editores.
Download