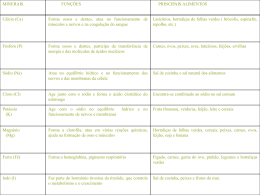
Unidade de Neonatologia do HRAS Apresentação: Érica de Cássia Ramos da Cruz (R3) Coordenação: Márcia Pimentel Paulo R. Margotto www.paulomargotto.com.br Brasília, 30/5/2012 Consultem o artigo integral! Impact of changes in serum sodium levels on 2-year neurologic outcomes for very preterm neonates. Baraton L, Ancel PY, Flamant C, Orsonneau JL, Darmaun D, Rozé JC. Pediatrics. 2009 Oct;124(4):e655-61. Epub 2009 Sep 14. PMID: 19752079 [PubMed - indexed for MEDLINE] Free Article Related citations Hiponatremia e Hipernatremia são distúrbios comuns em prematuros extremos; Hiponatremia e Hipernatremia estão associadas com desenvolvimento neurológico adverso. Variações grandes e muito grandes nos níveis séricos de sódio estão associadas significativamente com risco de deficiências funcionais na idade corrigida de 2 anos Objetivo: Analisar a relação entre mudanças no sódio sérico no primeiro mês de vida e desenvolvimento de deficiências funcionais na idade de 2 anos, em prematuros. Hiponatremia e Hipernatremia são comumente observados em prematuros extremos. Pesquisas mundiais sugerem que até um terço dos RN de muito baixo peso tem hiponatremia quando esta é definida como sódio < 130 mEq/L na primeira semana de vida e 25% a 65% após. Causas: Reabsorção deficiente no túbulo proximal; Resposta limitada à aldosterona no túbulo distal; Absorção intestinal limitada; Hiponatremia dilucional (após procedimentos cirúrgicos, choque séptico, tratamento com inibidores da cicloxigenase e/ou falência renal). Consequências: Aumento do risco de paralisia cerebral; Aumento do risco de perda auditiva Harkavy e Scanlon mostraram que a incidência de hipernatremia em prematuros de idade gestacional de 29 semanas era de 40% nos primeiros 3 dias de vida, quando esta era definida como níveis plasmáticos de sódio > 150 mEq/L. Causas: Desidratação; Aumento na ingesta de sódio (incomum). Consequências: Edema cerebral; Hemorragia Intracraniana; Hiperbilirrubinemia severa. Estudo realizado entre 1 de Janeiro de 2003 – 31 de Julho de 2004; Foram selecionados prematuros com menos de 33 semanas de gestação, hospitalizados em UTI neonatal, que saíram vivos, no Nantes University Hospital (Nantes, França): 1. Recém-nascidos (RN) sem variações significativas nos níveis de sódio sérico (controle); 2. RN com grandes variações nos níveis de sódio sérico; 3. RN com muito grandes variações nos níveis de sódio sérico. Dados iniciais relacionados à gravidez, parto e cuidados médicos foram coletados durante a hospitalização para testar associação entre os manejos obstétrico e neonatal e os desfechos. Os dados registrados nos questionários foram baseados em exames médicos detalhados antes da alta e com 3, 9, 12, 18 e 24 meses. Dados bioquímicos foram coletados do banco de dados do hospital: o número do prontuário do RN ligava os dados clínicos e laboratoriais. Foram anotados os níveis mais altos e os mais baixos para cada criança. Mudanças no nível sérico do sódio foram definidas como a diferença entre o maior e o menor nível de sódio no primeiro mês de vida. Foram definidos 3 tercis, utilizando uma função específica do SSPS 15 (SPSS, Chicago, IL): 0 a 7 mEq/L: pequena mudança no Na; 8 a 13 mEq/L: grande mudança no Na; > 13 mEq/L: muito grande mudança no Na. As crianças do primeiro tercil constituíram o grupo controle; as do segundo foram consideradas como expostas a grandes mudanças no sódio sérico e as do terceiro tercil foram as expostas a muito grandes variações do sódio sérico. Avaliação aos 2 anos por Pediatras e pelo teste de Brunet – Lézine, de forma cegada: Postura; Coordenação Visuo-Motora; Linguagem (compreensiva e expressiva); Relações Pessoais; Adaptação Escore DQ < 85 definiu deficiência cognitiva As crianças foram classificadas como possuidoras de função neuromotora subótima quando deterioração neuromotora moderada ou severa estava presente, resultando em paralisia cerebral ou quando sinais mais leves (estiramento fásico do tríceps, predominância do tônus extensor) estavam presentes. Mudanças no sódio sérico foram consideradas como variáveis categóricas que indicaram os 3 grupos: o primeiro foi o controle; O desfecho neurológico na idade de 2 anos foi considerado variável binária. A análise foi conduzida em 4 passos: O primeiro passo foi: análise da relação entre as mudanças no sódio sérico e: Idade gestacional; Características da gravidez; Características neonatais. O segundo passo foi: estimar as relações entre as variáveis anteriores e o desfecho no neurodesnvolvimento: A média e o desvio-padrão foram usados para variáveis contínuas e as frequências para as variáveis categóricas; O teste X2 com a correção de Yates, se necessário e análise da variância foram usados para comparar as características dos RN e o desfecho em 2 anos entre os tercis. O terceiro passo foi: estudar as associações entre as mudanças do sódio sérico e o desfecho no neurodesenvolvimento; A Regressão Logística foi usada para estudar as associações entre os tercis depois do ajuste para: Fatores pré-natais; Características dos RNs; Fatores neonatais. Três modelos foram usados: O Modelo A incluiu a idade gestacional; O Modelo B incluiu idade gestacional, características da gravidez (uso de corticóide antenatal, gravidez múltipla e DHEG) e características das crianças (gênero e pequeno para idade gestacional); O Modelo C incluiu os anteriores e fatores neonatais (SDR, sepse, choque hemodinâmico, PCA, tratamento diurético). No quarto passo, foram feitos ajustes adicionais para o número de determinações do sódio sérico e lesões cerebrais; Para completar a análise, foi estimado o OR (razão de chances) ajustado para deterioração neuromotora e cognitiva (DQ de 85) associados com grande e muito grandes mudanças no sódio sérico. O número total de medidas no sódio sérico foi de 3927: 84 de 237 RNs tiveram pequenas mudanças nos níveis de sódio; 86 de 237 RN tiveram grandes mudanças nos níveis de sódio; 67 de 237 RN tiveram muito grandes mudanças nos níveis de sódio. Crianças com grande ou aalterações muito grande do sódio fizeram significativamente mais exames de sangue; Os níveis de sódio diminuíram mais frequentemente no primeiro tercil (controle) e aumentaram a níveis máximos nos outros 2 tercis. 3o grupo tem mais controles de Na+, e mais mudanças no Na+ e a > velocidade de mudança Entre as 237 crianças, aquelas que exibiram grande e muito grandes mudanças no sódio tinham significativamente menor idade gestacional; De forma semelhante, Síndrome do desconforto respiratório-Doença da membrana hialina(SDR), displasia broncopulmonar, uso de diuréticos, persistência do canal arterial (PCA), sepse e choque hemodinâmico foram significativamente mais frequentes nesses grupos. IG < 28 semanas , SAR, DBP, choque, diurético e PCA mais presentes no 3o grupo... ... e possuíam significância estatística! Dados sobre os desfechos na idade corrigida de 2 anos estiveram disponíveis para 221 crianças (93%); As proporções não diferiram entre os tercis: 93% das 84 crianças do primeiro tercil; 93% das 86 crianças do segundo tercil; 94% das 67 crianças do terceiro tercil. Desfechos funcionais ruins diminuíram na medida em que a idade gestacional aumentou (OR por semana de gestação: 0.8 [95% (0.7 – 1.0)], sem significância estatística! A Tabela 3 mostra associação bruta entre desfechos ruins e uso de corticóide antenatal, SDR, sepse e uso de diuréticos. IG, PIG, sexo, DHEG, gestação múltipla, DBP, PCA ... ... não têm significân cia estatístic a! Desfechos funcionais deteriorantes foram de (p = 0,005): 5% no primeiro tercil; 19% no segundo tercil; 29% no terceiro tercil. OR para os desfechos ruins associados a grandes e muito grandes mudanças no Na estão representadas na Tabela 4; Estes persistiram após ajuste para IG, gravidez e características das crianças. Os grupos 2e3 associar am-se signific ativame nte com desfech o ruim... ...nos 3 ajustes ! Em outro modelo, ajustado para idade gestacional (IG), lesões cerebrais e número de medidas do Na, grandes e muito grandes mudanças no sódio foram significativamente associadas com aumento do risco de desfecho neurológico negativo: Grandes mudanças: OR ajustado 3,4 [IC 95%: 1,0 – 11,3] – p = 0,048; Muito grandes mudanças: OR ajustado 4,5 [IC 95%: 1,1 – 18] – p = 0,03. Há relação de causalidade entre variação do sódio sérico e deficiência neurológica.... ... essa variação é apenas um indicador da severidade da doença do prematuro ? Nesse estudo observacional, análise univariada mostrou que prematuros extremos com grandes mudanças nos níveis de sódio sérico (8 – 13 mEq/L) ou muito grandes mudanças no nos níveis de sódio sérico (> 13 mEq/L) no primeiro mês de vida têm maior risco de desenvolver desfecho neurológico negativo aos 2 anos de idade corigida do que os com pequenas mudanças (< 8 mEq/L); Grande e muito grandes mudanças no Na também encontram-se significativamente associados com idade gestacional mais baixa e com algumas doenças neonatais e seus tratamentos. RN com grandes e muito grandes variações no sódio sérico eram os de menor IG e menor peso para IG; SDR, Displasia broncopulmonar (DBP), PCA, uso de diuréticos, sepse, choque hemodinâmico eram mais frequentes nos RN com grandes e muito grandes variações no sódio sérico; Grandes e muito grandes mudanças no sódio sérico foram observados em RN mais doentes (que têm mais risco para desfechos neurológicos ruins). Os modelos foram ajustados para as características pré-natais e pós-natais para reduzir estes vieses, sugerindo relação direta entre as grandes e muito grandes mudanças do Na sérico e desfecho neurológico degenerativo. Mudanças grandes e muito grandes no Na são observadas mais frequentemente na primeira semana de vida (+/- 2 a 6 dias) e persistem por alguns dias (+/- 3 a 5 dias); As mudanças são grandes (> 14 mEq/L), mas não rápidas, garantindo tempo para detecção. Em particular, a associação observada com desenvolvimento neuromotor adverso sugere manejo cauteloso de fluidos e eletrólitos. Foram encontradas relações significativas entre grande e muito grande mudança no nível sérico do sódio e risco de desfecho neurológico adverso; Apesar dessas mudanças poderem refletir a severidade da doença e/ou a qualidade do serviço neonatal, uma relação causal não pode ser excluída; Assim, manejo cauteloso de fluidos e eletrólitos no primeiro mês é recomendado. 1. Day GM, Radde IC, Balfe JW, Chance GW. Electrolyte abnormalities in very low birthweight infants. Pediatr Res. 1976;10(5):522–526; 2. Kloiber LL, Winn NJ, Schaffer SG, Hassanein RS. Late hyponatremia in very-low-birth-weight infants: incidence and associated risk factors. J Am Diet Assoc. 1996;96(9):880– 884; 3. Takahashi N, Hoshi J, Nishida H. Water balance, electrolytes and acid base balance in extremely premature infants. Acta Paediatr Jpn. 1994;36(3):250 –255; 4. Modi N. Management of fluid balance in the very immature neonate. Arch Dis Child Fetal Neonatal. Ed. 2004;89(2):F108 –F111; 5. Modi N. Hyponatraemia in the newborn. Arch Dis Child Fetal Neonatal Ed. 1998;78(2):F81–F84; 6. Harkavy KL, Scanlon JW. Hypernatremia in the very low birthweight infant. Int J Pediatr Nephrol.1983;4(2):75–78; 7. Rees L, Shaw JCL, Brook CGD, Forsling ML. Hyponatraemia in the first week of life in preterm infants, part II: sodium and water balance. Arch Dis Child. 1984;59(5):423– 429; 8. Lorenz JM, Kleinman LI, Kotagal UR, Reller MD. Water balance in very low birth weight infants: relationship to water and sodium intake and effect on outcome. J Pediatr. 1982;101(3):423– 432; 9. Modi N. Clinical implications of postnatal alterations in body water distribution. Semin Neonatol. 2003;8(4):301– 306; 10. Murphy DJ, Hope PL, Johnson A. Neonatal risk factors for cerebral palsy in very preterm babies: case-control study. BMJ. 1997;314(7078):404–408; 11. Ertl T, Hadzsiev K, Vincze O, Pytel J, Szabo I, Sulyok E. Hyponatremia and sensorineural hearing loss in preterm infants. Biol Neonate. 2001;79(2):109 –112; 12. Laing IA, Wong CM. Hypernatraemia in the first few days: is the incidence rising? Arch Dis Child Fetal Neonatal Ed. 2002;87(3):F158 –F162; 13. Gawlowski Z, Aladangady N, Coen PG. Hypernatraemia in preterm infants born at less than 27 weeks gestation. J Paediatr Child Health. 2006;42(12):771–774; 14. Roze JC, Bureau-Rouger V, Beucher A, et al. Follow-up network for newborns at risk for handicaping a French region [in French]. Arch Pediatr. 2007;14(suppl 1):S65–S70; 15. Fouron JC, Gosselin J, Amiel-Tison C, et al. Correlation between prenatal velocity waveforms in the aortic isthmus and neurodevelopmental outcome between the ages of 2 and 4 years. Am J Obstet Gynecol. 2001;184(4):630–636; 16. Josse D. Revised Brunet-Le´ zine Scale of Psychomotor Development of First Childhood [in French]. Paris, France: Etablissement d’Applications Psychotechniques; 17. Fily A, Pierrat V, Delporte V, Breart G, Truffert P; NordPas-de-Calais EPIPAGE Study Group. Factors associated with neurodevelopmental outcome at 2 years after very preterm birth: the population based. Nord-Pas-de-Calais EPIPAGE cohort. Pediatrics. 2006;117(2):357–366; 18. Wood NS, Marlow N, Costeloe K, et al. Neurologic and developmental disability after extremely preterm birth. N Engl J Med. 2000;343(6):378 –384; 19. Wood NS, Costeloe K, Gibson AT, Hennessy EM, Marlow N, Wilkinson AR. The EPICure study: associations and antecedents of neurological and developmental disability at 30 months of age following extremely preterm birth. Arch Dis Child Fetal Neonatal Ed. 2005;90(2):F134 –F140; 20. Ancel PY, Livinec F, Larroque B, et al. Cerebral palsy among very preterm children in relation to gestational age and neonatal ultrasound abnormalities: the EPIPAGE cohort study. Pediatrics. 2006;117(3):828–835; 21. Bassan H, Benson CB, Limperopoulos C, et al. Ultrasonographic features and severity scoring of periventricular hemorrhagic infarction in relation to risk factors and outcome. Pediatrics. 2006;117(6):2111–2118; 22. Vollmer B, Roth S, Riley K, et al. Long-term neurodevelopmental outcome of preterm children with unilateral cerebral lesions diagnosed by neonatal ultrasound. Early Hum Dev. 006;82(10):655– 661; 23. Soupart A, Penninckx R, Namias B, Stenuit A, Perier O, Decaux G. Brain myelinosis following hypernatremia in rats. J Neuropathol Exp Neurol. 1996;55(1):106 –113; 24. Brown WD, Caruso JM. Extrapontine myelinolysis with involvement of the hippocampus in three children with severe hypernatremia. J Child Neurol 1999;14(7):428433 Consultem também..... Em condições basais, prematuros < 35 semanas têm maior excreção de sódio que RN a termo; Prematuros são incapazes de reter sódio quando em balanço negativo; A capacidade de concentrar urina é baixa em RN (um pouco maior que a do plasma); A capacidade de concentração de urina aumenta rapidamente nas 4-6 semanas pós natais (nível do adulto com 2 anos). Acta Paediatr Scand Suppl. 1983;305:61-5. Excreção 250 . Urinária de Sódio em RNs . 200 150 . . . . . 100 . . 50 0 . . . . . . . 26 . 28 . 30 32 34 36 38 40 Adaptado de: Neonatologia: Fisiopatologia e tratamento do recém nascido. Avery et cols. Hyponatraemia in the first week of life in preterm infants. Part I. Arginine vasopressin secretion. L REES, C G D BROOK, J C L SHAW, AND M L FORSLING Departments of Paediatrics and Physiology, Middlesex Hospital, and Department of Paediatrics, University College Hospital, London Archives of Disease in Childhood, 1984, 59, 414-422 Hyponatraemia in the first week of life in preterm infants. Part II. Sodium and water balance L REES, J C L SHAW, C G D BROOK, AND M L FORSLING Departments of Paediatrics and Physiology, Middlesex Hospital, and Department of Paediatrics, University College Hospital, London Archives of Disease in Childhood, 1984, 59, 423-429 Sodium homeostasis in term and preterm neonates. Part III. Effect of salt supplementation. J AL-DAHHAN, G B HAYCOCK, B NICHOL, C CHANTLER, AND L STIMMLER Evelina Children's Hospital, Guy's Hospital, London Archives of Disease in Childhood, 1984, 59, 945-950 Manuseio do balanço hídrico no recémnascido muito imaturo Autor(es): N. Modi. Apresentação:Camila Vieira, Márcia Pimentel de Castro
Baixar