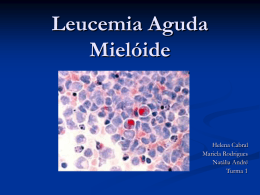
Perspectivas no tratamento farmacológico da Leucemia Mielóide Aguda (LMA)* Perpectives in the pharmacologic treatment of acute myeloid leukemia (AML) Mirian Kuhn1, Vanusa Manfredini2 *Universidade Regional Integrada do Alto Uruguai e das Missões Campus de Erechim, RS. Endereço para Correspondência: Prof. Dra. Vanusa Manfredini Rua Sergipe 161 apt 43 Bairro Fátima CEP: 99700-000 Erechim – RS Fone 55 54 3520 9000 ramal 9073 ou 55 51 81177884 [email protected] 1 Acadêmica do curso de Farmácia Bioquímica Clínica da Universidade Regional Integrada do Alto Uruguai e das Missões – URI – Campus de Erechim/RS. 2 Farmacêutica Bioquímica, Professora Doutora do Departamento de /ciências da Saúde da Universidade Regional Integrada do Alto Uruguai e das Missões – URI – Campus de Erechim/RS. 2 RESUMO A Leucemia Mielóide Aguda (LMA) é uma doença maligna, onde mieloblastos expandem-se, acumulam-se e suprimem a atividade hematopoética normal, constituindo um grande desafio diagnóstico e terapêutico. O tratamento consta de duas fases a primeira, chamada de terapia de indução cujo propósito é eliminar a maior quantidade possível de células leucêmicas para que o paciente passe para a fase de remissão. Quando em remissão, a segunda fase é iniciada, chamada de terapia de continuação, que objetiva eliminar qualquer célula leucêmica restante. O tratamento é constituído por forte estrutura clínica, por base laboratorial capaz de reconhecer e identificar grupos de risco e fatores de prognóstico, sendo que o principal é a quimioterapia. Assim, usa-se geralmente primeiro a citarabina e após a daunorrubicina. As pessoas cuja doença está em remissão recebem quimioterapia de consolidação depois do tratamento inicial, para assegurar a destruição da maior quantidade possível de células leucêmicas. Assim, o objetivo dessa revisão foi abordar as perspectivas farmacológicas no tratamento da LMA. Os resultados desse trabalho mostram que os fármacos ainda se encontram em fase de estudo, porém são promissores para o tratamento da LMA. Palavras-chave: Agentes. Diagnóstico. Leucemia mielóide aguda. Tratamento quimioterápico. Transplante de medula óssea. 3 ABSTRACT Acute Myeloid Leukemia (AML) is a malignant disease, where myeloblasts expand, accumulate and stop normal hematopoetic activity, being a great diagnosis and therapeutic challenge. Treatment has two phases: the first one is induction therapy whose purpose is to eliminate the greater quantity of leukemia cells so the patient can GO to the phase of remission. When in remission, second phase starts and its is called therapy of continuation, whose objective is to eliminate any leukemia cell that might be there. Treatment is constituted by strong clinical structure, by laboratorial base able to recognize and identify groups of risk and factors of prognosis, being chemotherapy the most important treatment. Citarabina is generally used first, after daunorrubicina is used. People whose disease is in remission receive chemotherapy of consolidation after the initial treatment, to assure the destruction of the greater number of leukemia cells. The aim of this paper was to study the pharmacological perspectives in the treatment of AML. Data showed that drugs to treat it are still being studied, but they are promissory. Key-words: Acute Myeloid MeduleTransplant. Diagnosis. Leukemia. Chemotherapic Treatment. Bone 4 INTRODUÇÃO A leucemia mielóide aguda (LMA) é uma doença em que existem células cancerosas no sangue e na medula óssea (MO), caracterizando-se pelo crescimento descontrolado e exagerado das células indiferenciadas chamadas blastos, sendo que estas células não apresentam as funções normais dos glóbulos brancos (1). Além disso, existe um bloqueio na produção das células normais, havendo uma deficiência de glóbulos vermelhos, plaquetas e leucócitos (2, 3). Os eventos moleculares responsáveis pela transformação leucêmica não são conhecidos, entretanto a proliferação inexorável das células hematopoéticas imaturas que perderam a sua capacidade de diferenciação normal, consistem no resultado final (4). Parecem estar envolvidas na patogênese das leucemias a ativação de protooncogenes e as mutações em genes supressores que regulam o ciclo celular, pois levam à perda dos mecanismos normais controladores da proliferação, diferenciaçãomaturação ou da morte celular programada (2, 5). É uma doença potencialmente letal na qual os mielócitos se tornam cancerosos e rapidamente substituem as células normais da MO (6). As células leucêmicas acumulam-se na medula óssea, destruindo e substituindo as que produzem as células normais do sangue, são libertadas no sangue e transportadas para outros órgãos, onde continuam a crescer e a dividir-se, podendo formar tumores pequenos na pele ou sob a mesma e provocar meningite, anemia, insuficiência renal e hepática e lesar qualquer outro órgão (7). A LMA pode ocorrer em crianças ou adultos, ainda que o tratamento seja diferente para cada grupo. Muitas vezes é difícil diagnosticar a doença, sendo que seus primeiros sintomas podem ser confundidos com os de uma gripe ou outra doença 5 comum como febre, calafrios, cansaço, palidez, dores nos ossos ou nas articulações (5, 8, 9). Geralmente a doença surge sem motivo aparente, embora possam se identificar possíveis causas como radiação ionizante, vírus oncogênicos, algumas substâncias químicas e fármacos (como benzeno e agentes alquilantes), fatores genéticos e congênitos e predisposição a doenças hematológicas. Esta síndrome pré-leucêmica é vista com freqüência em pacientes mais velhos e em pacientes que desenvolvem leucemia aguda depois de tratamento com um agente citotóxico (10, 9). A LMA é uma doença predominante em adultos do sexo masculino, geralmente acima de 60 anos de idade, sendo que apresenta um prognóstico pobre principalmente em pacientes idosos (5, 10, 11). Tão logo o diagnóstico seja possível, os pacientes devem ser submetidos ao tratamento quimioterápico inicial, chamado indução de remissão (12, 13). O objetivo é a obtenção da remissão, ou seja, desaparecimento das células blásticas na medula óssea, quando esta é atingida, a produção normal dos glóbulos vermelhos, brancos e plaquetas é restabelecida. Quando em remissão e sem sinais de leucemia, é iniciada a segunda fase, chamada de terapia de continuação, que objetiva eliminar qualquer célula leucêmica restante no sangue (14). Estudos complementares de diagnóstico, incluindo imunofenotipagem, avaliação citogenética e genética molecular são necessários para o desenvolvimento de tratamentos específicos, porque subtipos de LMA podem ser abordados com terapêutica direcionada (15). O tratamento está orientado para se conseguir a remissão precoce, mas, a doença responde a menos medicamentos do que outros tipos de leucemia e, além disso, 6 o tratamento costuma piorar o estado do doente antes de começar a proporcionar-lhe alguma melhoria (16, 17). Em face do exposto o objetivo deste trabalho foi abordar as perspectivas farmacológicas no tratamento da LMA uma vez que se trata de uma doença potencialmente letal. 7 LEUCEMIA MIELÓIDE AGUDA (LMA) A LMA é uma neoplasia hematológica heterogênea constituindo um enorme desafio diagnóstico e terapêutico, sendo um dos tipos mais comuns de malignidades hematológicas (16). Apesar de todos os progressos no campo da onco-hematologia, a taxa de cura em LMA permanece em torno de 20% (17). Quanto ao incremento em drogas e doses antiblásticas da imunoterapia e das modalidades de transplante de medula e célula tronco periféricas, a experiência dos grandes centros mundiais continua reportando a cura global da doença como baixa (16). As estimativas para o ano de 2008 no Brasil, segundo localização primária é de 5.220 novos casos para homens e 4.320 novos casos para mulheres, enquanto que no Rio Grande do Sul é de 810 casos, sendo que em Porto Alegre a estimativa gira em torno de 130 novos casos (18). CLASSIFICAÇÃO DAS LEUCEMIAS MIELÓIDES AGUDAS Mo Blastos grandes e agranulares. Negativos para mieloperoxidase; negativos para marcadores de linhagem B ou T; positivos para CD13 e/ou CD33; positivos para mieloperoxidase por imunoquímica ou microscopia eletrônica; TdT pode estar positivo (19, 20). M1 – Leucemia mieloblástica sem maturação Células blásticas agranulares ou granulares, mais que 90% das células nãoeritróides. Pelo menos 3% destas células são positivas para peroxidase ou preto do Sudão. Das células remanescentes, 10% (ou menos) são células granulocíticas em maturação (21, 19). 8 M2 – Leucemia mieloblástica com maturação A soma dos blastos granulares e agranulares é de 30 a 89% das células nãoeritróides (19). Células monolíticas são menores que 20% (19). Menos de 10% dos granulócitos originários dos promielócitos amadurecem em polimorfonucleares (21, 19). M3 – Leucemia promielocítica A maioria das células é do tipo promielócito anormal com intensa granulação. Estão presentes células características contendo feixes de bastonetes de Auer. Também pode ocorrer uma variante microgranular (21, 19). M4 – Leucemia mielomonocítica Na medula óssea os blastos perfazem mais que 30% das células não-eritróides. A somatória dos mieloblastos, promielócitos, mielócito e granulócitos tardios situa-se entre 30 e 80% das células não-eritróides. Mais de 20% das células não-eritróides são de linhagem monocítica. Quando as células monocíticas ultrapassam os 80%, o diagnóstico é de M5 (21, 19). Quando os achados de medula são como acima e os monócitos do sangue periférico são maior que 5,0 × 109/l, o diagnóstico é de M4 (21, 19). Quando a contagem de monócitos for inferior a 5,0 × 109/l, o diagnóstico de M4 pode ser confirmado com base na lisozima sérica e esterase combinada (21, 19). O diagnóstico de M4 pode ser confirmado quando os monócitos são responsáveis por mais de 20% dos precursores da medula (21, 19). 9 Eosinofilia com M4 Eosinófilos acima de 5% das células não-eritróides na medula óssea, anormais e, positivos para cloroacetato e ácido periódico de Schiff (21, 19). M5 – Leucemia monocítica Em torno de 80% das células não-eritróides da medula são monoblastos, promonócitos ou monócitos (21, 19). Em M5a, cerca de 80% das células monocíticas são monoblastos (21, 19). Em M5b, menos que 80% das células monocíticas são monoblastos e as remanescentes são predominantemente promonócitos e monócitos (21, 19). M6 – Eritroleucemia O componente eritróide da medula óssea excede 50% de todas as células nucleadas e 30% das células não-eritróides remanescentes são blastos granulares e agranulares (Tipo I e II) (21, 19). Se houver mais de 50% de células eritróides, mas menos de 30% de blastos, o diagnóstico é de síndrome mielodisplásica (21, 19). M7 – Leucemia megacarioblástica Pelo menos 30% das células nucleares são blastos, sendo identificados por peroxidase de plaquetas em microscopia eletrônica, ou por anticorpos monoclonais (21, 19). 10 TRATAMENTOS CONVENCIONAIS O tratamento principal para esse tipo de doença é a quimioterapia, ainda que a radioterapia possa ser recomendada em alguns casos, também podem ser necessários transplantes de medula óssea (TMO) e terapia biológica (22, 23). O primeiro passo da quimioterapia inclui citarabina durante sete dias e daunorrubicina durante três dias (24, 25). Muitos estudos sobre a LMA avaliaram os esquemas ótimos de administração de citarabina e daunorrubicina (26). Os pacientes cuja doença está em remissão recebem habitualmente quimioterapia adicional, chamada quimioterapia de consolidação, semanas ou meses depois do tratamento inicial, para assegurar a destruição da maior quantidade possível de células leucêmicas (27). O tratamento pós-remissão depende de uma série de fatores, tais como: idade do paciente, condições clínicas e, principalmente, dos resultados da citogenética, podendo variar desde a intensidade das doses de quimioterapia em um ou mais ciclos até o uso das diversas modalidades de transplantes de medula óssea (autólogo ou alogênico) (27). Em nosso país, o tratamento de LMA é realizado segundo as normas preconizadas internacionalmente, mas alguns pontos ainda poderiam ser melhorados, como o diagnóstico precoce nas unidades de saúde, o encaminhamento ágil para uma unidade referencial, a diminuição da mortalidade relacionada ao tratamento que muitas vezes esbarra no alto custo dos medicamentos, e a necessidade de implementação de um tratamento pós-consolidação para evitar as recaídas (28, 29). A inclusão dos TMO alogênico entre os recursos terapêuticos disponíveis, acarretou em um aumento na sobrevida dos pacientes, representando a única chance real 11 de cura para aqueles que recidivam (30). Grande parte dos portadores transplantados alogenicamente em primeira remissão, a partir de um irmão doador HLA-compatível, sobrevivem prolongadamente (31). O transplante medular alogenéico é superior à quimioterapia para o paciente com doença recidivante, mas na maioria das vezes os pacientes são idosos demais para o transplante ou não possuem um doador disponível. Para pacientes em segunda remissão, uma outra alternativa é o transplante medular autólogo (26). Quanto aos transplantes não-ablativos, além do efeito em si, se considera a menor toxicidade que permite sua aplicação em situações clínicas nas quais a indicação de programas mieloblativos seria inviabilizada pelo alto potencial tóxico associado (32). Monocinas e linfocinas purificadas, como os interferons, fatores da necrose tumoral (TNF) e fatores estimuladores de colônia (CSF) estão sendo investigados como modificadores do crescimento leucêmico in vitro e in vivo. O CSF pode exercer outra função na LMA, através do recrutamento de células em partes do ciclo celular que são mais sensíveis à quimioterapia. Tanto o gama-interferon quanto o fator de necrose tumoral (TNF) induziram células de uma linhagem celular leucêmica (HL-60) à diferenciação na direção dos macrófagos, podendo ainda inibir o crescimento clonal das células mielóides in vitro, mas sua utilização clínica ainda está por ser estabelecida (26). Há que ser destacada a introdução da droga 2-clorodeoxiadenosina (2-CDA), passível de induzir respostas completas e parciais em muitas crianças com LMA recidivada e virgens de tratamento, quando oferecida como “janela terapêutica”, prétratamento convencional (33). Seu impacto tem sido estudado, revelando-se promissora no tratamento das LMA (34). 12 NOVAS PROPOSTAS TERAPÊUTICAS Muitos agentes recentemente estudados têm se tornado promissores no tratamento da leucemia mielóide aguda. O plano para o futuro são estratégias terapêuticas baseadas na especificidade da doença, sendo que a combinação dos agentes com quimioterapia são importantes para avaliar uma melhora na resposta do tratamento (35). Os agentes estudados incluem gemtuzumab ozogamicim (GO), que se trata de um imunoconjugado de um anticorpo anti-CD33 ligado a um agente citotóxico potente, a caliomicina, eficiente para pacientes com LMA. A adição deste imunoconjugado à quimioterapia convencional pode melhorar significativamnte a taxa de remissão completa (36). A P-Glicoproteína (Pgp), chamada Zosuquidar, também tem mostrado benefício se a dose da quimioterapia concomitante não for reduzida, pois este parece não alterar a farmacocinética da droga co-administrada (37). O único estudo que mostrou beneficio foi realizado com pacientes que receberam Daunorrubicina ou Aracitina C infusional, com ou sem ciclosporina, sendo que em pacientes com pouco risco ocorreu uma taxa de remissão morfológica, ou seja, recuperação das plaquetas (38). A Farnesyl transferase é uma enzima chave na ativação da proteína RAS, sendo que mutações produzem RAS ativas que levam a proliferação. A inibição produzida por este fármaco previne a translocação e a ativação desta proteína (35). A Farnesyl transferase oral, Tipifarmib® (Zanestra, Tibotec), demonstrou boas respostas clínicas e excelente tolerância em pacientes com pouco risco, mostrando-se 13 uma alternativa para pacientes idosos que não podem submeter-se à terapia mais agressiva (39). Outra proposta terapêutica seria o inibidor de receptor tirosina quinase (inibidor FLT3), porém poucos pacientes têm conseguido a remissão completa com o uso deste inibidor, que possui uma atividade clínica modesta, embora uma combinação com Ara C sugere que este inibidor combinado com quimioterapia possa ser eficiente (35). Agentes alquilantes também tem sido investigados, entre eles destaca-se o Cloretazine®, um agente que induz as trocas entre as moléculas de DNA, atravessa a barreira da irrigação sanguínea, possuindo uma alta eficiência anti-tumor. Entretanto, pode ocorrer uma resistência que deve ser mediada com O6 alquiguanina DNA alquil transferase, sendo que alguns pacientes já apresentaram remissão completa (35, 40). Clofaralina é um novo análogo de purina, importante nos procedimentos de divisão e não divisão das células. É um componente ativo para a LMA refratária e não tratada, podendo ser usada em terapia combinada com Aracitina C (35). Rapamycim® é uma agente inibidor da m TOR, uma quinase que regula o crescimento celular e interage com uma variedade de proteínas, incluindo ciclinas DI, cmyc, e STAT3 (41). 14 CONSIDERAÇÕES FINAIS Os agentes estudados e que ainda se encontram em fase de estudo, são promissores e um grande número ainda deve ser desenvolvido, porém, a questão é como melhorar o seu uso. Múltiplos agentes podem ser combinados para inibir a leucemia mielóide aguda, se isto é eficiente ou não, ainda vamos descobrir. Entretanto, alguns destes agentes parecem ser eficientes em pacientes que não tem o alvo específico identificado, indicando que pode haver outros mecanismos de função. Fatores clínicos e biológicos que predizem respostas deveriam ser determinados e outras estratégias que cubram as resistências necessitam ser desenvolvidos. O tratamento da LMA é constituído por forte estrutura clínica, por base laboratorial capaz de reconhecer e identificar grupos de risco e fatores de prognóstico de suma importância, associados a programas de eficácia e disponibilização de recursos terapêuticos não-convencionais e clássicos. 15 REFERÊNCIAS BIBLIOGRÁFICAS: 1 Geer JP, Baer MR, Kinney MC. Acute Myelogenous Leukemia. In: Lee RG, Foerster JL, Paraskevas F, Geer JP, Rodgers GM. Wintrobe’s Clinical Hematology Philadelphia, Williams & Wilkins 1999, 10th ed. Cap 88: 2.272-2.319. 2 Martins SLR, Falcão RT. A importância da imunofenotipagem na leucemia mielóide aguda. Rev Assoc Med Bras 2000; v. 46, n. 1: p. 57-62. 3 Pelloso LAF. et al. Cariótipo em leucemia mielóide aguda: importância e tipo de alteração em 30 pacientes ao diagnóstico. Rev Assoc Med Bras 2003; v. 49, n. 2: p. 1505. 4 Goldman L, Bennett JC. Cecil Tratado de Medicina Interna. 21ª ed. São Paulo(SP): Guanabara Koogan; 2001. 5 Bain JB. Diagnóstico em Leucemias. 2ª ed. Rio de Janeiro (RJ): Revinter; 2003. 6 Silva, GC et al. Diagnóstico laborial das leuceminas mielóides agudas. Brás Patol Méd. Lab 2006 abr; v. 42, n, 2: 77-84. 7 Robb INS, S.L. et al. Patologia Estrutural e Funcional. 5ª ed. Rio de Janeiro (RJ): Guanabara Koogan; 1996. 8 Hoyer, JD et al. Detection and classification of acute leukemia by the Coulter STKS Hematology Analyzer. Am J Clin Pathol 1996: v. 106, n. 3: p. 352-8. 9 Liesner RJ, Goldstone A H. ABC of clinical haematology: the acute leukemias. Br J Haematol 1997: n. 314: p. 733. 10 Douer D. The epidemiology of acute promyelocytic leukaemia. Best Pract Res Clin Haematol 2003: v. 16, n. 3: p. 357-67. 11 Bene MC et al. Impact of immunophenotyping on management of acute leukemias. Haematologica 1999: v. 84, n. 11: p. 1024-34. 12 Chessells JM. Recent advances in management of acute leukaemia. Arch Dis Child. 2000; 82: 438-42. 13 Wells RJ, Woods WG, Buckley JD, Odom LF, Benjamin D, Bernstein I., et al. Treatment of newly diagnosed children and adolescents with acute myeloid leukemia: a Children's Cancer Group study. J Clin Oncol 1994; 12: 2367-77. 14 Hamerschlak N. Estudo retrospectivo do tratamento de leucemia mielóide aguda com o transplante de medula óssea – A experiência brasileira. Rev. bras. hematol. Hemoter 2006; 28(1):11-18. 16 15 Tallmann MS. Relevance of pathologic classifications and diagnosis of acute myeloid leukemia to clinical trials and clinical practice. Câncer Treatment Research 2004; 121: 45-67. 16 Bittencourt R et al. Leucemia Mielóide Aguda: perfil de duas décadas do Serviço de Hematologia do Hospital de Clínicas de Porto Alegre – RS. Rev Bras Hematol hemoter 2003; 25(1):17-24. 17 Appelbaum FP, Gilliland G, Tallman MS. The Biology and Treatment of Acute Myeloid Leukemia. American Society of Hematology- Education Program Book: 1998, p. 15-43. 18 Estimativas para Leucemia Mielóde Aguda no ano de 2008, disponível no site www.inca.gov.br, acesso em 12/04/2008. 19 HOFFBRAND, V. et al. Atlas colorido de Hematologia Clínica. 3ª ed. São Paulo (SP): Manole Ltda; 2001; p. 139-166. 20 Bennett JM, Catovsky D, Daniel MT et al. Proposal for the recognition of minimally differentiated acute myeloid leukaemia (AML-M0) Br J Haematol 1991; 78: 325-329. 21 RAPAPORT, Hematologia: introdução. 2 ª ed. São Paulo (SP): Roca; 1990; p. 450. 22 Wiernik PH. Diagnosis and treatment of acute nonlymphocytic leukemia. In: Wiernik PH, Canellos GP, Dutcher JP, et al., eds.: Neoplastic Diseases of the Blood. 3rd ed. New York, NY: Churchill Livingstone; 1996; pp 283-302. 23 Scheinberg DA, Maslak P, Weiss M. Acute leukemias. In: DeVita VT Jr, Hellman S, Rosenberg SA, eds.: Cancer: Principles and Practice of Oncology. 6th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2001, pp 2.404-32. 24 Cassileth PA, Lynch E, Hines JD et al.: Varying intensity of postremission therapy in acute myeloid leukemia. Blood 1992; 79 (8): 1.924-30. 25 Wiernik PH, Banks PL, Case DC Jr et al.: Cytarabine plus idarubicin or daunorubicin as induction and consolidation therapy for previously untreated adult patients with acute myeloid leukemia. Blood 1992; 79 (2): 313-9. 26 Lee RG et al. Hematologia Clinica. 2ª ed. São Paulo(SP): Manole Ltda; 1998: 2 v. p. 2131-2134. 27 Bostrom B, Brunning RD, McGlave P, et al.: Bone marrow transplantation for acute non-lymphocytic leukemia in first remission: analysis of prognostic factors. Blood 1985; 65(5): 1.191-6. 28 Burnett AK, Goldstone AH, Stevens RMF, Hann IM, Gray RG, Rees JKH, Wheatley KW. Randomised comparison of autologous bone marrow transplantation to intensive 17 chemotherapy for acute myeloid leukemia in first remission: results of MRC-AML 10 trial. Lancet 1998; 351:700. 29 Büchner T, Döhner H, Ehninger G, Ganser A, Hasford J, for the German AML intergroup. Up-front randomization and common standard arm: a proposal for comparing AML treatment strategies between different studies. Leuk Res 2002; 26: 1.073-1.075. 30 Grimwade D, Walker H, Oliver F, et al. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 Patients Entered Into the MRC AML 10 Trial. Blood 1998; 92: 2.322-33. 31 Long GD, Blume KG. Allogeneic bone marrow transplantation for acute myeloid leukemia. In: Forman SJ, Blume KG, Thomas ED, eds. Bone Marrow Transplantation. 1st ed. Boston: Blackwell Scientific; 1994: p.607-17. 32 Zanichelli MA. Perspectivas para a leucemia mielóide aguda na infância após a observação de um grupo de pacientes tratados convencionalmente. Rev Bras Hematol hemoter 2006; 28(4): 246-252. 33 Santana VM, Hurwitz CA, Blakeley RL, et al. Complete remissions induced by 2Clorodeoxyadenosine in children with newly diagnosed acute myeloid leukemia. Blood 1994; 84: 1.237-42. 34 Cristofani LM, Vianna S, Pereira WV, et al. Childhood acute myeloid leukemia (AML): International Outreach-97 protocol (IO-97) results. Proceedings of ASCO 2003; v. 22. p. 808. r. 3.249. 35 Tallman MS. New agents for the treatment of acute myeloid leukemia. Best Practice & Research Haematology 2006; vol 19, n. 2: pp311-320. 36 List AF, Kopecky KJ, Willman CL et al. Benefit of cyclisporine modulation of drug resistance in patients with poor-risk acute leukemia: a Southwest Oncology Group Study. Blood 2001: 98; 3212-3220. 37 Dantzig AH, Shepard RL, Cao J et al. Reversal of P-glycoprotein-mediated multidrug resistance by a potent cyclopropyldibenzosuberane modulator, LY 335979. Câncer Research 1996; 56: 4171-4179. 38 Cripe L, Cooper B. Eastern Cooperative Oncology Group. Phase III randomized study of daunoribicin and cytarabine with or without zosuquidar trihydrochloride in elderly patients with newly diagnosed açude myeloid leukemia, refractory anemia with excess blasts (RAEB) in transformation, or high-risk RAEB. Disponível em http://www.cancer.gov/ClinicalTrials.aspx?version=patient&cdrid=257122;9-27-2005. 39 Karp JE, Lancet JE, Kaufmann SH et al. Clinical and biologic activity of the farnnesyltransferase inhibitor R115777 in adults with refractory and relapsed acute leukeminas: a phase I clinical-laboratory correlativetrial. Blood 2001; 97: 3361-3369. 18 40 Giles F, Thomas D, Garcia-Manero G et al. A phase I and pharmacokinetic study of VNP4010IM, a novel sulfonylhydrazine alkylating agent, in patients with refractory leukemia. Clinical Câncer Research 2004;10: 2908-2917. 41 Recher C, Beyne-Rauzy O, Demur C et al. Antileukemic activity of rapamycin in acute myeloid leukemia. Blood 2005; 105: 2527-2534.
Baixar