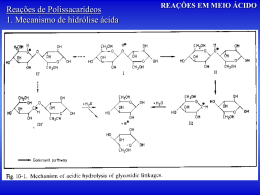
Engenharia Industrial Madeireira polpa e papel OBTENÇÃO DA PASTA CELULÓSICA E PAPEL Umberto Klock FIBRAS PARA PAPEL INDÚSTRIA DE CELULOSE E PAPEL Objetivo: Descrever de forma geral os procedimentos de obtenção de pastas celulósicas, seus usos O que é polpação? O que é polpação? Polpação é o processo pelo qual a madeira é reduzida a uma massa fibrosa. Isto significa romper as ligações entre as estruturas da madeira separando as fibras. TIPOS DE POLPAÇÃO • Existem duas maneiras de romper as ligações na madeira e liberar as fibras: • Mecânicamente e, • Quimicamente. • Também existem hibridos desses dois métodos: • Quimiomecanico, Termomecânico e, • Semi-químico. POLPAÇÃO MECÂNICA • Utiliza energia mecânica, com pouco ou nenhuma substância química. • Dividem-se em dois processos: • Desfibramento: toretes de madeira são forçados contra uma pedra em revolução que possue superfície abrasiva. (Processo mecânico convencional). (SGW) • Refinação: cavacos de madeira são lançados entre dois discos metálicos de superfícies abrasivas, sendo que um deles em revolução. • (Processo Mecânico de Refinador) (RMP) Polpação Mecânica – Pasta Mecânica • Maioria dos constituintes da madeira permanecem; • Resulta em alto rendimento – 85 a 95% • Papel pouco resistente, é necessário misturar fibras químicas longas; • Descolore rapidamente e facilmente; • Processo consome muita energia. Produtos de Pasta Mecânica • • • • Papel jornal, Papéis de impressão, Papéis revestidos; Misturas em papéis. Obtenção de pasta mecânica Polpação Química • Utiliza produtos químicos e calor para dissolver lignina; • A celulose permanece quase intacta, uma fração de polioses permanece na polpa. • Principais processos: • Kraft ou Sulfato, • Soda e, • Sulfito. Polpação Química • PROCESSO KRAFT • NaOH e Na2S • PROCESSO SODA • NaOH • PROCESSO SULFITO • SO2 e bases : Mg(OH)2, Ca(OH)2, NH4(OH) Alguns dados: • • • • Produção de polpas na América do Norte: Pastas mecânicas - 24% Polpas químicas - 70% Semiquímicas 6% • • • • Produção de polpas nos EUA Pastas mecânicas 9% Polpas químicas 85% Semiquímicas 6% •POLPAÇÃO KRAFT POLPAÇÃO KRAFT • KRAFT significa forte em alemão, • É a polpa de maior resistência • Processo dominante nos EUA, Brasil e no mundo em geral; • Flexível, e possui tecnologia eficiente de recuperação dos produtos químicos; • Rendimento na faixa de 40 a 50%; • Larga faixa de classificação: de branqueada a não branqueada. Produtos de polpa Kraft • • • • • Papel cartão, Papel para copiadoras, Papéis para alimentos, Muitos outros tipos, È uma fonte de fibras resistentes. A polpação kraft • Produtos químicos utilizados: • NaOH e Na2S • Operação: • Químicos e cavacos de madeira são carregados em um digestor; • Temperaturas se elevam a 170°C, • Cozimentos são de 2 a 4 horas, dependendo da quantidade de lignina a ser removida. A polpação kraft • Operação: • A polpa e licor negro são expelidos do digestor no final do cozimento; • • • • Licor negro consiste de: Químicos utilizados, Lignina dissolvida e, Carbohidratos. Equipamentos • Digestores contínuos • Digestores por batelada (Batch) Exemplos: Digestor por batelada de aquecimento direto Digestor em batelada Sistema em batelada Exemplo: Sistema Kamir de Vaso digestor simples Sistema contínuo Recuperação química • Para cada tonelada de polpa produzida tem-se de 9000 a 15000 litros de licor negro. • O licor negro contem: • Material orgânico – componentes da madeira que foram dissolvidos e, • Material inorgânico – químicos do cozimento na forma inativa. Recuperação química • Por razões economicas e ambientais, o licor negro precisa ser recuperado – daí o SISTEMA DE RECUPERAÇÃO QUÍMICA. • Objetivos: • Queimar material orgânico para gerar energia, • Converter material inorgânico inativo em material de cozimento ativo. Recuperação química • O licor negro é retirado da polpa em sistemas de lavagem de polpa marrom, • Este licor negro fraco é engrossado pela retirada de água em sistemas de evaporação; • O licor negro resultante chamado de forte é então queimado em caldeira, chamada de caldeira de recuperação. Caldeira de Recuperação • O calor gerado pela incineração do licor negro forte é usado para produzir vapor super aquecido, • Este vapor é utilizado na polpação (cozimento) e na fabricação do papel e ainda para produzir energia elétrica. Fluxograma simplificado do Processo Kraft BRANQUEAMENTO O QUE É BRANQUEAMENTO? • Branqueamento é o processo químico aplicado as polpas celulósicas para aumentar suas alvuras. • A celulose e as polioses não contribuem na coloração das polpas pois são naturalmente brancas, • A lignina, sujeira, feixes de fibras, rejeitos, contribuem na cor escura. Objetivos do branqueamento • Atacar e remover a lignina residual, • Atacar e destruir moléculas causadoras da cor escura, • Atacar e remover/descolorir sujeiras e feixes de fibras, • Aumentar a alvura da polpa e também promover sua limpeza. Mensurar a alvura A Alvura é medida por incidir luz sobre uma folha e medir quanto dessa luz incidente é refletida – Unidade %. Alvura do papel • TIPO DE PAPEL • Impressão/cópia • Jornal • Embalagem (sacos) ALVURA %ISO 80-90 60-70 25-30 Como a polpa é branqueada? • Os alvejantes mais comuns são oxidantes, • Na maioria dos casos esses oxidantes são fortemente eletrolíticos, roubam elétrons da lignina e de outras moléculas, quebrando as ligações existentes. Principais químicos branqueadores nas diferentes etapas: • • • • • • Cloração Extração Hipocloração Dióxido de Cloro Oxigênio Peróxido de Hidrog- C E H D O P - Cl2 - NaOH - NaClO - ClO2 - O2 e NaOH - H2O2 Sequências típicas do branqueamento • • • • Kraft (CD)(EO)DED – comuns até 1995 D(EOP)DED – requeridas por legislação OD(EOP)D – requeridas por legislação • Mecânicas • P • PY (Y = Hidrosulfito) Exemplo: estágios do branqueamento Esquema do processo de branqueamento Esquema do processo de branqueamento Esquema do processo de branqueamento Esquema do processo de branqueamento Esquema do processo de branqueamento Torres de branqueamento Impactos ambientais do branqueamento • Efluentes de qualquer tipo de sequência que usa cloro não pode ser queimado na caldeira de recuperação, causam corrosão e explosões. • Efluentes precisam ser tratados e despejados no ambiente, afetam a vida aquática. O branqueamento sem cloro • Mudança para sequências que usam apenas oxigênio como base, ex. ozônio, peróxido, etc. • Permitem que o efluente possa ser encaminhado para a Caldeira de recuperação, • Podem promover o circuito fechado de produção: sem a necessidade de água fresca, sem efluentes para fora do sistema. Papel FORMAÇÃO DO PAPEL Formação do papel Formação do papel Formação do papel • www.bracelpa.org.br • www.abtcp.org.br Polpação Kraft • Ciência Fundamental, • Conceito da polpação, • Cinética da reação química. Balanço de massa – processo Kraft Madeira – Pinus spp Licor branco Polpa Sulfat (Kraft) No processo kraft os carboidratos são atacados a uma temperatura relativamente baixa, o que ocasiona eliminação dos grupos acetila antes que se alcance a temperatura máxima de cozimento. A reatividade dos polissacarideos varia dependendo de suas acessibilidade e de sua estrutura, por exemplo, devido a que a celulose é de natureza cristalina e tem um alto grau de polimerização, sofrem menos perdas que as hemiceluloses. O que é Cinética? • Cinética é a razão na qual a reação química ocorre, • Pode ser descrita por uma equação, que é útil no dimensionamento do equipamento para o processo químico, • Pesquisadores tentam obter dados que poderão resolver a razão cinética por equação. Razão cinética • Usualmente, a razão ou a velocidade de uma reação é afetada por dois fatores: • Concentração dos reagentes; • Temperatura da reação. • A velocidade da reação deve portanto levar estes aspectos em consideração. Exemplo de uma reação simples de dois componentes • A + B C Equação de velocidade para uma reação com dois componentes Equação de velocidade para uma reação com dois componentes Dizemos que a reação é de : Primeira ordem com respeito ao reagente A Primeira ordem com respeito ao reagente B E de segunda ordem pelo geral. (o termo ordem refere-se ao expoente associado com o termo concentração) A equação K – “ de Arrhenius” é geralmente aceita como a fórmula para a constante de velocidade da reação: k= k0 x e(-E/RT) Onde: k0 = constante – fator de frequência E = energia de ativação para a reação R = constante dos gases T = temperatura de reação A equação k k= k0 x e(-E/RT) • Desde que todos os termos, exceto T são constantes, pode-se ver que aumentando a temperatura ocorrerá um aumento em k (o termo exponente tornar-se-á um número negativo menor), o que por sua vez deverá aumentar a razão (velocidade) da reação se a concentração dos reagentes for a mesma. • Concluindo: aumentando a temperatura em 10 graus, a velocidade da reação dobrará. Cinética da Polpação Alcalina • Demonstrou-se então que a polpação alcalina é de primeira ordem com respeito a concentração do OH- no licor de cozimento: • - dL = k x [ OH-] dt Dessa forma a velocidade da polpação pode ser aumentada tanto por aumento da concentração do NaOH ou pelo aumento da temperatura. “Fator H”. • Arrhenius encontrou em 1924, baseando-se em experimentos de polpação de S. Schmidt-Nielsen e J. Bruun, que a dissolução de "incrustantes" da madeira durante o processo kraft era uma reação de primeira ordem com respeito aos "incrustantes”. “Fator H”. • Posteriormente, em 1941, G.L. Larocque e O. Maas determinaram ao final de um cozimento kraft, com um conteúdo de lignina menor que 2%, que uma reação cinética de primeira ordem não era válida; estabeleceram também que a energia de ativação para o processo era de 32 000 cal/mol. “Fator H”. • Como o tempo e a temperatura são variáveis interdependentes “Vroom” por volta de 1956 desenvolveu um procedimento para expressar o tempo de cozimento e a temperatura com uma só variável, a qual chamou de • “Fator H”. • Vroom” sugeriu então exprimir o tempo e a temperatura de reação como variáveis ao empregar a versão modificada da equação de Arrhenius: • lnK = B – A T • A velocidade global para a deslignificação, pode aproximar-se da seguinte equação: - dL/dt = kL • onde L é o conteúdo de lignina na fibra no tempo t, e k é a constante de velocidade. • Com base em dados experimentais de k a várias temperaturas, o valor da energía de ativação (Ea) pode ser calculada da equação de Arrhenius: • ln k = ln A – (Ea/RT) lnK = B – A T • K é a velocidade de reação, • T é a temperatura absoluta (oK) e, • A e B são constantes. • A=ER • E = energia de ativação 32.097 cal/mol • R = constante dos gases perfeitos 1,986. • A velocidade de reação a 100oC foi arbitrariamente definida como unidade relativa e todos os valores são calculados nesta base e a equação assume então, a seguinte forma: • ln K = B - 32097 1,986 T • ln K = B – 16161,62 373oK T T = 100oC = • ln K = B – 16161,62 373 K=1 ln1 = 0 • 0 = B - 43,33 B = 43,33 • A velocidade de reação para temperatura é calculada como: • ln1 = ( 43,33 – 16161,62 •K=e qualquer T) ( 43,33 – 16161,62 T ) outra K=e ( 43,33 – 16161,62 T ) • Com esta equação pode-se construir uma tabela de velocidade de reação relativa a qualquer temperatura: T FATOR H H e ( 43 , 33 16161 , 62 /T ) 0 1000 900 800 700 600 500 H 400 300 200 100 0 0 20 40 60 80 A área sob a curva, denominada de fator H, pode ser empregada como medida de ajustagem do programa temperatura/tempo para qualquer cozimento, obtendo dessa maneira, o grau de cozimento desejado. Exemplo: Como exemplo de cálculo do fator H, considera-se um cozimento no qual a elevação da temperatura de 800C a 1700C foi realizado em 1,8h e o tempo à temperatura de 1700C, foi de 0,65 horas. Calculando temos: -Temperatura inicial = 80oC -Temperatura máxima = 170oC -Tempo para atingir a temperatura = 1,8 h -Tempo na temperatura máxima = 0,65 h logo: 1700C - 800C = t 108 min = 6 leituras t = 900 C 900C / 6 LEITURAS = 150C Exercícios Num digestor pequeno são necessários 2 000 unidades de H para se alcançaar um cozimento satisfatório a uma temperatura de 170°C. O aumento da temperatura foi o seguinte: Tempo (h) 0,00 0,25 0,50 0,625 _________________________________________________ Temperatura (°C) 80 138 162 170 a. Qual é o tempo no digestor na temperatura máxima para completar o cozimento? b. Qual será o tempo total de cozimento? Os cálculos do fator H são tradicionalmente feitos da seguinte maneira: utilizando a expressão K = e [43,33 - (16161,62/T)] se calcula o valor da velocidade relativa para cada tempo (ou ponto). O valor da velocidade é dividido por dois e se multiplica pelo intervalo para obter-se o valor de H. Para ilustrar a construção da tabela os cálculos para a temperatura de 162°C em 30 minutos (0,50 horas) são mostrados a seguir: K = e [43,33 - (16 161,62/(162+273))] = 480 K/2 = 480/2 = 240 Velocidade acumulada = K/2 a 138°C + K/2 a 162°C = 27 + 240 = 267 Intervalo = Tempo para 162°C - Tempo para 138°C = 0,50 – 0,25 = 0,25 horas H = (Velocidade acumulada) x (Intervalo) = (267) (0,25) = 66,75 Tabela A temperatura de 170°C será alcançada em 0,625 horas (0:37:30), obtendo-se um valor para H de 6,88 + 67,06 + 92,39 = 166,33. Portanto faltam 2 000 – 166,33 = 1 833,67 unidades de H. Da Tabela de Velocidade, para 170°C, K = 941,80, portanto: Tempo de cozimento a 170°C = H/K = 1833.67/941.80 = 1.95 horas (1:57:00) Tempo total de cozimento = 0.625 + 1.95 = 2.58 horas (2:34:48) Grupos de Trabalho Montar Tabela de Velocidade Relativa: Intervalos de 5 minutos – de 100 a 180 graus centígrados. Condições de cozimento para os grupos serão decididos em reunião após os cavacos estarem prontos.
Baixar

![Ppt0000004 [Somente leitura]](http://s1.livrozilla.com/store/data/000782222_1-d552d621aee64aef265e8bb675b10148-260x520.png)