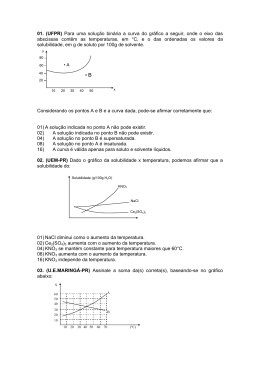
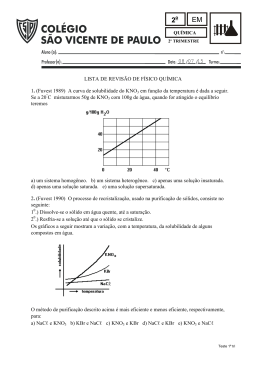
Militar Prof. Renan Borsoi Campos 01. (UFPR) Para uma solução binária a curva do gráfico a seguir, onde o eixo das abscissas contêm as temperaturas, em °C, e o das ordenadas os valores da solubilidade, em g de soluto por 100g de solvente. y Quimica 10°C ---------------- 20,9 20°C ---------------- 31,6 30°C ---------------- 45,8 40°C ---------------- 63,9 50°C ---------------- 85,5 170°C ---------------- 138 180°C ---------------- 169 190°C ---------------- 202 100°C ---------------- 245 80 04. Para formar uma solução saturada com 200g de água, a 30°C, precisamos de (2 x 45,8) gramas de KNO3 . •A 60 40 •B a) certo 20 b) errado x Considerando os pontos B e a curva dada, pode-se 10 20 30 40A e 50 afirmar corretamente que: 01) A solução indicada no ponto A não pode existir. 02) A solução indicada no ponto B não pode existir. 04) A solução no ponto B é supersaturada. 08) A solução no ponto A é insaturada. 16) A curva é válida apenas para soluto e solvente líquidos. 02. (UEM-PR) Dado o gráfico da solubilidade x temperatura, podemos afirmar que a solubilidade do: Solubilidade (g/100g H2O) KNO3 NaCl 05. Adicionando-se 25g de KNO3 a 100g de água, à temperatura constante de 10°C, temos: a) Precipitação de 20,9g de KNO3 b) Formação de uma solução não saturada. c) Dissolução de 20,9g de KNO3 e precipitação de 4,1g de KNO3 d) Dissolução de 25g de KNO3 e) Formação de uma solução supersaturada. 06. Adicionando-se 40g de KNO3 a 100g de água, à temperatura constante de 30°C, obtemos uma solução: a) Saturada b) Não saturada c) Supersaturada 07. (UFSC-SC) Fornecido o diagrama esquemático de solubilidade para os sais S1 e S2; observe-o e assinale a opção correta: Ce2(SO4)3 g/100mL 01) NaCl diminui como o aumento da temperatura. 02) Ce2(SO4)3 aumenta com o aumento da temperatura. 04) KNO3 se mantém constante para temperatura maiores que 60°C. 08) KNO3 aumenta com o aumento da temperatura. 16) KNO3 independe da temperatura. 03. (U.E.MARINGÁ-PR) Assinale a soma correta(s), baseando-se no gráfico abaixo: S1 da(s) S2 S 0 A 60 50 40 30 20 B 10 10 20 30 40 50 60 70 (°C) 01) A substância mais solúvel a 25°C é A. 02) A solubilidade de A e B são iguais em 40°C. 04) A 20°C, a quantidade de B necessária para saturar 300g de água é de 120g. 08) A 60°C, 20g de A em 100g de água constituem uma solução insaturada. As questões de número 4 a 6 referem-se à tabela abaixo: Solubilidade do KNO3 = gramas de KNO3 100g de água 10°C ---------------- 13,3 Atualizada16 /05/2008 5 10 15 (°C) a) A 15°C a solubilidade do sal S1 é o dobro da solubilidade do sal S2. b) A 10°C a solubilidade do sal S1 é menor que a do sal S2. c) A 5.°C os sais apresentam solubilidade iguais. d) A 5°C o sal S1 apresenta solubilidade menor que o sal S2. e) Para uma mesma variação de temperatura, o sal S2 apresenta maior variação de solubilidade que o sal S1. 08. (PUC-PR) A existência de um precipitado no fundo de uma solução, por bastante tempo, e sob temperatura constante, nos garante que a solução é: a) diluída. b) saturada com corpo de fundo. c) não-saturada. d) saturada. e) supersaturada. 160°C ---------------- 110 Neste curso os melhores alunos estão sendo preparados pelos melhores Professores 1 Militar Prof. Renan Borsoi Campos 09. (UEL-PR) Dentre os pares de afirmações, atribuídas a uma dada solução, e mencionadas abaixo, existe um que é contraditório. Aponte-o: a) concentrada e saturada b) concentrada e não-saturada c) diluída e saturada d) diluída e não-saturada e) diluída e concentrada Quimica 14.O gráfico a seguir refere-se à solubilidade (em g/100g de água) de determinado sal em diferentes temperaturas (em°C) 10. Foram misturados 400g de sulfato de bário com 750g de água a 20ºC, resultando em um sistema heterogêneo. Por filtração desse sistema, foram obtidos 900g de solução saturada. Calcule o Cs do sal a 20ºC. 11. (Objetivo-SP) Evapora-se completamente a água de 40g de solução saturada de nitrato de prata, saturada sem corpo de fundo, e obtém-se 15g de resíduo sólido. Determine o coeficiente de solubilidade desse sal para 100g de água, na temperatura inicial. 12.Seis soluções aquosas de nitrato de sódio, NaNO3, numeradas de I a VI, foram preparadas, em diferentes temperaturas, dissolvendo-se diferentes massas de NaNO3 em 100g de água. Em alguns casos, o NaNO3 não se dissolveu completamente. Este gráfico representa a curva de solubilidade de NaNO3, em função da temperatura, e seis pontos, que correspondem aos sistemas preparados: Se, a 40°C forem acrescentados 20,0g do sal em 200g de água, e deixada a mistura em repouso sob temperatura constante obter-se-á: I. solução saturada II. corpo de fundo III. solução diluída Dessas afirmações: a) apenas I é correta. b) apenas II é correta. c) apenas III é correta. d) I, II e III são corretas. e) I, II e III são INCORRETAS. 15. A curva de solubilidade de um dado sal é apresentada a seguir. Considerando a solubilidade deste sal a 30°C, qual seria a quantidade máxima (aproximada) de soluto cristalizada quando a temperatura da solução saturada (e em agitação) fosse diminuída para 20°C? A partir da análise desse gráfico, é CORRETO afirmar que os dois sistemas em que há precipitado são: a) b) c) d) I e II. I e III. IV e V. V e VI. 13. O gráfico a seguir representa as curvas de solubilidade de várias substâncias. Com relação ao gráfico anterior, assinale a afirmativa INCORRETA: a) KNO3 é mais solúvel do que o Pb(NO3)2 em água, a qualquer temperatura. b) A temperatura pouco afeta a solubilidade do NaCl. c) A substância que apresenta a maior aumento de solubilidade com o aumento de temperatura é o KNO3. d) À temperatura ambiente, a substância menos solúvel é o MgCl2. e) A 40°C, a solubilidade do KCl e a do NaCl são iguais. 2 Atualizada16 /05/2008 a) b) c) d) e) 5g 10 g 15 g 20 g 30 g 16. Considere o gráfico, representativo da curva de solubilidade do ácido bórico em água. Neste curso os melhores alunos estão sendo preparados pelos melhores Professores Militar Prof. Renan Borsoi Campos Quimica Adicionando-se 200g de H3BO3 em 1,00kg de água, a 20°C, quantos gramas do ácido restam na fase sólida? a) 50,0 b) 75,0 c) 100 d) 150 e) 175 17. A tabela a seguir fornece os valores de solubilidade do cloreto de sódio e do hidróxido de sódio, em água, a diferentes temperaturas. Calcule: a) a massa do sal que precipitou. b) a massa do sal que permaneceu em solução. As informações anteriores e os conhecimentos sobre soluções permitem concluir: 01. Soluções são misturas homogêneas. 02. Solução saturada é um mistura heterogênea. 04. O hidróxido de sódio é mais solúvel em água que o cloreto de sódio. 08. Soluções concentradas são soluções saturadas. 16. Quando se separa o soluto do solvente, obtêm-se substâncias diferentes daquelas que foram inicialmente misturadas. 32. Adicionando-se 145g de hidróxido de sódio a 100g de água, a 20°C, obtém-se um sistema bifásico, que, após aquecido a temperaturas acima de 50°C, apresenta-se monofásico. 20. Em 120g de solução aquosa saturada de um sal existem 40g de soluto dissolvidos.Calcule a solubilidade do referido sal, exprimindo-a em gramas do soluto por 100g de água na temperatura da experiência. 21. Tem-se 540g de uma solução aquosa de sacarose (C12H22O11), saturada, sem corpo de fundo, a 500C. Qual é a massa de cristais que se separam da solução, quando ela é resfriada até 300C? 0 Dados: C.S. a 30 C = 220g/100g de água C.S. a 500C = 260g/100g de água 22. Observe o gráfico a seguir e responda às questões que se seguem. 18. (Fuvest) 160 gramas de uma solução aquosa saturada de sacarose a 30°C são resfriados a 0°C. Quanto do açúcar cristaliza? Temperatura °C Solubilidade da sacarose g/100 g de H‚O 30 30 180 220 a) b) c) d) e) 20 g. 40 g. 50 g. 64 g. 90 g. a) Qual a menor quantidade de água necessária para dissolver completamente, a 60°C, 120g de B? 19. Uma solução saturada de nitrato de potássio (KNO3) constituída, além do sal, por 100g de água, está à temperatura de 70°C. Essa solução é resfriada a 40°C, ocorrendo precipitação de parte do sal dissolvido. A seguir, o gráfico da solubilidade do nitrato de potássio em função da temperatura. Atualizada16 /05/2008 b) Qual a massa de A necessária para preparar, a 0°C, com 100g de água, uma solução saturada (I) e outra solução insaturada (II)? 23. Uma solução saturada de NH4Cl foi preparada a 80°C utilizando-se 200g de água. Posteriormente, esta solução sofre um resfriamento sob agitação até atingir 40°C. Determine a massa de sal depositada neste processo. A solubilidade do NH4Cl varia com a temperatura, conforme mostrado no gráfico abaixo. Neste curso os melhores alunos estão sendo preparados pelos melhores Professores 3 Militar Prof. Renan Borsoi Campos Quimica 24. A solubilidade do oxalato de cálcio a 20°C é de 33,0 g por 100 g de água. Qual a massa, em gramas, de CaC2O4 depositada no fundo do recipiente quando 100 g de CaC2O4(s) são adicionados em 200 g de água a 20°C? 4 Atualizada16 /05/2008 Neste curso os melhores alunos estão sendo preparados pelos melhores Professores
Baixar