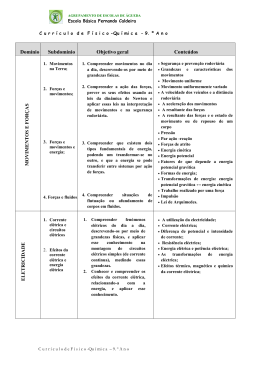
Condutividade eléctrica de líquidos e soluções Objectivos Observar a condutividade eléctrica de líquidos e soluções. Introdução Quando se mergulha dois eléctrodos num líquido/solução e se ligam aos pólos de uma bateria, ela poderá deixar passar a corrente eléctrica ou não. Pretende-se estudar o comportamento de soluções alcalinas, ácidos fortes e fracos, sais, solventes orgânicos e água desionizada. Uma das características das soluções é a sua maior ou menor capacidade de condução da corrente eléctrica. A água pura é má condutora de electricidade. A fraca condutividade apresentada resulta de uma ligeira ionização das moléculas de água, H2O (l) --> H+(aq) + OH-(aq) Originando apenas uma pequena concentração, tanto em hidrogeniões como em oxidriliões, da ordem de 10-7 mol/l, a 25ºC. Um grande número de solutos, não introduz modificação na capacidade da água conduzir a corrente eléctrica. São exemplos a acetona, o açúcar, que não formam iões em solução aquosa. Designam-se por não electrólitos e as soluções são moleculares. As moléculas dissolvidas mantêm a sua identidade, apenas são dispersas pelo solvente, outras substâncias, ácidos, bases e sais, em solução aquosa formam soluções iónicas, boas condutoras e chamam-se electrólitos. Os iões resultam da dissociação iónica, obtidas por acção dos solventes sobre as substâncias em solução. Os solventes ionizantes são geralmente solventes polares, como a água, ou seja, assimétricos do ponto de vista eléctrico, podendo considerar-se constituídos por dipolos no sentido eléctrico. A presença de água conduz à diminuição das forças de atracção entre iões e à sua consequente dispersão. As substâncias que em solução aquosa dão lugar à formação de iões podem classificar-se em: - Iónicas, que quando puras, são já constituídas por aniões e catiões, fortemente atraídos entre si por forças eléctricas, em solução, o solvente separa-os. - Ionizáveis: não iónicas, mas ionizáveis. Não são formados por iões, mas por moléculas, que quando dissolvidas dão origem a iões. Por exemplo o HCl. O ácido clorídrico, HCl, são moléculas polares de ligação covalente, em solução aquosa, a atracção das moléculas de água pode romper as ligações covalentes do composto, originando iões HCl(l) + H2O(l) --> Cl-(aq)+ H3O+(aq) Uma vez os iões formados, não há razão para que a atracção entre dipolos e iões cesse. Verifica-se hidratação das espécies. O fenómeno não é exclusivo da água e pode dizer-se que os solventes provocam solvatação das espécies neles dissolvidos.Procedimento experimental Material - Lâmpada - Pilha de 9 Volts - Fios condutores e crocodilos -Gobelé de 500 ml - Eléctrodos Produtos/Reagentes - Solução de cloreto de sódio 1M Solução hidróxido de sódio 1M Solução de ácido clorídrico 1M Solução de ácido acético 1M Álcool etílico Clorofórmio Água da torneira Água desionizada Procedimento experimental 1- Adicionar 200 ml de cada um dos líquidos e soluções em gobelés bem identificados. 2- Mergulhar os eléctrodos dentro do gobelé para cada uma das soluções. 3- Efectuar as ligações aos polos da pilha, conforme ilustrado nas fotos.Observar em que situações a lâmpada acende e com que intensidade. 4- Antes de passar ao próximo gobelé, lavar os eléctrodos com água desionizada e limpar com papel absorvente.
Baixar