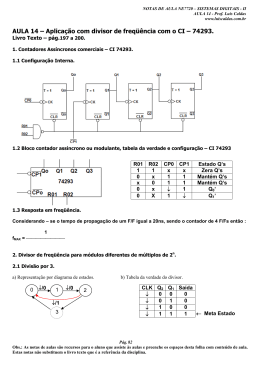
Rafaela Cristina Landeiro da Silva PUC-Rio - Certificação Digital Nº 0921909/CA Tratamento de efluentes contendo cianeto livre através dos sistemas SO2/O2; SO2/H2O2 e H2O2 Tese de Doutorado Tese apresentada como requisito parcial para obtenção do grau de Doutor pelo Programa de Pós-Graduação em Engenharia de Materiais e de Processos Químicos e Metalúrgicos do Centro Técnico Científico da PUC-Rio. Orientador: Prof. Luiz Alberto Cesar Teixeira Rio de Janeiro Março de 2014 Rafaela Cristina Landeiro da Silva PUC-Rio - Certificação Digital Nº 0921909/CA Tratamento de efluentes contendo cianeto livre através dos sistemas SO2/O2; SO2/H2O2 e H2O2 Tese apresentada como requisito parcial para obtenção do grau de Doutor pelo Programa de Pós-Graduação em Engenharia de Materiais e de Processos Químicos e Metalúrgicos do Departamento de Engenharia de Materiais do Centro Técnico Científico da PUC-Rio. Aprovada pela Comissão Examinadora abaixo assinada. Prof. Luiz Alberto Cesar Teixeira Orientador e Presidente Departamento de Engenharia de Materiais - PUC-Rio Prof. Roberto José de Carvalho Departamento de Engenharia de Materiais - PUC-Rio Profa. Márcia Walquiria de Carvalho Dezotti COPPE - Universidade Federal do Rio de Janeiro Profa. Fabiana Valéria da Fonseca Araujo Universidade Federal do Rio de Janeiro - UFRJ Prof. Roberto de Barros Emery Trindade Petróleo Brasileiro - Rio de Janeiro Prof. José Eugenio Leal Coordenador Setorial de Pós-Graduação do Centro Técnico Científico da PUC - Rio Rio de Janeiro, 31 de março de 2014. Todos os direitos reservados. É proibida a reprodução total ou parcial do trabalho sem autorização da universidade, do autor e do orientador. Rafaela Cristina Landeiro da Silva Graduou-se em Química Industrial pela Universidade Severino Sombra. Mestre em Engenharia de Materiais e Processos Químicos e Metalúrgicos pela PUC-Rio. PUC-Rio - Certificação Digital Nº 0921909/CA Ficha Catalográfica Silva, Rafaela Cristina Landeiro da Tratamento de efluentes contendo cianeto livre através dos sistemas: SO2/O2 ; SO2/H2O2 e H2O2 / Rafaela Cristina Landeiro da Silva ; orientador: Luiz Alberto Cesar Teixeira. – 2014. 169 f. : il. (color.) ; 30 cm Tese (doutorado)–Pontifícia Universidade Católica do Rio de Janeiro, Departamento de Engenharia de Materiais, 2014. Inclui bibliografia 1. Engenharia de materiais – Teses. 2. Cianeto livre. 3. Tratamento de efluentes. 4. Peróxido de hidrogênio. 5. Dióxido de enxofre. I. Teixeira, Luiz Alberto Cesar. II. Pontifícia Universidade Católica do Rio de Janeiro. Departamento de Engenharia de Materiais. IV. Título. CDD: 620.11 Agradecimentos Ao meu orientador, Luiz Teixeira, pela confiança e apoio para a realização deste trabalho. Ao Professor Roberto Carvalho, pelo incentivo e disponibilidade ao longo desses anos. PUC-Rio - Certificação Digital Nº 0921909/CA À PUC-Rio, ao CNPq e à Peróxidos do Brasil pelo apoio financeiro concedido durante o curso de doutorado. Aos professores e funcionários do DEMa que contribuíram direta ou indiretamente para a realização deste trabalho. Aos professores integrantes da Banca examinadora, pela contribuição crítica fundamental ao enriquecimento do trabalho. Aos técnicos do Departamento de Química, Rodrigo e Douglas pelo auxílio e disponibilidade para realização das análises de absorção atômica. À Rosana pela parceria no laboratório de tratamentos de efluentes, e aos amigos do DEMa pelas sugestões dadas ao longo do trabalho. A Deus, pela força concedida sempre e, principalmente, nos momentos mais difíceis, nos quais nunca me faltou. À minha família, em especial meus pais, Rosa Landeiro e Valter Pinheiro, por serem meu porto seguro. À minha avó, Maria Landeiro, da qual tenho muita saudade, por tudo que me ensinou, pelo exemplo de ser humano que foi, e pelo auxílio espiritual que me concede sempre. Por fim, agradeço ao meu marido Thiago, simplesmente pelo fato da sua existência em minha vida, por estar sempre caminhando ao meu lado, me apoiando e auxiliando incondicionalmente. Resumo Silva, Rafaela Cristina Landeiro; Teixeira, Luiz Alberto Cesar (Orientador). Tratamento de efluentes contendo cianeto livre através dos sistemas SO2/O2; SO2/H2O2 e H2O2. Rio de Janeiro, 2014. 169p. Tese de Doutorado - Departamento de Engenharia de Materiais, Pontifícia Universidade Católica do Rio de Janeiro, PUC-Rio. Cianetos têm sido vastamente utilizados como insumos em diversos tipos de indústrias incluindo: mineração, agricultura, plásticos, têxteis, corantes e farmacêutica. Os compostos de cianeto são potencialmente tóxicos a qualquer tipo de vida e podem estar presentes no ambiente sob várias formas. A presença de cianeto na água tem efeito significativo sobre a atividade biológica nos ecossistemas. Efluentes contendo cianeto devem ser tratados para reduzir a PUC-Rio - Certificação Digital Nº 0921909/CA concentração de cianeto total e cianeto livre a um nível que atenda as especificações da legislação vigente. Neste contexto, a oxidação química apresenta-se como um dos tratamentos principais utilizados pelas indústrias. Este trabalho teve como objetivo investigar a oxidação de cianeto livre através dos sistemas: SO2/O2, SO2/H2O2 e H2O2. Todos os sistemas em presença e ausência de catalisador de íons cobre. Para isso, foram empregadas soluções sintéticas de KCN com características de pH e concentrações similares às condições de um efluente industrial real. As variáveis avaliadas foram pH inicial da solução, razão molar dos oxidantes: [SO2 + O2]/[CN-], [SO2 + 2H2O2]/[CN-], [2H2O2]/[CN-] e razão molar [Cu2+]/[CN-]. Para soluções contendo concentração inicial de cianeto livre de 100 mg/L, foi possível alcançar 99% de oxidação em 2 minutos de reação para o sistema SO2/O2 com adição de cobre na razão molar [Cu2+] /[CN-] = 0,16, pH do meio reacional igual a 9 e razão molar [SO2+ O2]/[CN-] = 2. Está mesma eficiência na oxidação de cianeto livre foi atingida em 10 minutos para os sistemas SO2/H2O2 e H2O2, também com [Cu2+]/[CN-] = 0,16, pH do meio reacional igual a 9, razão molar [SO2 + 2H2O2]/[CN-] = 2 para o processo SO2/O2 e [2H2O2]/[CN-] = 2 para o processo H2O2. Palavras-chave Cianeto livre; tratamento de efluentes; peróxido de hidrogênio; dióxido de enxofre. Abstract Silva, Rafaela Cristina Landeiro; Teixeira, Luiz Alberto Cesar (Advisor). Treatment of effluents containing free cyanide through the systems: SO2/O2; SO2/H2O2 e H2O2. Rio de Janeiro, 2014. 169p. Doctor Thesis Departamento de Engenharia de Materiais, Pontifícia Universidade Católica do Rio de Janeiro, PUC-Rio. Cyanide has been widely used as an essential raw material in several industries including mining/metallurgy, agriculture, plastics, textile, paints and medicine. Cyanides and cyanides compounds in wastewater stream are regulated. The present work had the objective of studying the treatment of effluents containing free cyanide through the systems: H2O2, SO2/O2 e H2O2. All the systems in the presence and absence of copper catalyst ions. For that, it was employed synthetic PUC-Rio - Certificação Digital Nº 0921909/CA solutions of KCN with characteristics of pH and concentration similar to those of a real effluent. The evaluated variables were initial pH of the solution, molar ratio [Cu2+]/[CN-] and molar ratio [oxidant]/[CN-]. For solution containig an initial concentration of cyanide equal to 100 mg/L, it was possible to reach a removal efficiency of 99% in 2 minutes for SO2 systems in pH equal to 9, with a molar ratio of [Cu2+]/[CN-] = 0,16 and with a molar ratio [SO2 + O2]/[CN-] =2. Is as efficient in the oxidation of free cyanide was achieved in 10 minutes for SO2/H2O2 and H2O2 systems, also with molar ratio [Cu2+]/[CN-] = 0,16 in pH equal to 9 and molar ratio [SO2 + 2H2O2]/[CN-] = 2 for the SO2/O2 systems and molar ratio [2H2O2]/[CN-] for the H2O2 process. Keywords Free cyanide; effluents treatment; hydrogen peroxide, sulphur dioxide. PUC-Rio - Certificação Digital Nº 0921909/CA Sumário 1 Introdução 1.1 Panorama da utilização de cianeto 21 21 2 Revisão Bibliográfica 2.1 Cianeto 2.1.1 Aspectos toxicológicos 2.1.2 Legislação e limites 2.1.3 Incidentes com cianeto 2.1.4 Efluentes contendo cianeto 2.1.5 Química das soluções contendo cianeto 2.1.6 Compostos de cianeto no meio ambiente 2.1.6.1 Complexos ciano-metálicos 2.1.6.1.1 Complexos cianídricos de cobre 2.1.6.2 Precipitação 2.1.6.3 Adsorção 2.1.6.4 Formação de cianato 2.1.6.5 Formação de tiocianato 2.1.6.6 Volatização 2.1.6.7 Biodegradação 2.1.6.8 Hidrólise 2.2 Processos de tratamento de efluentes contendo cianeto 2.2.1 Tratamentos utilizados industrialmente 2.2.1.1 Oxidação pelo peróxido de hidrogênio ou ácido de Caro 2.2.1.2 Oxidação combinada H2O2/Cobre 2.2.1.3 Oxidação com dióxido de enxofre (SO2) /(O2) ar 2.2.1.4 Processos naturais de degradação do cianeto 2.2.2 Tratamentos avaliados em pesquisa 2.2.2.1 Processo combinado H2O2/SO2 2.2.3 Química das soluções contendo SO2 e espécies S(IV) 23 23 25 26 27 29 31 33 34 35 38 38 38 39 39 39 39 40 40 43 44 44 45 48 48 49 3 Materiais e Métodos 3.1 Solução sintética 3.2 Geração de SO2 3.3 Adição de ar (O2) 3.4 Adição de cobre 3.5 Adição de peróxido de hidrogênio 3.6 Arranjo experimental 3.7 Rotinas analíticas 3.7.1 Análise de cianeto 3.7.2 Análise de cobre 3.8.1 Planejamento fatorial 3.8.1.1 Processo H2O2:CN- 53 53 53 53 53 54 54 55 55 55 56 56 PUC-Rio - Certificação Digital Nº 0921909/CA 3.8.1.2 Processo SO2:O2:CN3.8.1.3 Processo SO2:H2O2:CN- 58 59 4 Resultados e Discussão 4.1 Análise estatística 4.1.1 Análise estatística da oxidação de cianeto livre através do sistema H2O2 4.1.2 Análise estatística da oxidação de cianeto livre através do sistema 69 SO2:O2 4.1.3 Análise estatística da oxidação de cianeto livre através do sistema SO2:H2O2 4.2 Avaliação físico-química da oxidação do cianeto livre por diferentes processos 4.2.1 Oxidação pelo processo H2O2:CN4.2.1.1 Efeito da adição de íons Cu2+ na oxidação de cianeto livre pelo peróxido de hidrogênio 4.2.1.2 Efeito do pH e da razão molar [2H2O2]/[CN-] na oxidação de 92 cianeto livre pelo peróxido de hidrogênio 4.2.1.3 Cinética da oxidação do cianeto livre pelo peróxido de hidrogênio 4.2.2 Oxidação pelo processo SO2:O2:CN4.2.2.1 Efeito da adição de íons Cu2+ na oxidação de cianeto livre pelo dióxido de enxofre e oxigênio 4.2.2.2 Efeito do pH e da razão molar [SO2 + 2O2]/[CN-] na oxidação de cianeto livre pelo dióxido de enxofre e oxigênio 4.2.2.3 Cinética da oxidação de cianeto livre pelo dióxido de enxofre e oxigênio 4.2.3 Oxidação pelo processo SO2:H2O2:CN4.2.3.1 Efeito da adição de íons Cu2+ na oxidação de cianeto livre pelo dióxido de enxofre e peróxido de hidrogênio 4.2.3.2 Efeito do pH e da razão molar [SO2 + 2H2O2]/[CN-] na oxidação de cianeto livre pelo dióxido de enxofre e peróxido de hidrogênio 4.2.3.3 Cinética da oxidação do cianeto livre pelo dióxido de enxofre e peróxido de hidrogênio 4.3 Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre 4.3.1 Comparação da concentração final do cobre dissolvido nos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre 4.3.2 Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre em ausência de íons Cu2+ 4.3.3 Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre em presença de 10 mg/L de íons Cu2+ 4.3.4 Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre em presença de 20 mg/L de íons Cu2+ 4.3.5 Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre em presença de 40 mg/L de íons Cu2+ 4.3.6 Comparação das equações de velocidades e constantes de velocidade para processos de oxidação de cianeto livre 5 Conclusões 61 61 61 71 80 89 90 90 96 99 106 107 113 117 123 123 129 131 137 137 139 143 148 150 153 155 PUC-Rio - Certificação Digital Nº 0921909/CA 6 Sugestões para trabalhos futuros 157 7 Referências Bibliográficas 158 8 Anexos 8.1 Teste F da análise estatística 8.2 Teste t da análise estatística 8.3 Dados experimentais da oxidação do cianeto livre para cada experimento 163 163 164 165 PUC-Rio - Certificação Digital Nº 0921909/CA Lista de Figuras Figura 1: Concentração de cianeto em vários materiais 24 Figura 2: Relação ente HCN e CN- com pH, 25 °C 32 Figura 3: Diagrama Eh-pH do sistema CN-H2O a 25ºC 33 Figura 4: Diagrama EH-pH para o siatema Cu-CN-H2O a 25ºC e atividade para todas as espécies consideradas de 1, considerando Cu(OH)2 como uma espécie estável e utilizando dados da Tabela 6 36 Figura 5: Diagrama EH-pH para o sistema Cu-CN-H2O a 25ºC e atividade para todas as espécies consideradas de 10-4, considerando Cu(OH)2 como uma espécie estável e utilizando dados da Tabela 6 37 Figura 6: Degradação natural do cianeto em bacias de rejeito 47 Figura 7: Diagrama Eh-pH para espécies metaestáveis do sistema SH2O a 25˚C 51 Figura 8: Esquema de montagem do reator utilizado nos ensaios de oxidação do cianeto. 55 Figura 9: Diagrama de Pareto para o processo H2O2:CN- 65 Figura 10.a: Gráfico da superfície de resposta da interação pH x [2H2O2]/[CN-] para o processo H2O2:CN-. a) [Cu2+]/[CN-] =0 66 Figura 10.b: Gráfico da superfície de resposta da interação pH x [2H2O2]/[CN-] para o processo H2O2:CN-.b) [Cu2+]/[CN-] = 0,16 67 Figura 11.a: Gráfico da superfície de resposta da interação [Cu2+]/[CN-] x pH para o processo H2O2:CN-. a) [2H2O2]/[CN-] = 1 68 Figura 11.b: Gráfico da superfície de resposta da interação [Cu2+]/[CN-] x pH para o processo H2O2:CN-. a) [2H2O2]/[CN-] = 2 69 Figura 12.a: Gráfico da superfície de resposta da interação [Cu2+]/[CN-] x [2H2O2]/[CN-] para o processo H2O2:CN-. a) pH = 9 70 Figura 12.b: Gráfico da superfície de resposta da interação [Cu2+]/[CN-] x [2H2O2]/[CN-] para o processo H2O2:CN-.b) pH = 10 71 Figura 13: Gráfico de Pareto para o processo SO2:O2:CN- 74 Figura 14.a: Gráfico da superfície de resposta para a interação pH x [SO2 + O2]/[CN-] para o processo SO2:O2:CN-. a) [Cu2+]/[CN-] =0 75 Figura 14.b: Gráfico da superfície de resposta para a interação pH x [SO2 + O2]/[CN-] para o processo SO2:O2:CN-.b) [Cu2+]/[CN-] = 0,16 76 PUC-Rio - Certificação Digital Nº 0921909/CA Figura 15.a: Gráfico da superfície de resposta para a interação [Cu2+]/[CN-] x pH para o processo SO2:O2:CN-.a) [SO2 + O2]/[CN-] = 1 77 Figura 15.b: Gráfico da superfície de resposta para a interação [Cu2+]/[CN-] x pH para o processo SO2:O2:CN-.b) [SO2 + O2]/[CN-] = 2 78 Figura 16.a: Gráfico da superfície de resposta para a interação [Cu2+]/[CN-] x [SO2 +O2]/[CN-] para o processo SO2:O2:CN-. a) pH = 9 79 Figura 16.b: Gráfico da superfície de resposta para a interação [Cu2+]/[CN-] x [SO2 +O2]/[CN-] para o processo SO2:O2:CN-. b) pH = 10 80 Figura 17: Diagrama de Pareto para o processo SO2:H2O2:CN- 83 Figura 18.a: Gráfico da superfície de resposta para a interação pH x [SO2 + 2H2O2]/[CN-] para o processo SO2:H2O2:CN-. a) [Cu2+]/[CN-] = 0 84 Figura 18.b: Gráfico da superfície de resposta para a interação pH x [SO2 + 2H2O2]/[CN-] para o processo SO2:H2O2:CN-.b) [Cu2+]/[CN-] = 0,16 85 Figura 19.a: Gráfico da superfície de resposta para a interação [Cu2+]/[CN-] x pH para o processo SO2:H2O2:CN-. a) [SO2 + 2H2O2]/[CN-] = 1 86 Figura 19.b: Gráfico da superfície de resposta para a interação [Cu2+]/[CN-] x pH para o processo SO2:H2O2:CN-.b) [SO2 + 2H2O2]/[CN-] = 2 87 Figura 20.a: Gráfico da superfície de resposta para a interação [Cu2+]/[CN-] x [SO2 + 2H2O2]/[CN-] para o processo SO2:H2O2:CN-. a) pH = 9 88 Figura 20.b: Gráfico da superfície de resposta para a interação [Cu2+]/[CN-] x [SO2 + 2H2O2]/[CN-] para o processo SO2:H2O2:CN-.b) pH = 10 89 Figura 21: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, [H2O2]/[CN-]= 1, pH = 9, T = 25°C 91 Figura 22: Efeito da adição de Cu2+ na taxa de oxidação inicial de CNno processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, [H2O2]/[CN-]= 1, pH = 9, T = 25°C 92 Figura 23: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, [2H2O2]0/[CN-]0= 1, pH = 10, T = 25°C 93 Figura 24: Efeito da adição de Cu2+ na taxa de oxidação inicial de CNno processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, [2H2O2]0/[CN-]0= 1, pH = 10, T = 25°C 93 2+ Figura 25: Efeito da adição de Cu na oxidação de cianeto livre no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, [2H2O2]0/[CN-]0= 2, pH = 9, T = 25°C 94 Figura 26: Efeito da adição de Cu2+ na taxa de oxidação inicial de CNno processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, [2H2O2]0/[CN-]0= 2, pH = 9, T = 25°C Figura 27: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, [2H2O2]0/[CN-]0= 2, pH = 10, T = 25°C PUC-Rio - Certificação Digital Nº 0921909/CA 2+ 94 95 - Figura 28: Efeito da adição de Cu na taxa de oxidação inicial de CN no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, [2H2O2]0/[CN-]0= 2, pH = 10, T = 25°C 96 Figura 29: Efeito do pH e da razão molar [2H2O2]0/[CN-]0 na oxidação de cianeto livre em ausência de íons Cu2+ no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 97 Figura 30: Efeito do pH e da razão molar [2H2O2]0/[CN-]0 na oxidação de cianeto livre com adição de 10 mg/L de íons Cu2+ no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 97 Figura 31: Efeito do pH e da razão molar [2H2O2]0/[CN-]0 na oxidação de cianeto livre com adição de 20 mg/L de íons Cu2+ no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 98 Figura 32: Efeito do pH e da razão molar [2H2O2]0/[CN-]0 na oxidação de cianeto livre com adição de 40 mg/L de íons Cu2+ no processo CN- : H2O2. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C. 98 - Figura 33: Oxidação de cianeto livre pelo processo H2O2:CN com adição de 20 mg/L de íons Cu2+. Condições experimentais: [CN-]0 = 500 mg/L, [2H2O2]0/[CN-]0= 1, pH = 9, T = 25°C. 99 Figura 34: Ordem aparente da reação (α) de oxidação do cianeto livre pelo peróxido de hidrogênio. Condições experimentais: pH = 9, adição de 20 mg/L de íons Cu2+, T = 25°C. 100 Figura 35: Ordem aparente da reação (β) de oxidação do cianeto livre pelo peróxido de hidrogênio. 102 Figura 36: Reação de oxidação de cianeto livre pelo peróxido de hidrogênio com adição de 20 mg/L de íons Cu2+. Condições experimentais: [CN-]0 = 100 mg/L, [2H2O2]0/[CN-]0= 2, pH = 9, T = 25°C 104 Figura 37: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : SO2 : O2. Condições experimentais: [CN-]0 = 100 mg/L, [SO2 + O2]0/[CN-]0=1, pH = 9; T = 25°C 107 Figura 38: Efeito da adição de Cu2+ na taxa de oxidação inicial de CNno processo CN- : SO2 : O2. Condições experimentais: [CN-]0 = 100 mg/L, [SO2 + O2]0/[CN-]0=1, pH = 9, T = 25°C 108 Figura 39: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : SO2 : O2. Condições experimentais: [CN-]0 = 100 mg/L, [SO2 + O2]0/[CN-]0=1 pH = 10, T = 25°C 109 Figura 40: Efeito da adição de Cu2+ na taxa de oxidação inicial de CNno processo CN- : SO2 : O2. Condições experimentais: [CN-]0 = 100 mg/L, [SO2 + O2]0/[CN-]0=1, pH = 10, T = 25°C 109 Figura 41: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : SO2 : O2. Condições experimentais: [CN-]0 = 100 mg/L, [SO2 + O2]0/[CN-]0=2, pH = 9, T = 25°C 110 PUC-Rio - Certificação Digital Nº 0921909/CA 2+ Figura 42: Efeito da adição de Cu na taxa de oxidação inicial de cianeto livre no processo CN- : SO2 : O2. Condições experimentais: [CN]0 = 100 mg/L, [SO2 + O2]0/[CN-]0=2, pH = 9, T = 25°C 111 Figura 43: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : SO2 : O2 Condições experimentais: [CN-]0 = 100 mg/L, [SO2 + O2]0/[CN-]0=2, pH = 10, T = 25°C 112 Figura 44: Efeito da adição de Cu2+ na velocidade inicial de oxidação cianeto livre no processo CN- : SO2 : O2. Condições experimentais: [CN]0 = 100 mg/L, [SO2 + O2]0/[CN-]0=2, pH = 10, T = 25°C 113 Figura 45: Efeito da pH e da relação molar [SO2 + O2]0 /[CN-]0 na oxidação de cianeto livre em ausência de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C. 114 Figura 46: Efeito da pH e da relação molar [SO2 + O2]0 /[CN-]0 na oxidação de cianeto livre com adição de 10 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 115 Figura 47: Efeito da pH e da relação molar [SO2 + O2]0 /[CN-]0 na oxidação de cianeto livre com adição de 20 mg/L Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 116 Figura 48: Efeito do pH e da relação molar [SO2 + O2]0 /[CN-]0 na oxidação de cianeto livre com adição de 40 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 117 Figura 49: Oxidação de cianeto livre pelo processo SO2:O2:CN- com adição de 20 mg/L de íons Cu2+. Condições experimentais: [CN-]0 = 500 mg/L, [SO2 + O2]0/[CN-]0= 1, pH = 9, T = 25°C 118 Figura 50: Ordem aparente da reação (a) de oxidação do cianeto livre pelo dióxido de enxofre e oxigênio. Condições experimentais: pH = 9, adição de 20 mg/L de íons Cu2+, T = 25°C 119 Figura 51: Ordem aparente da reação (b) de oxidação do cianeto livre pelo peróxido de hidrogênio. 120 Figura 52: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : H2O2 : SO2. Condições experimentais: [CN-]0 = 100 mg/L, relação molar [2H2O2 + SO2]0/[CN-]0 = 1, pH = 9, T = 25°C 124 Figura 53: Efeito da adição de Cu2+ na velocidade inicial de oxidação de cianeto livre no processo CN-:H2O2:SO2. Condições experimentais: [CN-]0 = 100 mg/L, relação molar [2H2O2+SO2]0/[CN-]0 = 1, pH = 9, T = 25°C 125 Figura 54: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : H2O2 : SO2. Condições experimentais: [CN-]0 = 100 mg/L, relação molar [2H2O2 + SO2]0/[CN-]0 = 1, pH = 10, T = 25°C 126 Figura 55: Efeito da adição de Cu2+ na velocidade inicial de oxidação de cianeto livre no processo CN- : H2O2 : SO2. Condições experimentais: [CN-]0 = 100 mg/L, relação molar [2H2O2 + SO2]0/[CN-]0 = 1, pH = 10, T = 25°C 126 Figura 56: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : H2O2 : SO2. Condições experimentais: [CN-]0 = 100 mg/L, relação molar [2H2O2 + SO2]0/[CN-]0 = 2, pH = 9, T = 25°C 127 Figura 57: Efeito da adição de Cu2+ na velocidade inicial de oxidação de cianeto livre no processo CN- : H2O2 : SO2. Condições experimentais: [CN-]0 = 100 mg/L, relação molar [2H2O2 + SO2]0/[CN-]0 = 2, pH = 9, T = 25°C 127 Figura 58: Efeito da adição de Cu2+ na oxidação de cianeto livre no processo CN- : H2O2 : SO2. Condições experimentais: [CN-]0 = 100 mg/L, relação molar [2H2O2 + SO2]0/[CN-]0 = 2, pH = 10, T = 25°C 128 PUC-Rio - Certificação Digital Nº 0921909/CA 2+ Figura 59: Efeito da adição de Cu na velocidade inicial de oxidação de cianeto livre no processo CN- : H2O2 : SO2. Condições experimentais: [CN-]0 = 100 mg/L, relação molar [2H2O2 + SO2]0/[CN-]0 = 2, pH = 10, T = 25°C 128 Figura 60: Efeito do pH e da relação molar [SO2 + 2H2O2]0 /[CN-]0 na oxidação de cianeto livre em ausência de Cu2+ na reação. Condições experimentais:[CN-]0 = 100 mg/L, T = 25°C 129 Figura 61: Efeito do pH e da relação molar [SO2 + 2H2O2]0 /[CN-]0 na oxidação de cianeto livre com adição de 10 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 130 Figura 62: Efeito do pH e da relação molar [SO2 + 2H2O2]0 /[CN-]0 na oxidação de cianeto livre com adição de 20 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 130 Figura 63: Efeito do pH e da relação molar [SO2 + 2H2O2]0 /[CN-]0 na oxidação de cianeto livre com adição de 40 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, T = 25°C 131 Figura 64: Oxidação de cianeto livre pelo processo SO2:H2O2:CN- com adição de 20 mg/L de íons Cu2+. Condições experimentais: [CN-]0 = 500 mg/L, [SO2 + 2H2O2]0/[CN-]0= 1, pH = 9, T = 25°C 132 Figura 65: Ordem aparente da reação (a) de oxidação do cianeto livre pelo dióxido de enxofre e peróxido de hidrogênio. Condições experimentais: pH = 9, adição de 20 mg/L de íons Cu2+, T = 25°C 133 Figura 66: Ordem aparente da reação (y) de oxidação do cianeto livre pelo dióxido de enxofre e peróxido de hidrogênio. 135 Figura 67: Ordem aparente da reação (z) de oxidação do cianeto livre pelo dióxido de enxofre e peróxido de hidrogênio. 136 PUC-Rio - Certificação Digital Nº 0921909/CA Figura 68: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre em ausência de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 1, pH = 9, T = 25°C 140 Figura 69: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre em ausência de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 1, pH = 10, T = 25°C 141 Figura 70: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre em ausência de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 2, pH = 9, T = 25°C 142 Figura 71: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre em ausência de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 2, pH = 10, T = 25°C 143 Figura 72: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 10 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 1, pH = 9, T = 25°C 145 Figura 73: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 10 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 1, pH = 10, T = 25°C 146 Figura 74: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 10 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 2, pH = 9, T = 25°C 147 Figura 75: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 10 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 2, pH = 10, T = 25°C 147 Figura 76: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 20 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 1, pH = 9, T = 25°C 148 Figura 77: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 20 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 1, pH = 10, T = 25°C 149 Figura 78: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 20 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 2, pH = 9, T = 25°C 149 PUC-Rio - Certificação Digital Nº 0921909/CA Figura 79: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 20 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 2, pH = 10, T = 25°C 150 Figura 80: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 40 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 1, pH = 9, T = 25°C 151 Figura 81: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 40 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 1, pH = 10, T = 25°C 151 Figura 82: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 40 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 2, pH = 9, T = 25°C 152 Figura 83: Comparação dos processos H2O2, SO2/O2 e SO2/H2O2 na oxidação de cianeto livre com adição de 40 mg/L de Cu2+ na reação. Condições experimentais: [CN-]0 = 100 mg/L, [Oxidante] 0/[CN-]0 = 2, pH = 10, T = 25°C 153 PUC-Rio - Certificação Digital Nº 0921909/CA Lista de Tabelas Tabela 1: Limites de concentração de cianeto total para descarte de efluentes 26 Tabela 2: Acidentes envolvendo contaminação por cianeto 28 Tabela 3: Cianocomplexos metálicos 29 Tabela 4: Processos e indústrias que geram efluentes contendo espécies cianídricas 30 Tabela 5: Constantes de estabilidade dos complexos cianometálicos 35 Tabela 6: Dados da energia livre de Gibbs para cobre e espécies de cianeto (J/mol) a 25ºC 36 Tabela 7: Métodos disponíveis para remoção ou destruição de cianeto e mecanismos envolvidos 42 Tabela 8: Níveis das variáveis independentes do plano fatorial 23 para o processo 2H2O2:CN- 57 Tabela 9: Condições Experimentais do plano fatorial 23 para o processo 2H2O2:CN- 58 Tabela 10: Níveis das variáveis independentes do plano fatorial 23 para o processo SO2:O2:CN- 58 Tabela 11: Condições Experimentais do plano fatorial 23 para o processo SO2:O2:CN- 59 Tabela 12: Níveis das variáveis independentes do plano fatorial 23 para o processo SO2:2H2O2:CN- 60 Tabela 13: Condições Experimentais do plano fatorial 23 para o processo SO2:2H2O2:CN- 60 Tabela 14: Condições experimentais adotadas em cada teste para o processo H2O2:CN- com as respectivas velocidades iniciais em mg/L.min 62 Tabela 15: Resultados da análise de variâncias para o processo H2O2:CN- 63 Tabela 16: Efeito de todas as variáveis e de suas interações na velocidade inicial e seus respectivos erros padrões para o processo H2O2:CN- 64 Tabela 17: Condições experimentais adotadas em cada teste para o processo SO2:O2:CN- com as respectivas velocidades iniciais em mg/L.min 72 Tabela 18: Resultados da análise de variâncias para o processo SO2:O2:CN- 73 Tabela 19: Efeito de todas as variáveis e de suas interações na velocidade inicial e seus respectivos erros padrões para o processo SO2:O2:CN- 74 PUC-Rio - Certificação Digital Nº 0921909/CA Tabela 20: Condições experimentais adotadas em cada teste para o processo SO2:H2O2:CN- com as respectivas velocidades iniciais em mg/L.min 81 Tabela 21: Resultados da análise de variâncias para o processo SO2:H2O2:CN- 81 Tabela 22: Efeito de todas as variáveis e de suas interações na velocidade inicial e seus respectivos erros padrões para o processo SO2:H2O2 82 Tabela 23: Oxidação do cianeto livre pelo peróxido de hidrogênio 90 Tabela 24: Valores calculados para ordem aparente da reação (α) e pseudo constante de velocidade aparente. Condições experimentais: pH = 9, adição de 20 mg/L de íons Cu2+, T = 25°C 101 Tabela 25: Valores calculados para ordem aparente da reação (β) e pseudo constante de velocidade aparente. 102 Tabela 26: Oxidação do cianeto livre pelo dióxido de carbono combinado com oxigênio 106 Tabela 27: Valores calculados para ordem aparente da reação (a) e pseudo constante de velocidade aparente. Condições experimentais: pH = 9, adição de 20 mg/L de íons Cu2+, T = 25°C 119 Tabela 28: Valores calculados para ordem aparente da reação (b) e pseudo constante de velocidade aparente. 121 Tabela 29: Oxidação do cianeto livre pelo dióxido de enxofre e peróxido de hidrogênio 123 Tabela 30: Valores calculados para ordem aparente da reação (x) e pseudo constante de velocidade aparente. Condições experimentais: pH = 9, adição de 20 mg/L de íons Cu2+, T = 25°C 134 Tabela 31: Valores calculados para ordem aparente da reação (y) e pseudo constante de velocidade aparente. Condições experimentais: pH = 9, adição de 20 mg/L de íons Cu2+, T = 25°C 135 Tabela 32: Valores calculados para ordem aparente da reação (z) e constante de velocidade aparente. 137 Tabela 33: Concentração de íons Cu2+ ao final de 60 minutos de reação. Processos com adição de 20 mg/L de íons Cu2+ 139 2+ Tabela 34: Concentração de íons Cu ao final de 60 minutos de reação. Processos com adição de 40 mg/L de íons Cu2+ 139 Tabela 35: Equação de velocidade e constante de velocidade em diferentes processos na oxidação de cianeto livre 154 Tabela A.1: Pontos de percentagem da distribuição F, 5% 163 Tabela A.2: Pontos de probabilidade da distribuição t com ʋ graus de liberdade 164 Tabela A.3: Concentração do cianeto livre versus tempo – Condições experimentais (Processo H2O2:CN-; pH=9; [2H2O2]/[CN-] =1, sem cobre) 165 PUC-Rio - Certificação Digital Nº 0921909/CA Tabela A.4: Concentração do cianeto livre versus tempo – Condições experimentais (Processo H2O2:CN-; pH=9; [2H2O2]/[CN-] =1) 165 Tabela A.5: Concentração do cianeto livre versus tempo – Condições experimentais (Processo H2O2:CN-; pH=10; [2H2O2]/[CN-] =1) 165 Tabela A.6: Concentração do cianeto livre versus tempo – Condições experimentais (Processo H2O2:CN-; pH=9; [2H2O2]/[CN-] =2) 166 Tabela A.7: Concentração do cianeto livre versus tempo – Condições experimentais (Processo H2O2:CN-; pH=10; [2H2O2]/[CN-] =2) 166 Tabela A.8: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:O2:CN-; pH=9; [SO2 + O2]/[CN-] =1) 166 Tabela A.9: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:O2:CN-; pH=10; [SO2 + O2]/[CN-] =1) 167 Tabela A.10: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:O2:CN-; pH=9; [SO2 + O2]/[CN-] =2) 167 Tabela A.11: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:O2:CN-; pH=10; [SO2 + O2]/[CN-] =2) 167 Tabela A.12: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:H2O2:CN-; pH=9; [SO2 + 2H2O2]/[CN-] =1) 168 Tabela A.13: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:H2O2:CN-; pH=10; [SO2 +2 H2O2]/[CN-] =1) 168 Tabela A.14: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:H2O2:CN-; pH=9; [SO2 +2 H2O2]/[CN-] =2) 168 Tabela A.15: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:H2O2:CN-; pH=10; [SO2 + 2H2O2]/[CN-] =2) 169 Tabela A.16: Concentração do cianeto livre versus tempo – Condições experimentais (Processo H2O2:CN-; pH=9; [2H2O2]/[CN-] =1, adição de 20mg/L de íons Cu2+) 169 Tabela A.17: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:O2:CN-; pH=9; [SO2 + O2]/[CN-] =1, adição de 20mg/L de íons Cu2+) 169 PUC-Rio - Certificação Digital Nº 0921909/CA Tabela A.18: Concentração do cianeto livre versus tempo – Condições experimentais (Processo SO2:H2O2:CN-; pH=9; [SO2 + 2H2O2]/[CN-] =1, adição de 20mg/L de íons Cu2+) 169
Baixar