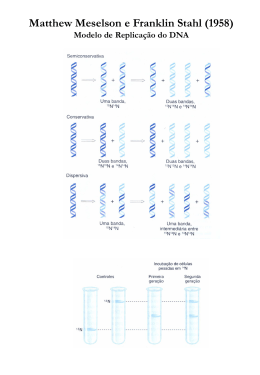
Pós-Graduação em Genética Mutagênese e Instabilidade Genética Disciplina: Genética Humana Molecular Docente responsável: Profa. Dra. Ana Elizabete Silva Dra. Fernanda da Silva Manoel Caetano Pós-doutoranda do Programa de Pós-Graduação em Genética MUTAÇÃO Qualquer mudança na sequência de nucleotídeos Células somáticas: Mutação somática Células germinativas: Mutação herdável Espontâneas: Ocorrência natural Erros na replicação: pareamento errôneo durante a síntese do DNA levando à substituição de bases - mudança tautomérica, transições, transversões, mudança de matriz de leitura, deleções e duplicações Lesões espontâneas - desaminação; depurinação; dano oxidativo Induzidas: Agentes mutagênicos Agentes físicos Agentes químicos Agentes biológicos Mutações espontâneas • Erros na replicação do DNA: – Cada uma das bases no DNA pode se apresentar como tautômeros (isômeros que diferem nas posições e nas ligações entre seus átomos – forma ceto de cada base está normalmente presente no DNA Mutações espontâneas • Erros na replicação do DNA: – Formas imino e enol das bases são raras – Mudança tautomérica: pareamentos errados que resultam da mudança de um tautômero para outro Mutações espontâneas • Erros na replicação do DNA: – Mutação por mudança tautomérica Mutações espontâneas • Erros na replicação do DNA Mutações espontâneas • Erros na replicação do DNA Mutação frameshift Mutações espontâneas • Erros na replicação do DNA – Deleções e duplicações ocorrem geralmente em sequências repetidas – Grandes duplicações geram múltiplas cópias de genes – Grandes deleções removem genes do genoma Mutações espontâneas • Lesões espontâneas Interrupção da ligação glicosídica entre a base e o açúcar e perda de uma G ou A Mutações espontâneas • Lesões espontâneas – Dano oxidativo Transversão G T Mutações induzidas Agentes Mutagênicos Agentes Mutagênicos MUTÁGENOS FISICOS Radiações ionizantes: raios X, radiações alfa, beta e gama Mutações cromossômicas (deleções e translocações) Radiações não-ionizantes: luz UV Formação de dímeros de pirimidina Agentes Mutagênicos MUTÁGENOS QUÍMICOS Ácido nitroso: desaminação de A e C Incorporação de bases errôneas durante a replicação Agentes intercalantes : acridina orange, brometo de etídio... Intercalam entre 2 pb dando origem à inserções ou deleções de 1 pb Análogos de base: 5-BU, 2-AP Substituição de bases provocando transições Agentes alquilantes: EMS, NG Adição de grupos etil ou metil às bases Agentes Mutagênicos MUTÁGENOS BIOLÓGICOS Vírus: HPV, Hep. B Transposons Alteram as sequências do material genético do hospedeiro HPV HBV Genes de controle do ciclo celular AGENTES MUTAGÊNICOS CARCINÓGENOS Divisão celular controlada Divisão celular descontrolada CÂNCER Sociedade moderna depende do uso extensivo de químicos Indústria e agricultura Novas substâncias químicas são produzidas a cada ano Mutagenicidade e carcinogenicidade devem ser testadas Teste de Ames para mutagenicidade • 1970: Bruce Ames forte correlação entre a habilidade de compostos causar câncer e sua habilidade para causar mutações – medida das taxas de mutação em sistemas bacterianos seria eficiente para avaliar a mutagenicidade de compostos – nem todos os carcinógenos sozinhos são mutagênicos, porém alguns metabólitos de carcinógenos produzidos no corpo por reações enzimáticas no fígado são agentes mutagênicos: tais reações enzimáticas não aconteceriam em bactérias Teste de Ames para mutagenicidade • método rápido, sensível e barato • utilizado para identificar químicos que possam ser carcinogênicos http://mbioscience.com/ames-test.html Fontes de danos no DNA Falhas em algumas destas vias INSTABILIDADE GENÔMICA Sancar et al., 2004 LESÕES NO DNA E MECANISMOS DE REPARO Reparo por Excisão de Base – Base Excision Repair (BER) • Depois da leitura de prova (DNA proofreading) pela DNA polimerase, é o mecanismo de reparo mais importante para a remoção de bases danificadas ou incorretas. • Sistema de reparo que depende da complementariedade da fita molde. Base Excision Repair (BER) http://www.nature.com/emm/journal/v46/n7/fig_tab/emm201442f3.html Reparo por Excisão de Nucleotídeo – Nucleotide Excision Repair (NER) • Principal sistema de reparo para a remoção de lesões volumosas no DNA formadas pela exposição à radiação ou químicos • Reparo por excisão de nucleotídeo acoplado à transcrição (TC-NER): repara regiões transcritas de DNA e é ativado por complexos de transcrição paralisados • Reparo genômico global (GGR): corrige lesões em qualquer lugar do genoma e é ativado por forquilhas de replicação paralisadas Lans et al. Epigenetics & Chromatin 2012 5:4 doi:10.1186/1756-8935-5-4 Nucleotide Excision Repair (NER) Reparo de mal pareamento – Mismatch repair )MMR) • Principal via que corrige erros remanescentes da replicação • Reduz a taxa de erro para 10-9 : reconhece e repara bases mal pareadas e pequenos loops causados por inserção e deleção de nucleotídeos durante a replicação • 3 passos: – reconhecimento dos pares de base mal pareados – determinação de qual base do par está errada – excisão da base incorreta e síntese de nova base E. coli http://gizmodo.com/dna-repair-earned-the-nobel-prize-in-chemistry-and-her-1735347676 Junção de extremidades não-homólogas – Nonhomologous end joining (NHEJ) • Sistema de reparo propenso a erro • Ativado quando fitas não danificadas ou cromátidesirmãs não estão presentes Gent and Burg, 2007 Recombinação homóloga – Homologous Recombination (HR) Mecanismo livre de erro Ativado quando DSBs ocorrem após a replicação de uma região cromossômica de uma célula em divisão http://mpmp.huji.ac.il/maps/dsbRecomb.html DOENÇAS HUMANAS HEREDITÁRIAS COM DEFEITOS NO REPARO DO DNA Xeroderma Pigmentoso Síndrome de Cockaine Tricotiodistrofia Anemia de Fanconi Ataxia telangiectasia Síndrome de Bloom defeitos nos mecanismos de reparo e replicação do DNA freqüência aberrações cromossômicas incidência câncer XERODERMA PIGMENTOSUM (XP) • indivíduos extremamente sensíveis à luz do sol • risco elevado de desenvolver câncer de pele • deficiência de reparo de dano no DNA induzido por UV (dímeros de T) - NER • resulta de defeitos de qualquer um de 8 genes diferentes (XPA, XPB, XPC, XPD XPE, XPF, XPG e XPV) • ~30% dos indivíduos XP desenvolvem anormalidades neurológicas progressivas SÍNDROME DE COCKAYNE (CS) • defeitos nos genes CSA e CSB (TCR-NER) • indivíduos com CS exibem sensibilidade à luz UV (sem risco para câncer de pele), retardo do crescimento e das habilidades mentais e envelhecimento precoce TRICOTIODISTROFIA • defeitos nos genes TTDA, XPB, XPD (TCR-NER) • indivíduos exibem baixa estatura, cabelos frágeis e pele escamosa, sensibilidade à luz UV, distúrbios neurológicos e retardo mental ANEMIA DE FANCONI (FA) • • • • • • • células dos indivíduos com FA exibem defeitos na remoção de ligações cruzadas inter-cadeia no DNA (inter-stand cross-links) formadas pelo antibiótico mitomicina C, por ex. envolve 8 genes (FANCA-FANCH) em 5 cromossomos diferentes início dos sintomas: 5-10 anos mais frequente em homens (2:1) baixa estatura hiperpigmentação da pele (manchas “café com leite” ausência do polegar ou do rádio, hipogonadismo, distúrbios renais, anomalias oculares, microcefalia, deficiência mental ATAXIA TELANGECTASIA (AT) • células de pacientes com AT exibem sensibilidade anormal à radiação ionizante • ataxia cerebelar (12-14 meses); disfunção neuromotora • telangiectasia olhos e pele (3 e 5 anos) • retardo de crescimento (70%) • incidência neoplasias (linfoma e leucemia linfóide) e imunodeficiências • incidência: 1/40.000 • risco câncer de mama (heterozigotos AT) • células AT: rearranjos espontâneos dos cromossomos 7 e 14 ATAXIA TELANGECTASIA (AT) • mutações no gene ATM (11q22-23) http://www.nature.com/nrg/journal/v2/n3/fig_tab/nrg0301_196a_F2.html SÍNDROME DE BLOOM (SB) • peso ao nascimento • retardo de crescimento pré e pós-natal • telangiectasias e fotossensibilidade (borboleta) • cabeça alongada, microcefalia, inteligência normal • imunodeficiência: infecções (respiratórias e gastrointestinais) SÍNDROME DE BLOOM (SB) • Incidência: 1/58.000 judeus (Ashkenazi) • Cromossomos em figuras quadrirradiais • mutações no gene BLM (15q26.1) • DNA helicase ( RecQ) papel na replicação e reparo do DNA Risco maior de câncer: carcinomas, Leucemias e linfomas Por quê indivíduos com algumas destas doenças hereditárias com defeitos no reparo do DNA apresentam risco elevado de desenvolver alguns tipos de câncer Instabilidade Genética – uma característica evolutiva do câncer • Formas de instabilidade genética em câncer – instabilidade cromossômica (aberrações numéricas e estruturais) – instabilidade de microssatélite (expansão ou contração de repetições de oligonucleotídeos em sequências de microssatélite) – frequência aumentada de mutações de pares de base Formas de instabilidade genética em cânceres hereditários Mutações em genes de reparo do DNA Fornece suporte para a “hipótese do mutador” A instabilidade genética está presente em lesões pré-cancerosas e direciona o desenvolvimento do tumor Por aumentar a taxa de mutação espontânea Instabilidade genética em leões précancerosas Mutações em genes “guardiões” (caretaker genes) Genes que funcionam primariamente para manter a estabilidade genômica (TP53, ATM) TP53 e ATM - Resposta aos danos no DNA http://clincancerres.aacrjournals.org/content/14/13/4032/F1.expansion.html CÂNCERES HEREDITÁRIOS Mutações na linhagem germinativa tendo como alvo genes de reparo estão presentes em todas células do corpo do paciente Um único evento (perda do alelo selvagem remanescente) levaria à instabilidade genômica e direcionaria o desenvolvimento do tumor (hipótese do mutador) http://sphweb.bumc.bu.edu/otlt/MPH-Modules/PH/PH709_Cancer/PH709_Cancer4.html DNA DAMAGE RESPONSE - DDR • DDR pode sofrer regulação pós-transcricional por miRNAs • miRNAs podem reduzir direta ou indiretamente a expressão de genes de resposta aos danos no DNA http://www.nature.com/ncb/journal/v11/n3/full/ncb0309-228.html Biogênese de miRNA Liu and Lu, 2012 miRNAs na DDR • Defeitos na DDR e repressão global de miRNA são atualmente consideradas características de muitos tipos de câncer humano • Várias proteínas cruciais da via DDR são reguladas por miRNAs • miRNA regulados pela DDR e miRNAs que regulam os genes da DDR estão envolvidos na iniciação e progressão da tumorigênese • podem fornecer uma nova visão para a sensibilidade ou resistência das células cancerosas às drogas genotóxicas e possivelmente levar ao desenvolvimento de novas estratégias terapêuticas Han et al., 2012 2015 Nobel Prize in Chemistry for Understanding DNA Repair Tomas Lindahl Francis Crick Institute and Clare Hall Laboratory, Hertfordshire, UK (via BER) Paul Modrich Howard Hughes Medical Institute and Duke University School of Medicine, Durham, NC, USA (via MMR) Aziz Sancar University of North Carolina, Chapel Hill, NC, USA (via NER) “for mechanistic studies of DNA repair"
Download