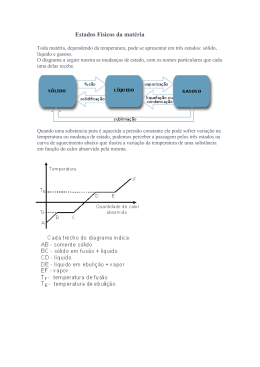
Capítulo 11: Forças intermoleculares, líquidos e sólidos Bianca Colicchio (14286) Lara Midori Silva Takano (14302) Prof. Dr. Élcio Rogério Barrak Tópicos abordados: • Forças intermoleculares de gases, líquidos e sólidos; • Algumas propriedades dos líquidos; • Mudanças de Fase; • Pressão de vapor; • Diagrama de fases; • Estruturas dos sólidos Forças íon-dipolo: • Entre íon e carga parcial em certo lado de uma molécula polar; • A magnitude do dipolo aumenta conforme a carga do íon; • Importantes em soluções de substâncias iônicas em líquidos polares; Forças dipolo-dipolo: • Atração entre o lado positivo de uma molécula polar e o lado negativo de outra; • Para moléculas de massas e tamanhos aproximadamente iguais, a força das atrações intermoleculares aumenta com o aumento da polaridade. Forças de dispersão de London: • Deve existir algum tipo de interação atrativa porque gases apolares podem ser liquefeitos; • Ocorrem entre todas as moléculas (polares ou apolares); • Tendem a aumentar em intensidade com o aumento da massa molecular. Ligação de hidrogênio: • Entre átomo de hidrogênio em ligação polar e um íon ou átomo eletronegativo; • Geralmente ligado a um átomo de F, O ou N em outra molécula Observações gerais: • A intensidade das forças aumenta com o aumento da massa molecular; • A intensidade das forças depende das formas moleculares: - sem ramificações > com ramificações • Forças de dipolo-dipolo, dispersão de London e ligação de hidrogênio são chamadas forças de Van der Waals. Algumas propriedades dos líquidos: • Viscosidade; • Tensão superficial; • Ação capilar; Mudanças de fase: • Calor de fusão; • Calor de vaporização; • Calor de sublimação; Curva de aquecimento: • Temperatura crítica: é a temperatura acima da qual uma substância pura não pode existir em fase líquida; • Pressão crítica: é a pressão necessária para levar à liquefação na temperatura crítica. Pressão de vapor: • Quando a velocidade de condensação iguala-se à velocidade de evaporação, o sistema atinge o equilíbrio termodinâmico; Pressão de vapor: • É a pressão que o vapor exerce quando em equilíbrio com o líquido correspondente; • Quanto menores as forças atrativas, maior será a pressão de vapor; • Líquidos que evaporam rapidamente são conhecidos como voláteis; Pressão de vapor x temperatura: • O aumento da temperatura provocará o aumento da pressão de vapor de um líquido ou de um sólido; Pressão de vapor e ponto de ebulição: • Um líquido entra em ebulição quando sua pressão de vapor for igual à pressão atmosférica; • Quanto maior a altitude, menor a pressão e menor será o ponto de ebulição. Diagrama de fases: • Resumo das condições de equilíbrio entre os diferentes estados da matéria; • Permite a determinação da fase de uma substância estável em qualquer temperatura e pressão. Estruturas dos sólidos: • Tipos de sólidos: - Amorfos; - Cristalinos; • Célula unitária: unidade de um sólido que se repete nas três direções; • Rede cristalina: rede tridimensional de pontos; Tipos de células unitárias: • Cúbica; - Cúbica simples - Cúbica de corpo centrado - Cúbica de face centrada • • • • • • Tetragonal; Ortorrômbica; Hexagonal; Trigonal; Monoclínico; Triclínico. Ligações nos sólidos: • Sólidos moleculares: - macios; - baixo ponto de fusão; - água / sacarose. • Sólidos covalentes: - muito duros; - alto ponto de fusão; - diamante / quartzo. • Sólidos iônicos: - duros e quebradiços; - alto ponto de fusão; - NaCl / CaO. • Sólidos metálicos: - podem ser de macios a muito duros; - baixos a altos pontos de fusão. Referências Bibliográficas: • “Química: A Ciência Central”. Brown, Lemay, Bursten. São Paulo: Pearson, 2005. (9ª edição) • “Princípios de Química”. Masterton, Slowinski, Stanitski. • http://www.qmc.ufsc.br • pt.wikipedia.org/wiki/Estrutura_cristalina
Download