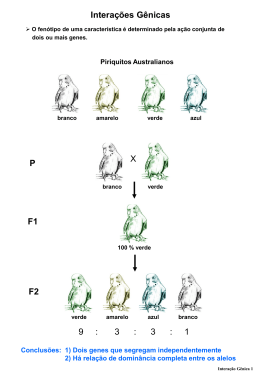
TRATAMENTO DE DOENÇAS GENÉTICAS TERAPIA GÊNICA Aconselhamento Genético Profa. Dra. Ana Elizabete Silva TRATAMENTO DE DOENÇAS GENÉTICAS Na maioria das vezes o tratamento das doenças genéticas é somente paliativo, embora frequentemente melhore a qualidade de vida dos pacientes amenizando os sintomas ao invés de agir na causa primária: o gene ESTRATÉGIAS DE TRATAMENTO DOENÇAS MONOGÊNICAS -Tratamento se baseia na reposição da proteína deficiente → melhora do funcionamento ou minimizando as consequências de sua deficiência -efetivo em 12% dos distúrbios DOENÇAS COMPLEXAS – MULTIFATORIAIS -se o fator ambiental é conhecido: oportunidade efetiva de intervenção → modificação ou não exposição ao fator ambiental -tratamento cirúrgico ou médico Quanto mais precoce o diagnóstico e instituído um tratamento → mais favorável será a evolução dos pacientes. TRATAMENTO AO NÍVEL DO FENÓTIPO AFETADO Transplante de órgão ADA e Talassemia: Medula óssea Ativação de um gene dormente Talassemia Beta: Gene cadeia da hemoglobina Fornecimento da proteína Hemofilia B: fator IX de coagulação.Diabetes: insulina Evitar o agente danoso Xeroderma pigmentosum: luz solar Remoção do produto tóxico acumulado Fenilcetonúria: dieta baixa de fenilalanina; D. Wilson: acúmulo de cobre da DOENÇAS MONOGÊNICAS COM TERAPIA EFETIVA Hiperplasia adrenal congênita: reposição hormonal Fenilcetonúria: restrição dietética de fenilalanina Hemofilia: reposição do fator Imunodeficiência combinada grave: transplante de medula Cistinúria: ingestão de líquidos: D-penicilina Agamaglobulinemia: reposição de imunoglobulinas Acidúria metilmalônica: vitamina B12 Doença policística adulta: transplante renal DOENÇAS MULTIFATORIAIS COM TERAPIAS EFETIVAS Fenda labial e palatina: cirurgia Estenose pilórica: cirurgia Cardiopatia congênita: cirurgia e medicação Hidrocefalia: cirurgia e medicação Hipertensão: medicação Úlcera péptica: medicação e cirurgia Epilepsia: medicação CONSEQUÊNCIAS DO TRATAMENTO DAS DOENÇAS GENÉTICAS Necessidade de uma avaliação a longo prazo: o tratamento aparentemente bem sucedido pode demonstrar-se imperfeito 1. Após longa observação apresenta inadequações: Ex. PKU Crianças bem-tratadas→ escapam de RM → QI normal Manifestam distúrbios de aprendizagem e comportamento → prejuízo no desempenho acadêmico CONSEQUÊNCIAS DO TRATAMENTO DAS DOENÇAS GENÉTICAS 2.Tratamento bem-sucedido de mudanças patológicas em um órgão → podem surgir problemas inesperados em tecidos, antes não observados (pacientes não sobreviviam tempo suficiente). Ex.: Galactosemia galactose-1-fosfato GALT UDPG Quadro clínico: Criança tratada: Problemas gastrintestinais Problemas de aprendizagem Cirrose hepática Mulheres desenvolvem insuficiência ovariana → toxidez continuada de galactose Catarata RM grave CONSEQUÊNCIAS DO TRATAMENTO DAS DOENÇAS GENÉTICAS 2. Outros exemplos: Cistinose: acúmulo de cistina nos lisossomos → insuficiência renal → pacientes com transplante renal após envelhecimento → desenvolvem hipotireoidismo, diabetes e anomalias neurológicas Retinoblastoma: tumor de retina → pacientes correm o risco de desenvolver outras malignidades independentes após a primeira década: osteossarcoma CONSEQUÊNCIAS DO TRATAMENTO DAS DOENÇAS GENÉTICAS 3. Efeitos colaterais a longo prazo: Exemplos: Hemofilia: infusão do fator de coagulação → formação de anticorpos contra a proteína Talassemia: transfusão de sangue → sobrecarga de ferro ESTRATÉGIAS DE TRATAMENTO TRATAMENTO DAS DOENÇAS METABÓLICAS Desvio Metabólico: Distúrbios do ciclo da uréia -conversão da amônia em uréia -defeito enzimático → hiperamonemia -benzoato de sódio → ligação da amônia com glicina → hipurato Inibição: Hipercolesterolemia Familiar Lovastatina: redução 40 a 60% nos níveis de LDL-colesterol do plasma nos heterozigotos TRATAMENTO NO NÍVEL DA PROTEÍNA TRATAMENTO POR MODIFICAÇÃO DO GENOMA OU SUA EXPRESSÃO TRANSPLANTE DE MEDULA ÓSSEA: DOENÇAS DE ARMAZENAMENTO LISOSSÔMICO Terapia Gênica Envolve diversas tecnologias que têm em comum, um novo conceito terapêutico a introdução de material genético para atuar na causa fundamental da doença : o gene, fragmento gênico ou oligonucleotídeos Descreve qualquer processo destinado a tratar ou aliviar doenças pela modificação genética das células do paciente. PROPÓSITOS DA TERAPIA GÊNICA Compensação: gene mutante com perda de função Substituição: gene mutante dominante (difícil) alternativa: degradação do mRNA mutante (ribozimas ou RNA de interferência) Efeito farmacológico: contrabalancear os efeitos de um gene mutante ou compensar a patogenia da doença, como no câncer FORMAS POTENCIAIS DE TERAPIA GÊNICA Terapia gênica germinativa Terapia gênica somática TERAPIA GÊNICA DE CÉLULAS SOMÁTICAS Terapia ex vivo: as células do paciente são retiradas e manipuladas fora do corpo Terapia in vivo: as células são tratadas dentro do corpo 1. Inserção de um gene em um vetor 2. Contato Vetor / Célula 3. Entrada e transporte do gene até o núcleo da célula 4. Transcrição do RNAm a partir do gene 5. Tradução do RNAm em proteína 6. Secreção, fixação na membrana ou expressão citoplasmática da proteína PROCEDIMENTO BÁSICO PARA TERAPIA GÊNICA Doença apropriada Estratégia de transferência: ex vivo ou in vivo Células alvo Vetor CÉLULAS ALVO Características: acessíveis, tempo de vida longo no corpo, alta taxa de proliferação Tipos de células alvo: Células tronco (medula óssea- cordão umbilical) linfócitos fibroblastos de pele células musculares (mioblastos) células vasculares endoteliais hepatócitos Técnicas de introdução de genes em células de mamíferos: A- Técnicas que utilizam métodos físicos ou químicos: baixa eficácia e transitório microinjeção precipitado de fosfato de cálcio eletroporação (choque elétrico) lipossomos biobalística (gene gun) precipitado c/DNA- endocitose (cultura celular – ex vivo) Microinjeção: núcleo da célula (terapia ex vivo ou in vivo- embrião) Eletroporação: choque elétrico→poros (morte celular) vesícula m. lipídica Bombardeio partículas de ouro: bomba de hélio (morte celular) Técnicas de introdução de genes em células de mamíferos: B Técnicas que utilizam vetores biológicos: retrovírus Adenovírus Adenovírus associado-AAV (parvovírus) Lentivírus (retrovírus → cels. não dividem) Herpes vírus (invadir neurônios) Cromossomo artificial CROMOSSOMO HUMANO ARTIFICIAL •5-10 Mb •DNA telomérico humano •DNA centromérico •DNA genômico •Introduzidos em células em cultivo (lipofectina) RETROVÍRUS Retrovírus (vírus de RNA) são os vetores ideais para a transferência de genes em células humanas: são capazes de infectar quase 100% das células-alvo em divisão→ integra no genoma hospedeiro carregam fragmentos relativamente grandes de DNA (8kb) Desvatagem: infectam somente células em divisão Gag: proteína cápsula interna Env: transcriptase reversa e integrase Pol: envelope glicoproteína 1. DNA Humano 2. Célula reparada por terapia gênica Terapia Gênica A inserção casual do DNA no genoma das células hospedeiras pode : inativar um gene importante: morte celular ativar um oncogene: alterar o padrão normal de controle e divisão celular causar mutação OUTROS VETORES VIRAIS PARVOVÍRUS: vantagem de integração estável ao DNA (ou epissomo); células com/sem divisão; nenhuma associação conhecida com doença humana: Desvantagem: inserção de DNA de cerca de 5kb HERPES VÍRUS desativado: capacidade de invadir neurônios. Desvantagem: não se integram aos cromossomos: inviabiliza expressão a longo prazo http://www.eurordis.org/article.php3?id_article=1006 Pré-Requisitos : Terapia Gênica escolher a doença apropriada a ser tratada identificar e clonar o gene e suas regiões reguladoras assegurar que prejudiciais o gene inserido não tenha efeitos determinar as células-alvo certas que tenham duração de vida adequada verificar se a técnica é segura e eficiente para a introdução do gene nas células restringir a transferência do gene às células alvo somáticas documentar e divulgar os resultados obtidos Classes de Doenças Passíveis de Terapia Gênica Doenças Hereditárias (monogênicas) Neoplasias Doenças infecciosas (AIDS) Outras Doenças: doença arterial coronária; artrite; doença renal, etc Cerca de 650 protocolos aprovados Algumas tentativas de terapia gênica : Deficiência da enzima desaminase de adenosina (ADA) Imunodeficiência combinada severa ligada ao X (XSCID) Fibrose Cística Hemofília DMD Hipercolesterolemia Familial: LDLR (receptor de lipoproteína de baixa densidade) Câncer AIDS Deficiência da Desaminase de Adenosina - (ADA) Doença imunológica rara: debilitação do sistema imune (imunodeficiência) Enzima ADA: via purinas (tóxica) linfócitos T (células-alvo) são muito acessÍveis grande variação no nível de expressão do gene ADA entre indivíduos normais o primeiro protocolo aprovado para terapia gênica foi para a correção da deficiência da ADA. 1990: Drs. Anderson e Blease (Ashanti De Silva) ADA o linfócitos T foram coletados e expandidos em cultura ex vivo infectadas com retrovírus recombinante os linfócitos foram injetados nos pacientes expressão do gene ADA detectada por 12 anos nos linfócitos periféricos transferência do gene não foi eficiente: receberam PEG-ADA DEFICIÊNCIA DA DESAMINASE DE ADENOSINA - ADA NOVA TÉCNICA: gene ADA transferido para células tronco: sangue do cordão umbilical 10% dos linfócitos T circulantes carregavam o gene normal tratamento com enzima ADA exógena (PEG-ADA) foi removida progressivamente Células T expressando ADA significantemente IMUNODEFICIÊNCIA COMBINADA SEVERA LIGADA AO X - XSCID Devido mutação do gene IL2RG: codifica a cadeia do receptor IL-2 Pacientes faltam células T e células B prejudicadas França: 10 crianças selecionadas para terapia gênica: células da medula óssea retrovírus 9/10 crianças apresentaram células T com o gene transduzido Duas crianças desenvolveram leucêmia de células T ~ 3 anos após a terapia inserção do retrovírus próximo ao promotor do oncogene LMO2 (fator de crescimento) FIBROSE CÍSTICA gene mutante: CFTR - 7q31-32 (AR) proteína reguladora de condutância transmembrana: transporte de Cldiminuído e do Na+ aumentado Fibrose Cística vetor adenoviral: infecta os pulmões, penetra em células que não estão em divisão sem integrar no seu DNA, permitindo que estas expressem o DNA viral, introduzido pelo nariz com um spray desvantagem: inflamação com ataque imune que neutraliza as células contendo gene adenoviral; efeito da terapia de vida curta, cerca de 6 semanas TERAPIA GÊNICA DA HEMOFILIA Mutação no gene do fator VIII de coagulação afeta 1:5000 homens (recessiva ligada ao X) Sintomas: sangramento espontâneo nas juntas, nos tecidos moles e órgãos vitais Tratamento: injeções regulares de fator VIII TERAPIA GÊNICA DA HEMOFILIA 6 pacientes submetidos à terapia gênica Procedimento: extração de células da pele (fibroblastos) inserção do gene normal em plasmídeo (não provocam rejeição pelo organismo) inseridos nos fibroblastos por choque elétrico clonagem dos fibroblastos pacientes receberam implantes dos fibroblastos no abdomem, após pequenas incisões aumento de 1 a 4% do fator VIII (melhora qualidade de vida dos pacientes) benefícios foram temporários: apenas 10 meses VÍTIMA DE TERAPIA GÊNICA Universidade de Pensilvania:rapaz de 18 anos faleceu durante sua participação em uma triagem de TERAPIA GÊNICA Doença: deficiência de ornitina transcarbamilase (OTC): doença genética ligada ao X distúrbio do ciclo da uréia (fígado) causa níveis impróprios de amônia no sangue Vetor adenoviral (alta dose- 38 trilhões de adenovírus) injeção no fígado altos níveis de IL-6 consequências sistêmicas síndrome de resposta inflamatória sistêmica letal TERAPIA GÊNICA DO CÂNCER Cerca de 420 protocolos: 2/3 dos protocolos de terapia gênica em estudo envolvem cânceres não herdados introdução de genes supressores de tumor para restaurar a função perdida. Ex.: inserção gene TP53 normal em tumores de pulmão bloquear a progressão tumoral e apoptose Imunoterapia: introdução de lipossomos com DNA para HLA-B27 em melanoma: expressão de HLAB27 na superfície das células e destruição pelas células T citotóxicas regressão do melanoma em alguns casos TERAPIA GÊNICA DO CÂNCER Terapia "antisense“: bloqueia a tradução de mRNA transcritos por genes tumorais (Ex:VEGF, c-Fos) Terapia pró-droga ou gene suicida: transferência de um gene (HSV-tk) que torna as células em divisão sensíveis a drogas selecionadas Tripla hélice: TFO ligam-se ao DNA duplex → bloqueia expressão gênica Ribozima: moléculas de RNA → clivam RNA AS: 15-20 pb ou complementar ao mRNA inteiro bloqueiam os fatores de iniciação da tradução ou interação do mRNA e ribossomos. Ex.: AS complementar ao VEGF AS Oligos nucleasesresistentes Terapia pró-droga TFO: polipurina ou poliadenina ligam-se a cadeia rica em purina no sulco principal do DNA através de pontesTFO de hidrogênio região de regulação de transcrição gênica Ex.: TFO promotor c-Myc, H-Ras,Her-2/neu Mudança conformacional do sulco: bloqueio interação DNAproteína Ribozimas: moléculas de RNA que catalizam a clivagem sítioespecífica de RNA (geralmente sítio 3’- códon GUN do mRNA) Ex.: mRNA c-fos mRNA H-Ras: (mutação códon 12) GGU→GUU DIFICULDADES DA TERAPIA GÊNICA Obtenção da alta eficiência na transferência gênica Dificuldades de atingir o tecido alvo. Ex. neurônios (distúrbios do SNC) Expressão adequada do gene transferido: expressão transitória e de baixo nível (<1%) Necessidade de regulação precisa da atividade gênica. Ex. Talassemia Ocorrência de inserção casual no genoma da célula hospedeira GRANDE DESAFIO????? TRAZER A TERAPIA GÊNICA À PRÁTICA CLÍNICA!!!!!!!!!!!!
Baixar