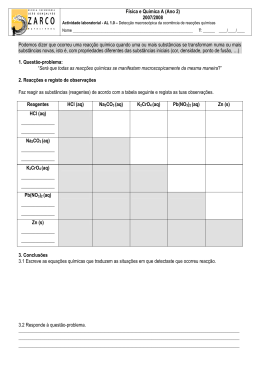
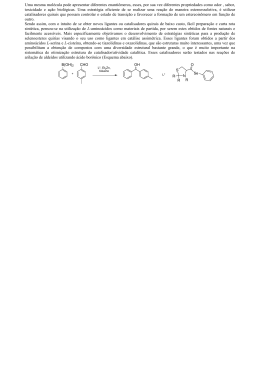
Departamento de Química Universidade de Aveiro 3810-193 Aveiro Portugal Química Orgânica I Docente: Prof. Armando Silvestre Curso(s): Lic. em Química, Lic. em Bioquímica. Escolaridade: 4h TP - 1h OT Ano Lectivo: 2006/07 ECTS: 6 OBJECTIVOS Introdução à nomenclatura, estrutura, reactividade e propriedades físicas das principais famílias de compostos orgânicos. Introdução às técnicas de caracterização espectroscópica de compostos orgânicos. No final deste curso o aluno deverá ser capaz de: 1. Representar e identificar estruturas de compostos orgânicos, incluindo os diferentes tipos de isómeros. 2. Compreender as transformações características de cada família de compostos orgânicos e os respectivos mecanismos. 3. Identificar as diferentes famílias de compostos orgânicos através de reacções químicas e das suas características espectroscópicas. 4. Propor esquemas reaccionais que lhe permitam preparar moléculas simples a partir de reagentes específicos. METODOLOGIA Aulas TP envolvendo momentos de exposição com apoio de meios audiovisuais, seguidos de resolução de exercícios (individualmente ou em grupo), alguns deles para avaliação. Realização “em casa” de pequenos problemas/trabalhos, seguidos de apresentação e discussão na aula. A disciplina terá um site na plataforma Blackboard Learning onde serão disponibilizados, em formato electrónico, o material usado nas aulas. MÉTODO DE AVALIAÇÃO De acordo com o regulamento de avaliação em vigor, a disciplina funcionará em Avaliação Mista. Envolvendo os seguintes Elementos de avaliação: A- Resposta a pequenos questionários (12-15) nas aulas, sem aviso prévio. (20%) B- Um teste escrito a meio do semestre (40%). C- Um teste na época de exames (40%). Química Orgânica I Ano Lectivo: 2006/07 Pág. 1 de 3 PROGRAMA 1. Considerações gerais sobre Química Orgânica (5 aulas) Objectivos da disciplina Conceito de grupo funcional e de família de compostos orgânicos. Diferentes famílias de compostos orgânicos. Sistemas de nomenclatura em Química Orgânica. Representação de estruturas de compostos orgânicos. Estrutura e propriedades físicas. Forças intermoleculares; pontos de ebulição e solubilidade em água. Conformações de alcanos e cicloalcanos; tensão interna torsional, estérea e angular. 2. Hidrocarbonetos: Alcanos, Alcenos e Alcinos 2.1. Alcenos Isomeria cis/trans e E/Z. Regras de Cahn, Ingold e Prelog. Adição electrófila: mecanismo; orientação (adições Markovnikov e anti-Markovnikov); reactividade; rearranjo. Reacções dos alcenos: Hidrogenação catalítica. Estabilidade de alcenos Hidratação. Adição de ácido sulfúrico. Dimerização Hidro-halogenação Halogenação Hidroxilação Epoxidação Ozonólise 2.2. Sistemas conjugados Tipos de dienos e a sua estabilidade Adição electrófila a dienos conjugados A reacção de Diels-Alder 2.3. Alcinos Caracter ácido dos alcinos terminais; reacções de alcinos terminais com metais alcalinos e bases fortes: o ião alcineto. Reacções de adição: Halogenação Hidro-halogenação Hidratação: tautomerismo ceto-enólico. Hidrogenação com Na/NH3 e catalítica. Catalisador de Lindlar. 2.4. Alcanos (2 aula) Reacções dos alcanos: Combustão Halogenação do metano; mono- e poli-halogenação; reactividade dos vários halogéneos. Halogenação de alcanos: orientação; reactividade e selectividade. 3. Compostos Aromáticos Aromaticidade - regra de Hückel. Substituição aromática electrofílica. Halogenação Nitração Sulfonação Alquilação de Friedel-Crafts Acilação de Friedel-Crafts Efeito dos grupos substituintes: Activação/desactivação, orientação da substituição electrofílica aromática. Compostos aromáticos heterocíclicos. Compostos aromáticos iónicos. 4. Estereoquímica Centros quirais: conceito de "carbono quiral". Estruturas resultantes da ligação de quatro átomos ou grupos de átomos diferentes a um carbono sp3. Distinção entre "estrutura quiral" e "par de estruturas quirais". Relação objecto/imagem em estruturas quirais. Enantiómeros: atribuição das designações R e S para distinguir um par de enantiómeros. Moléculas com vários centros quirais: número máximo de estereoisómeros. Racematos e resolução de um racemato. Propriedades físicas e químicas de enantiómeros. Quiralidade e centros quirais: exemplos de moléculas quirais sem centros quirais e de moléculas aquirais com centros quirais. Actividade Óptica Natureza da luz: luz monocromática e luz polarizada. Substâncias opticamente activas: as experiências de Biot e de Pasteur. O polarímetro. Substâncias dextrógiras e levógiras. Rotação específica. Pureza química e pureza óptica. Química Orgânica I Ano Lectivo: 2006/07 Pág. 2 de 3 Interpretação da actividade óptica em substâncias quirais. Características quirais da luz polarizada. Importância da quiralidade molecular em processos biológicos. Origem da quiralidade na matéria viva. 5. Haletos de Alquilo: Reacções de substituição e eliminação Reacções de eliminação e de substituição: Substituição nucleófila unimolecular e bimolecular. Eliminação unimolecular e bimolecular. Competição entre substituição nucleófila e eliminação Formação de reagentes de Grignard. 6. Álcoois, Éteres e Epóxidos 6.1. Álcoois Reacções de substituição e eliminação: Substituição vs. eliminação Conversão em haletos de alquilo (reacção com HX, tribrometo de fósforo e cloreto de tionilo) Teste de Lucas Desidratação (com ácido sulfúrico) Oxidação (com dicromato de potássio, trióxido de crómio, clorocromato de piridíneo e permanganato de potássio) Formação de alcóxidos . 6.2. Éteres e Epóxidos Reacções de éteres com ácidos fortes. Éteres cíclicos. Epóxidos. Reacções de epóxidos com nucleófilos. 7. Aldeídos e Cetonas Reacções de oxidação /redução: Oxidação de aldeídos (com permanganato de potássio, dicromato de potássio, reagente de Tollens e reagente de Fehling). Oxidação Baeyer/Villiger de cetonas. Redução (com H2/Pt, LiAlH4 e NaBH4). Reacções de adição nucleófila: Água (em meio ácido e em meio básico) Ácido cianídrico. Derivados de amoníaco (hidrazinas, amoníaco, hidroxilamina e aminas primárias). Álcoois Reagentes de Grignard Condensação aldólica simples e cruzada. Tautomerismo ceto-enólico. Reacção de Cannizaro Reacção de Wittig BIBLIOGRAFIA Francis A. Carey, Organic Chemistry, 4rd ed., McGraw-Hill, 2000 T. W. G. Solomons, Organic Chemistry, 6th ed., John Wiley & Sons Inc., 1996 L. G. Wade, Jr., Organic Chemistry, 3rd ed., Prentice-Hall, 1995 K. Peter C. Vollhardt & Neil E. Schore, Organic Chemistry, 3rd ed., W.H. Freeman and Company, 1999 Jonathan Clayden, Nick Greeves, Stuart Warren & Peter Wothers, Organic Chemistry, 1rd ed., Oxford University Press, 2001 R. Morrison & R. Boyd, Química Orgânica, Fundação Calouste Gulbenkian O Regente da Disciplina Química Orgânica I Ano Lectivo: 2006/07 Pág. 3 de 3
Baixar