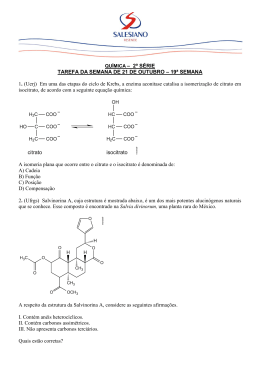
química QS0403 aula de reforço – 2EM Para acessar a resolução dos exercícios, assista ao vídeo desta aula na seção “vídeosdeaaz Aulas de Reforço” no site do _A_Z. Nesta lista, encontram-se questões relativas aos seguintes tópicos da matéria: Cinética Química (Lei da Velocidade) Equilíbrio Químico Isomeria Plana Isomeria Espacial 4. O cravo-da-índia e a noz moscada são condimentos muito utilizados na culinária, e seus principais constituintes são, respectivamente, o eugenol e o isoeugenol. Observe suas fórmulas estruturais: 1. Na reação abaixo: foram introduzidos, em um recipiente de 1L, 6mol de N2 e 16mol de H2. Verificou-se no equilíbrio a existência de 8mol de NH3. Determine o Kc. 2. Fosgênio (COCl2) é um gás venenoso. Quando inalado, reage com a água nos pulmões para produzir ácido clorídrico (HCl), que causa graves danos pulmonares, levando, finalmente, à morte: por causa disso, já foi até usado como gás de guerra. Aponte o tipo de isomeria plana que ocorre entre essas duas estruturas e nomeie aquela que apresenta estereoisomeria geométrica. Este gás pode ser obtido pela seguinte reação: Conhecendo temperatura: os seguintes dados coletados a uma dada 5. A partir da hidrogenação parcial de óleos vegetais líquidos, contendo ácidos graxos poliinsaturados (contendo mais de uma dupla ligação), são obtidas as margarinas sólidas. Nos óleos vegetais originais, todas as duplas ligações apresentam configuração cis. No entanto, na reação de hidrogenação parcial ocorre, também, isomerização de parte das ligações cis, formando isômero trans, produto nocivo à saúde humana. O ácido linoléico, presente em óleos e gorduras, é um ácido graxo que apresenta duas insaturações, conforme fórmula molecular representada a seguir. C5H11-CH=CH-CH2-CH=CH-(CH2)7-COOH Apresente a expressão da lei de velocidade e o valor da constante k de velocidade para a reação que produz o fosgênio. 3. O cheiro característico do peixe é causado por uma substância orgânica denominada metilamina, de fórmula O caráter básico dessa substância está indicado no seguinte sistema em equilíbrio: Escreva as fórmulas estruturais do isômero cis e do isômero trans que podem ser obtidos a partir da reação de hidrogenação da dupla ligação mais próxima do grupo carboxílico deste ácido. 6. O Mal de Parkinson, doença degenerativa cuja incidência vem crescendo com o aumento da duração da vida humana, está associado à diminuição da produção do neurotransmissor dopamina no cérebro. Para suprir a deficiência de dopamina, administra-se por via oral um medicamento contendo a substância dopa. A dopa é absorvida e transportada nessa forma para todo o organismo, através da circulação, penetrando no cérebro, onde é convertida em dopamina, através de reação catalisada por enzima adequada, representada pela equação: A sabedoria popular recomenda que, logo após o manuseio do peixe, se use o limão para remover o cheiro que ficou nas mãos. Aplicando o princípio de Le Chatelier, apresente uma justificativa para a eliminação do cheiro de peixe pelo uso de limão. 1 química aula de reforço Analise as fórmulas da dopa e da dopamina e decida se as substâncias apresentam atividade óptica. Em caso positivo, copie a fórmula estrutural correspondente para o espaço de resolução e resposta, de uma ou de ambas as substâncias, assinalando na fórmula o átomo responsável pela atividade óptica. ATENÇÃO: o texto a seguir refere-se as questões 7, 8 e 9. Compostos nitrogenados são utilizados em diversos segmentos da sociedade. Na produção agrícola, por exemplo, NH3, NH4NO3, (NH4)2SO4 e H2NCONH2 são utilizados como adubos. Para suprir a demanda desses compostos, Fritz Haber e Carl Bosh desenvolveram um processo industrial que converte o nitrogênio atmosférico em amônia. Esse processo, conhecido como HaberBosh, pode ser representado através da equação química N2(g) + 3H2(g) ↔ 2NH3(g) ∆H = - 92,4 kJ/mol Dado: Kc = 1,5 × 10-5 (500 °C) De acordo com os dados anteriores, 7. Escreva a expressão da constante de equilíbrio (Kc) para essa reação e explique por que o aumento da temperatura diminui o valor da constante de equilíbrio; 8. Calcule a concentração de equilíbrio de NH3, em mol/L, a 500 °C, a partir da mistura de 1,0 mol de N2 e 3,0 moles de H2 em um recipiente de 1,0 L; 9. explique por que o processo Haber-Bosh é mais vantajoso, industrialmente, quando são utilizadas pressões elevadas. 10. Cloreto de nitrosila puro (NOCℓ) foi aquecido a 240 °C em um recipiente fechado. No equilíbrio, a pressão total foi de 1,000 atm e a pressão parcial do NOCℓ foi de 0,640 atm. A equação a seguir representa o equilíbrio do sistema: 2NOCℓ(g) 2NO(g) + Cℓ2(g) a) Calcule as pressões parciais do NO e do Cℓ2 no equilíbrio. b) Calcule a constante do equilíbrio. 2
Baixar