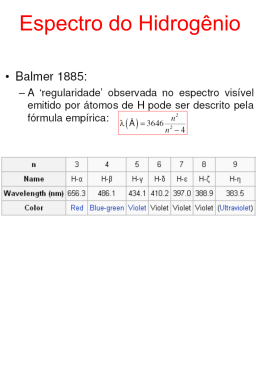
Caro Professor, O principal objetivo do projeto RIVED é oferecer aos professores do Ensino Médio novos recursos didáticos, em forma de módulos, para a melhoria da aprendizagem dos alunos em sala de aula. O módulo de aprendizagem é um conjunto de atividades de computador que exploram uma determinada unidade curricular. Porém, as atividades digitais nem sempre são adequadas para mediar todos os conteúdos de uma unidade. Por isso, atividades complementares são sugeridas no guia do professor. Cada atividade dos módulos RIVED vem acompanhada de um guia do professor para ajudar a informar sobre as decisões relacionadas à escolha e execução da atividade. Os guias, além de fornecerem dicas de como usar as atividades do módulo, também são criados como uma fonte de enriquecimento do professor. Considere as informações dos guias como sugestões. Você não precisará segui-las exatamente como são descritas. Você poderá utilizar os guias como referência e adequá-los a seus alunos e ao seu planejamento pedagógico. Guia do Professor Módulo – Estrutura Atômica Atividade 4 - Entendendo o átomo Introdução Nesta atividade, serão tratados assuntos mais complexos acerca da estrutura atômica além daqueles até então discutidos. As atividades aqui propostas deverão ser realizadas como complemento às aulas ministradas pelo professor em sala de aula e servirão para complementar e sedimentar os conceitos referentes ao modelo atômico proposto por Bohr. Objetivos 1. Compreender que o uso tecnológico da radiação eletromagnética está associado ao seu comprimento (comprimento de onda); 2. Compreender como os espectros dos elementos são formados; 3. Reconhecer a existência de níveis de energia dentro do átomo; 4. Identificar como ocorre a absorção e a emissão de energia pelos saltos eletrônicos; Pré-requisitos 1. 2. 3. 4. Conhecer a proposta de Dalton do modelo atômico indivisível; Conhecer a proposta de Thomson - a existência do elétron; Conhecer o modelo atômico proposto por Rutherford; Conhecer as propriedades das cargas elétricas. Tempo previsto para a atividade Três aulas de 50 minutos Na sala de aula Para um melhor aproveitamento do tempo na sala de informática, o professor deverá utilizar as animações depois de ter estudado alguns conceitos fundamentais para a compreensão do modelo atômico proposto por Bohr. Questões para discussão 1. Radiação eletromagnética; 2. Espectros atômicos; 3. Quantização da luz; 4. As idéias de Bohr sobre o átomo; Na sala de computadores Preparação É importante que o professor utilize os trabalhos realizados em sala para orientar as atividades propostas no computador. As simulações poderão ser exploradas em uma única aula. Organização da sala Grupo de dois alunos, em cada computador, facilita a troca de idéias e discussões. Material Material para anotações, como lápis e papel. Requerimentos técnicos 1. Versão mínima de navegador (Browser): -Internet Explorer versão 5 -Netscape versão 7 2. PLUG-INS -Plug-in do Flash MX -Plug-in Java(TM) Plug-in Version 1.4.1 -Acrobat Reader Durante a atividade 1. Peça aos estudantes que observem as animações, discutam as questões que acompanham cada animação e anotem suas respostas no diário; 2. Quando uma discussão se fizer necessária, peça aos estudantes que desliguem o monitor e virem suas cadeiras de modo a garantir sua atenção para o assunto a ser discutido. Impressão digital espectral Essa atividade inicia com a pergunta “Por que os fogos de artifícios são coloridos?”. 1. Incentive os estudantes a manifestarem suas idéias. Não é importante agora que eles dêem respostas corretas, apenas coloquem suas opiniões. Se nenhum estudante se colocar, o professor poderá instigá-lo sobre o tema. O texto Hanabi, a trajetória dos fogos de artifícios, disponível no Material de Suporte, poderá ser útil para este propósito. 2. Em seguida, são mostrados alguns espectros que servirão para o apresentar a “assinatura espectral” de alguns elementos. Neste momento, os estudantes já deverão saber o que é um espectro. Dica: Neste momento é interessante ressaltar pontos que são importantes, como a faixa dos comprimentos de onda da região do visível e o conceito de quantização da luz. A radiação eletromagnética. Esta atividade é apenas uma ilustração para auxiliar o aluno na sedimentação dos conceitos sobre as radiações eletromagnéticas aprendidos na aula expositiva. E, tem como objetivo mostrar alguns exemplos de fontes e usos de radiações eletromagnéticas. É desejável que estabeleça uma relação contextual e explore o uso dado às radiações eletromagnéticas como ondas de rádio, microondas, raios – X, dentre outras. 1. Incentive os estudantes para que eles observem as animações, respondam às perguntas que aparecem após a animação e anotem as respostas no diário. Um tempo aproximado de 10 minutos é suficiente para que cada dupla discuta e responda as questões sugeridas. Questões para discussão a) b) c) d) Das ondas eletromagnéticas apresentadas na simulação acima, quais podem ser percebidas pelos nossos sentidos? (As ondas percebidas pelos nossos sentidos são as do visível, microondas e infravermelho, que estão na faixa de 3,0 x 10-7 a 3,0 x 10-1 cm-1); Das ondas eletromagnéticas apresentadas na simulação acima, escolha três exemplos e fale sobre outros usos de cada um delas; Qual destas radiações pode ser parcialmente bloqueada pelo uso de filtro solar? (A radiação ultravioleta); Que outras aplicações de ondas eletromagnéticas você conhece? Pesquise e descubra seu comprimento de onda e a história relacionada a sua aplicação. O modelo atômico de Bohr Esta atividade tem como objetivo ilustrar as idéias contidas no modelo atômico de Bohr. O aluno já terá conhecido os fundamentos desse modelo em aulas ministradas pelo professor anteriormente. A simulação – permite que o aluno observe os saltos eletrônicos devido à absorção ou emissão de energia. Essas variações de energia são registradas no diagrama ao lado do átomo. Os saltos eletrônicos do sexto nível para o quinto, quarto, terceiro e segundo níveis são registrados no espectro abaixo do átomo. Esse espectro se refere ao átomo de hidrogênio. Procedimentos 1. Peça a cada dupla para clicar nas diferentes órbitas mostradas na animação, observar o que acontece e responder às perguntas que seguem a animação. e) O que acontece quando o elétron salta de um nível mais interno para um mais externo? f) E quando ele salta de um nível mais externo para um mais interno? g) Como se comporta a variação de energia do elétron, mostrada no gráfico ao lado, em relação a sua posição nos níveis de energia na eletrosfera? Observe com atenção o que acontece quando o elétron salta do 6°, 5°, 4° e do 3° níveis para o 2° nível de energia. h) Todas as linhas espectrais mostradas no espectro apresentam a mesma cor? i) Que relação você poderá fazer entre a cor da linha espectral e a quantidade de energia liberada no salto eletrônico? j) Agora que você já sabe como o espectro de um elemento é formado e já conhece o espectro de alguns elementos, que resposta daria a uma pessoa que perguntasse por que os fogos de artifícios são coloridos? 2. Se possível, permita que, durante cerca de 15 minutos, cada dupla discuta as questões e anotem suas respostas no diário. Em seguida, peça que os estudantes desliguem seus monitores e convide-os a relatar suas respostas para a classe. Assegure-se de que as respostas dos estudantes estejam corretas. Importante: Bohr admitiu que os elétrons poderiam girar em órbita circular somente a determinadas distâncias permitidas do núcleo e assumiu que para mudar de órbita, o elétron deveria ganhar ou emitir quantidade fixa de energia. Ele propôs, ainda, que os espectros são descontínuos porque os níveis de energia são quantizados, ou seja, só são permitidas certas quantidades de energia para o elétron, cujos valores são múltiplos inteiros do fóton. Depois da atividade Neste momento é importante abordar as deficiências do modelo atômico proposto por Bohr. Questões para discussão O modelo de Bohr conseguia explicar apenas o espectro do hidrogênio, mas não o espectro de outros átomos. Além disso, surgia uma revolução no conhecimento da física. Os estudos evidenciavam que partículas muito pequenas possuem um comportamento diferente daquele que costumamos observar no nosso cotidiano para corpos de maiores dimensões. A teoria de Bohr sobre o sistema atômico prevê a trajetória, a energia e até a velocidade do elétron. No entanto, estudando este sistema, o físico alemão Werner Karl Heisenberg observou que não havia nenhuma evidência experimental que mostrasse como os elétrons se moviam no átomo. Heisenberg afirmou que, se a velocidade e a posição dos elétrons não são observáveis, então nada se pode afirmar a respeito delas. Assim, pode-se afirmar que um átomo possui diferentes níveis energéticos e que, ao saltar de um nível para outro, o elétron absorve ou emite energia, pois este fato é observado através dos espectros atômicos. Mas se esses estados energéticos estão relacionados a diferentes órbitas eletrônicas, isto não pode ser verificado. Segundo Heisenberg, é impossível determinar a posição e a velocidade do elétron por uma razão bem simples; quando fazemos a medição de uma determinada propriedade em um sistema em estudo, este ato de medir perturba de tal modo o sistema que o resultado obtido não é o resultado real. Esta idéia ficou conhecida como Princípio da Incerteza. A partir de tal princípio, foram introduzidos cálculos que descrevem a região na qual há grande possibilidade de se encontrar o elétron. Essa região em volta do núcleo, onde é possível encontrar os elétrons, foi denominada orbital. Surge então, a partir dessa teoria, um novo modelo atômico, o modelo orbital. Sobre este modelo, sugerimos que sejam discutidas apenas as suas idéias básicas, sem entrar nos detalhes matemáticos e em idéias com alto nível de abstração. Avaliação É interessante que a avaliação seja feita ao longo das atividades e, especialmente, durante as discussões. Como este é um assunto um pouco mais complexo para o aluno do Ensino Médio, é conveniente não sermos muito exigentes em relação às respostas e observações dos estudantes. Porém, precisamos estar atentos para que as idéias e conceitos trabalhados nestas atividades tenham sido abstraídos de forma correta. Utilize o diário como um outro instrumento de avaliação. Referências bibliográficas 1. REIS, Martha, Completamente Química, Editora FTD, 2001. 2. MAHAN, Química – Um curso universitário, Editora Edgard Blücher LTDA, 3. CARUSO, Francisco e OGURI, Vitor, A eterna busca do indivisível: Do átomo filosófico aos Quarks e Léptons, Química nova, vol. 20, número 3, 1997. 4. SEGRÈ Emílio, Dos raios-x aos quarks, Brasília: Editora da UnB, 1987.
Download