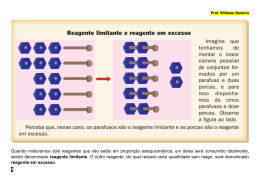
Aula: 14. Temática: Excesso de reagentes. Como proceder quando não há uma proporcionalidade entre as quantidades de reagentes? Vamos aprender nesta aula. Quando são dadas as quantidades de dois reagentes, ou mais, nem sempre estes reagentes se encontram em proporções estequiométricas, podendo estar em excesso. Neste caso, para resolver o problema, precisamos trabalhar apenas com o reagente que obedece aos coeficientes da equação. Não podemos deixar de lembrar a importância da interpretação do enunciado e a escolha do reagente que não se encontra em excesso. Nem sempre as substâncias reagem na proporção que a reação exige, ou seja, de acordo com a aplicação da lei de Proust. Observe a resolução do exercício abaixo: Juntando-se 196g de ácido sulfúrico com 240g de soda cáustica. Qual a massa de sulfato de sódio obtida? 1ª etapa: escrever a reação, devidamente balanceada, interpretando-a de acordo com o enunciando. H2SO4 + 2 NaOH Na2SO4 + 2 H2O 2ª etapa: como foram fornecidos mais de um reagente, precisamos verificar se então em quantidades proporcionais. H2SO4 + 2 NaOH 98g Na2SO4 + 2 H2O 2x40g 2x 3x 196g 240g 3ª etapa: uma vez verificada a proporcionalidade, encontramos excesso no NaOH, o que significa que a massa de 240g de NaOH não reagirá totalmente. Para efeito de cálculo, esta massa poderá ser desprezada. Somente nos exercícios em que a massa do excesso é solicitada no enunciado, precisaremos calcular este valor. 4ª etapa: agora basta calcular através da massa que obedece a estequiometria da reação, assim chegaremos ao resultado que responde ao problema. H2SO4 98g + 2 NaOH Na2SO4 + 2 H2O 2x40g 2x 2x 196g x A massa de sulfato de sódio obtida será: 160g Caso fosse solicitado no enunciado a quantidade em excesso, bastaria subtrair a massa que reagiu da fornecida, assim: 240 – 160 = 80 excesso de 80g de NaOH. Vimos nesta aula que nem sempre as substâncias reagem na proporção que a reação exige. Preste atenção ao interpretar um enunciado para saber como proceder. Deixo alguns exercícios para você praticar o que aprendeu nesta aula. Resolva os exercícios: 1) 98g de H2SO4 são adicionados a 100g de NaOH. Completada a reação, existe reagente em excesso? Em caso afirmativo qual o reagente em excesso e qual a massa? 2) Em uma experiência entre metano (CH4) e oxigênio (O2), foram colocados para reagir 0,25 mol de metano e 1,25 mol de O2, produzindo CO2 e H2O. Quantos gramas de CO2 foram produzidos? Caso exista algum reagente em excesso, qual a massa desde excesso?
Download