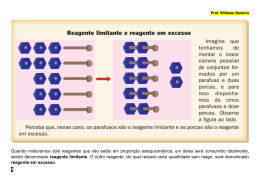
Abril – Físico-Química – 2ª Série Pessoal, iniciada por centelha elétrica. A equação para a reação é: Nas últimas aulas estudamos sobre os tipos de estequiometria. Esta dica mensal tem como objetivo relembrar algumas características dos problemas que envolvem reagente em excesso e reações consecutivas . NaN3 + Fe2O3 Na2O + Fe + N2 Misturando 97,5 kg de NaN3 com 90 kg de Fe2O3 Dados: Na= 23, Fe= 56, N = 14 e O= 16 Volume molar nas CNTP = 22,4 L/mol Determine: a) O reagente em excesso? E quanto sobra desse reagente? 6NaN3 + Fe2O3 3 Na2O + 2 Fe + 9 N2 Bons estudos. Gesiane. 1º tipo – Reagente limitante e reagente em excesso São problemas que não apresentam todos os reagentes nas condições estequiométricas, sendo assim, um dos reagentes estará em excesso. É possível identificar esse tipo de estequiometria, quando o problema fornecer as quantidades dos reagentes que participam da reação. 6NaN3 Fe2O3 195 g 160 g 97,5 kg X X = 80 kg de Fe2O3 reagem. Massa em excesso = 90 – 80 = 10 kg de Fe2O3 b) O volume de N2 produzido nas CNTP. 6NaN3 9 N2 195 g 9.22,4L 97500 g Y Y = 100800L Em todo o mundo, os índices de acidentes de trânsito têm levado os órgãos responsáveis a tomar medidas reguladoras, entre elas campanhas educativas. Paralelamente, a indústria automobilística desenvolveu o "air bag", um balão que infla rapidamente para diminuir o impacto do passageiro com as partes internas do veículo. c) O número de mols de ferro produzido. Os automóveis modernos estão equipados com air bags (bolsas de ar) para proteger os ocupantes em caso de colisão. Muitos deles são inflados com nitrogênio, N2, gás liberado na reação muito rápida entre azida de sódio, NaN3, e o óxido de ferro III, 6NaN3 195 g 97500 g 1 2 Fe 2 mols Z Z = 1000 mols de Fe 2º tipo – Reações sucessivas ou consecutivas Vejamos: Tipo de estequiometria cujo problemas fornecem duas ou mais reações que fazem parte de um mesmo processo. Para a resolução desse problemas é importante encontrarmos a equação global. Veja o exemplo abaixo: O ácido nítrico surge a partir e algumas reações observem a equação dessas reações. 1) 4NH3 + 5O2 → 4NO + 6H2O 2) 2NO + O2 → 2NO2 3) 3NO2 + H2O → 2HNO3 + NO Agora, para calcular a massa da amônia é preciso para que ocorra a preparação de 6,3 gramas de ácido nítrico. Dado: Massas molares em g/mol: NH3: 17 HNO3: 63 NO2: 46 NO: 30 Vejamos a resolução: NH3, está presente na reação 1). HNO3, está presente na reação 3). NO, participa das reações 1) e 2). NO2, está presente nas reações 2) e 3). Efetuando a multiplicação da equação 2) por 2, e a equação 3) por 4/3, obteremos: 1) 4NH3 + 5O2 → 4NO + 6H2O 2) 4NO + 2O2 → 4NO2 3) 4NO2 + 4/3H2O → 8/3HNO3 + 4/3NO É possível conseguir 8/3 mols de HNO3, a partir de 4 mols NH3. 2
Baixar