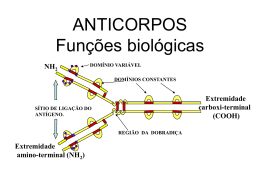
Métodos Imunológicos Guido Lenz Biofísica, 2004 1. Introdução Ter como função proteger um organismo de qualquer componente externo num mundo de miriades de componentes internos e de uma imensidão de prováveis invasores fez do sistema imunológico, ao longo da evolução, um dos sistemas biológicos mais complexas. Pela sua importância vital e talvez pela sua transparente complexidade, o sistema imunológico sempre produziu um grande fascínio sobre os cientistas, fascínio este comparável ao dedicado ao sistema nervoso, talvez por suas semelhanças no que se refere à memória, comunicação e inteligência (para usar os termos cunhados para este, mas certamente úteis naquele). O conhecimento adquirido sobre o sistema imunológico, principalmente sobre a produção de anticorpos, conduziu a uma revolução nas técnicas usadas nas ciências biológicas. Atualmente uma grande parte dos métodos bioquímicos e histológicos lança mão desta poderosa ferramenta chamada anticorpo para alcançar os seus objetivos. Acredito que os métodos imunológicos, ao lado da biologia molecular, estão entre os maiores avanços em termos metodológicos conseguidos nos últimos 10 ou 20 anos. Duas afirmações podem ser citadas para argumentar porque os métodos imunológicos são um conhecimento imprescindível na formação de estudantes das áreas biológicas: 1. o envolvimento direto com estes métodos, para estudantes que irão usá-los em trabalhos experimentais e 2. melhor compreensão de assuntos que usam estes métodos, que são largamente encontrados em todas os ramos das ciências biológicas. Estes argumentos, aliás, valem para o estudo dos métodos como um todo, pois, para que se possa analisar de forma crítica um texto científico, é necessário ter conhecimento dos métodos usados para produzir os resultados, sem o qual a análise se torna no mínimo superficial. 2. Anticorpos Anticorpos são proteínas que reconhecem um antígeno de forma específica e com alta afinidade. Discutiremos a seguir como estas proteínas são produzidas nos organismos pelos linfócitos e como isto pode ser manipulado para fins específicos. 1 2.1 Produção A descoberta dos mecanismos de produção de anticorpos é, sem sombra de dúvida, uma das grandes vitórias das ciências biológicas neste século, devido a sua complexidade, mas principalmente pelos benefícios que representa para a humanidade. Discutiremos apenas superficialmente os mecanismos que levam à geração de anticorpos, pois a complexidade deste assunto não permite a sua análise aprofundada neste texto (certamente isto será feito em disciplinas específicas). 2.1.1 Mecanismo de Síntese de Anticorpos Os anticorpos são produzidos pelos linfócitos B, que se originam na medula, sendo distribuídos pelo organismo inteiro através do sistema linfático. A quantidade de linfócitos no corpo humano é estimado em cerca de dois trilhões (2 x 1012), sendo esta quantidade elevada fundamental para o perfeito funcionamento do sistema imunológico, como veremos a seguir. O funcionamento do sistema imunológico, e conseqüentemente da produção de anticorpos é explicada pela teoria de seleção clonal. Esta teoria afirma que no embrião sejam produzidos, por recombinação genética,1 uma imensa variedade de linfócitos cada qual contendo um receptor diferente 2. No período embrionário, os receptores dos linfócitos que reagirem com algum antígeno serão eliminados, fazendo com que os linfócitos que respondem a componentes do próprio organismo morram. Se neste período estiverem presentes antígenos externos, não se desenvolverá nenhuma imunidade contra este antígeno. Por outro lado, se algum antígeno do organismo não puder ser “encontrado”, futuramente este antígeno será interpretado como estranho e se desenvolverá uma reação autoimune. Quando um antígeno ingressa em um organismo adulto, o(s) linfócito(s) que tiver(em) o receptor para este antígeno se reproduzem, e se diferenciam, voltando toda a sua atividade para a síntese de anticorpos (o mesmo anticorpo que eles possuem como receptor - ou seja, aquele que reage com o antígeno). Desta forma, um certo período após o antígeno ter entrado em contato com o organismo, inicia-se um grande produção de anticorpos, que poderá então precipitar o antígeno, tirando-o de circulação (Figura 1). 1 acredita-se que genes altamente variáveis possam se recombinar de inúmeras formas para produzir uma variedade extremamente grande de anticorpos. 2 este receptor na realidade é um anticorpo produzido somente por este linfócito que pode se comunicar com o interior, sinalizando tanto a morte (no embrião) como a proliferação (no adulto) 2 Figura 1. Produção de anticorpos pelos linfócitos B. É necessário destacar que o sistema imunológico produz uma diversidade tão grande de anticorpos que ligará em virtualmente tudo e depois seleciona o que é próprio e o que é estranho, o que significa que os linfócitos são selecionados e não moldam o anticorpo de acordo com o antígeno3. Linfócitos imaturos quando ativados pelo antígeno se diferenciam em linfócitos maduros, produtores de anticorpos e também linfócitos de memória, que, numa segunda exposição ao antígeno, se ativam muito mais rapidamente do que as células virgens fazendo com que a segunda resposta imunológica seja muito mais intensa e rápida do que a primeira. 2.1.2 Tipos Um certo antígeno pode ser reconhecido por vários linfócitos, levando a ativação de vários clones de linfócitos B. Cada qual destes clones reconhece uma parte diferente ou se liga de uma forma diferente ao antígeno, através de uma parte do antígeno denominada epitopo, que é a parte do antígeno efetivamente reconhecida pelo anticorpo para que a interação antígeno-anticorpo possa ocorrer. Até antígenos pequenos como a grupo dinitrofenil podem ser reconhecidos por vários linfócitos, ou seja, possuem vários epitopos. Desta forma, 3 embora o anticorpo, após a seleção do linfócito B que o produz, pode ser alterado afim de produzir um aumento na sua afinidade, o que parece ser um forma de moldagem antígeno específica. 3 um antígeno grande, como uma proteína, pode possuir inúmeros epitopos, cada qual induzindo a produção de um anticorpo específico. 2.1.2.1 Policlonais Anticorpos policlonais (como diz o nome) possuem vários clones, ou seja, se originam de diferentes linfócitos B, o que significa que reagem com vários epitopos do antígeno (por exemplo, várias partes de uma proteína). 2.1.2.2 Monoclonais Este tipo de anticorpo provém de somente um linfócito B, selecionado artificialmente e replicado diversas vezes como um clone. Desta forma, este anticorpo liga somente a um epitopo de uma única forma. 2.1.3 Produção de Anticorpos Policlonais 2.1.3.1 Antígeno O primeiro passo para a produção de um anticorpo é a purificação do antígeno. Isto pode ser realizado de diversas formas, usando técnicas de purificação como cromatografia e eletroforese. Com o desenvolvimento e o barateamento da síntese de peptídeos, muitos anticorpos são produzidos usando-se peptídeos de 10 a 14 aminoácidos acoplados a uma proteína carreadora. 2.1.3.2 Imunização A imunização é realizada aplicando-se no animal (coelho, camundongo, cabra etc.) o antígeno juntamente com conjunto de substâncias que ativam o sistema imunológico, denominados de coadjuvantes, como por exemplo o coadjuvante de Freud. Após alguns dias, o sangue do animal é recolhido e, através de centrifugação, é separado o plasma sanguíneo (soro), na qual se encontram os anticorpos. 2.1.3.3 Purificação Algumas vezes é possível utilizar o soro, pois a grande maioria de anticorpos ali presentes são os anticorpos sintetizados contra o antígeno injetado, mas geralmente é importante separar a fração das imunoglobulinas ou de preferência do anticorpos específico. Isto geralmente é realizado com cromatografia por afinidade, na qual se usa a a proteína A (ver Pontes item 2.3.1) ou o próprio antígeno como fase estacionária numa coluna de afinidade, sendo que o anticorpo purificado é liberado da coluna através do uso de uma solução com pH 2,5. 4 2.1.4 Produção de Anticorpos Monoclonais A Figura 2 mostra um esquema da produção de anticorpos monoclonais. Após imunizar o animal Camundongo Imunizado com antígeno X (como descrito no item anterior), retira-se linfócitos do baço e funde-se estas células com mielomas (ver legenda da Figura 2) o que produz hibridomas imortalizados. Após selecionar as células com um meio de cultura que permite o crescimento Linfócitos do baço que produzem AC contra X são isolados. Linfócitos são fundidos com mielomas (imortais) somente de hibridomas, estas são colocadas em placas de cultura a uma densidade de uma célula por poço, fazendo com que as células de cada Células híbridas são selecionadas (mieloma/linfócito) poço sejam descendentes de somente uma célula de hibridoma, ou seja, um clone. Estes hibridomas Células são clonadas iniciarão a produção de anticorpos, que estarão presentes no meio de cultura. O(s) clone(s) que produzirem os anticorpos com maior afinidade e AC é produzido no meio de cultura e este meio é testado. mais específicos podem ser selecionados através de testes usando técnicas imunológicas como a imunodetecção. Uma descoberta crucial para a produção de anticorpos monoclonais foi a imortalização dos linfócitos, fazendo com que, uma vez feito este processo, se possa produzir anticorpos por um Linhagem que produz o melhor AC é crescida e o AC é purificado. Por serem células imortais, isto pode ser realizado indefinidamente. Figura 2. Produção de anticorpos monoclonais* tempo indeterminado. * 1. Injetar o rato com a proteína X; 2. Células de mieloma imortalizadas (tipo de cançer) e inaptas de crescer em um meio HAT (meio que contém certos inibidores que afetam somente estas células); 3. retirar alguns linfócitos do baço do rato, sendo que alguns destes produzirão o anticorpo desejado; 4. misturar e fundir as células e passar para um meio HAT; 5. células não fundidas morrerão pois não são imortalizadas (linfócitos) ou não resistem ao HAT; 6. hibridomas crescem e se multiplicam; 7. células únicas são cultivadas em poços individuais; 8. testar o sobrenadante de cada poço contra a proteína X. 2.2 Estrutura Os anticorpos, coletivamente denominados imunoglobulinas (Ig), são formados por quatro subunidades ligadas entre si por quatro pontes dissulfeto, como mostra a Figura 3. 5 Estas quatro subunidades são constituídas de duas cadeias pesadas (H) e duas cadeias leves (L). A forma dos anticorpos se assemelha a de um “Y”, sendo que na parte de “cima” se encontram dois sítios idênticos de ligação ao antígeno, o que possibilita a ligação cruzada entre eles, podendo desta forma produzir uma malha antígeno/anticorpo, isto é, um precipitado. Os anticorpos são classificados em IgA, IgD, IgE, IgM e IgG, sendo que o IgG representa 75% das Ig totais e devido a isso é tão largamente utilizado nas técnicas envolvendo anticorpos. O sítio de reconhecimento dos antígenos está localizado onde as partes variáveis de H e L se encontram, fazendo com que variações tanto de H como Figura 3. Estrutura anticorpos. geral dos de L alterem este sítio, sendo que o responsável pela imensa variedade de anticorpos possíveis parece ser a combinação das variações destes dois sítios. 2.3 Conjugados Como foi discutido acima, os anticorpos têm como principal característica a especificidade pelo antígeno. Para que estes possam ser usados na detecção de antígenos específicos num universo de milhares, é necessário que os anticorpos estejam conjugados, isto é, ligados, geralmente de forma covalente, a compostos que permitam a separação (esferas de agarose) ou a detecção (peroxidase, flouróforos, ouro). A seguir, analisaremos as características dos conjugados mais utilizados. No caso da agarose, geralmente usa-se o brometo de cianogênio (NCBr), que reage com os grupos OH da agarose formando a agarose ativada (contendo o grupo (-O-C(=NH2)-Br)). Este grupo reage com aminas primárias, como é o caso do aminoácido lisina. Pode ocorrer que esta forma de ligação não funcione adequadamente devido ao impedimento estérico (isto é, a lisina da proteína não consegue atingir a agarose ativada). Para contornar este problema, pode utilizar-se agarose ativada por grupos epoxi ligadas à agarose por espaçadores (por exemplo contendo 12 carbonos). Estes grupos epoxi podem ligar-se a vários grupos químicos como NH2, COOH, SH e OH, facilitando em muito a ligação da agarose ao anticorpo. 2.3.1 Pontes A modificação de anticorpos é um processo bastante trabalhoso. Devido a isso, geralmente usa-se vários anticorpos, sendo o primeiro (que reconhece o antígeno - ver Figura 7), sem nenhuma modificação, reconhecido por um segundo anticorpo, que nada mais é do 6 que um anticorpo contra a imunoglobulina do animal no qual foi produzido o primeiro anticorpo, sendo este anticorpo ligado a alguma molécula de detecção, como por exemplo a peroxidase ou moléculas fluorescentes. 2.3.2 Separação Para que se possa separar um antígeno do restante de componentes de um homogeneizado, é necessário que o anticorpo específico para este antígeno esteja ligado a algo facilmente separável. Geralmente liga-se o anticorpo a esferas de agarose que é um material inerte e pode ser utilizado tanto em colunas cromatográficas como pode ser facilmente separado por centrifugação (como no caso da imunoprecipitação). A ponte entre as esferas de agarose e o anticorpo é geralmente feita pela proteína A, um polipeptídeo de 42 kDa, isolado do Stphylococcus aureus, que se liga fortemente à região Fc das imunoglobulinas de várias espécie. Esta propriedade é muito útil para separar imunoglobulinas, especialmente do tipo IgG, através de cromatografia de afinidade ou na imunoprecipitação. 2.3.3 Detecção Para a detecção do anticorpo são utilizados diversos métodos, escolhidos de acordo com a técnica. 2.3.3.1 Peroxidase A peroxidase é uma enzima que usa o H2O2 para oxidar os seus substratos. Estes substratos são desenhados de tal forma que a sua oxidação possa ser detectada pela liberação de luz (luminol), pela formação de uma precipitado colorido (DAB) ou então pela transformação de um composto incolor num O composto colorido e que possa ser determinado NH luminol, na presença de H2O 2 O+ N2 + O- NH Peroxidase quantitativamente por espectroscopia. O O H2O2 e peroxidase emite luz, que pode ser captada por NH2 O NH 2 Luz O Figura 4. Reação do luminol filmes de raio-X, sendo principalmente usada na imunodetecção. A diaminobanzidina (DAB), na presença de H2O2 e peroxidase, forma um polímero de cor marrom, precipitando no local no qual se encontra a peroxidase, sendo principalmente utilizada em estudos de imunocitoquímica. Existe uma grande variedade de compostos que podem ser utilizados como cromóforos, fornecendo as mais variadas cores, utilizáveis na técnica de ELISA, sendo o ABTS (2, 2'-azino-di(3-ethylbenzthiazoline-6-sulfonate) um exemplo de corante que se torna verde-azulado na presença de peroxidase. 7 2.3.3.2 Fosfatase alcalina A fosfatase alcalina é uma enzima que hidrolisa ligações fosfato. Desta forma, os cromóforos são compostos que possuem grupos fosfato, e que com a perda deste grupo fosfato adquiram cor, como é o caso do p-Nitrofenil-fosfato, que se torna amarelo ao perder o grupo fosfato. 2.3.3.3 Fluoróforo Fluoróforo é um composto que emite luz de uma certo comprimento de onda (λ) (coloração) quando excitado por uma luz de um outro λ. A tabela abaixo mostra alguns fluoróforos: Tabela 1. Fluoróforos com os seus λs de excitação, emissão e coloração. Fluoróforo λ de excitação (nm) λ de emissão (nm) Coloração 495 552 525 570 verde vermelho Fluoresceína Rhodamina Fluoróforos com características diferentes torna possível marcar antígenos diferentes com cores diferentes em um mesmo tecido ou célula, permitindo a observação simultânea de dois ou mais componentes. 2.3.4 Metais pesados O principal metal pesado conjugado a anticorpos é ouro. Isto permite localizar antígenos através da microscopia eletrônica, permitindo o estudos citológicos bastante específicos. 2.4 Amplificação do sinal Uma das características mais importantes dos métodos imunológicos de detecção é a sua alta sensibilidade. Para que isto seja possível, utiliza-se vários “truques” que amplificam o sinal. Quando se utiliza uma enzima para a detecção, esta amplificação provém do fato de que aquela enzima poderá produzir vários sinais (fótons de luz, cromóforos, etc), pois a enzima continuará ativa enquanto tiver substrato. 3. Técnicas 3.1 Purificação 8 Como discutido anteriormente, uma das principais características dos anticorpos é a sua especificidade pelo substrato. Parece óbvio que este especificidade possa ser utilizada para a purificação de proteínas. Neste item abordaremos duas técnicas que utilizam anticorpos como forma de purificação, a imunoprecipitação e a cromatografia por afinidade. 3.1.1 Imunoprecipitação Na imunoprecipitação usa-se um anticorpo ligado à minúsculas esferas agarose (que é uma resina) para precipitar o antígeno. Geralmente esta ligação entre anticorpo e agarose é feita através de uma proteína A, mas também pode ser feita através de outras pontes como a biotina/estreptoavidina (ver Ponte 2.3.1). Nesta técnica é importante mencionar que o lisado deve ser feito em um meio que permite a ligação antígeno/anticorpo, reduzidas concentrações de isto é, contendo detergentes não- iônicos e condição de pH e força iônica adequadas. A este lisados, adiciona-se o anticorpo contra o antígeno que se deseja separar e depois a proteína A ligada à agarose. Como as esferas de agarose Figura 5. Imunoprecipitação. A esquerda uma sepação das proteínas da célula. A direita uma imunoprecipitação com anticorpo específico, que reconhece o antígeno e um outro um um anticorpo inespecífico possuem um tamanho imenso quando comparadas com os componentes celulares encontrados no lisado, pode-se precipitá-las com facilidade usando uma centrifugação a baixa velocidade. Após esta centrifugação pode-se dissolver o precipitado (no qual está o antígeno ligado à agarose) em uma solução de eletroforese para que esta antígeno possa ser analisado através da técnica eletroforética. 3.1.2 Cromatografia por Afinidade A principal característica que se busca na fase estacionária de uma cromatografia é que esta ligue de forma diferenciada os compostos a serem separados. Vários compostos podem produzir esta ligação diferencial baseados principalmente em propriedades químicas dos compostos. Os anticorpos tem como principal vantagem não ligar apenas de forma diferenciada a certos compostos, mas sim selecionar de forma específica um composto. Para conseguir isto, ligando-se um anticorpo a uma fase estacionária e se faz passar o lisado que contém o antígeno. 9 Após lavar a coluna cromatográfica por um certo período de tempo para retirar os componentes não ligados, se elui o antígeno purificado com uma solução contendo condições que diminuam a interação antígeno/anticorpo, como, força iônica mais elevada, pH diferente do pH fisiológico, detergentes ou solventes apolares. Quando comparado com outras cromatografias, a de afinidade geralmente é a que tem um poder de purificação mais elevado. 3.2 Quantificação e análise 3.2.1 Imunodetecção A imunodetecção (também denominada “imunoblotting”) é uma técnica que possibilita reconhecer e quantificar antígenos a partir de um gel de eletroforese, geralmente SDS-PAGE. 3.2.1.1 Transferência para a Membranas O gel de eletroforese é um meio pouco apropriado para a imunodetecção, isto é, não é um bom suporte para as ligações antígeno/anticorpo. Assim sendo, utiliza-se membranas constituídas geralmente de papel, isto é, de celulose, alterada quimicamente. Como exemplo pode-se citar a nitrocelulose, que possui grupos nitro ligados à celulose produzindo desta forma um suporte com alta afinidade por proteínas, fazendo com que estas permaneçam presas a sua superfície. Para transferir o antígeno do gel de eletroforese membrana elétrico utiliza-se (mesmo para um a campo princípio da eletroforese). Neste método, coloca- Figura 6. Transferência das proteínas para a membrana. se a membrana sobre o ânodo (+) coberto por vários papeis filtro e em seguida o gel, que entrará em contato com o cátodo (-), também através de papéis filtro, fazendo com que as proteínas, ainda embebidas em SDS (-), possam migrar para o ânodo. Este “sanduíche” é mostrado na Figura 6. Um método alternativo, denominado “dot”, permite o uso do lisado celular para a detecção do antígeno. Neste caso, não é necessário separar as proteínas por eletroforese, sendo uma pequena quantidade do lisado celular (~0,3µl) pingado diretamente sobre a membrana. 10 3.2.1.2 Bloqueio Como a membrana possui uma alta afinidade por proteínas é necessário bloqueá-la, pois ao contrário os anticorpos se ligariam a toda a superfície da membrana e não, como desejado, especificamente ao antígeno. Figura 7. Componentes da imunodetecção Para bloquear a membrana geralmente se usa leite em pó desnatado, mas polímeros sintéticos como a poli-vinil-pilorridona (PVP) também podem ser usados, principalmente em casos nos quais os componentes do leite prejudicam a ligação antígeno/anticorpo. 3.2.1.3 Primeiro anticorpo Feito isto, adiciona-se o primeiro anticorpo, ou seja, aquele que se ligará ao antígeno. Este anticorpo é adicionado em uma solução que mimetiza a solução na qual ele foi sintetizado, ou seja, o meio extracelular nos quais os linfócitos B estão embebidos na hora de se ligarem ao antígeno e serem selecionados para produzí-lo (um tampão com pH 7,5 e força iônica em torno de 1 0sm - 500mM NaCl). A diluição (título) e o tempo de reação, quando não especificado pelo fabricante (no caso de anticorpos comerciais) precisam ser determinados empiricamente. 3.2.1.4 Segundo anticorpo 11 Muitas vezes o primeiro anticorpo já possui um componente que possa ser detectado (dispensando o presente item e o seguinte) ou uma molécula ponte que se ligue a uma molécula de detecção, dispensando o segundo anticorpo. Quando isto não é o caso, o segundo anticorpo se faz necessário. Este anticorpo é desenvolvido contra o IgG do animal no qual foi desenvolvido o primeiro anticorpo. Por exemplo: se o primeiro anticorpo foi desenvolvido em camundongo, precisaremos neste passo um anticorpo anti-IgG de camundongo (obviamente desenvolvido em outro animal). Este segundo anticorpo possui ou um componente do tipo ponte ou um componente detectável. Mas por que da existências deste passo, se estes componentes podem ser colocados diretamente nos primeiros anticorpos? Isto está principalmente relacionado com a dificuldade de se modificar um anticorpo, ou seja, colocar nele algum componente. Usando o segundo anticorpo, dispensa a modificação do primeiro anticorpo, sendo possível desta forma produzir primeiros anticorpos contra vários antígenos e modificar somente o segundo anticorpo. A montagem de todos os componentes da imunodetecção pode ser vista na Figura 7. Figura 8. Especificidade da imunodetecção. Somente a proteína específica é reconhecida. A detecção pode ser feita de várias formas, como discutido no item 2.3.3. 3.2.2 Imunocitoquímica A imunocitoquímica usa o mesmo princípio da imunodetecção, isto é, a ligação específica do anticorpo detectável ao antígeno. A única diferença está na apresentação do antígeno, que em vez de estar sobre uma membrana se encontra no tecido fixado. Este método tem uma precisão menor quando comparado com a imunodetecção, mas tem como principal vantagem mostrar a localização cito e histológica do antígeno. Os sistemas de detecção nesta técnica geralmente são a peroxidase / DAB (diaminobenzidina) + H2O2 ou então os fluoróforos discutidos no item 2.3.3.3. Usando diversos fluoróforos ligados a diferentes anticorpos é possível determinar em um mesmo tecido a colocalização de dois ou mais antígenos, fato muito importante para a pesquisa em biologia celular. 12 Figura 9. Imunocitoquímica utilizando dois anticorpos. Foto da esquerda: Imunocitoquímica com um anticorpo contra uma cinase (verde) sendo o DNA corado com DAPI (azul); figura do meio: a mesma célula, corado com um anticorpo que reconhece γ-tubulina (vermelho), um componente do centrosomo. Figura da direita, sobreposição das outras duas imagens, mostrando a co-localização no centrosomo. 3.2.3 Radioimunoensaio Este método usa o antígeno marcado radioativamente e anticorpos para determinar a concentração de antígenos com uma precisão bastante elevada, sendo bastante usada para a determinação da concentração de hormônios. Este método se baseia basicamente na reação reversível antígeno anticorpo. Como podemos ver na Figura 10 o antígeno marcado (At*) compete pelo anticorpo (Ac) com o antígeno não marcado (At) para formar o complexo AcAt (marcado ou não). Figura 10. Radioimunoensaio Quando se adiciona o antígeno não marcado (cuja concentração é desconhecida) a reação Ac + At* em equilíbrio com AcAt* será deslocada para a esquerda, pois a concentração de um dos reagentes, isto é Ac, diminuiu, fazendo com que a concentração de AcAt* também diminua (segundo a lei de equilíbrio de Le Chatelier). Assim sendo, isolando-se o complexo AcAt (marcado ou não) e medindo-se a radiaoatividade deste complexo (com isso somente detectando AcAt*) será possível determinar At, que é justamente a concentração de antígeno que se pretende determinar. Como em outros métodos quantitativos, estes métodos também exigem que se faça uma curva padrão (usando concentrações conhecidas de At) e comparar estes valores com os encontrados nas amostras desconhecidas. Alguns variantes desta técnica podem usar, ao invés do antígeno marcado, anticorpo marcado, sendo o procedimento experimental bastante semelhante. 13 3.2.4 ELISA Esta técnica usa um princípio semelhante à imunodeteção, com a diferença que na ELISA o antígeno é preso a uma superfície (geralmente de poliestireno) através de um anticorpo. Uma vez o antígeno ligado ao anticorpo imobilizado, este complexo pode ser reconhecido por um outro anticorpo, desta vez ligado a uma enzima que possa produzir um composto facilmente detectável. A grande vantagem desta técnica é que, como a detecção é uma reação enzimática, torna possível a detecção de quantidades muito reduzidas de antígeno pois permitindo que a reaão ocorra por um tempo elevado cosegue-se produzir uma quantidade considerável de alguma molécula detectável (fluoróforo). Um exemplo é a detecção do hormônio placental ganadotrofina corínica, um teste de gravidez bastante confiável. 4. Conclusão Os métodos imunológicos estão distribuído amplamente tanto na pesquisa como na análise bioquímica. Dentre as diversas vantagens destas técnicas, duas parecem ser as mais importantes para o grande sucesso destes métodos: A grande especificidade facilmente conseguida com os anticorpos e a grande sensibilidade destes métodos além da imensa diversidade e maleabilidade destas técnicas, uma vez que praticamente todos os componentes usados nestes métodos podem ser interligados, basta utilizar as pontes adequadas. Estas características fizeram dos métodos imunológicos de grande utilidade em várias áreas das ciências biológicas e médicas, sendo o seu conhecimento fundamental tanto nas ciências básicas como nas aplicadas. 5. Referências Alberts, B, Dennis, B., Lewis, J., Raff, M., Roberts, K., Watson, J. D., Molecular Biology of the Cell, 3rd Ed. Garland Publ. New York. (1995). Voet, D. Voet, J., Biochemistry, 2nd Ed. John Wiley & Sons, New York, (1995). Roitt, I., Brostoff, J., Male, D., Immunology, 2nd Ed. Gower Med. Publishing, London, (1989). 14
Baixar