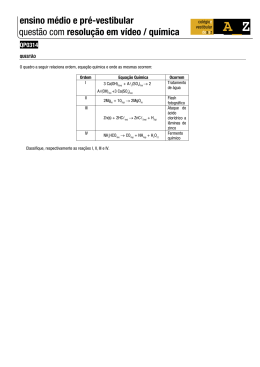
Capacidade Todos temos capacidades... o problema é acreditarmos NELAS... Onde encher nosso copo, balde, caminhão pipa... Para adquirir melhor CAPACIDADE de excelência??? Bebedouros Torneiras Riachos... Utilize seus Recursos... Analise o POTENCIAL... Data de Início As idéias são todos os seus sonhos transformados para algo que você pensa que esta realizado... Os projetos são materializações das idéias. Nunca os deixe na “memória”. Escreva-os sempre que os definir. Neles estão contidos o que você esta disposto a fazer ou a não fazer. Que tipo de ESTUDANTE é VOCÊ? Estratégia coerente com a realização Clareza de Objetivo Objetivo Secundário Estratégias Secundárias Prazo de Realização (Data de término) Sempre bem Visível. Ver TODOS os Dias Aula 04 Cálculos Químicos Caracterização de materiais ou substâncias Cálculos Químicos Fórmulas Químicas Tipos de Fórmulas Químicas É a forma pela qual podemos representar uma substância pura. Sabendo-se que o mol de uma substância é 180 e que em sua composição existe C em 40%, H em 6,67% e O em 53,33%, qual a fórmula molecular e a fórmula mínima do composto? (dados: H=1, C=12, O=16) Na fórmula química existem as proporções definidas de cada um dos elementos que constitui a substância. Resolução Dados: Mol = 180 C = 40% H = 6,67 % O = 53,33% C = 12 H=1 O = 16 Pergunta do problema: Fórmula Molecular ? Fórmula Mínima ? Reações Químicas C = 72 H = 12,006 = 12 O fenômeno químico também é conhecido como reação química. O = 95,994 = 96 Reação química é a descrição de um fenômeno químico. C = 6 H = 12 O = 6 C6H12O6 (CH2O)(6) Equações Químicas Reagentes Quando uma reação química é representada através de fórmulas e símbolos temos a Equação Química. Produtos Atomocidade x Coeficientes 2 H2O (ℓ) Fase Física 1 Coeficiente 2 H2(g) + O2(g) → 2 H2O(ℓ) Indica contato Indica produção Números que colocados antes de reagentes e produtos determinam uma relação em quantidade de matéria entre eles. Atomicidade Números que nas fórmulas indicam a menor proporção entre os elementos que constituem uma substância Acerto de Coeficientes Acerto de Coeficientes A lei que determina o acerto de coeficientes é a Lei de Lavoisier: A Lei da Conservação da Matéria possui uma conseqüência imediata: “Na natureza nada se perde, nada se cria, tudo se transforma”. Transformação Número de átomos dos Reagentes Método das Tentativas Procedimento Dada a equação: Aℓ(OH)3 + H2SO4 → Aℓ2(SO4)3 + H2O Passo 1: determine a maior atomicidade Aℓ(OH)3 + H2SO4 → Aℓ2(SO4)3 + H2O Passo 2: nessa substância coloque coeficiente 1 Massa dos Produtos Massa dos Reagentes = Número de átomos dos Produtos Método das Tentativas Passo 3: O maior índice de um lado passa como coeficiente do outro lado no mesmo átomo 2 Aℓ(OH)3 + H2SO4 → 1 Aℓ2(SO4)3 + H2O Ou : Aℓ(OH)3 + 3 H2SO4 → 1 Aℓ2(SO4)3 + H2O Aℓ(OH)3 + H2SO4 → 1 Aℓ2(SO4)3 + H2O Método das Tentativas Passo 4: Os outros átomos são acertados por Número de átomos dos Reagentes = Número de átomos dos Produtos Aℓ(OH)3 + H2SO4 → Aℓ2(SO4)3 + H2O 2Aℓ(OH)3 + 3H2SO4 → 1Aℓ2(SO4)3 + 6H2O Passo 5: Os átomos de H e O SEMPRE deixar por último Tipos de reações Químicas Síntese: A + B → AB (fotossíntese) Analise: AB → A + B (decomposição térmica) Simples troca (deslocamento): AB + C → CB + A (produção de gás hidrogênio) Dupla troca (duplo deslocamento) AB + CD → CB + AD (neutralização) Ocorrência das reações Químicas As condições para que ocorra uma reação qualquer são: Contato entre os reagentes Reatividade química entre os reagentes. As principais reações, em termos de ocorrência de reações, são as de dupla troca. Molécula - grama ( mol ) É a massa molecular de uma substância expressa em gramas; Quantidade de matéria existente em um determinado sistema. Ocorrência das reações Químicas Ocorre dupla troca quando: Um dos produtos é insolúvel em água; Um dos produtos é mais fraco que os reagentes; Um dos produtos é gás na temperatura ambiente; Um dos produtos é substância instável. Molécula - grama ( mol ) H2 → 2 x H = 2 x 1 = 2 S → 1 x S = 1 x 32 = 32 H2SO4 O4 → 4 x O = 4 x 16 = 64 + Total = 98 1 mol de H2SO4 é igual a 98 g Cálculo Estequiométrico É o cálculo que representa os aspectos quantitativos das reações químicas. Para se fazer cálculo estequiométrico em relações químicas é necessário os seguintes passos: Cálculo Estequiométrico Passo 1: Observe a reação ou o que o problema relata sobre a reação. Passo 2: Acerte os coeficientes se for necessário e com eles Faça a relação do mol de cada uma das substâncias. Observe o exemplo: 2 H2(g) +1O2(g) → 2 H2O(ℓ) 2 mols 1 mols 2 mols Cálculo Estequiométrico Passo 3: Após estabelecer a relação com o número de mols estabeleça a relação: 1 mol = massa em g. 2 H2(g) +1O2(g) → 2 H2O(ℓ) 2 mols 1 mols 2 mols Caracterização de substâncias químicas 2 x 2 g 1 x 32 g 2 x 18 g Passo 4: Resolva o problema por regra de três utilizando os dados fornecidos e as quantidades de matéria da relação do mol. Iônico – Molecular - Metálico Propriedade dos compostos Iônico – Molecular – Metálico Ácido – Base – Sal – Óxido Alguns compostos e suas Utilizações Iônico Sólidos cristalinos, cristais duros e quebradiços, Altos PF e PE, condução de eletricidade em solução ou derretidos, solúveis em água. Molecular Sólidos, líquidos ou gasosos, baixos PF e PE, insolúveis em água, não conduzem Metais Sólidos, brilho característico, insolúveis, conduzem na fase sólida. Ácidos – Bases – Sais - Óxidos Ácidos Moleculares, sabor azedo, conduzem em solução Bases Iônicos, sabor caustico, conduzem em solução Sais Iônicos, reação de ácido e base, conduzem em solução ou derretidos Óxidos Iônicos ou moleculares, em geral poluentes, podem ser minérios. Alguns Ácidos Água boricada - ácido bórico ( H3BO3 ) Ácido Nítrico – (HNO3), Água de bateria - ácido sulfúrico ( H2SO4 ), Vinagre - ácido acético ( CH3COOH ), Refrigerantes - ácido carbônico ( H2CO3 ) Chuva Ácida Alguns Ácidos Ocorrem quando alguns óxidos de nitrogênio, carbono e enxofre entram em contato com o vapor de água e o oxigênio da atmosfera, formando assim, ácido nítrico, ácido sulfúrico e carbônico. Essas chuvas causam grande destruição ao caírem sobre florestas pois queimam as folhas das árvores e expõem o solo à erosão. Algumas Bases Algumas Bases Soda Cáustica – hidróxido de sódio (NaOH) Potassa – hidróxido de potássio (KOH), Cal extinta – hidróxido de cálcio (Ca(OH)2) Magnésia – hidróxido de magnésio (Mg(OH)2) Pepsamar – hidróxido de alumínio (Al(OH)3) Amoníaco – hidróxido de amônia (NH4OH) Alguns Sais Sal de cozinha – cloreto de sódio (NaCl) K-boa – hipoclorito de sódio (NaClO) Calcário – carbonato de cálcio (CaCO3) Sais minerais – Ca, P, Fe, Mg, Zn, K, Cl, F Fertilizantes Alguns Sais Alguns Óxidos Alguns Óxidos Gás carbônico – dióxido de carbono (CO2) Gás sulfuroso – trióxido de enxofre (SO3) Gás nítrico-nitroso – pentóxido de dinitrogeno (N2O5) Gás hilariante – monóxido de dinitrogeno (N2O) Bauxita, cassiterita, pirolusita, hematita, caolim (Al2O3.SiO2) Lua Laranja Lua Laranja Quando a lua esta cheia e próxima ao horizonte, em determinadas épocas do ano, ela assume uma coloração alaranjada ou vermelha. Esta maior quantidade de atmosfera provoca um refração nos raios de coloração azulada fazendo seus espalhamento. Isto ocorre porque os seus raios luminosos tem que atravessar maior quantidade de atmosfera. Os raios de coloração avermelhada são concentrados e isto provoca a coloração anormal da lua.
Baixar