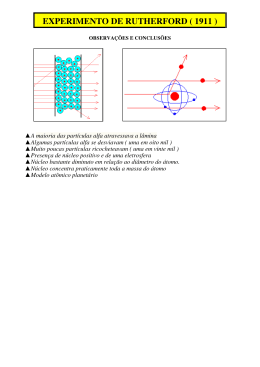
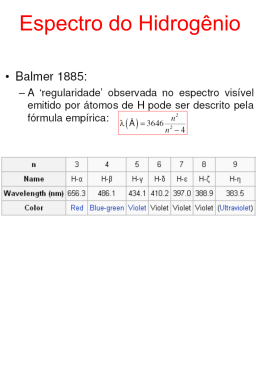
FÍSICA Prof. Rovilson FÍSICA QUÂNTICA Introdução Em 2000 completamos cem anos da constante de Planck, um marco histórico na física. Em 1900, a física quântica estava dando seus primeiros passos. Seria muita pretensão de nossa parte apresentar cem anos de pesquisa nesta pequena apostila. Queremos passar para você uma noção das principais ideias dessa nova área. Planck lançou mão de uma expressão inusitada para explicar os seus resultados da medida da intensidade da radiação emitida por um radiador ideal - o corpo negro - levando-o assim a estabelecer o valor de uma nova constante universal que ficou conhecida como a constante de Planck. A partir daí, e também em função de outras experiências que apresentavam resultados igualmente surpreendentes no contexto da mecânica de Newton e do eletromagnetismo de Maxwell, os pesquisadores do começo do século passado se viram obrigados a formular hipóteses revolucionárias que culminaram na elaboração de uma nova física, capaz de descrever os estranhos fenômenos que ocorriam na escala atômica; a mecânica quântica. Esta teoria, com a sua nova conceituação sobre a matéria e os seus intrigantes postulados, gerou debates não só no âmbito das ciências exatas, mas também no da filosofia provocando assim uma grande revolução intelectual no século XX. Obviamente que, além das discussões sérias e conceitualmente sólidas, as características não cotidianas dos fenômenos quânticos levaram muitos pesquisadores, e também leigos, a formular interpretações equivocadas da nova teoria, o que infelizmente, ainda em nossos dias, atrai a atenção das pessoas menos informadas. Mas, no final das contas, quais são estes efeitos tão estranhos dos quais estamos falando e qual é a sua relevância para o nosso cotidiano, se existe alguma? Bem, para provar que não estamos falando de coisas inúteis: O aluno certamente se surpreenderia se disséssemos que sem a mecânica quântica não conheceríamos inúmeros objetos com os quais lidamos corriqueiramente hoje. Só para se ter uma ideia podemos mencionar o nosso aparelho de CD, o controle remoto de nossas TVs, os aparelhos de ressonância magnética em hospitais ou até mesmo o microcomputador que ora usamos na elaboração desta apostila. Todos os dispositivos eletrônicos usados nos equipamentos da chamada high-tech só puderam ser projetados porque conhecemos a mecânica quântica. A título de informação, 30% do PIB americano é devido a estas tecnologias. A teoria quântica representa uma generalização da física clássica, assim como, a relatividade estende o campo de aplicação das leis físicas para a região de grandes velocidades, a física quântica estende seu campo para regiões de pequenas dimensões, e, assim como a constante universal da relatividade é c(velocidade da luz), na física quântica a constante de significado é h(constante de Planck). Planck introduziu essa constante em 1900 quando tentava explicar as propriedades observadas da radiação térmica. Assim, no século XX nascia uma nova constante na física, a chamada constante de Planck de valor -34 -15 h = 6,63 · 10 J · s ou 4,14 · 10 eV · s O Efeito Fotoelétrico Ao final do século XIX já se conhecia o fato de que alguns eletroscópios podiam ser descarregados quando iluminados por luz, especialmente luz ultravioleta. A luz, de alguma forma, arrancava cargas elétricas de uma placa emissora. A emissão deelétrons de uma superfície é chamada Efeito Fotoelétrico (Emissão de elétrons por uma superfície devido à incidência de luz). Os elétrons liberados são chamados fotoelétrons. Essas cargas podiam ser aceleradas por uma diferença de potencial (ddp) e coletadas por 1 outra placa. Um amperímetro registrava a chegada das cargas, medindo uma corrente elétrica. O esquema está ilustrado na figura a seguir. Diante dos resultados experimentais, o físico alemão Lenord, concluiu que: I – O efeito fotoelétrico só ocorre a partir de uma determinada frequência . II – A partir do momento que o fenômeno tem início, a quantidade de cargas emitidas da placa é diretamente proporcional à intensidade da luz. III – Para frequências menores que , o fenômeno não existe. Há dois aspectos principais do efeito fotoelétrico que não podem ser explicados em termos da teoria ondulatória clássica da luz. 1º) A teoria ondulatória requer que a amplitude do campo elétrico oscilante da onda luminosa cresça se a intensidade da luz for aumentada. Já que a força aplicada ao elétron e , isto sugere que a energia cinética dos fotoelétrons deveria crescer ao se aumentar a intensidade do feixe luminoso. Entretanto, a experiência mostra que a energia cinética máxima ( ), que é igual a ( ), independe da intensidade da luz. 2º) De acordo com a teoria ondulatória, o efeito fotoelétrico deveria ocorrer para qualquer frequência de luz, desde que esta fosse intensa o bastante para dar a energia necessária à ejeção de elétrons. Entretanto, a experiência mostra que existe um limiar de frequência f 0 característica. Para frequências menores que f0 o efeito fotoelétrico não ocorre, qualquer que seja a intensidade da iluminação. Resumindo: considerando a luz incidente na placa como uma onda eletromagnética e sabendo que a ela há um campo elétrico associado, até que seria possível imaginarmos uma força elétrica capaz de arrancar as cargas das placas. Mas, se essa fosse a explicação correta, para acontecer o fenômeno, a explicação e que deveria haver força suficiente para arrancar as cargas e isso dependeria apenas da intensidade da luz incidente e não da frequência. Assim, com uma luz intensa, para qualquer frequência, o efeito deveria começar a ocorrer. Não era o que se observava. Tanto para luz fraca quanto para luz forte, abaixo de certafrequência ( ) o efeito não aconteceria. Não havia como explicar classicamente a influência da frequência no fenômeno. A explicação de Einstein para o Efeito Fotoelétrico Em 1905 Einstein colocou em questão a teoria clássica da luz, propôs uma nova teoria, e citou o efeito fotoelétrico como uma aplicação que poderia testar qual teoria estava correta. Como já mencionamos Planck originalmente restringiu seu conceito de quantização de energia aos elétrons nas paredes de um corpo negro. Ele acreditava que a energia eletromagnética, uma vez irradiada, se espalhava pelo espaço da mesma forma que onda de água se espalha na água. Em vez disso, Einstein propôs que a energia radiante estaria quantizada em pacotes concentrados, que mais tarde vieram a ser chamados fótons. Com isso, a luz passou a ser tratada não mais como um conjunto de partículas. Cada partícula seria um pacote discreto de energia ou quanta de luz. Pela equação de Planck, Einstein concluiu que cada quanta de luz teria energia .Segundo Einstein, as partículas de luz deveria se chocar contra os elétrons, transferindo energia para eles durante a colisão. Só que o elétron está preso no material e, para se libertar de sua ”prisão energética” precisava receber certa dose de energia que, fisicamente corresponde a um trabalho a ser realizado. Essa dose de energia para arrancar o elétron é chamada de função trabalho ( ). Na tabela abaixo alguns valores para o valor da função trabalho: 2 Φ (eV) 2,28 4,08 4,31 4,50 4,73 METAL Sódio Alumínio Zinco Ferro Prata O elétron recebe um quanta de energia e temos as seguintes hipóteses: I) Se a energia ( ) for menor que a função trabalho ( ), não haverá energia mínima suficiente para liberar o elétron e nada ocorre. II) Se a energia ( ) for maior que a função trabalho ( ), haverá energia suficiente para liberar o elétron com “sobra”. Esse excedente de energia( ), será igual à energia cinética ( ) adquirida pelo elétron( ). III) Se a energia ( ) for igual à função trabalho ( ) haverá energia suficiente apenas para liberar o elétron, mas não teremos “sobra”. Nesse caso, . Essa hipótese corresponde ao caso limite a partir do qual o elétron passa a ser liberado do metal. A frequência na expressão corresponde ao valor mínimo ( ) a partir do qual o efeito fotoelétrico começa ocorrer. Assim: Obs.: Para cada material temos um valor da função trabalho ( ) e independentemente do material a reta da energia cinética versos a frequência sempre será paralela, pois o seu coeficiente angular é a própria constante de Plank (veja a figura). Aplicação: ´´olho elétrico`` Dispositivo que abre e fecha circuitos elétricos de portas para estabelecimento em geral. Na figura abaixo, esse dispositivo está representado esquematicamente. 3 A luz proveniente de uma lâmpada passa através de aberturas na lateral do portal e incide numa placa metálica colocada ao lado do mesmo. Essa placa ao ser iluminada libera elétrons da sua superfície. O fluxo desses elétrons através do fio constitui a corrente elétrica que passará na bobina, fazendo-a atuar sobre o braço metálico, o que evita o acionamento da campainha. Embora Einstein tenha ficado famoso pela Teoria da Relatividade, foi a explicação original do efeito fotoelétrico que lhe concedeu o prêmio Nobel em 1924. Exemplo 1:A função trabalho do zinco é 4,3 eV. Um fotoelétron do zinco é emitido com energia cinética máxima de 4,2 eV. Qual a frequência do fóton incidente que emitiu aquele fotoelétron? Dado: Constante de -34 -19 Planck h = 6,63.10 J.s e 1 eV.s = 1,6.10 J.s) Solução: Utilizando a equação de Einstein para o efeito foto elétrico, Temos: -19 Para passar para Joule basta multiplicar pelo valor 1,6.10 . Assim temos: Logo: 15 Resposta: 2,05.10 Hz Exemplo 2:O comprimento de onda de corte do potássio é 558 nm. Qual é a função trabalho do potássio? Qual é o potencial de cortepara a luz incidente de 400 nm? Solução: Utilizando a equação de Einstein para o efeito fotoelétrico, Temos: O comprimento de onda de corte é aquele pelos quais os elétrons excitados têm exatamente a -15 energia necessária para vencer a barreira de potencial. Dado: Constante de Planck = 4,14.10 eV.s Para luz incidente de 400 nm a energia pode ser dada por: OBS: O potencial de corte é igual à energia cinética máximas dos elétrons. Resposta = 0,88 eV Exemplo 3:A intensidade luminosa é a quantidade de energia que a luz transporta por unidade de área transversal à sua direção de propagação e por unidade de tempo. De acordo com Einstein, a luz é constituída por partículas, denominadas fótons, cuja energia é proporcional à sua frequência. 14 2 Luz monocromática com frequência de6 x 10 Hz e intensidade de 0,2 J/m .s incide 2 perpendicularmente sobre uma superfície de área igual a 1 cm . Qual o número aproximado de fótons que atinge a superfície em um intervalo de tempo de 1 segundo? -34 (Constante de Planck: h = 6,63 x 10 J.s) Solução: Dados: Resposta: 5.10 13 fótons 4 O Átomo do Bohr Uma breve história dos modelos atômicos: Na Grécia antiga, já existia a ideia de algo muito simples, fundamental, do qual tudo seria feito: o átomo. A ideia de átomo foi proposta por Leucico e elaborada por Demócrito no século Va.c. A partir daí o conceito de átomos começa a ganhar força e aparecem vários defensores da sua existência, inclusive Isaac Newton (1942-1727). Em 1803, o químico inglês John Dalton (1766-1844), trabalhou com o conceito de que a matéria comoconhecemos deveria ser constituída por átomos que seriam partículas maciças e indivisíveis, muito rígidas, como minúsculas bolas de bilhar. Em 1897 THOMSON (1856-1940) conseguiu produzir um feixe de partículas negativas utilizando um tubo de raios catódicos, algo semelhante ao tubo de TV dos nossos dias. THOMPSON fez um ajuste no modelo de Dalton, propondo que o átomo não era indivisível, mas tinha subpartículas negativas, os elétrons. Como o átomo deDalton era neutro, Thomson imaginou que deveriam existir cargas positivas para contrabalançarem as negativas. Em 1907, Ernest Rutherford (1871-1937), observou um espalhamento não esperado bombardeando finas lâminas metálicas com partículas alfa (íons de hélio). Rutheford conclui que isso só seria possível se o átomo tivesse um núcleo, positivo, muito concentrado e rígido, de 10.000 a 100.000 vezes menor que o átomo todo. Rutheford não sabia da existência de prótons, mas ele próprio já havia elaborado a teoria de desintegração radioativa e sabia que as partículas alfas saíam dos átomos. Em 1911, época do modelo atômico de Rutherford, já se sabia que, aquecendo um gás ou fazendo uma corrente elétrica passar por ele, haveria emissão de luz. Para elementos que não são gases na temperatura ambiente, bastava colocá-los dentro de um recipiente evacuado (ampola) para que se desprendesse um vapor do material. Esse vapor excitado emitia luz. Também era muito comum o teste dos materiais em contato com a chama num bico de Bunsen, emitindo cores variadas, característico do material, como mostrado na figura abaixo. Num procedimento um pouco mais sofisticado, essa luz emitida pelo elemento excitado era coletada, colimada por uma fenda e, depois de passar por um prisma ou uma rede de difração, as suas diversas faixas de frequência (cores) eram separadas. Apareciam então as linhas (ou raias) de emissão que constituem o espectro atômico do elemento. Esse espectro podia ser projetado num anteparo ou fixado numa chapa fotográfica. Não havia explicação para o fato de o espectro ser descontínuo, ou seja, a existência de frequências (cores) da luz emitida tão bem definidas. Essa luz emitida pelos átomos excitados era associada ao movimento dos elétrons, mas nem o novo modelo de Rutherford, que foi um avançado científico para aépoca, era compatível com o espectro descontínuo. Repare bem que os elétrons, girando em movimento circular ao redor do núcleo, mesmo que o movimento fosse circular uniforme, estariam constantemente sendo acelerados, pois o MCU tem uma aceleração centrípeta. Já se sabia na época a partir do trabalho de Maxwell sobre eletromagnetismo, que cargas aceleradas irradiam ondas eletromagnéticas e, portanto, “gastam” energia. Sendo assim, os elétrons não poderiamter órbita circular estável, mantendo sempre a mesma distância do núcleo. Pelo contrário, para compensar essa perda de energia, deveria se aproximar gradativamente do núcleo em movimento espiral, até uma colisão final. 5 Quanto mais perto do núcleo os elétrons estivessem, mais depressa eles deveriam girar (como os planetas do sistema solar). Sendo assim,a frequência do movimento circular do elétron deveria mudar continuamente, emitindo uma onda equivalente a um espectro contínuo e não raias discretas como mostravam os experimentos. O problema ainda estava em aberto e só iria começar a ser resolvido com um novo modelo proposto por Niels Bohr (1885-1965), como uma correção do modelo de Rutherford e que será visto a seguir. O Modelo de Bohr Em 1913, o físico dinamarquês Niels Bohr (1885-1965) propôs uma correção no modelo atômico de Rutherford com base no conceito de quantização da energia. No modelo de Bohr continuava a existir um núcleo concentrado e positivo com elétrons girando a seu redor em órbitas circulares. No entanto, havia uma restrição quanto às órbitas permitidas para o elétron. Segundo Bohr, os elétrons poderiam ocupar apenas órbitas permitidas, cujos raios r n fossem dados pela expressão: Bohr chamou essas órbitas de estados estacionários para os quais o valor correspondente a n = 1 é chamado de estado fundamental. Para cada um dos estados (ou órbitas) o elétron poderia permanecer por um tempo indeterminado girando ao redor do núcleo, sem emanar energia alguma. Sendo assim, a cada um dos estados estacionários haveria sempre uma energia fixa associada E n, dada por: Nas expressões anteriores considera-se n = 1,2,3,... Para cada órbita permitida. Além disso, é a permissividade elétrica do vácuo, h é a constante de Planck, é o conhecido número pi, m é a massa do -19 elétron bem como e = 1,6.10 C é o valor de sua carga elétrica em módulo (carga elementar). Z é o número atômico (número de prótons ou de elétrons no estado fundamental) do elemento considerado. O Salto Quântico e os Espectros de Absorção e Emissão A frequência da luz emitida pelos átomos excitados, pela teoria clássica, deveria ser a própria frequência do elétron girando ao redor do núcleo. Mas o modelo revolucionário de Bohr mostra que não é exatamente isso. Aparece a ideia de salto quânticodo elétron e afrequência da luz emitida depende na verdade da diferençade energia entre os níveis ocupados pelo elétron. A descontinuidade do espectro está exatamente aí, uma vez que as energias são quantizadas. Se o elétron ganhar (absorver) energia, poderá saltar para uma órbita mais externa (com r n e En maiores). Caso contrário se perder (emitir) energia, então poderá voltar para uma órbita menos energética (com rn e En menores). Em concordância com a teoria de Einstein, como a energia eletromagnética sempre está disponível em “pacotes” ( ), o elétron não pode soltar para qualquer órbita, mas apenas para certas órbitas permitidas. Em outras palavras, ganhar energia aqui significa absorver um quanta de luz (ou fóton) de energia predefinida ( ). A diferença de energia entre os estados inicial ( ) e final ( ) do elétron durante um salto quântico será dada pela fórmula de Planck, ou seja: O Espectro de Emissão Vamos supor uma amostra de hidrogênio que é de alguma forma excitada. Um elétron salta do nível n = 2 para n = 3 . Em seguida volta para seu estado inicial, n = 2 emitindo um fóton. No estado n = 3 a 6 energia é E3 = -1,51 eV e no estado n = 2 a energia é E 2 = -3,4 eV. A frequência do fóton emitido será: Note que essa frequência equivale à raia da série de Balmer, veja a figura abaixo: Com uma chapa fotográfica podemos registrar essa e outras linhas brilhantes de luz emitida sobre um fundo negro. Houve emissão de energia pelo átomo e, por isso mesmo, esse tipo de espectro é chamado de espectro de emissão. O Espectro de Absorção Vamos supor agora uma amostra de hidrogênio que é atravessada por um feixe de luz. Os elétrons de gás podem absorver energia da luz incidente e “roubar” fótons. Não é qualquer fóton que “interessa” para o elétron, mas apenas aqueles cuja energia for suficiente para dar um salto quântico entre dois níveis de energia permitidos. Assim, alguns fótons de certa frequência (ou energia) serão absorvidos e outros passarão ilesos pelo gás. Vamos imaginar, por exemplo, que um elétron esteja ocupando o estado , com energia , e absorva um determinado fóton do feixe incidente, saltando para uma órbita superior, digamos , com energia . Agora o elétron absorveu o fóton de frequência: Note que esse valor de frequência equivale à raia da série de Balmer. Uma chapa fotográfica também pode registrar o espectro. Só que agora teremos um espectro diferente: as linhas são escuras, pois são relativas à luz de certas frequências convenientes que foram “roubadas” do feixe incidente. Como houve absorção de energia, esse tipo de espectro é chamado de espectro de absorção. 7 Repare que as linhas do espectro de emissão e do espectro de absorção ocupam a mesma posição, pois estão associadas a uma mesma frequência . Exemplo 4:Qual o raio da órbita do estado fundamental do átomo de hidrogênio? (Dados: constante de Planck: ; massa do elétron: ; permissividade do vácuo: ; carga do elétron: .) Solução: Basta aplicar a expressão Temos, portanto: do raio de uma órbita do átomo de hidrogênio para . Exemplo 5:Determine os cinco primeiros valores permitidos para a energia de um elétron no átomo de hidrogênio em elétrons-volt. (Dados: constante de Planck: ; massa do elétron: ; carga do elétron: Solução: Basta aplicar . Para ; permissividade do vácuo: a expressão dos e níveis de energia ) do átomo de hidrogênio, , temos: Esse é o valor da energia do elétron no estado fundamental do átomo de hidrogênio. Dualidade Onda Partícula Partícula: Para nós este termo significa um objeto que possui massa e é extremamente pequeno, como uma minúscula bolinha de gude. Podemos imaginar que os corpos grandes sejam compostos de um número imenso destas partículas. Este é um conceito com o qual estamos bem acostumados porque lidamos diariamente com objetos dotados de massa e que ocupam uma certa região do espaço. Onda: Este, apesar de ser também observado no nosso dia a dia, escapa à atenção de muitos de nós. Um exemplo bem simples do movimento ondulatório é o das oscilações da superfície da água de uma piscina. Se mexermos sistematicamente a nossa mão sobre esta superfície, observaremos uma ondulação se afastando, igualmente em todas as direções, do ponto onde a superfície foi perturbada. A luz apresenta uma natureza dual: ora se comporta como onda, ora se comporta como partícula. O fenômeno fotoelétrico comprova a sua natureza corpuscular (de partícula), pois os fótons interagem com os elétrons do metal da mesma forma que duas partículas interagem como colisão. Um fóton é então uma partícula sem massa que não pode ser encontrada em repouso, apenas a velocidade da luz. Lembrar que os fótons possuem momento p e energia E = h.f, mas que em função de seu momento e E = p.c. Um evento raro, porém possível, é a fusão de dois fótons, produzindo um par de elétron-pósitron, 2 sendo a massa do pósitron igual à massa do elétron. Onde a energia associada à partícula é E = m.c . Já a difração, a interferência e o efeito Doppler são evidências da natureza ondulatória da luz. 8 O Postulado De Broglie O Físico Francês Broglie dirigiu sua pesquisa teórica para a compreensão de um dos grandes problemas da física da época: a natureza dual da luz. Havia fenômenos em que a luz tinha um comportamento tipicamente ondulatório, como a interferência e difração, e também havia experiências que demonstravam seu caráter corpuscular, como o efeito fotoelétrico. A Hipótese de Broglie era de que o comportamento dual, isto é, onda-partícula, se aplicava à matéria. Assim como um fóton tem associado a ele uma onda luminosa que governa seu movimento, também uma partícula material (por exemplo, um elétron) tem associado a ela uma onda de matéria que governa seu movimento. De acordo com De Broglie, tanto a matéria quanto a radiação, a energia total E está relacionada com a frequência f da onda associada ao seu movimento pela equação ea quantidade de movimento ou momento linear (p) é relacionada ao comprimento de onda da onda associada pela equação: Essa mesma equação escrita na forma abaixo é chamada relação De Broglie. Ela prevê o comprimento de onda de uma onda de matéria associada ao movimento de uma partícula material que tem um momento . onde, m é a massa da partícula e Relação massa - energia: Energia de um fóton: Momento linear de um fóton: é a velocidade da partícula. DEMONSTRAÇÃO (Equação 1) (Equação 2) (Equação 3) Comparando: (1) e (2): Como Logo, Então, relacionando com (3): Esta equação relaciona-se ao momento linear (grandeza tipicamente corpuscular) com o comprimento de onda (grandeza tipicamente ondulatória). A natureza ondulatória da propagação da luz não é revelada por experiências em ótica geométrica, porque as dimensões importantes dos equipamentos utilizados são muito grandes se comparados ao comprimento de onda da luz. Se a representa uma dimensão característica de um equipamento ótico (por exemplo, a abertura da lente, espelho e fenda) e é o comprimento de onda da luz que atravessa o equipamento, estamos no limite da ótica geométrica. Observa-se que a ótica geométrica envolve a propagação de raios, o que é análogo à trajetória de partículas clássicas. No entanto, quando a dimensão característica de um equipamento ótico se torna comparável ou menor do que o comprimento de onda da luz que o atravessa, entramos no domínio da ótica física. Não apenas elétrons, mas todos os objetos materiais, carregados ou não, apresentam características ondulatórias em seu movimento, quando estão sob as condições da ótica física. Tanto para grandes como para pequenos comprimentos de onda, a matéria e a radiação apresentam os dois aspectos, o ondulatório e o corpuscular. Os aspectos corpusculares são salientados quando se estuda a emissão e ou absorção, e os aspectos ondulatórios são salientados quando se estuda o movimento por meio do sistema. EXERCÍCIOS PROPOSTOS Efeito Fotoelétrico 1. Considere as seguintes afirmações sobre o efeito fotoelétrico. I. O efeito fotoelétrico consiste na emissão de elétrons por uma superfície metálica atingida por radiação eletromagnética. II. O efeito fotoelétrico pode ser explicado satisfatoriamente com a adoção de um modelo corpuscular para a luz. 9 III. IV. Uma superfície metálica fotossensível somente emite fotoelétrons quando a frequência da luz incidente nessa depende do metal. Quais estão corretas? 2. O gráfico mostrado a seguir resultou de uma experiência na qual a superfície metálica de uma célula fotoelétrica foi iluminada, separadamente, por duas fontes de luz monocromática distintas, de 14 14 frequências f1 = 6,0×10 Hz e f2 = 7,5×10 Hz, respectivamente. As energias cinéticas máximas, K1 = 2,0 eV e K2 = 3,0 eV, dos elétrons arrancados do metal, pelos dois tipos de luz, estão indicadas no gráfico. A reta que passa pelos dois pontos experimentais do gráfico obedece à relação estabelecida por Einstein para o efeito fotoelétrico, ou seja, K = hf - onde h é a constante de Planck e é a chamada função trabalho, característica de cada material. Baseando-se na relação de Einstein, o valor de é: 3. Para explicar o efeito fotoelétrico, Einstein, em 1905, apoiou-se na hipótese de que: a) a energia das ondas eletromagnéticas é quantizada. b) o tempo não é absoluto, mas depende do referencial em relação ao qual é medido. c) os corpos contraem-se na direção de seu movimento. d) os elétrons em um átomo somente podem ocupar determinados níveis discretos de energia. e) a velocidade da luz no vácuo corresponde à máxima velocidade com que se podem transmitir informações. 4. Utilizando um controlador, André aumenta a intensidade da luz emitida por uma lâmpada de cor vermelha, sem que esta cor se altere. Com base nessas informações, é CORRETO afirmar que a intensidade da luz aumenta por que: a) a frequência da luz emitida pela lâmpada aumenta. b) o comprimento de onda da luz emitida pela lâmpada aumenta. c) a energia de cada fóton emitido pela lâmpada aumenta. d) o número de fótons emitidos pela lâmpada, a cada segundo, aumenta. 5. A intensidade luminosa é a quantidade de energia que a luz transporta por unidade de área transversal à sua direção de propagação e por unidade de tempo. De acordo com Einstein, a luz é constituída por partículas, denominadas fótons, cuja energia é proporcional à sua frequência. 14 2 Luz monocromática com frequência de 6 x 10 Hz e intensidade de 0,2 J/m .s incide 2 perpendicularmente sobre uma superfície de área igual a 1 cm . Qual o número aproximado de fótons que atinge a superfície em um intervalo de tempo de 1 segundo? -34 (Constante de Planck:h = 6,63 x 10 J.s) Átomo de Bohr e as Transições Eletrônicas 6. Considerando os processos que ocorrem na lâmpada fluorescente, podemos afirmar que a explicação para a emissão de luz envolve o conceito de a) colisão elástica entre elétrons e átomos de mercúrio. b) efeito fotoelétrico. c) modelo ondulatório para radiação. d) níveis de energia dos átomos. 7. Os modelos atômicos anteriores ao modelo de Bohr, baseados em conceitos da física clássica, não explicavam o espectro de raias observado na análise espectroscópica dos elementos químicos. Por exemplo, o espectro visível do átomo de hidrogênio - que possui apenas um elétron - consiste de quatro raias distintas, de frequências bem definidas. O modelo Bohr, propôs para o átomo de hidrogênio o espectro de raias de diferentes frequências que é explicado: a) pelo caráter contínuo dos níveis de energia do átomo de hidrogênio. b) pelo caráter discreto dos níveis de energia do átomo de hidrogênio. c) pela captura de três outros elétrons pelo átomo de hidrogênio. d) pela presença de quatro isótopos diferentes numa amostra comum de hidrogênio. e) pelo movimento em espiral do elétron em direção ao núcleo do átomo de hidrogênio. 10 8. Um átomo de hidrogênio tem sua energia quantizada em níveis de energia (E n), cujo valor genérico é 2 dado pela expressão En = -E0/n , sendo n igual a 1, 2, 3,... eE0 igual à energia do estado fundamental (que corresponde a n = 1). Supondo-se que o átomo passe do estado fundamental para o terceiro nível excitado (n = 4), a energia do fóton necessário para provocar essa transição é: a) (1/16) E0. b) (1/4) E0. c) (1/2) E0. d) (15/16) E0. e) (17/16) E0. 9. Na figura a seguir, as flechas numeradas de 1 até 9 representam transições possíveis de ocorrer entre alguns níveis de energia do átomo de hidrogênio, de acordo com o modelo de Bohr. Para ocorrer uma transição, o átomo emite (ou absorve) um fóton cuja energia (hc/λ) é igual a |ΔE| (h é a constante de Planck, c é a velocidade da luz no vácuo, λ é o comprimento de onda do fóton e ΔE é a diferença de energia entre os dois níveis envolvidos na transição). Suponha que o átomo emite os fótons X e Y, cujos 7 7 comprimentos de onda são, respectivamente, λx= 1,03x10 m e λy= 4,85x10 m. As transições 15 8 corretamente associadas às emissões desses dois fótons são (use h = 4,13 x 10 eV.s e c = 3,0 x 10 m/s): a) 4 e 8 b) 2 e 6 c) 3 e 9 d) 5 e 7 e) 1 e 7 O Postulado De Broglie 10. Dobrando-se a energia cinética de um elétron não-relativístico, o comprimento de onda original de sua função de onda fica multiplicado por? Exercícios de Vestibulares Resolvidos 1. Considere as seguintes afirmações: I. No efeito fotoelétrico, quando um metal é iluminado por um feixe de luz monocromático, a quantidade de elétrons emitidos pelo metal é diretamente proporcional à intensidade do feixe incidente, independentemente da frequência de luz. II. As órbitas permitidas ao elétron em um átomo são aquelas em que o momento angular orbital é , sendo n = 1, 3, 5,... . III. Os aspectos corpuscular e ondulatório são necessários para a descrição completa de um sistema quântico. IV. A natureza complementar do mundo quântico é expressa, no formalismo da Mecânica Quântica, pelo princípio de incerteza de Heisenberg. Quais estão corretas? a) I e II b) I e III c) I e IV d) II e III e) III e IV Resolução: I. Falsa. Para que ocorra o efeito fotoelétrico, a frequência de luz incidente deve ser maior que certo valor , em que é a função de trabalho do átomo do metal e a constante de Planck. II. Falsa.As órbitas permitidas ao elétron são aquelas em que o momento angular orbital ( m V.r ) é um múltiplo inteiro de ,, isto é do tipo n ,, em que n = 1, 2, 3 ... . III. Correta. É a hipótese da dualidade proposta por Louis de Broglie. IV. Correta. A natureza complementar está ligada ao fato de não podermos medir simultaneamente com precisão a posição e a quantidade de movimento de uma partícula, o que traduz o “Princípio da Incerteza de Heisenberg”. 11 2. Utilizando o modelo de Bohr para átomo, calcule o número aproximado de evoluções efetuadas por um elétron no primeiro estado excitado do átomo de hidrogênio, se o tempo de vida do elétron, nesse -8 -11 estado excitado é de 10 s. São dados: o raio da órbita do estado fundamental é de 5,3 · 10 m e a 6 velocidade do elétron nesta órbita é de 2,2.10 m/s. 6 a) 1 · 10 revoluções. 4 b) 4 · 10 revoluções. 6 c) 4 · 10 revoluções. 6 d) 8 · 10 revoluções. 6 e) 9 · 10 revoluções. Resolução: No modelo do átomo de Bohr, o raio r da órbita é dado por , em que órbita do estado fundamental) e n = 1, 2, 3, ... Para o estado fundamental,n = 1 e para o primeiro estado excitado, n = 2. Assim, No átomo de Bohr, a força colombiana é centrípeta: (raio da . Sendo , concluímos que a velocidade do elétron no primeiro estado excitado é a metade da velocidade no estado fundamental: De vem: 8 No intervalo de tempo 10 s, que é o tempo de vida do elétron, o número de revoluções efetuadas é dado por: 3. Num experimento que usa o efeito fotoelétrico, ilumina-se sucessivamente a superfície de um metal com luz de dois comprimentos de onda diferentes, 1 e 2, respectivamente. Sabe-se que as velocidades máximas dos fotoelétrons emitidos são, respectivamente, v1 e v2 , em que v1 = 2 v2. Designando C a velocidade da luz no vácuo, e h constante de Planck, pode-se, então, afirmar que a função trabalho Ǿ do metal é dada por: a) (2 1 - 2) h C/(12). b) (2 - 2 1) h C/(12). c) (2 - 4 1) h C/(3 12). d) (4 1 - 2) h C/(3 12). e) (2 1 - 2) h C/(3 12). Resolução: A função trabalho do metal corresponde à energia de ligação dos seus fotoelétrons Para a radiação de comprimento de onda 1, temos: (Equação 1) Para a radiação de comprimento de onda 2, temos: (Equação 2) Comparando-se (1) e (2), vem: 12 Logo: 4. Um átomo de hidrogênio inicialmente em repouso emite um fóton numa transição do estado de energia n para o estado fundamental. Em seguida, o átomo atinge um elétron em repouso que com ele se liga, assim permanecendo após a colisão. Determine literalmente a velocidade do sistema átomo + elétron após a colisão. 2 Dados: a energia do átomo de hidrogênio no estado n é En = E0/n ; o mometum do fóton é hv/c; e a energia deste é hv, em que h é a constante de Planck, v a frequência do fóton e c a velocidade da luz. Resolução O átomo de hidrogênio e o fóton emitido passam a ter quantidades de movimento de mesmo módulo (conservação da quantidade de movimento). A energia do fóton ( ) pode ser calculada por: Dessa forma,para a quantidade de movimento do hidrogênio, temos: A conservação da quantidade de movimento para a colisão inelástica do átomo de hidrogênio com o elétron em repouso remete-se a: Assim: onde m é a massa do elétron e m H é a massa do átomo de hidrogênio. Se considerarmos a massa do elétron desprezível em comparação com a do átomo, podemos escrever: (Equação 1) 3 5. Num experimento, foi de 5,0 x 10 m/s a velocidade de um elétron, medida com a precisão de 0,003%. Calcule a incerteza na determinação da posição do elétron, sendo conhecidos: massa do elétron m(e) = -31 -34 9,1 x 10 kg e constante de Planck reduzida h = 1,1 x 10 J s. Resolução Do Princípio da Incerteza de Heisenberg, temos: Supondo-se que a incerteza na determinação da quantidade de movimento velocidade V do elétron, temos: ocorra, somente, na em que e são, respectivamente, as incertezas na determinação do módulo da velocidade e da posição do elétron. Assim: 13 6. Einstein propôs que a energia da luz é transportada por pacotes de energia , em que é a constante de Planck e é a frequência da luz, num referencial na qual a fonte está em repouso. Explicou, assim, a existência de uma frequência mínima , para arrancar elétrons de um material, no chamado efeito fotoelétrico. Suponha que a fonte emissora de luz está em movimento em relação ao material. Assinale a alternativa correta. a) Se , é possível que haja emissão de elétrons desde que a fonte esteja se afastando do material. b) Se , é possível que elétrons sejam emitidos, desde que a fonte esteja se afastando do material. c) Se , não há emissão de elétrons qualquer que seja a velocidade da fonte. d) Se , é sempre possível que elétrons sejam emitidos pelo material, desde que a fonte esteja se afastando do material. e) Se , é possível que elétrons sejam emitidos, desde que a fonte esteja se aproximando do material. Resolução O movimento relativo entre a fonte de luz e o material altera a frequência nele incidente f i em relação àquela emitida f. Sabe-se que pelo efeito Dopple-Fizeau, a frequência incidente aumenta na aproximação e diminui no afastamento. Assim, temos as seguintes possibilidades para a emissão ou não dos elétrons: a) b) De acordo com o item b-3, temos alternativa e como correta. 7. Um elétron é acelerado a partir do repouso por meio de uma diferença de potencial U, adquirindo uma quantidade de movimento p. Sabe-se que, quando o elétron está em movimento, sua energia relativística é dada por , em que m0 é a massa de repouso do elétron e c sua velocidade da luz no vácuo. Obtenha o comprimento de onda de De Broglie do elétron em função de U e das constantes fundamentais pertinentes. Resolução De acordo o teorema de energia cinética, vem: Mas Em que Elevando a equação 1 ao quadrado temos: (Equação 1) e Portanto: De acordo com De Brogli, temos: 8. O átomo de hidrogênio no modelo de Bohr é constituído de um elétron de carga que se move em órbitas circulares de raio r, em torno do próton, sob influência da força de atração colombiana. O trabalho efetuado por esta força sobre o elétron ao percorrer a órbita do estado fundamental é: 2 a) – e /(2є0 r). 2 b) e /(2 є0 r). 2 c) - e /(4πє0r). 2 d) e /r. e) n.d.a. 14 Resolução A força de atração coulombiana que age no elétron de carga atua como resultante centrípeta e, desta maneira, o trabalho efetuado por esta força é nulo. 9. No modelo proposto por Einstein, a luz se comporta como se sua energia estivesse concentrada em pacotes discretos, chamados de "quanta" de luz, e atualmente conhecidos por fótons. Estes possuem momento p e energia E relacionados pela equação , em que c é a velocidade da luz no vácuo. Cada fóton carrega uma energia , em que h é a constante de Planck e f é a frequência da luz. Um evento raro, porém possível, é a fusão de dois fótons, produzindo um par elétron-pósitron, sendo a massa do pósitron igual à massa do elétron. A relação de Einstein associa a energia da partícula à massa do elétron ou pósitron, isto é, Assinale a frequência mínima de cada fóton, para que dois fótons, com momentos opostos e de módulo iguais, produzam um par elétron-pósitron após a colisão: a) b) c) d) e) Resolução A figura abaixo mostra de maneira esquemática as principais características da produção do par de elétrons pósitron proposta. Para a frequência mínima pedida de cada fóton, a energia cinética do par formado deve ser nula. A conservação de energia garante a igualdade das energias inicial e final, , respectivamente. 10. O ano de 2005 foi declarado o Ano Internacional da Física, em comemoração aos 100 anos da Teoria 2 da Relatividade, cujos resultados incluem a famosa relação E = Δm.c . Num reator nuclear, a energia provém da fissão do Urânio. Cada núcleo de Urânio, ao sofrer fissão, divide-se em núcleos mais leves, e uma pequena parte, Δm, de sua massa inicial transforma-se em energia. A Usina de Angra II tem uma potência elétrica de cerca 1350 MW, que é obtida a partir da fissão de Urânio-235. Para produzir tal potência, devem ser gerados 4000 MW na forma de calor Q. Em relação à Usina de Angra II, estime a a) quantidade de calor Q, em joules, produzida em um dia. b) quantidade de massa Δm que se transforma em energia na forma de calor, a cada dia. c) massa MU de Urânio-235, em kg, que sofre fissão em um dia, supondo que a massa Δm, que se -4 transforma em energia, seja aproximadamente 0,0008 (8 × 10 ) da massa MU. 15 Essa relação indica que massa e energia podem se transformar uma na outra. A quantidade de energia E que se obtém está relacionada à quantidade de massa Δm, que "desaparece", através do produto dela pelo quadrado da velocidade da luz (c). NOTE E ADOTE: 4 Em um dia, há cerca de 9 × 10 s 6 1 MW = 10 W 8 c = 3 × 10 m/s Resolução a) b) Sendo , então c) 11. Na época da formação da Terra, estimada como tempo ocorrido há cerca de 4,2 bilhões de anos, os 235 238 isótopos de urânio radioativo U e U existiam em maior quantidade, pois, ao longo do tempo, parte deles desintegrou-se, deixando de existir como elemento Urânio. Alem disso, eram encontrados em proporções diferentes das de hoje, já que possuem meias-vidas diferentes. Atualmente, em uma 238 235 235 amostra de1,000 Kg de Urânio, há 0,993 Kg de U e 0,007 Kg de U, de modo que o U corresponde a 0,7 % da massa total e tem importância estratégica muito grande, pela sua utilização em reatores nucleares. 238 a) Estime a massa M238, em Kg, de uma amostra de U, na época da formação da Terra, a partir da qual 238 restaram hoje 0,993 Kg de U. 235 b) Estime, levando em conta o número de meias-vidas do U, a massa de M235, em Kg, de uma amostra 235 235 de U, da época da formação da Terra, a partir da qual restaram hoje 0,007 Kg de U. 235 c) Estime a porcentagem P em massa de U em relação à massa total de Urânio em uma amostra na época da formação da Terra. NOTE E ADOTE A meia-vida de um elemento radioativo é o intervalo de tempo necessário para que a metade da massa de uma amostra se desintegre; o restante de sua massa a se desintegrar. 238 9 Meia-vida do U ≈ 700 milhões de anos (0,7. 10 anos) 235 9 Meia-vida do U ≈ 4,2 bilhões de anos (4,2. 10 anos) (Os valores acima foram aproximados, para facilitar os cálculos). Resolução a) Como o intervalo de tempo considerado é igual à meia-vida do concluímos que: b) (II) c) 12. Todos os corpos trocam energia com seu ambiente através da emissão e absorção de ondas eletromagnéticas em todas as frequências. Um corpo negro é um corpo que absorve toda a onda eletromagnética nele incidente, sendo que também apresenta a máxima eficiência de emissão. As intensidades das ondas emitidas por um corpo negro só depende da temperatura desse corpo. O corpo humano à temperatura normal de 37ºC pode ser considerado como um corpo negro.Considere que a 8 velocidade das ondas eletromagnéticas é igual a 3,0.10 m/s. 16 a) A figura a seguir mostra a intensidade das ondas eletromagnéticas emitidas por um corpo negro a 37ºC em função da frequência. Qual o comprimento de onda correspondente à frequência para a qual a intensidade é máxima? b) Se um corpo negro cuja temperatura absoluta é T se encontra num ambiente cuja temperatura absoluta é Ta, a potência líquida que ele perde por emissão e absorção de ondas eletromagnéticas é dado por P = 4 4 -8 2 4 σA(T – Ta ), onde A é a área da superfície do corpo e σ = 6.10 W/(m K ). Usando como referência uma pessoa com 1,70 m de altura e 70 Kg de massa, faça uma estimativa da área da superfície do corpo humano. A partir da área estimada, calcule a perda total diária de energia por emissão e absorção das ondas eletromagnéticas por essa pessoa se ela se encontra num ambiente a 27ºC. Aproxime a 4 duração de 1 dia por 9,0.10 s. Resolução a) No diagrama, temos: Assim: b)Na estimativa,podemos imaginar que essa pessoa corresponde a um bloco de 1,70m x 0,40m x 0,20m. 2 Dessa forma, vamos encontrar uma superfície de aproximadamente 2,0m de área. Portanto: Sendo 13. O efeito fotoelétrico, cuja descrição por Albert Einstein completou 100 anos em 2005 (ano internacional da Física), consiste na emissão de elétrons por um metal no qual incide um feixe de luz. No processo, "pacotes" bem definidos de energia luminosa, chamados fótons, são absorvidos um a um pelos elétrons -15 do metal. O valor da energia de cada fóton é dado por E(fóton) = h f, onde h = 4 × 10 eV.s é a chamada constante de Planck e f é a frequência da luz incidente. Um elétron só é emitido do interior do metal se a energia do fóton absorvido for maior que uma energia mínima. Para os elétrons mais fracamente ligados ao metal, essa energia mínima é chamada função trabalho W e varia de metal para metal (ver a tabela a seguir). Considere c = 300.000 km/s. -7 a) Calcule a energia do fóton (em eV), quando o comprimento de onda da luz incidente for 5 × 10 m. -7 b) A luz de 5 × 10 m é capaz de arrancar elétrons de quais dos metais apresentados na tabela? c) Qual será a energia cinética de elétrons emitidos pelo potássio, se o comprimento de onda da luz -7 incidente for 3 × 10 m? Considere os elétrons mais fracamente ligados do potássio e que a diferença entre a energia do fóton absorvido e a função trabalho W é inteiramente convertida em energia cinética. Metal W (eV) Césio 2,1 Potássio 2,3 Sódio 2,8 17 Resolução a) b) A luz de é capaz de arrancar alétrons do césio e do potássio,pois suas funções trabalho W são menores que 2,4 eV. c) 14. Fragmento infinitésimo, Quase que apenas mental, Quantum granulado no mel, Quantum ondulado do sal, Mel de urânio, sal de rádio Qualquer coisa quase ideal. Um trecho da música "Quanta", de Gilberto Gil, foi reproduzido anteriormente. As frases "Quantum granulado no mel" e "Quantum ondulado do sal" relacionam-se, na Física, com: a) Conservação de Energia. b) Conservação da Quantidade de Movimento. c) Dualidade Partícula-onda. d) Princípio da Causalidade. e) Conservação do Momento Angular. Resolução: A expressão “Quantum granulado no mel” sugere energia associada às partículas, enquanto a expressão “Quantum ondulado do sal”, sugere energia associada às ondas. Isso nos remete à opção C, que menciona o conceito de dualidade partícula-onda. 15. (UFES 2007) Considerando a relação massa-energia oriunda da relatividade, a energia de um fóton e a expressão do momento linear (quantidade de movimento), De Broglie obteve uma expressão para o comprimento de onda de uma partícula. a) Demonstre a expressão obtida por De Broglie. –34 b) Considerando a constante de Planck,h = 6,6 · 10 J.s, calcule: a. o comprimento de onda de De Broglie para um elétron de massa que se move com 6 velocidade v = 6,0 · 10 m/s, b. o comprimento de onda de um elétron que estava inicialmente em repouso e que foi acelerado por uma diferença de potencial de 1Vols. Resolução: a) Relação massa - energia: Energia de um fóton: (Equação 2) Momento linear de um fóton: (Equação 3) (Equação 1) Comparando: (1) e (2): Como Logo, Então, relacionando com (3): 18 Esta equação relaciona o momento linear (grandeza tipicamente corpuscular) ao comprimentode onda (grandeza tipicamente ondulatória). b) Da letra a temos ; onde Assim, Para um elétron com velocidade v: (Equação 4) A partir da expressão da energia cinética, obtemos o valor de v: Substituindo na equação (4): Substituindo os valores dados: Notamos que a ordem de grandeza da velocidade do elétron é de 106 m/s, logo os efeitos relativísticos do aumento de massa, por exemplo, são desprezíveis. Considerando que a equação de De Broglie estabelece uma relação entre o comprimento de onda da onda associada ao movimento de uma partícula (dualidade onda – partícula) mesmo estando a uma velocidade muito abaixo da velocidade da luz, concluímos que: Que é a resposta dada como correta no livro:(D. Halliday, R. Resnick e J. Walker, Fundamentos de Física, 4a ed., cap. 44. Probl. 10),de onde provavelmente se originou a questão. Divisão do Conteúdo O efeito fotoelétrico 1º Aplicação do questionário (de int rodução) e int rodução nº de aulas 4 no total 2º e 3º aplicação de conteúdo 4º Aplicação do questionário (de int rodução) O átomo de Bohr, O salto quântico (O espectro de emissão) 1º Aplicação do questionário (de int rodução) e int rodução nº de aulas 4 no total 2º e 3º aplicação de conteúdo 4º Aplicação do questionário (de int rodução) Dualidade onda Partícula 1º Aplicação do questionário (de int rodução) e int rodução nº de aulas 4 no total 2º e 3º aplicação de conteúdo 4º Aplicação do questionário (de int rodução) 19
Download