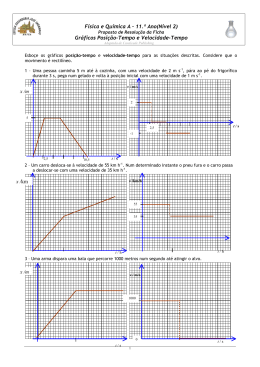
Página 1 de 3 Lista de Exercícios 1 – Teoria Cinética dos Gases 1) Calcule as raízes quadradas das velocidades quadráticas médias das moléculas de (a) metano, (b) etano e (c) propano, todas em – 20°C. 2) Determine as razões entre (a) as velocidades médias e (b) as energias cinéticas médias das moléculas de H2 e dos átomos de Hg, a 20°C. 3) Um balão de vidro de 1,0 dm3 contém 1,0 x 1023 moléculas de H2. A pressão do gás é 100 kPa. (a) Qual é a temperatura do gás? (b) Qual é a raiz quadrada da velocidade quadrática média das moléculas? (c) A temperatura seria diferente se as moléculas fossem de O2? 4) Calcule a energia cinética molar (em joules) de uma amostra de gás criptônio em (a) 55,85°C e (b) 54,85°C. (c) A diferença de energia molar entre as respostas (a) e (b) é a energia por mol necessária para elevar a temperatura do gás criptônio de 1,00°C. Essa quantidade é conhecida como capacidade calorífica molar. Quanto ela vale? 5) Uma garrafa contém 1,0 mol He (g). Outra garrafa contém 1,0 mol Ar (g) na mesma temperatura. Nessa temperatura, a raiz quadrada da velocidade quadrática média do hélio é 1477 m.s -1 e a do Ar é 467 m.s-1. Qual é a razão entre o número de átomos de hélio na primeira garrafa e de argônio na segunda garrafa que têm essa velocidade? Imagine que os dois gases têm comportamento ideal. 6) Usando a distribuição de velocidades de Maxwell, estime a fração de moléculas de CO 2 que, a 300 K, têm velocidades no intervalo de 200 a 250 m.s-1. 7) A que pressão o livre médio do argônio a 25°C torna-se comparável ao tamanho de um recipiente cúbico de 1 L que contém o argônio? Considere = 0,36 nm3. 8) A uma altitude de 20 km, a temperatura é de 217 K e a pressão 0,050 atm. Qual é o livre percurso médio das moléculas de N2? ( = 0,43 nm2) 9) Quantas colisões um certo átomo de Ar faz em 1,0 s, quando a temperatura do gás é de 25°C e a pressão é (a) de 10 atm, (b) 1,0 atm e (c) 1,0 atm? 10) Calcule o livre percurso médio das moléculas no ar quando = 0,43 nm2, a 25°C, e (a) 10 atm, (b) 1 atm e (c) 1,0 atm. 11) Um mol de gás He, em um volume de 25,0 L, exerce uma pressão de 0,877 bar. (a) Qual é a raiz quadrada da velocidade média quadrática? (b) Qual é a temperatura da amostra de hélio? (c) Qual é a velocidade mais provável dos átomos de He? 12) Considere uma amostra do gás Ar. Determine a temperatura do gás se as seguintes velocidades forem iguais a 500 m.s-1: (a) c, (b) c*, (c) . Página 2 de 3 13) Suponha que o raio de um átomo de criptônio, considerado uma esfera rígida, seja 1,85 Å. Calcule o caminho livre médio desses átomos a 20°C e à pressão de 1,0 bar. 14) Suponha que uma molécula de nitrogênio atue como uma esfera rígida com um raio de 1,60 Å. Se você tem uma câmara de vácuo com 1,0 m de lado, que pressão deve ser aplicada par que uma molécula de nitrogênio, indo de um lado para o outro, tenha uma chance razoável de não colidir com outra molécula (isto é, o caminho livre médio de 1,0 m)? Suponha uma temperatura de 22°C. 15) Temos o metal ferro confinado em uma pequena cela com um pequeno orifício com um diâmetro de 0,5 mm. A um temperatura de 2050 K, a pressão de vapor do Fe dentro da cela é de 1,0 mmHg. Calcule o número de átomos de Fe que efundem através do orifício por segundo. 16) Uma superfície sólida, com 3,5 mm x 4,0 cm, está exposta ao hélio gasoso a 111 Pa e 1500 K. Quantas colisões os átomos de He fazem com esta superfície em 10 s? 17) Uma câmara de efusão tem um orifício circular com diâmetro de 3,0 mm. Se a massa molar do sólido na câmara for de 300 g.mol-1, e se a pressão de vapor, a 450 K, for de 0,224 Pa, de quanto diminuirá a massa do sólido em um período de 24 h? 18) Um composto sólido de massa molar 100 g.mol-1 foi introduzido em um recipiente e aquecido a 400°C. Quando um orifício com um diâmetro igual a 0,50 mm foi aberto no recipiente por 400 s, foi medida uma perda de massa de 285 mg. Calcule a pressão de vapor do composto a 400°C. 19) Uma célula de Knudsen foi usada para medir a pressão de vapor do germânio a 1000°C. A perda de massa foi de 43 µg, na efusão do vapor, durante 7200 s, através de um orifício de 0,50 mm de raio. Qual a pressão do vapor de germânio a 1000°C? 20) A partir da distribuição de Maxwell, deduza a expressão da velocidade mais provável das moléculas de um gás, na temperatura T. 21) A partir da distribuição de Maxwell, demonstre que a energia cinética média de translação das moléculas de um gás ideal, definida como , se reduz a . 22) De acordo com a definição, que segue abaixo, deduza a fórmula para o calculo da raiz quadrada da velocidade quadrática média usando a distribuição de Maxwell. (1,0) Gabarito 1) (a) 627 m.s-1; (b) 458 m.s-1; (c) 378 m.s-1. 3) (a) 72 K; (b) 946 m.s-1; (c) não. 5) 0,316 7) 0,0652 Pa 2) (a) 9,975; (b) 1. 4) (a) 4103,2 J.mol-1; (b) 4090,7 J.mol-1; (c) 12,5 J.mol-1. 6) 9,54%. 8) 0,97 m Página 3 de 3 9) (a) 5 x 1010 s-1; (b) ) 5 x 109 s-1; (c) ) 5 x 103 s-1 11) (a) 1282 m.s-1; (b) 264 K; (c) 1048 m.s-1 13) 941 Å 15) 2,03 x 1017 átomos.s-1 17) 0,498 g 10) (a) 6,7 nm; (b) 67 nm; (c) 6,7 cm 12) (a) 400,4 K; (b) 600,6 K; (c) 471,7 K 14) 1,27 x 10-7 bar 16) 5,3 x 1021 colisões 18) 415 Pa 19) 7,3 mPa 20) 21) Dica: comece com . 22)
Baixar