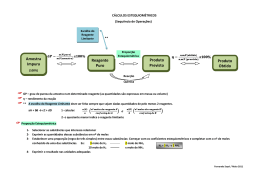
Reagente limitante e em excesso & Rendimento de uma reação química Reagente limitante e em excesso 5 pães 4 fatias de queijo Quantas sanduíches de queijo posso fazer? 4 sanduíches de queijo As fatias de queijo limitam o nº de sanduíches que é possível fazer Reagente limitante e em excesso Na 3 AsO 4 + 3AgNO 3 ➞ Ag 3 AsO 4 + 3NaNO 3 1 mol 207,89 g + + 3 mol ➞ 1 mol + 509,62 g ➞ 462,52 g + 3 mol 254,98 g “Proporção Estequiométrica” A quantidade de AgNO3 que eu adiciono é exatamente a quantidade necessária para reagir com Na3AsO4 Reagente limitante e em excesso Se adicionar maior quantidade de AgNO3 o que acontece? Na3AsO4 Reagente limitante é aquele cuja quantidade condiciona a quantidade de produtos formados + 3AgNO3 ➞ Reagente em excesso é aquele cuja quantidade presente na mistura reacional é superior à prevista pela proporção estequiométrica. Ag3AsO4 + 3NaNO3 A quantidade máxima de produto formada irá depender da quantidade inicial do reagente limitante Na indústria química este é um conceito importante, pois geralmente escolhe-se o reagente mais dispendioso como reagente limitante para que seja totalmente consumido. Reagente limitante e em excesso Exercício A ureia [(NH2)2CO] é usada como fertilizante e em rações para animais, bem como na indústria de polímeros; é preparada pela reação entre o amoníaco e o dióxido de carbono:(1) 2NH3(g) + CO2(g) ➞ (NH2)2CO(aq) + H2O(l) Num dado processo 637,2 g de NH3 são postos a reagir na presença de 1,142 g de CO2. Determinem o reagente limitante. Calculem a massa de (NH2)2CO formada. Calculem a quantidade de reagente em excesso que fica por reagir. (1) Fonte: Chang, R. (1994). Química (5ª edição). Lisboa: McGraw-Hill. REAÇÕES QUÍMICAS Completa Incompleta Pelo menos um dos reagentes transforma-se quase completamente nos produtos de reação. Nenhum dos reagentes se esgota. Ex: reações de combustão CH4(g) + 2O2(g) →CO2(g) + 2H2O(g) Ex: síntese do amoníaco N2(g) + 3H2(g) ⇄2NH3(g) Rendimento de uma reação química O rendimento de uma reação pode variar entre 0 - 1 (0 - 100%). O rendimento de uma reação é quase sempre inferior a 1 (ou 100%)(1). Nota: os processos industriais envolvem geralmente (milhares a milhões de toneladas) de produtos. Assim, mesmo um pequeno aumento do rendimento pode reduzir significativamente os custos de produção.(2) (1) (2) Fonte: Martins et al. (2003). Programa de Física e Química A 11º ou 12º ano do Curso científico-Humanístico de Ciência e Tecnologias. Lisboa: Ministério da Educação. Fonte: Chang, R. (1994). Química (5ª edição). Lisboa: McGraw-Hill. Rendimento de uma reação química Exercício O titânio é um metal resistente à corrosão e que é usado na construção de foguetes, aviões e motores de jato. É preparado por redução do cloreto de titânio (IV) com magnésio fundido a temperaturas entre 950 - 1150 ºC:(1) TiCl4(g) + 2Mg(g) ➞ Ti(s) + 2MgCl2(l) Num dado processo 3,54 x 104 kg de TiCl4 reagem com 1,13 x 104 kg de Mg. Determinem o reagente limitante. Calculem a massa teórica de Ti formado. Calculem o rendimento da reacção considerando que efetivamente foram obtidos 7,91 x 103 kg de Ti. (1) Fonte: Chang, R. (1994). Química (5ª edição). Lisboa: McGraw-Hill.
Baixar