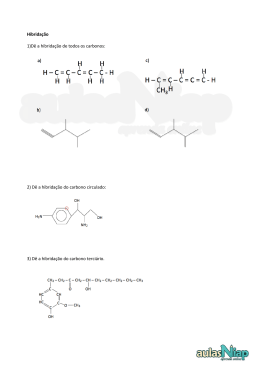
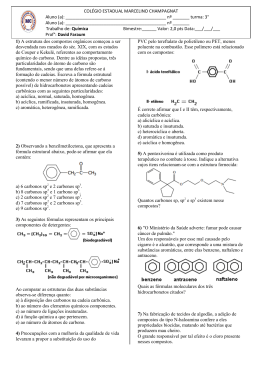
Lista de Exercícios Aluno(a):_______________________________________Nº.____ Professor: Série: 2° Data da prova: Disciplina: 1. Considere duas latas do mesmo refrigerante, uma na versão “diet” e outra na versão comum. Ambas contêm o mesmo volume de líquido (300 mL) e têm a mesma massa quando vazias. A composição do refrigerante é a mesma em ambas, exceto por uma diferença: a versão comum contém certa quantidade de açúcar, enquanto a versão “diet” não contém açúcar (apenas massa desprezível de um adoçante artificial). Pesando-se duas latas fechadas do refrigerante, foram obtidos os seguintes resultados: amostra lata com refrigerante comum lata com refrigerante “diet” 316,2 massa (g) 331,2 Por esses dados, pode-se concluir que a concentração, em g/L, de açúcar no refrigerante comum é de, aproximadamente, a) 0,020 b) 0,050 c) 1,1 d) 20 e) 50 1. Qual a concentração em g L–1 de uma solução resultante da dissolução de 50 gramas de NaCl para um volume final de 200 mL? 2. A mistura de 26,7 g de NaCl (massa molar 53,4 g.mol-1) em água suficiente para que a solução apresente o volume de 500 mL resulta numa concentração de: a) 26,7% (m/v). b) 26,7 g.L-1. c) 1,0 mol.L-1. d) 0,0534 g.L-1. e) 13,35 L.mol. Soluções de cloreto de sódio são muito utilizadas em laboratório. Considerando que um químico necessita de uma solução de cloreto de sódio a 0,5 mol/L, marque a alternativa que indica a quantidade de massa necessária para a preparação de 5 L de solução de cloreto de sódio(NaCl) nessa concentração. a) 146,25 g b) 292,5 g c) 87,75 g d) 145,75 g e) 73,13 g 4. 5. Qual é a massa, em gramas, de hidróxido de sódio necessária para se preparar 500 mL de uma solução aquosa 2,0 mol/L? (Dados: H = 1; Na = 23; O = 16 ) 6. O gráfico a seguir mostra a solubilidade de alguns sais, em gramas do soluto/100mL de água, em função da temperatura: 1 Baseando-se nesse gráfico, responda às questões a seguir: a) qual o sal cuja solubilidade sofre um maior efeito da temperatura, no intervalo de 60oC a 100oC? b) qual o sal cuja solubilidade sofre um menor efeito da temperatura, no intervalo de 60oC a 100oC? c) qual a temperatura em que o NaCl e o KCl apresentam a mesma solubilidade? d) qual a menor quantidade de água, a 60oC, necessária para dissolver completamente 200g de Pb(NO3)2? 7. O gráfico a seguir apresenta os coeficientes de solubilidade, em gramas/100mL de água, de algumas substâncias A, B, C, D em função da temperatura. a) b) c) d) e) D é a substância mais solúvel, em gramas, a 20oC. B é mais solúvel a quente a 40oC a substância A é mais solúvel em gramas, que a substância D a concentração de C duplica a cada 20oC. todas as substâncias têm o mesmo coeficiente de solubilidade a 45oC. 8. Dê a definição para: a) Solução saturada: b) Solução insaturada: c) Solução saturada com corpo de fundo. 9. a) b) c) d) e) A seqüência correta dos orbitais híbridos em que estão ligados os átomos de carbono na molécula do 1,3-pentadieno, cuja fórmula está abaixo representada, é: H2C = CH – CH = CH – CH3 sp2 – sp2 – sp2 – sp2 – sp3. sp3 – sp2 – sp2 – sp2 – sp3. sp3 – sp2 – sp3 – sp3 – sp2. sp2 – sp2 – sp2 – sp2 – sp. sp2 – sp – sp3 – sp – sp2. 10. No hidrocarboneto de fórmula estrutural representada abaixo, os átomos de carbono estão numerados de 1 a 7. 2 H H H H H C C C C4 7 6 H 5 H C 3 H C 2 C1 H H Sobre esse hidrocarboneto são feitas as seguintes afirmativas: I. O total de ligações π (pi) na estrutura é igual a 3. II. O átomo de carbono 2 forma 3 ligações π (pi) e 1 ligação σ (sigma). III. O átomo de carbono 5 forma 3 ligações σ (sigma) e 1 ligação π (pi). IV. O átomo de carbono 1 forma 4 ligações σ (sigma). São CORRETAS apenas as afirmativas: a) I, III e IV. b) II e IV. c) I e II. d) I, II e IV. 11. Um composto é orgânico quando: a) Possui carbono em sua molécula; b) Deriva dos seres vivos; c) Deriva dos vegetais; d) Possui obrigatoriamente carbono e nitrogênio em sua molécula; 12. A química orgânica estuda: a) Apenas os compostos produzidos por animais; b) Todos os compostos que derivam dos seres vivos; c) Apenas compostos que vieram do planeta Marte; d) Todos os compostos produzidos por vegetais; 13. Quem lançou a “Teoria da Força Vital”? a) Berzelius; b) Kekulé; c) Wöhler; d) Bergman; e) Newton. 14. Qual destes constatou a presença de uréia partindo do cianeto de amônio: a) Kekulé ; b) Torricelli; c) Vant´Hoff; d) Whöler ; e) Lavoisier; 15. Qual a definição de carbono primário? a) É o carbono que está ligado a um átomo de oxigênio e dois de carbono; b) É o carbono que está ligado apenas por ligação simples a três carbonos e um oxigênio; c) É o carbono que está ligado a apenas um outro carbono; d) É o carbono que não se liga a nenhum carbono; e) É o carbono que está ligado a um carbono secundário; 16. Carbono secundário é aquele que: a) Está ligado a dois carbonos; b) Está ligado a um oxigênio por ligação dupla; c) Na cadeia carbônica é o segundo da esquerda para a direita; d) Está ligado a dois átomos de hidrogênio; 3 17. Analisando a estrutura da molécula de etano é fácil observar que: a) Os dois carbonos são secundários; b) Os dois carbonos estão a quatro hidrogênios; c) Os dois carbonos são terceários; d) Um carbono é secundário e o outro é primário; e) Os dois carbonos são primários; 4
Baixar