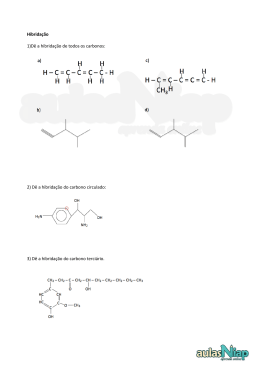
EXAME DE QUÍMICA MI Engenharia Aeroespacial+LEAN Data: 13 de janeiro de 2014 Duração: 2h 30m ATENÇÃO: Justifique todas as suas respostas com o detalhe sensato para o tempo disponível I (3 valores) Quando uma superfície metálica de cálcio é irradiada por radiação visível com o comprimento de onda de 650 nm não se oberva efeito fotoelétrico. Mas se se mudar para uma lâmpada ultravioleta de 325 nm, observa-se a ejeção de eletrões com a energia cinética de 1,53 eV. a) Determine qual o comprimento de onda máximo para o qual se pode observar o efeito fotoelétrico no cálcio b) Se tivesse utilizado uma lâmpada ultravioleta de 50W e mudasse para uma lâmpada de 100W, com o mesmo comprimento de onda, que diferenças observaria na experiência? Justifique Resolução: A energia da radiação incidente será Erad= hc/= 6,626×10-34×2,998×108/325×10-9 = 6,11×1019 J Energia cinética dos eletrões ejetados: Ecin= 1,53×1,6×1019 = 2,45×1019 J A energia de remoção do electrão do cálcio (ou função de trabalho) é W= Erad Ecin= 3,66×1019 J A esta energia corresponde o comprimento de onda máximo para observação do efeito fotoeléctrico max = hc/W= 5,42×107 m Resposta: O comprimento de onda máximno é de 542 nm. b) O efeito foteléctrico observava-se na mesma, com idêntica energia cinética dos eletrões ejetados. O número de eletrões ejetados por unidade de tempo seria o dobro. Obsevar-se-ia uma diferença na corrente fotoeléctrica. II (4,5 valores: 3+1,5) O poliviniltolueno é um polímero obtido a partir do monómero viniltolueno, (CH3)(C6H4)CH=CH2 em que -C6H4- é um anel benzénico. Considere os grupos substituintes no anel benzénico, vinilo e metilo, nas posições 1,4 ou para-. a)Descreva pormenorizadamente a estrutura do monómero, indicando a hibridação dos átomos e carbono, os ângulos entre as ligações, os tipos de ligações (sigma, pi) e ainda, caso existam, pares de electrões não partilhados e ligações deslocalizadas. b) Classifique o tipo de reação de polimerização que conduz à formação do poliviniltolueno. Desenhe um fragmento da cadeia de polímero com três unidades repetitivas (meros). Resolução: a) Comecemos pelo grupo metilo. Temos o átomo de carbono ligado a 4 átomos. A possibilidade de termos orbitais híbridas para poder formar ligações a 4 átomos, é a que resulta da combinação de 2s1 + 2px1+ 2py1 +2pz1 dando quatro orbitais híbridas (sp3) cada uma delas com um eletrão. Para efeitos de identificação, vamos numerar os átomos de carbono do anel de 1 a 6, e os do grupo vinilo como 7 e 8, sendo o carbono 1 o ligado ao metilo. Os seis átomos de carbono do anel benzénico bem como os dois do grupo vinilo estão cada um deles ligado a 3 átomos. Depois de hibridados, os eletrões de valência ficam assim dispribuídos (sp2)1(sp2)1(sp2)12pz1. As orbitais sp2 vão participar em ligações com orbitais híbridas dos átomos vizinhos. As do carbono 1 do anel (ligado ao grupo metilo) será (sp2)+(sp3) (C do metilo) e as outras são (sp2)(C1)+ (sp2)(C2) e (sp2)(C1)+ (sp2)(C6); No carbono C2, há ainda (sp2)(C2)+ (sp2)(C3) e (sp2)(C2)+1s(H); no carbono C3, há (sp2)(C3) + (sp2)(C4) e e(sp2)(C3)+1s(H); no carbono C4 há (sp2)(C4) + (sp2)(C5), e (sp2)(C4) + (sp2)(C7) sendo este do grupo vinilo; o carbono C5 tem ligações com C6 e com um átomo de hidrogénio, (sp2)(C5) + (sp2)(C6) e (sp2)(6 + (1s)(H); o carbono C6 além da ligação a C1 e C5 tem a ligação (sp2)(C6) + (1s)(H). No grupo vinilo, o C7 tem ainda 2 outras ligações (sp2)(C7) + (sp2)(C8) e (sp2)(C7) + (1s)(H). O carbono C8 tem outras duas ligações (sp2)(C8) + (1s)(H). No carbono do metilo há 3 ligações , (sp3)(C)+(1s)(H), além da já referida a C1. Como nos carbonos do anel benzénico mais os do grupo vimnilo há 8 orbitais 2p z, a combinação destas vai dar origem a oito orbitais deslocalizadas, sendo 4 ligantes preenchidas com 2 eletrões cada uma e outras 4 antiligantes vazias. Os ângulos entre as ligações no grupo metilo são de 109,5º e no anel benzénico e grupo vinilo sãp de 120º. Não há pres de eletrões não partilhados. b) A reação de polimerização é de adição por rompimento da ligação do gupo vinilo e propagação da cadeia pelos radicais formados nesse grupo, ficando o toluilo (grupo metilo mais anel benzénico) como grupos laterais da cadeia do polímero. Na figura está representado um fragmento com 3 unidades repetitivas III (4,5 valores: 1,5+3) 1-A temperatura de fusão da prata (Z=47) é 1235 K e a do nióbio (Z= 41) é de 2750 K. Explique a ordem relativa dos pontos de fusão destes dois metais. A prata e o nióbio são dois metais do 5º período. As diferenças de temperaturas de fusão devem-se à diferença de energia de coesão dos metais. Esta por sua vez depende do grau de preenchimento da banda metálica, sendo tanto maior quanto maior for a diferença entre eletrões em níveis de energia (orbitais) ligantes e antiligantes. A banda metálica é devida aos níveis atómicos 5s 4d 5p. Para N átomos isso corresponde a 9N níveis de energia. Empiricamente sabe-se que o máximo de níveis ligantes não ocorre a meio do preenchimento mas a cerca de um terço, isto é há 3N níveis ligantes com 6N eletrões. O nióbio encontra-se precisamente perto da zona de máximo, uma vez que tem 5 eletrões de valência por átomo, preenchendo apenas níveis ligantes. A prata tem 11 eletrões de valência e, por isso tem 3N níveis ligantes preenchidos e 2,5 níveis antiligantes. Daí a menor energia de coesão da prata e consequentemente a menor temperatura de fusão. 2-O brometo de prata, AgBr, é uma substância iónica que cristaliza no sistema cúbico, com uma estrutura do tipo cloreto de sódio. A aresta da célula unitária é 577,5 pm. a) Qual é a distância entre os centros dos iões Br- e Ag+? b) Calcule a massa volúmica (ou densidade absoluta) do brometo de prata em unidades do Sistema Internacional (SI). c) A dureza do sulfureto de magnésio, outra substância que cristaliza com o mesmo tipo de estrutura, é maior ou menor do que a do brometo de prata? Justifique. Resolução: a) Na estrutura do cloreto de sódio, os iões de um tipo ocupam o centro das faces e os vértices e os do outro tipo o meio das arestas e o centro do cubo. Assim a aresta do cubo será a= 2×(ra+rc) em que ra é o raio do anião e rc o raio do catião. Assim a distância entre anião e catião é metade da aresta, isto é, 288,75 pm. b) Há 4 catiões e 4 aniões por célula unitária. Então a massa volúmica será a soma das massas dos iões dividida pelo cubo da aresta da célula unitária. = m/V= 4(mAg+mBr)/ a3 A massa de um ião de prata é mAg=107,87×10-3/NA e de bromo mBr=79,90×10-3/NA expressas em kg. A massa é 1,25×10-24 kg V= a3 = (577,5×10-12)3= 1,93×10-28 m3 = 1,25×10-24/1,93×10-28= 6,48×103 kg m-3 Resposta: A massa volúmica é 6,48×103 kg m-3 c) A dureza dos sólidos iónicos depende diretamente da sua energia reticular. Uma vez que se afirma que a estrutura é a mesma, isso quer dizer que a constante de Madelung é a mesma para os dois compostos. Na expressão Er=[ NAAZAZCe2/(4π0r0)](1-1/n) o que difere de um composto para o outro são os valores do módulo das cargas dos iões ZAe e ZCe, o valor de ro e o valor do expoente do termo repulsivo de Born n. É fácil concluir que o mais importante é o produto das cargas que é 4 para o sulfureto de magnésio (S2 e Mg2+ ) e 1 para o brometo de prata. Os raios iónicos sãos diferentes e os valores de n também mas nunca atingem um ratio de 4, como o produto das cargas. Assim, a energia reticular é maior para o sulfureto de magnésio e consequentemente a sua dureza. IV (4 valores) A reação de decomposição do fosgénio é dada pela seguinte equação: COCl2(g) CO(g) + Cl2(g) Introduziu-se 0,10 mol de fosgénio a 620K, num recipiente de 2,0 dm3. A pressão foi variando até que se atingiu o equilíbrio. a) Qual a composição da mistura reacional (quantidade, ni, de cada um dos componentes) no recipiente quando se atingiu o equilíbrio a 620K? b) Calcule a pressão total no recipiente quando se atingiu o equilíbrio. Conhecem-se os seguintes dados termodinâmicos a 620K: Entalpia da reação rH0= 110,91 kJ mol-1 COCl2(g) S0=385,14 JK-1 mol-1 CO(g) S0=256,63 JK-1 mol-1 Cl2(g) S0=297,42 JK-1 mol-1 Resolução: A partir dos dados termodinâmicos, vamos calcular G0 para a reacção a 620K e nas condições padrão, isto é, quando as pressãoes parciais de todos os componentes são de 1 bar. G0= H0 TS0 S0= 256,63 + 297,42 - 385,14= 168,91 JK-1mol-1 G0= 110910 - 620×168,91= 6185,8 J mol-1 Como G=G0 +RT ln Q e no equilíbrio G=0 e Q=K G0=-RT lnK ou K= exp(-G0/RT) . Então K= exp [-6185,8/(8,3141 ×620)] K= 0,3 Para calcularmos a composição da mistura reacional no equilíbrio, fazemos o balanço COCl2(g) CO(g) + Cl2(g) 0,1 0,1 – x 0 x Como K= PCOPCl2/ PCOCl2 equilíbrio. K= x2 RT/[(0,1 x) V] e 0 x PCO=PCl2=xRT/V PCOCl2 = (0,1 x)RT/V sendo estas as pressões parciais em o que substituindo conduz à equação do segundo grau 25,773 x2 + 0,3x – 0,03 = 0 Esta equação tem duas raízes, 0,029 e 0,040, das quais só a primeira tem significado físico. Assim teremos no equilíbrio 0,029 mol de CO, 0,029 mol de Cl2 e 0,071 mol de COCl2 Resposta alínea a) No total são 0,129 mol de substâncias no estado gasoso, a que vai corresponder a pressão P=nRT/V P= 0,129×0,08314×620/2 = 3,32 bar A pressão no interior do recipiente reacional no equilíbrio era 3,32 bar Resposta alínea b) Laboratorial (4 valores: 1+1+1+1) 1- Use o modelo da partícula na caixa de potencial nulo a uma dimensão para prever o comprimento de onda da transição electrónica de mais baixa energia do CH3CHCHCN. Tome para distância média C-C 141 pm e para C-N 121pm. De acordo com o modelo, considera-se o comprimento da caixa unidimensional como o comprimento da cadeia conjugada, isto é, envolvendo as ligações deslocalizadas L= 2,5 dCC + 1,5dCN L= 2,5×141+ 1,5×121=534 pm L= 5,34×10-10m Como há 4 eletrões na cadeia conjugada, os níveis 1 e 2 estão preenchidos, dando-se a transição do nível 2 para o nível 3. A energia da transição é dada por E= (32 – 22)×(6,626×10-34)2/[8×9,11×10-31×(5,34×10-10)2]= 1,06×10-18 J A esta diferença de energia corresponde o comprimento de onda =hc/E =6,626×10-34×2,998×108/1,06×10-18 = 1,88×10-7 m O comprimento de onmda é de 188 nm. 2- Disscuta a miscibilidade de viniltolueno, (CH3)(C6H4)CH=CH2, em benzeno (C6H6) e em água. O viniltolueno é uma molécula com momento dipolar praticamente nulo. Ente as moléculas de viniltolueno há só interações de London, bastante significativas. O benzeno tem também apenas interações de London, mais fracas do que as do viniltolueno (tem menos 22 eletrões). A água tem interações de Keesom, Debye e London (muito mais fracas do que as do viniltolueno e do benzeno) e pontes de hidrogénio bastante fortes. No balanço entre o que se ganha e o que se perde na mistura há o termo entrópico, sempre favorável, e o termo entálpico que pode ser favorável ou desfavorável. No caso da água com o viniltolueno é claramente desfavorável: rompimento de fortes pontes de hidrogénio e das forças de Keesom na água, rompimento de fortes interações de London no vinitolueno. Só se podem estabelecer interações de Debye (sempre fracas) e de London, muito mais fracas do que entre as moléculas de viniltolueno umas com as outras. No caso do bvenzeno o tipo de interações que se quebram e as q ue se estabelecem são do mesmo tipo, de London. O que se forma é intermediário entre as do benzeno e do viniltolueno. O balanço entre o que se perde e o que se ganha é mais equilibrado. Com o factor entrópico favorável, é de prever que sejam miscíveis 3- No trabalho de laboratório, estudou a cinética da reação de hidrólise básica do violeta de cristal (VC) na condição em que [NaOH] >> [VC]. a) Qual a ordem da reação em relação ao violeta de cristal? b) Se em vez dessas condições, tivesse usado [NaOH] = [VC], qual seria a ordem da reação em relação ao violeta de cristal? Admita que a reação é elementar. a) Como verificou experimentalmente a odem de reação era 1 não só em relação ao violeta de cristal como global uma vez que se pode fazer a aproximação de considerar [VC]≈ constante e assim substituir a constante de velocidade k, por uma consatante de velocidade aparente kap = k [VC]. b) A ordem em ralação ao violeta de cristal mantém-se igual a 1. Mas neste caso como também será de ordem 1 em relação ao ião hidróxido, uma vez que a reação é elementar (a ordem é igual à molecularidade). Assim, o que muda é a ordem global que passa a ser 2. 4-Considere a experiência de um prego de ferro e uma placa de zinco, ligados por um fio condutor e mergulhadas num gel com um indicador de pH, fenolftlaleìna (transição incolor/vermelho carmim) e outro indicador de Fe2+, hexacianoferrato(III) de potássio (passagem de amarelo a azul). Que mudanças obervaria pela mudança de a) Prego de ferro por um de prata, mantendo a placa de zinco b) Placa de zinco por uma de prata, mantendo o prego de ferro. Quando temos a placa de zinco ligada ao ferro, obervamos a cor vermelho carmim no ferro por estar protegido contra a corrosão, em virtude do zinco ter menor potencial de eléctrodo padrão do que o ferro. a) O potencial de eléctrodo padrão da prata é também maior do que o zinco e, portanto, na prata continuaria a obervar-se a cor vermelho carmim. b) No par ferro/prata , é a prata o que tem maior potencial de eléctrodo padrão. O ferro sofreria corrosão, e assim apareceria sobre o prego de ferro a cor azul, indicativa do aparecimento de Fe2+ em solução.
Baixar