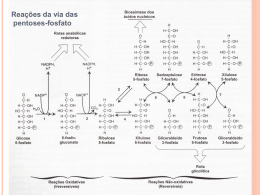
UNIVERSIDADE FEDERAL DE OURO PRETO INSTITUTO DE CIÊNCIAS EXATAS E BIOLÓGICAS BIOQUÍMICA ALÉM DA BIOQUÍMICA Prof. Dr. Leandro Marcio Moreira Ouro Preto, Julho de 2010 _________________________________________________________________________________ 1 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ PREFÁCIO A disciplina de Bioquímica em muitos dos cursos de graduação tem levado em conta um conteúdo programático voltado quase que exclusivamente para o conhecimento presentes exclusivamente em livros textos especializados. No entanto, estes livros são voltados quase especificamente para o ensino de bioquímica cujo contexto insere-se no modelo humano, salvo algumas exceções. Desta forma, quando vias metabólicas são discutidas, muitas das peculiaridades interessantes e inerentes a alguns organismos ficam deixadas de lado. Assim, modelos interessantes de estudo quase sempre relacionados com evolução e adaptação dos organismos ficam na obscuridade, e passam a ser estudados ao acaso, se o forem. De forma sinérgica a este contexto ainda pode ser citado o pouco tempo de contato desta disciplina com o aluno que, por ainda ser imaturo em um conhecimento mais aprofundamento de química, o desgaste em sala de aula. Podemos então resumir, com base neste curto prospecto que em um único semestre é impossível conhecer a beleza das vias metabólicas integradas e as exceções passíveis de serem discutidas em organismos específicos. Com base no fato de que é possível expandir este conhecimento bioquímico, bem como a curiosidade dos alunos para esta disciplina, foi elaborada a proposta pedagógica apresentada a seguir. Para isso, os alunos ficaram incumbidos de escolherem as temáticas, independentemente da área do conhecimento, desde que o pano de fundo da discussão fosse a Bioquímica. Curiosamente, e de forma surpreendente, muitas temáticas variadas e bem abordadas foram introduzidas nas últimas semanas do semestre letivo. Isso mostrou não apenas o potencial que nossos alunos possuem como geradores e divulgadores do conhecimento científico, como também abriu o leque de oportunidades para que a Bioquímica seja vinculada numa futura proposta científica a ser elaborada por estes promissores pesquisadores. A seguir são apresentados na íntegra os trabalhos feitos por estes alunos. Bioquímica além da Bioquímica embora seja uma proposta preliminar de algo que possa se tornar grandioso no futuro é fruto do trabalho destes alunos, e nada mais justo do que tornar público o investimento de tempo dos mesmos na geração de um produto elaborado a partir de interesse próprio. Prof. Dr. Leandro Marcio Moreira _________________________________________________________________________________ 2 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Sumário NEM TUDO SÃO FLORES: O LADO DARK DAS PLANTAS. .....................................................................5 Guilherme F. P. Pociano 1 e Letícia R. Alves1. ....................................................................................5 A NEUROTOXINA DO PEIXE-PEDRA COMO ALTERNATIVA PARA A TOXINA BOTULÍNICA NO TRATAMENTO COSMÉTICO TEMPORÁRIO (BOTOX®) .........................................................................9 Ane Catarine Tosi Costa e Felipe Donateli Gatti ...............................................................................9 EXPLICAÇÃO BIOQUÍMICA PARA OS DIAS DE INDISPOSIÇÃO E MELANCOLIA NO INVERNO............. 13 Gabriela O. Faria 1 e Karine P. Lúcio 2............................................................................................... 13 PREVENÇÃO DE DOENÇAS EM PLANTAS: A TEORIA DA TROFOBIOSE............................................... 17 Mariana Fernandes Monteiro Guimarães1 e Rachel Germiniani Resende² ..................................... 17 VENENO PODE SER UMA SUBSTÂNCIA DO BEM? ............................................................................. 20 Priscila M. de Souza e Renata de A. B. Assis................................................................................... 20 APOPTOSE NO TRATAMENTO DO CÂNCER....................................................................................... 25 Denise C. Miranda e Silvana Melo ................................................................................................. 25 TRAPACEANDO O TRIPANOSOMA.................................................................................................... 28 Lucas Á. Ferreira e Marcelo C. Mucci Daniel .................................................................................. 28 OXIGÊNIO: TER OU NÃO TER, EIS A QUESTÃO!................................................................................. 30 Hilda de Cássia Ferreira 1 e Jaqueline Malta Rolim 2 ........................................................................ 30 ÁCIDOS GRAXOS ESSENCIAIS PARA A ALIMENTAÇÃO HUMANA...................................................... 35 Juliana F. V. Tófoli e Lorena A. F. Brito........................................................................................... 35 BACTÉRIAS FAMINTAS POR PETRÓLEO: MICRORGANISMOS ANAERÓBIOS NA BIORREMEDIAÇÃO DE HIDROCARBONETOS ........................................................................................................................ 38 Leonardo R Santos1 e Sarah F Guimarães1 ..................................................................................... 38 ESTRATÉGIAS DE PLANTAS CONTRA O ATAQUE DE AGENTES FITOPATOGÊNICOS ........................... 41 Saulo Rodrigues Leles e Felipe Telles............................................................................................. 41 FIXAÇÃO BIOLÓGICA DE NITROGÊNIO E A DIVERSIDADE DE BACTÉRIAS DIAZOTRÓFICAS ............... 45 Giordano P. P. Freitas e Rafael C. Cardoso ..................................................................................... 45 MELATONINA: COMO ESTE HORMÔNIO ATUA NA DOENÇA DE PARKINSON ................................... 48 Gabriela M. Z. da Silva e Lucas R. C. Aguiar.................................................................................... 48 BIOQUÍMICA DO MEL: PRODUÇÃO E QUALIFICAÇÃO....................................................................... 55 Ana Laura de A. F. D. Pimentel1 e Thiago C. Nepomucena 1 ............................................................ 55 USO DE FEROMÔNIOS DE INSETOS SINTETIZADOS ARTIFICIALMENTE NO CONTROLE BIOLÓGICO DE PRAGAS DA AGRICULTURA............................................................................................................... 64 _________________________________________________________________________________ 3 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Ana C.F. Magalhães¹ e Carlos R.A. Barreto¹.................................................................................... 64 PRODUÇÃO DE HERBICIDAS NATURAIS A PARTIR DE PLANTAS ALELOPÁTICAS ............................... 70 Iuri S. Martins e Lorena M. Dias..................................................................................................... 70 ASPECTOS FARMACOLÓGICOS DA HIPERTENSÃO: Uso do Captopril ................................................ 73 Barbara S. Passos e Lorena R. Vieira .............................................................................................. 73 ALERTA: O QUE A CAFEÍNA TEM, JÁ QUE O MUNDO NÃO VIVE SEM! .............................................. 75 Carolina F. De Angelis 1 e Geysa C. Mendes Silva 2 ........................................................................... 75 VÍCIO QUE GERA PRAZER? UMA RELAÇÃO ENTRE DOPAMINA E COCAÍNA ...................................... 78 Ana Cláudia A. Carneiro 1 e Márcia Regina F. Luzia 2 ..................................................................... 78 DOCE VENENO.................................................................................................................................. 83 Lucas de Almeida Barbosa e Samuel Ramos de Souza.................................................................... 83 ÓPIO: A DROGA DO SONO ............................................................................................................... 87 Thiago C. Silva e Renata P. Fumes ................................................................................................. 87 LANTERNA VIVA ............................................................................................................................... 92 Karoline Estefani Duarte* e Walles Henrique Vieira Souza* .......................................................... 92 PEPTIDEOS ANTIMICROBIANOS DE ORIGEM CUTÂNEA.................................................................... 95 Ester A. Mota e Fernanda Marcondes ........................................................................................... 95 FORMIGAS, FUNGOS, BACTÉRIAS E SEUS COMPOSTOS MISTERIOSOS ............................................. 99 Antoniazzi-Junior, R.L.1,2 e Leite, A.C.1,3.......................................................................................... 99 _________________________________________________________________________________ 4 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ NEM TUDO SÃO FLORES: O LADO DARK DAS PLANTAS. Guilherme F. P. Pociano1 e Letícia R. Alves1. Graduandos em Ciências Biológicas Licenciatura pela Universidade Federal de Ouro Preto. RESUMO A grande biodiversidade das plantas e sua presença em todos os ambientes foi possível devido a diversos mecanismos adaptativos desenvolvidos por elas ao longo de sua evolução. Uma delas é a síntese de aminoácidos por meio da absorção de compostos nitrogenados, um elemento químico essencial. Outra adaptação muito interessante são os mecanismos de defesa contra a herbívora, um dos mais eficientes é a produção de compostos secundários, em especial o fitoecdisona. Esta molécula representa um terpeno produzido pela planta que é muito semelhante a um hormônio dos artrópodes, o ecdisona que estimula a muda e a metamorfose, assim quando o inseto ingere esse composto ele entra muda ou em metamorfose sem estar preparado o que o leva a morte Palavras-chave: plantas, defesa, compostos nitrogenados, compostos secundários, fitoecdisona. INTRODUÇÃO Você já parou para pensar como é difícil a vida de uma planta? Ficar parada de baixo de sol e chuva, tempo quente ou frio. Além disso, estar sempre à mercê de predadores, vorazes e prontos para atacar as pobres plantinhas sem que as mesmas possam correr para se esconder ou lutar para sobreviver. Se realmente fosse tão difícil sua sobrevivência em detrimentos destas ações deletérias que sofrem, não teríamos a grande diversidade de plantas habitando o planeta. As plantas se adaptaram muito bem para poderem sobreviver no ambiente. Elas têm a capacidade de se protegerem de predadores e também de fazerem associações com outros organismos para se defender ou para melhorar suas condições de vida. Aquela plantinha que você vê ali no quintal não está só parada, sem fazer nada, ela está tão ativa ou até mais do que você em termos metabólicos. Vamos discutir levando em conta algumas das complexidades que as plantas apresentam, tais como a produção de compostos secundários para ser usado como estratégias de defesa e em especial o fitoecdisona que é um terpeno que tem a mesma ação que o hormônio ecdisona produzido pelos artrópodes, esse é responsável por iniciar a muda e metamorfose. As plantas fazem xixi? Você já parou para pensar por que a planta não faz xixi? Para responder essa pergunta, primeiro temos que entender por que os animais fazem xixi. Os animais se alimentam de carboidratos, lipídeos e proteínas, na degradação desse último formam como subprodutos compostos nitrogenados tóxicos ao organismo que devem ser eliminados. Alguns animais como as aves e répteis liberam esses compostos em forma de acido úrico, outros como os peixes liberam em forma de amônia ou também ureia como nos mamíferos. Os mamíferos também sintetizam ácido úrico, porém esse não é proveniente da degradação de proteínas e sim como um subproduto do metabolismo de bases nitrogenadas púricas. Já as plantas como são autótrofas, sintetizam o seu alimento, elas usam a fotossíntese para produzirem carboidrato e usam os compostos nitrogenados como a amônia e nitrato para sintetizar suas proteínas. Ou seja, as plantas não fazem xixi porque elas não ingerem proteínas e as degrada, ela as sintetizam e por mais que ela possa degradar suas proteínas e gerar compostos nitrogenados que nos animais são tóxicos, elas reutilizam esses na síntese de outras novas. Como não vai ter subprodutos nitrogenados tóxicos para serem eliminados, a planta não tem a necessidade de fazer xixi. O esquema na figura 1 ilustra de forma simples como são formados esses compostos nitrogenados e a síntese básica de proteína nas plantas. _________________________________________________________________________________ 5 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Figura 1: Esquema (a) da degradação de proteína em animais que liberam ure ia; (b) degradação de prote ínas em animais que liberam acido úrico; (c) degradação de proteínas em animais que liberam amônia e (d) síntese de prote ínas em plantas, a síntese é fe ita a partir de compostos nitrogenados e se esse for nitrito ele e convertido à amônia para que a síntese comece. Como as plantas se defendem dos predadores? Para se defenderem as plantas apresentam alguns mecanismos como espinhos, cristais, tricomas e também compostos secundários. Essas substâncias produzidas pelas plantas podem servir para varias funções, uma delas é caracterizar uma palatabilidade desagradável e com essa experiência ruim o anima l não volta para predá-la novamente, pode também ter a função de repelir o predador afastando-o. O lado DARK da planta Algumas espécies de plantas como, as do gênero Pfaffia conhecidas popularmente como ginseng, figura 2a e 2b, algumas samambaias do gênero Polypodium, figura 2c, 2d e 2e, a quinoa, figura 2f e o espinafre, figura 2g, são capazes de produz um composto chamado de fitoecdsona que é um terpeno, uma das três classes de compostos secundários. (a) (d) (b) (e) (c) (f) (g) Figura 2: algumas das plantas capazes de produzir o fitoecdisona. _________________________________________________________________________________ 6 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ O fitoecdisona é semelhante ao hormônio ecdisona produzido pelos artrópodes e é esse hormônio que estimula a metamorfose e a ecdise (muda). O zooecdisona, o produzido pelos artrópodes só é sintetizado quando ele está pronto para fazer a muda, ou seja, está na hora de trocar o exoesqueleto para crescer, visto que a ecdise é fundamental para o crescimento do animal. Quando o inseto se alimenta de plantas que produzem o fitoecdsona esse composto dentro do organismo do bicho induz a muda assim como o sintetizado por ele, porém essa é estimulada sem o inseto estar devidamente preparado para isso ocorrer, o que o leva a morte e também pode levar a metamorfose prematura o que causa a morte devido não está na hora certa para que isso ocorra. Não se sabe ao certo se esse composto produzido pela planta faz parte de outras vias hormonais dela ou se é apenas um composto desenvolvido para defesa contra herbívora. A produção do fitoecdisona é um lado negro da planta, pois ela tem a via de sínteses de outros compostos secundários que servem como repelente, afasta o predador ou como também já foi citado a deixa com um gosto ruim desse modo gerando uma memória negativa no anima l que não mais voltará para preda-la ou a qualquer outra que se pareça com ela. Já o fitoecdisona mata o bicho, ele não vai mais voltar nem a predá-la nem a qualquer outra planta. A seguir está a estrutura do fitoecdisona e do zooecdisona: Figura 3: comparação entre o fitoecdisona e o zooecdisona. Segue um esquema simplificado das duas rotas para as vias de síntese dos terpenos. Figura 4: Esquema da síntese dos terpenos A mesma via do mevalonato está presente tanto em plantas quanto em animais. Nos animais essa via também leva ao isopentenil e com a junção desses formam o esqualeno, um composto com trinta carbonos, que é o precursor da sínese de colesterol. Tanto o colesterol quanto o fitoecdisona têm como precursor a molécula de esqualeno, figura 5, o que os diferem é que a molécula de fitoecdisona possui mais grupos hidroxila e uma cetona do que o colesterol. _________________________________________________________________________________ 7 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Figura 5: representação do esqualeno, do fitoecdisona e do colesterol. Importância econômica: A extração e o estudo do fitoecdisona são interessantes, pois a partir deste pode ser criados inseticidas naturais de interesse da indústria agronômica, pois esse composto não é toxico aos mamíferos. Considerações finais: Algo a ser pensado para estudos posteriores e como sintetizar o fitoecdisona em laboratórios. Um dos possíveis métodos pode ser o estudo da via a partir do esqualeno até o fitoecdisona, pois essa não é bem conhecida e outra linha alternativa é devido ao esqueleto carbônico do fitoecdisona ser idêntico ao da molécula de colesterol e a via de síntese desse último composto é bem conhecida, então basta fazer uma analise da molécula de ecdisona e descobrir qual é o grupo hidroxila que é responsável por ativar a função do hormônio no inseto, sabendo isso o próximo passo seria adicionar o grupo hidroxila na molécula de colesterol no ponto onde ela é o agente que causa a reatividade do hormônio no artrópode. E podemos ver que as plantas são sofisticadas no quesito “defesa”. É enorme a quantidade de mecanismos que as plantas desenvolvem para se defender, se adaptar ao meio, fazer associações com outros seres, fazer seu próprio alimento, dentre outros e tudo isso parada. Porém nem tudo são flores, como foi citado algumas plantas tem o seu lado perverso. REFERENCIAS BIBLIOGRÁFICAS TAIZ, Lincoin; ZEIGER, Eduardo. Fisiologia Vegetal, 4° Ed, Porto Alegre, Artmed, 2009. FESTUCCI-BUSELLI, Reginaldo A.; CONTIM, Luis A. S.; BARBOSA, Luiz Cláudio A.; STUART, Jeff end OTONI, Wagner C. Biosynthesis and potential functions of the ecdysteroid 20hydroxyecdysone – a review. Disponível em http://article.pubs.nrccnrc.gc.ca/ppv/RPViewDoc?issn=1916-2804&volume=86&issue=9&startPage=978 acessado em 14 de jun de 2010. Imagem disponível em: http://www.naturezadivina.com.br/loja/catalog_products_with_images.php?listing=&page=11 acessado em 17 de jun. 2010. Imagem disponível em: http://www.flordocamponatural.com.br/chas/pfaffia.htm acessado em 17 de jun. 2010. Imagem disponível em: http://www.sucupiraonline.com.br/noticias/ler.php?noti1_cod=94 acessado em 17 de jun. 2010. Imagem disponível em: http://www.vidavegetariana.com/artigos/redacao/espinafre.htm acessado em 17 de jun. 2010. Imagem disponível em: http://drstoilov.wordpress.com/2009/01/04/quinoa-the-ancient-secret-of-theinca/ acessado em 17 de jun. 2010. _________________________________________________________________________________ 8 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ A NEUROTOXINA DO PEIXE-PEDRA COMO ALTERNATIVA PARA A TOXINA BOTULÍNICA NO TRATAMENTO COSMÉTICO TEMPORÁRIO (BOTOX®) Ane Catarine Tosi Costa e Felipe Donateli Gatti Alunos de graduação do curso de Bacharelado em Ciências Biológicas UFOP RESUMO Neste trabalho foi realizada uma sucinta abordagem sobre a Clostridium botulinum, onde foi enfatizada a ação de sua neurotoxina no tratamento cosmético temporário. Também foi feita uma abordagem rápida sobre o peixe-pedra enfatizando a capacidade neurotóxica do seu veneno. Observada as ações das duas toxinas foi feita uma proposta para que a neurotoxina do peixe-pedra pudesse ser usada como alternativa para a toxina botulínica no tratamento cosmético temporário. Caso seja possível a execução desta hipótese através de pesquisas bibliográfica já existente e novos estudos a sua produção em massa poderia ser realizada através da técnica do DNA recombinante. Palavras chaves: Veneno de peixe; Neurotransmissores; Botulismo; BOTOX®; Recombinação gênica; Transcriptoma. INTRODUÇÃO Venenos e toxinas vêm sendo estudadas há anos por sua utilização na indústria farmacêutica. Um exemplo desse tipo de estudo foi o desenvolvido com a bactéria Clostridium botulinum, causadora da doença conhecida como botulismo. A mesma neurotoxina que causa a doença letal é também muito utilizada em todo mundo como tratamento estético (BOTOX®). Mais recentemente o veneno do peixe-pedra despertou o interesse de pesquisadores, pois estão sendo registrados muitos casos de acidentes de humanos com esse peixe na região da Indonésia e Oceania, alguns ocasionando ate mortes. Ao analisar estudos sobre as toxinas que compõe o veneno do peixe-pedra a neurotoxina nos chamou atenção pela similaridade de atuação no organismo de ratos com a toxina botulínica. Peixe-pedra Os Peixe-pedras (gênero Synanceja) são comumente encontrados em águas rasas da região tropical do Indo-Pacífico e é considerado o mais perigoso e venenoso da família do peixe-escorpião. Estão distribuídos ao longo das águas em torno de Singapura, Malásia, Indonésia, Índia e até na África. Uma das características mais marcantes desta espécie é a sua coluna de 13 projeções hipodérmicas, cada um capaz de perfurar ate um sapato (KHOO, 2002). Fig. 1. Peixe-pedra. Fonte: Bioactive proteins from stonefish venom. Khoo, 2002. _________________________________________________________________________________ 9 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ As experiências iniciais de investigação das propriedades enzimáticas do veneno de S. horrida revelaram apenas a presença de atividade da hialuronidase, essa é um importante fator de propagação presentes em muitos venenos, pois degrada hialuronato que é um dos principais componentes do tecido conjuntivo nos animais, por tanto ela é a causadora da grande necrose observada depois de acidentes envolvendo o peixe-pedra (KHOO, 2002). Também foi observado que o veneno possui a capacidade hemolítica em alguns animais, a capacidade de causar efeitos cardiovasculares como a queda de pressão observada em ratos e efeitos neuromusculares como a parada respiratória (KHOO, 2002). Clostridium botulinum As toxinas produzidas pela Clostridium botulinum são responsáveis pelo botulismo, sendo essas toxinas as mais potentes neurotoxinas conhecidas. Essas neurotoxinas são descritas em oito diferentes tipos (A, B, C1, C2, D, E, F, G), que se diferem pelas características antigênicas, embora tenham ação farmacológica similar (JOHNSON e BRADSHAW, 2001). Em 1989 a toxina tipo A foi registrada e seu uso foi aprovado por oftalmologistas, para o tratamento de espasmos involuntários da musculatura das pálpebras, estrabismo e distonias. Os médicos perceberam que a toxina botulínica tipo A também tinha efeito sobre as linhas de expressão do rosto, diminuindo ou amenizando as marcas na face e evitando cirurgias plásticas. Os resultados obtidos foram bastante satisfatórios e bem difundidos, de forma que a utilização da toxina botulínica tipo A atingiu alta receptividade tanto pelos profissionais, quanto pelos clientes, o que fez dele uma das técnicas mais procuradas da atualidade (BOTOX®), por aqueles que buscam uma aparência mais jovem (SPOSITO, 2004). Hipótese Sabendo de tudo isso que foi anteriormente revisado surgiu a seguinte pergunta: A neurotoxina do peixe-pedra poderia ser usada como alternativa a toxina botulínica? A proposta deste trabalho é provar através de estudos já realizados que seria possível a utilização da neurotoxina do peixe-pedra como alternativa a toxina botulínica no tratamento cosmético temporário. DISCUSSÃO Fomos pesquisar através de revisão bibliográfica como seria a ação da toxina botulínica no organismo e chegamos a seguinte informação: A ação da toxina no corpo é inserto, mas supõe-se que bloqueie a liberação da acetilcolina (Neurotransmissores) nas junções neuromusculares, terminais nervosos colinérgicos periféricos nos gânglios autônomos, e nas terminações nervosas parassimpáticas pós-glanglionares (SMITH, 1993), (Fig. 2. B). Fig. 2. A) Neurotransmissão normal. B) Com a ação da toxina botulínica. Fonte: Universidade do Porto, Faculdade de Farmácia, Toxicologia. _________________________________________________________________________________ 10 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Já a toxina do peixe-pedra atua um pouco diferente, porém com a mesma finalidade. No veneno de S. horrida foi relatado a inibição da captação de colina e ácido aminobutírico em sinaptossomas. A toxina também provoca uma depleção na liberação de acetilcolina. Isto sugere que o veneno de S. horrida pode interferir tanto na síntese como na liberação de neurotransmissores (KHOO, 2002), (Fig. 3). Fig. 3. Possível ação da neurotoxina do peixe-pedra. Colina não captada acetilcolina não sinte tizada. Por essa ótica a neurotoxina do peixe-pedra seria sim uma potencial alternativa para a toxina botulínica no tratamento cosmético temporário (BOTOX®). Partindo desse ponto a técnica do DNA recombinante poderia ser usada para a produção em larga escala da neurotoxina, onde se identificaria a gene que produz a proteína específica da neurotoxina, ele seria implantado em um plasmídeo bacteriano. Esse plasmídeo, por sua vez, seria inserido em uma bactéria, essa por sua vez passaria a produzir a neurotoxina e seria cultivada, para posteriormente se extrair a toxina que passaria por um processo de purificação e estaria pronta para ser comercializada (Fig. 4). Fig. 4. Técnica do DNA re combinante. Fonte: Genética em Mov imento. José Salsa, 2006. Um fato que reforça a idéia foi o Trancrissoma de Thalassophryne nattereri (MAGALHÃES, G. S. et al, 2006), pois nos permite saber qual o gene que transcreve a proteína da neurotoxina, e já foi feito _________________________________________________________________________________ 11 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ com um peixe da família do peixe-pedra. O Thalassophryne nattereri é mais conhecido aqui no Brasil como “Niquim” ou “peixe-escorpião”, e é encontrado em quase toda costa atlântica das Américas. CONCLUSÃO Diante dos dados apresentados neste trabalho, fica claro que seria possível sim o uso da neurotoxina do peixe-pedra como alternativa a toxina botulínica no tratamento cosmético temporário de forma até mais eficaz, pois além de inibir a liberação de acetilcolina ela também impede sua produção. É de extrema importância que se continue estudando a fundo os venenos e toxinas existentes, pois nessas substâncias podem estar o tratamento para a uma grande quantidade de doenças. REFERÊNCIAS BIBLIOGRÁFICAS KHOO, H. E. Bioactive proteins from stonefish venom. Clinical and Experimental Pharmacology and Physiology (2002) 29, 802–806; JOHNSON, E.A.; BRADSHAW, M. Clostridium botulinum and its neurotoxins: a metabolic and cellular perspective. Toxicon, Oxford, v.39, p.1703-1722, 2001; SPOSITO, M. M. M. Toxina botulínica tipo A - propriedades farmacológicas e uso clínico. Acta Fisiatr. 2004; SMITH, P. BRADFORD. Tratado de Medicina Interna de Grandes Animais: moléstia de eqüinos, bovinos, avinos e caprinos/ Bradford P. Smith; revisor cientifico da edição brasileira Prof. Dr. José de Alvarenga; / Tradução Fernando Gomes do Nascimento/. – São Paulo: Manole. v. 2, p. 1028-1030, 1993; MAGALHÃES, G. S. Transcriptoma analysis of expressed sequence tags from the venom glands of the fish Thalassophryne nattereri. Biochimie 88 (2006). _________________________________________________________________________________ 12 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ EXPLICAÇÃO BIOQUÍMICA PARA OS DIAS DE INDISPOSIÇÃO E MELANCOLIA NO INVERNO Gabriela O. Faria1 e Karine P. Lúcio2 1 Graduanda em Ciências Biológicas – Bacharelado pela UFOP 2 Graduanda em Ciências Biológicas – Licenciatura pela UFOP RESUMO A depressão de inverno é um tipo de distúrbio afetivo sazonal no qual os pacientes apresentam sintomas como abatimento e desânimo, além de transtornos de peso, insônia, agitação, fadiga, sentimentos de culpa, dificuldade de concentração e até mesmo pensamentos suicidas. Essa patologia é desencadeada a partir de distúrbios no ritmo circadiano. O ritmo circadiano pode ser definido como alterações das funções biológicas e comportamentais que ocorrem com uma ciclicidade diária e que são promovidas por meio de sinalização de neurotransmissores. O presente artigo visa esclarecer do ponto de vista bioquímico, como a depressão de inverno se desenvolve baseando-se para isso no metabolismo de dois neurohormônios (melatonina e serotonina) que atuam no ritmo circadiano. Palavras-chave: ritmo circadiano, melatonina,fotoperíodos curtos, serotonina, depressão sazonal. INTRODUÇÃO O estudo do ciclo circadiano e de outras formas de regulação do tempo pelo corpo são objetos de estudo da cronobiologia. Este campo busca o entendimento de como os seres vivos manuseiam as recorrências temporais e como os diferentes organismos são capazes de sincronizar as suas atividades a essas variações. Do ponto de vista físico, a alternância claro-escuro é a forma básica de marcação do tempo (BARBOSA JÚNIOR; FERREIRA; MARKUS, 2003). Segundo sua etimologia, ritmo circadiano significa “cerca de um dia” (do Latim: circa – cerca; diem – dia). Ele designa o período de aproximadamente um dia (24 horas) sobre o qual se baseia todo o ciclo biológico do corpo humano e de qualquer outro ser vivo influenciado pela luz solar. A manutenção do ritmo circadiano é realizada por aglomerados de neurônios localizados no hipotálamo, denominados núcleos supraquiasmáticos (NSQ). Eles são responsáveis pelo controle tanto da produção quanto da secreção da melatonina que é um neurotransmissor liberado, geralmente, à noite pela glândula pineal e tem como função básica informar ao organismo que está escuro. Esse processo se dá através de uma via retino-hipotalâmica que informa aos NSQ a alternância claro-escuro. De acordo com Barbosa Júnior, Ferreira e Markus (2003), “A fotorrecepção é feita na retina por células especializadas, conhecidas como cones e bastonetes. Essas células são capazes de traduzir a onda luminosa em um sinal químico e com isso iniciar alterações elétricas no nervo óptico” [que irá induzir a síntese de melatonina]. _________________________________________________________________________________ 13 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Estimula a síntese de melatonina Núcleo supraquiasmático • Ausência de luz solar Captação pelas células da retina (cones e bastonetes) • Envia sinais sobre as condições de luminosidade do ambiente para o SNC utilizando o nervo óptico. • Medula espinhal Glândula pineal Esquema de ativação da síntese de melatonina De acordo com CAPITELLI (2007), a síntese de melatonina se processa da seguinte forma: O aminoácido triptofano, pela ação da enzima triptofano 5 monooxigenase (T5M), é convertido em 5hidroxitriptofano. A partir do 5-hidroxitriptofano pela ação da enzima aromática aminoácido descarboxilase (AAAD), ocorre a síntese de 5-hidroxitriptamina (5-HT), que em seguida é convertida em N-acetilserotonina pela enzima serotonina-N-acetiltransferase (AANAT), que é a enzima passo limitante da síntese de melatonina na glândula pineal, local onde esta enzima é expressa. O passo final do processo de síntese da melatonina ocorre pela ação da enzima hidroxindol-Ometiltransferase (HIOMT) resultando na formação de melatonina. Certa quantidade de melatonina produzida é excretada de forma inalterada, outra parte é eliminada através de uma via clássica de hidroxilação envolvendo enzimas do citocromo P450 1A2, que catalisa a formação de 6-hidroximelatonina que então sofre conjugação com ácido glicurônico ou sulfato, gerando um composto mais habilitado a excreção. Uma via alternativa a estes processos consiste na abertura do núcleo indol durante o processo de oxidação pela enzima indolamina-2,3-dioxigenase (IDO) e/ou pela mieloperoxidase (MPO) levando a produção de N-acetil-5-metoxiquinuramina (AMK). A importância deste metabólito ativo da melatonina é ainda pouco conhecida, mas acredita-se que ele possa estar envolvido em muitos dos efeitos desse hormônio. DISTÚRBIO AFETIVO SAZONAL O distúrbio afetivo é caracterizado por episódios de depressão grave que costumam coincidir com a redução de horas de luz nos dias de outono e inverno. É decorrente de uma alteração no ritmo circadiano causado pela ausência de sincronização entre o relógio solar e o relógio biológico humano durante as estações de fotoperíodos curtos. Indivíduos que desenvolvem essa patologia, geralmente, apresentam os seguintes sintomas: Dormem mais horas por dia no inverno, mas mesmo assim continuam cansadas e tem dificuldade em acordar pela manhã; Aumento do apetite, vontade de comer carboidratos; _________________________________________________________________________________ 14 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Mudanças na energia e motivação: dificuldade de concentração, execução de tarefas rotineiras, fadiga, isolamento social e diminuição do impulso sexual. Mudanças no humor: irritabilidade, apatia, baixa auto-estima, sensação de depressão. Piora da Tensão Pré-Menstrual Estudos afirmam que a depressão de inverno é desencadeada devido a níveis baixos de serotonina na corrente sanguínea em estações de fotoperíodos curtos. Demonstrando sua relação com o ritmo circadiano. A via metabólica de síntese de melatonina é estimulada quando a ausência de luz é percebida pelas células da retina. A partir dessa percepção do ambiente, ATP e noradrenalina são liberados atuando respectivamente nos receptores noradrenérgicos (alfa e beta) e purinérgico P2Y1(5), controlando a produção de N-acetiltransferase (NAT), que é uma enzima-chave na produção de melatonina. De acordo com (BARBOSA JÚNIOR; FERREIRA; MARKUS, 2003), a glândula pineal é capaz de captar o aminoácido 5-hidroxitriptofano e transformá-lo em serotonina (5-hidroxitriptamina). A concentração de serotonina durante o dia é alta. Na fase de escuro há síntese da enzima NAT, que metaboliza a serotonina em N-acetilserotonina. Parte deste produto lipossolúvel é lançada na circulação, mas parte é metabolizada pela enzima hidroxi-indol-O-metil-transferase (HIOMT) em melatonina. A melatonina também é uma molécula lipossolúvel e também é lançada prontamente na circulação. Assim, temos um sinal formado no escuro, o qual deve ter sua duração considerada. No caso da enzima NAT, logo após ser sintetizada, ela pode sofrer dois destinos: o primeiro é ser rapidamente degradada pelo sistema de proteassoma e o segundo é ser fosforilada e protegida desta degradação. Produtos intracelulares derivados da estimulação simpática são responsáveis por esta proteção. As variações da enzima HIOMT não são diárias, mas variam com o fotoperíodo. Essa enzima é responsável por catalisar a conversão da N-acetilserotonina em melatonina. A variação fotoperiódica faz com que a produção de melatonina tenha uma maior duração no inverno. Com a produção de melatonina aumentada o acúmulo de serotonina tende a ser menor desencadeando os sintomas típico da depressão de inverno. A serotonina é um neurotransmissor que além de atuar no ritmo circadiano, de modo geral, regula o humor, o sono, a atividade sexual, o apetite, as funções neuroendócrinas, temperatura corporal, sensibilidade à dor, atividade motora e funções cognitivas. Durante o dia, sua concentração no corpo humano tende a estar elevada. Isso porque a luz inibe a produção de melatonina, e dessa forma a serotonina não é consumida na via de síntese da mesma. Portanto, temos o sinal ideal; a luz controla tanto o desencadear do sinal como a sua duração. TRATAMENTO A depressão de inverno tem maior ocorrência em indivíduos que habitam países de médias e altas latitudes, pois o inverno se mostra mais rigoroso nesses locais. E devido a esse fato, países como EUA tem investido em pesquisas que caminham no sentido de desenvolver fármacos com potenciais de ação sobre a patologia em questão, visto que pacientes que são acometidos por ela tem uma significativa redução na qualidade de vida. A supressão da secreção de melatonina com antagonistas adrenérgicos não afeta notavelmente o sono. Entretanto, a sonolência exibe um ritmo circadiano positivamente correlacionado com a concentração de melatonina no plasma e negativamente correlacionado com medidas de atividade. Ao contrário de drogas hipnóticas – que induzem sono por depressão universal do sistema nervoso central, tais como barbitúricos e benzodiazepínicos, a melatonina afeta a propensão ao sono (sonolência), mas não o induz diretamente. Um ensaio clínico controlado (STONE, TURNER, MILLS e NICHOLSON apud BARBOSA JÚNIOR; FERREIRA; MARKUS, 2003), comparando o efeito de diferentes doses de melatonina, temazepam (um benzodiazepínico) ou p lacebo no sono precoce (entre 18 e 24 h) e no sono tardio (entre 23:30 e 7:30 h) concluiu que a melatonina não difere do placebo no sono tardio, mas tem efeito semelhante ao temazepam no sono precoce, melhorando o tempo total de sono, reduzindo o período de latência para o adormecer e aumentando o número de episódios de sono REM. No sono tardio esse efeito só é observado com temazepan. Consequentemente, a atividade hipnótica da melatonina ocorre numa janela temporal específica. Outros dados indicam que melatonina pode ter efeitos clínicos benéficos no tratamento da insônia provocada por estados de desordem temporal interna (como viagens transcontinentais), primariamente devido à sua ação sincronizadora. O descobrimento de uma nova molécula fotorreceptora (melanopsina) feita recentemente abre uma nova fronteira para o entendimento da percepção da luz e sua influência sobre os ritmos _________________________________________________________________________________ 15 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ biológicos. Recentemente foi mostrado que além de cones e bastonetes [células fotorreceptoras presentes na retina], existem fotorreceptores em células ganglionares. Estas células contêm moléculas de melanopsina, que fazem parte da superfamília de receptores acoplados a proteínas G e que estão presentes em células que se projetam diretamente para os núcleos supraquiasmáticos. Portanto, além de enviar informações luminosas para o córtex cerebral e formar imagens, a retina envia informações para o relógio biológico, promovendo o ajuste do mesmo. É importante frisar que este sistema de recepção de luz é redundante e os diferentes mecanismos compõem um processo que só é perdido totalmente com a enucleação do globo ocular. Estes achados recentes são a base estrutural que faltava para um antigo conhecimento clínico. Muitos sujeitos que são cegos totais, sem nenhuma percepção luminosa consciente, são capazes de ajustar o relógio biológico ao ciclo claroescuro ambiental. Saber que a via retino-hipotalâmica opera de forma independente da visão consubstancia a percepção clínica existente (ROLLAG, BERSON e PROVENCIO, 2003 apud BARBOSA JÚNIOR; FERREIRA; MARKUS, 2003). REFERÊNCIAS BIBLIOGRÁFICAS BARBOSA JÚNIOR, Eduardo J M; FERREIRA, Zulma S; MARKUS, Regina P. Ritmos biológicos: entendendo as horas, os dias e as estações do ano. Disponível em: 2003. CAPITELLI, Caroline S. Efeito da melatonina em modelo animal de Parkinsonismo induzido pelo MPTP. Disponível em: 2007 BRUIN, Veralice M S de. A importância da melatonina na regulação do sono e do ritmo circadiano – uma abordagem clínica. http://www.medicinacomplementar.com.br/estrategia_nutrologia_caractipob.asp. Acessado em: 16/06/10 – 09:35 http://www.clinicadasconchas.pt/clubzone/artigos_22.html . Acessado em: 16/06/10 – 09:40. http://www.sbpcnet.org.br/livro/57ra/programas/CONF_SIMP/textos/veralicebruin.htm. Acessado em: 16/06/10 – 09:45. http://www.amebrasil.org.br/html/pesq_art2.htm. Acessado em: 16/06/10 – 10:20. http://www.cienciahoje.pt/index.php?oid=17450&op=all. Acessado em: 16/06/10 – 10:35 http://www.mentalhelp.com/depressao_sazonal.htm. Acessado em: 16/06/10 – 10:37. http://knoplich.sites.uol.com.br/. Acessado em: 16/06/10 – 10:40. http://www.socimol.com.br/nova/dicas/default134.asp. Acessado em: 16/06/10 – 10:45. http://extremosbiobio.blogspot.com/2009/06/bioquimica-do-sono.html. Acessado em: 17/06/2010. http://www.crono.icb.usp.br/glandpineal.htm. Acessado em: 17/06/2010 http://www.psicosite.com.br/tex/out/son002.htm. Acessado em: 17/06/2010 http://www.melatonina.com.br/. Acessado em 17/06/2010 http://www.pediatriasaopaulo.usp.br/upload/html/362/body/06.htm. Acessado em:18/06/2010 http://helamor.multiply.com/journal/item/191. Acessado em: 18/06/2010 _________________________________________________________________________________ 16 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ PREVENÇÃO DE DOENÇAS EM PLANTAS: A TEORIA DA TROFOBIOSE Mariana Fernandes Monteiro Guimarães1 e Rachel Germiniani Resende² 1 Graduando em Ciências Biológicas pela Universidade Federal de Ouro Preto – Ouro Preto/MG, [email protected]; ² Graduando em Ciências Biológicas pela Universidade Federal de Ouro Preto – Ouro Preto/MG, [email protected]. RESUMO O presente trabalho tem como objetivo divulgar a Teoria da Trofobiose, mostrando sua relação com o equilíbrio nutric ional das plantas e como este pode ser influenciado pela forma de cultivo. A teoria é apresentada com ênfase nas alterações metabólicas relacionadas à susceptibilidade da planta ao ataque de organismos patógenos. A saúde do organismo vegetal mostrou-se fortemente relacionada à constituição genética da planta, aos fatores ambientais e ao cultivo orgânico, cujas práticas promovem um equilíbrio do sistema metabólico e contribui para a sustentabilidade do sistema de produção. Palavras-chave: Trofobiose, saúde das plantas, equilíbrio nutricional, uso de agrotóxicos, ataque de pragas, agricultura orgânica. INTRODUÇÃO O termo Trofobiose origina-se do grego: Trophos (alimento) e Biosis (existência de vida (Polito, 2006). Portanto pode-se inferir que todo processo vital encontra-se sob a dependência da satisfação das necessidades do organismo vivo, seja ele animal ou vegetal (Chaboussou, 2006). A resistência ou sensibilidade das plantas ao ataque de pragas foi inicialmente relacionada às suas condições nutricionais em 1936, quando o patologista francês Dufrénoy apud Chaboussou, 2006 propôs que toda circunstância desfavorável à formação de nova quantidade de citoplasma, isto é, desfavorável ao crescimento, tende a provocar na solução vacuolar das células, um acúmulo de produtos solúveis inutilizados, como açúcares e aminoácidos; este acúmulo de produtos solúveis parece favorecer a nutrição de microorganismos parasitas e, portanto, diminuir a resistência da planta às doenças parasitárias. Baseando-se nas afirmações de Dufrénoy, Chaboussou propôs a Teoria da Trofobiose, que consiste na seguinte afirmação: “A planta ou, mais precisamente o órgão será atacado somente na medida em que seu estado bioquímico, determinado pela natureza e teor em substâncias solúveis nutricionais, corresponda às exigências tróficas do parasita em questão”. Diversos experimentos propostos por Chaboussou (2006) mostram que a maior parte dos insetos e ácaros de plantas depende, para viver, de substâncias solúveis, tais como aminoácidos e açúcares redutores, que não são encontrados em plantas totalmente equilibradas. O presente estudo consiste em um levantamento bibliográfico a cerca desta teoria, com o objetivo de entender como a trofobiose se relaciona com a saúde das plantas e como agem os fatores envolvidos nesse processo. A trofobiose e o metabolismo das plantas Uma planta nutricionalmente equilibrada possui suas proteínas e carboidratos organizados em estruturas complexas, inviáveis ao metabolismo de organismos patógenos, uma vez que seu aparato bioquímico não fornece as enzimas necessárias a essa degradação. Para que essas substâncias estejam disponíveis ao metabolismo das pragas, a planta precisa sofrer alterações capazes de desestruturar os carboidratos e proteínas, tornando livres os aminoácidos e açúcares, que poderão ser facilmente consumidas por esses organismos. Isso acontecerá quando uma perturbação for estressante o suficiente para desorganizar a complexidade dessas moléculas (Figura 1). _________________________________________________________________________________ 17 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Figura 1 – Alterações metabólicas em plantas em função de uma perturbação. Fatores que alteram o metabolismo das plantas Segundo Chaboussou (2006), os fatores que provocam desequilíbrios nas plantas são aqueles capazes de inibir a proteossíntese e estimular a proteólise, provocando o acúmulo de substâncias livres nos vacúolos. Esses fatores podem ser classificados em três categorias: - Fatores intrínsecos: constituição genética da planta (a espécie e a variedade, a idade dos órgãos ou da planta); - Fatores abióticos: o clima (energia solar, temperatura, umidade, precipitação, influência da lua); - Fatores culturais: o solo, a fertilização e o tratamento com agrotóxicos. Será enfatizado como agem os fatores culturais, por serem mais aplicáveis ao cotidiano. 1. Adubação orgânica - De acordo com Paschoal (1996) apud Vilanova (2010), ao contrário dos fertilizantes minerais de alta solubilidade, os adubos orgânicos, quando utilizados de forma adequada, fornecem todos os macro e micronutrientes que as plantas precisam e em doses proporcionais, sem excessos nem carências. Por isso culturas adubadas organicamente podem se achar perfeitamente equilibradas em seu metabolismo, não ocorrendo acúmulos de substâncias solúveis, o que as torna mais resistentes à ação deletéria das espécies daninhas. Estimulando a proteossíntese, o húmus protege as plantas de pragas e doenças. A matéria orgânica humificada também melhora as propriedades físicas e biológicas do solo, permitindo que as raízes desenvolvam-se mais e assim a planta consiga competir mais satisfatoriamente pelos recursos disponíveis. 2. Uso eficiente da irrigação – esta prática procura manter a umidade do solo sempre em condições adequadas para o desenvolvimento das plantas, sem falta nem excesso de água. O déficit hídrico como fator de estresse ocorre quando muito pouca água está disponível à planta. Não há processo vital que não seja afetado de alguma forma pelo declínio do potencial hídrico, alterando numerosas funções celulares. A primeira e mais sensível resposta ao déficit hídrico é a diminuição da turgescência, associada à diminuição do processo de crescimento. O metabolismo das proteínas e dos aminoácidos é logo limitado (Larcher, 2001; Fumis & Pedras, 2002 apud Vilanova, 2009). Quando a turgescência começa a diminuir são iniciadas medidas osmorregulatórias. A combinação de síntese de compostos orgânicos nitrogenados e a conversão de amido para carboidratos solúveis ocasionam a acumulação de substâncias orgânicas de baixo peso molecular nos compartimentos celulares e no citosol (Larcher, 2001). 3. Uso de agrotóxicos – Forsyth (1954) apud Chaboussou (2006) constata que essas substâncias alteram o metabolismo de tal forma que os aminoácidos e açúcares acumulam na planta, como resultado de uma inibição de síntese das proteínas e carboidratos. Vlassal e Livens (1975) apud Chaboussou (2006) afirmam que a maior parte dos carbamatos (compostos presentes na maioria dos pesticidas) provoca uma regressão da nitrificação no solo. Os autores concluem que não apenas a nitrificação é sensível a certos produtos, mas que o próprio processo da fixação de nitrogênio pelas bactérias é afetado por alguns agrotóxicos. DISCUSSÃO A agricultura orgânica reafirmando a Trofobiose As informações obtidas através deste trabalho revelaram a existência de uma forte ligação entre a Teoria da Trofobiose e o manejo agroecológico das culturas, corroborando as observações de Feiden (2001) apud Vilanova (2010), quando propõe que as práticas executadas nos agroecossistemas pela _________________________________________________________________________________ 18 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ agricultura orgânica possibilitam otimizar os fluxos de nutrientes, reduzir as perdas e melhorar as condições ambientais para proporcionar produtividades ótimas das culturas com sustentabilidade. CONCLUSÃO A ocorrência de pragas e doenças em uma cultura parece estar mesmo relacionada com o desequilíbrio nutricional da planta hospedeira. É importante ressaltar que nenhum nutriente por si só controla todas as doenças em todas as culturas, sendo que a natureza dos elementos, os fatores abióticos e a constituição genética exercem influência sobre a resistência das plantas. A forma como o metabolismo pode ser afetado não está detalhadamente esclarecida, sendo necessários estudos mais aprofundados sobre o tema. Os trabalhos consultados na realização dessa pesquisa se baseiam basicamente nas mesmas fundamentações teóricas. É importante ler trabalhos publicados por pesquisadores que possuem perspectivas diferentes e testam outras metodologias a fim de esclarecer como esta teoria tem sido aceita pela comunidade científica e de que forma está sendo testada, para estimular novos estudos relacionados a essa temática. REFERÊNCIAS CHABOUSSOU, F. Plantas doentes pelo uso de agrotóxicos: novas bases de uma prevenção contra doenças e parasitas: A Teoria da Trofobiose; tradução [de] Maria José Guazzelli. 1ª. Ed. São Paulo: Expressão Popular, 2006 POLITO, W.L. The Trofobiose Theory and organic agriculture: the active mobilization of nutrients and the use of rock powder as a tool for sustainability. Anais da Academia Brasileira de Ciências, v.78, n.4, p.765-779, 2006. VILANOVA, Clélio; SILVA JÚNIOR, Carlos Dias. A Teoria da Trofobiose sob a abordagem sistêmica da agricultura: eficácia de práticas em agricultura orgânica. Rev. Bras. de Agroecologia. 4(1): 39-50, ISSN: 1980-9735, 2009. VILANOVA, Clélio; SILVA JÚNIOR, Carlos Dias. Avaliação da trofobiose quanto às respostas ecofisiológicas e bioquímicas de couve e pimentão, sob cultivos orgânico e Convencional. Rev. Bras. de Agroecologia, Porto Alegre, 5(1): 127137, ISSN: 1980-9735, 2010. _________________________________________________________________________________ 19 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ VENENO PODE SER UMA SUBSTÂNCIA DO BEM? Priscila M. de Souza e Renata de A. B. Assis Ciências Biológicas Licenciatura, Universidade Federal de Ouro Preto – UFOP, Instituto de Ciências Exatas e Biológicas - ICEB RESUMO Já imaginou se pudéssemos aumentar a velocidade de cicatrização de um ferimento? Pois bem, pesquisadores brasileiros descobriram que o veneno de serpentes como a jararaca e a cascavel possui compostos capazes de aumentar a velocidade da cicatrização de pequenos ferimentos. Além de não deixar cicatrizes ainda dispensa o uso de suturas. Mas como isso é possível? Após um corte na pele o sangramento é estancado porque o fibrinogênio, uma proteína que participa da coagulação do sangue, é quebrado em moléculas de fibrina, a principal componente dos coágulos sanguíneos, formando uma rede adesiva. Essa transformação do fibrinogênio em fibrina acontece por causa da ação de uma enzima chamada trombina. O veneno da serpente também possui uma enzima muito semelhante a esta, porém muito mais eficaz chamada de trombina-símile. Se ela é mais eficaz do que a trombina huma na, fica claro que ela pode ser usada como mecanismo para acelerar o processo de cicatrização. Primeiramente, o veneno passa por vários processos para isolamento dessa enzima, pois este possui vários outros compostos que são danosos ao paciente. Daí a necessidade do isolamento desta enzima. Os pesquisadores diante deste fato criaram uma “cola” para o fechamento de feridas constituída da enzima trombina-símile e fibrinogênio extraído de búfalos. A cola também possui fibrinogênio, pois quanto mais fibrinogênio maior a atuação da trombina-símile e consequentemente, maior produção de fibrina. Portanto, a rede adesiva se formará mais rápido assim como o processo de cicatrização como um todo. Desse modo, pessoas hemofílicas, por exemplo, estariam com seus problemas resolvidos, já que possuem distúrbios na coagulação sanguínea em que esta ocorre mais lentamente dificultando a cicatrização. Palavras-chave: Veneno, cobra, cicatrização, fibrinogênio, adesivo fibrínico (“cola”). INTRODUÇÃO Imagine que você cortou o rosto e, em vez de dar pontos, o seu médico passa uma supercola feita de sangue de boi e veneno de cascavel. Isso pode mesmo acontecer. Mas não se assuste. A história moderna das serpentes não tem nada a ver com o medo ancestral que inspiram. Para a ciência, elas guardam produtos utilíssimos nas glândulas letais. O mais recente é uma cola de pele genuinamente brasileira, que, segundo os testes já feitos, dá uma cicatrização perfeita. É assim mesmo que a ciência caminha. O que está em jogo é uma caça aos tesouros bioquímicos que a natureza pode ter escondido, ao longo de milhões de anos de evolução, num lugar surpreendente: justo nas glândulas de veneno das serpentes. Vale a pena vasculhar essa mina, já que, das mais de 2.000 espécies conhecidas, cerca de 300 produzem poções letais. E as cobras não são as únicas espécies peçonhentas. De acordo com os biólogos, só o grupo das aves não contribui para o caldeirão planetário de coquetéis tóxicos. Nada menos de um milhão de animais possuem algum tipo de veneno, ou seja, dois terços de todas as espécies já catalogadas no planeta. Para se ter uma idéia, até a carne do urso polar se não for preparada de modo correto provoca espasmos e vômitos podendo levar a morte. Em poucas palavras, certamente não será por carência de veneno que a medicina moderna vai reclamar da falta de matéria-prima, ou pelo menos de inspiração, para descobrir e fabricar remédios novos e mais eficientes. REFERENCIAL TEÓRICO O mecanismo de coagulação tem grande importância para obtenção da hemostasia que consiste na interrupção fisiológica de uma hemorragia evitando perdas de sangue de uma lesão vascular, e também na manutenção da fluidez do sangue evitando a formação de trombos. Nesse mecanismo são observadas uma seqüência de reações chamadas cascata de coagulação. Desta forma, quando _________________________________________________________________________________ 20 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ a pessoa sofre um dano vascular, ocorre uma série de reações para a formação de uma rede de fibrina, proteína resultante da ação da trombina no fibrinogênio e responsável pela formação de coágulos sanguíneos e pela manutenção da hemostasia. A cascata de coagulação é dividida em seis fases. A primeira fase é dividida em duas etapas chamadas de via intrínseca e via extrínseca. A via extrínseca é iniciada quando o tecido sofre uma lesão, então, há a liberação de substâncias que intervêm na coagulação do sangue ao transformarem a protrombina em trombina. A via intrínseca é iniciada pela exposição do sangue a uma superfície negativamente carregada, geralmente o colágeno. Nesta via um fator é ativado espontaneamente no momento em que entra em contato com as bordas da lesão vascular e uma vez ativado dá origem à cascata. Numa segunda fase ocorrerá a transformação da protrombina em trombina. Posteriormente, dentro do que ROBERT et al. (1991) chama de terceira fase, a protrombina catalisa a transformação de fibrinogênio em fibrina, que consequentemente desencadeará a próxima fase. Na quarta fase ocorrerá a polimerização das moléculas de fibrina transformando-as em filamentos que se entrelaçam formando a rede de fibrina, responsável pela retenção do sangue em suas malhas, originando assim o coágulo sanguíneo que é uma estrutura frouxa que pode ser deslocado pela própria pressão do sangue. Na quinta fase ocorre a retração do coágulo caracterizada pela expulsão da água e dos sais minerais, retendo apenas a parte celular e as proteínas plasmáticas, assim o coágulo passa a apresentar uma estrutura mais sólida e resistente, a conhecida “casquinha do machucado”. A sexta fase é caracterizada pela fibrinólise, que consiste na reabsorção gradual do coágulo simultaneamente com a cicatrização da parede do vaso sanguíneo, processo este que ocorre entre 24 a 48 horas após o início da coagulação. A substância responsável pela reabsorção do coágulo é a fibrinolisina ou plasmina, enzima do plasma que pode degradar a fibrina e o fibrinogênio e acelerar assim a dissolução dos coágulos sanguíneos. Resumindo, os vasos sanguíneos e as plaquetas são os fatores que promovem a fase inicial da interrupção de um sangramento, essa fase pode ser denominada hemostasia primária, processo pelo qual se forma um tampão plaquetário no local do traumatismo vascular. A ativação plaquetária irá promover o acúmulo de plaquetas aderidas formando o tampão plaquetário. A coagulação consiste na ativação sequencial em cascata de várias proteínas plasmáticas que culminam com a formação de fibrina aumentando e solidificando o tampão plaquetário inicial. Esse processo é também denominado hemostasia secundária, e foi conceitualmente divid ida em três vias: via extrínseca, intrínseca, e a via comum. Ao sistema coagulante contrapõe-se um sistema anticoagulante cuja finalidade é evitar coagulação excessiva intravascular e consequente formação de trombos. Assim como o endotélio intacto e normal promove a fluidez do sangue, ele também é fundamental na anticoagulação natural do sangue, por impedir o acúmulo de fibrina. Ao lado do sistema anticoagulante existe um mecanismo fibrinolítico que se destina a destruir o excesso de fibrina formada e a recanalizar os vasos quando a hemostasia se completa. No mecanismo de ação da cola o fibrinogênio, depois de transformado em fibrina, forma uma rede de sustentação para o coágulo. O fator estabilizador da fibrina (FEF) que é obtido do plasma humano é ativado pela trombina na presença de íons de cálcio sendo que o FEF é um catalisador da formação de ligações cruzadas entre as moléculas de fibrina, proporcionando a formação de um coágulo de fibrina estável e insolúvel (HERMANS & MACDONAGH, 1982). O FEF também protege o coágulo contra uma possível degradação prematura pela plasmina, pois ele atua como um catalizador do inibidor da plasmina (TAMAKAI & AOKI, 1982). Esse FEF também se mostrou capaz de estimular a proliferação de fibroblastos (BECK et al., 1961), melhorando a reparação tecidual. A fibronectina pode contribuir para a fixação do coágulo no local da lesão quando faz a ligação cruzada com a fibrina (BOCKENSTEDT et al., 1986; MOSHER, 1984). A trombina humana é uma enzima que converte o fibrinogênio em fibrina, além de ser responsável pela ativação do FEF na presença de íons de cálcio. Os componentes do fibrinogênio e trombina, antes do uso, são liofilizados (secagem e eliminação de substâncias voláteis, realizados sob baixa temperatura e pressão reduzida) e solubilizados com soluções de aprotinina e cloreto de cálcio respectivamente. A aprotinina é obtida do tecido pulmonar bovino e é um inibidor de proteases. Possui um efeito antifibrinolítico porque inibe fortemente a plasmina. Assim, podemos dizer que a aprotinina tem como função impedir a fibrinólise excessivamente rápida do coágulo de fibrina pela plasmina endógena. O cloreto de cálcio é um componente inorgânico composto por íons de cálcio necessários para a ativação do FEF e para a manutenção de sua forma ativa. Tais íons influenciam na estabilização da fibrina através de ligações cruzadas. A mistura dos dois componentes é feita na presença de íons de cálcio, reproduzindo a última fase da cascata da coagulação e levando à polimerização gradual da principal proteína estrutural do sangue _________________________________________________________________________________ 21 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ (fibrinogênio), ocorrendo formação de coágulos de fibrina insolúveis, quando estão em união com as plaquetas. Os venenos animais consistem, geralmente, de uma mistura complexa de diversas biomoléculas como proteínas, aminas biogênicas e peptídeos com diferentes atividades. A atividade biológica de cada componente é característica e irá definir sua importância no quadro clínico do envenenamento. No Brasil, os envenenamentos acontecem com serpentes do gênero Bothrops (73,1%), Crotalus (6,2%), Lachesis (1,1%) e Micrurus (0,3 %). As ocorrências com Crotalus geralmente são as mais sérias com 1,87% de letalidade (FUNASA, 2001). O objeto de estudo deste trabalho foi a giroxina. Esta proteína parece ser multifuncional, induzindo um comportamento neurotóxico, atuando na coagulação e na pressão arterial. A giroxina foi descrita por BARRIO (1961) e mais tarde isolada por BARRABIN et al. (1978). A giroxina também é conhecida por sua atividade enzimática trombina-símile, atuando sobre o fibrinogênio humano, clivando o fibrinopeptídeo (RAW et al., 1986). Os monômeros de fibrina resultantes polimerizam-se em uma rede anormal que difere da produzida pela trombina. Esta rede anormal é instável e mais susceptível a ação de agentes fibrinolíticos (MARKLAND, 1998; KOH et al., 2001). A incoagubilidade sanguínea parcial ou total observada em casos graves de pacientes picados pode ser decorrente do consumo do fibrinogênio (BUCARETCHI et al., 2002). As enzimas trombinasímile possuem similaridades mecânicas com a trombina (CASTRO et al., 2001). Estas enzimas são largamente encontradas em veneno de serpentes da subfamília Crotalinae (SCHVARTSMAN, 1992), tendo ação pró-coagulante (MATSUI et al., 2000). Estas toxinas podem agir em um ou mais fatores da coagulação (ANDREWS et al., 2004). A trombina da cobra e o fibrinogênio do boi fazem um trançado incrível onde se prendem células e partículas do sangue, chamadas respectivamente fibroblastos e plaquetas. Os testes mostram que a trombina da cobra é até 500 vezes mais eficaz na cicatrização. Representação esquemática do processo de coagulação. _________________________________________________________________________________ 22 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Representação esquemática do mecanismo de ação dos componentes do adesivo fibrínico. PROSPECTOS PARA O FUTURO A cola de pele e o remédio para a hipertensão não são os únicos benefícios que os cientistas esperam tirar do veneno das cobras. O foco principal dessas corridas são os analgésicos, medicamentos contra o câncer e para doenças associadas ao coração, como a trombose. O especial interesse pela atividade sobre o fibrinogênio deve-se à possibilidade de utilização destas enzimas no tratamento de doenças trombóticas e como anticoagulante. Do ponto de vista clínico, estas enzimas provaram ser úteis na dissolução de coágulos formados, por exemplo, durante infarto do miocárdio, tromboses em veias profundas, pancadas e embolia pulmonar (MARKLAND, 1998). No Canadá, um extrato de víbora já virou remédio experimental contra derrames. Mas estejam onde estiverem os pesquisadores sabem muito bem que os resultados práticos não são para depois de amanhã. REFERÊNCIAS BIBLIOGRÁFICAS ERENO, Dinorah. Veneno que cola: Enzima substitui sutura tradicional sem deixar cicatrizes. 2009. Disponível em: <http://orgulhonacional-brasil.blogspot.com/2009/04/veneno-que-cola-enzimasubstitui-sutura.html>. Acesso em 10 jun. 2010. ARAÚJO. L. F.; PIÑEIRO-MACEIRA j.; MELO P. A. Modelo experimental de cicatrização cutânea pós-lesão induzida pelo veneno da serpente Bothrops jararaca na pele de camundongos. Disponível em:<http://docs.google.com/viewer?a=v&q=cache:mhjdOBeUonMJ:www.dermato.med.br/ufrj2004/Ca mundongo.pdf+veneno+cicatriza%C3%A7%C3%A3o+pele&hl=ptBR&gl=br&pid=bl&srcid=ADGEEShv S3fABplRXX84Vtm3nG5LJc7ets_AVPRG8QOXDr_xuxHCESPpS9foqR7TA72UYzszTNNokjp_nyCun cnlT38TaX0Y9vhhe3NgJXzctOcANXiyaMD4nibJ2j3UWtQN9zKi7T&sig=AHIEtbRMU78sTBIUPvyKipS L3MGjTHcgsw>. Acesso em 10 jun. 2010. CARVALHO D. D. de; SCHMITMEIER S.; NOVELLO J. C.; MARKLAND F. S. Effect of BJcuL (a lectin from the venom of the snake Bothrops jararacussu) on adhesion and growth of tumor and endothelial cells. 2000. Disponível em:<http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6TCS43K2G134&_user=10&_coverDate=10%2F31%2F2001&_rdoc=1&_fmt=high&_orig=search&_sort=d_ docanchor=&view=c&_searchStrId=1365843962&_rerunOrigin=scholar.google&_acct=C000050221& _version=1&_urlVersion=0&_userid=10&md5=f9e1e74895aace05b5a4f9572301dfc5> Acesso em 10 jun. 2010. _________________________________________________________________________________ 23 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ PRADO R. C.O veneno do bem. 1997. Disponível em:<http://super.abril.com.br/ciencia/veneno-bem436963.shtml> Acesso em 10 jun. 2010. LEAL E. Cosméticos exóticos. 2009. Disponível em:<http://leals.wordpress.com/2009/04/27/cosmeticos-exoticos/> Acesso em 10 jun. 2010. AMARAL M.S.P.; RAHAL S.C.; Dal-Pai V.; BARRAVIERA S.R.C.S.; LIMA A.F.M.; CROCCI A.J. Fixação de enxerto cutâneo em malha de espessura total com sutura ou cola de fibrina. 2004. Disponível em:<http://www.scielo.br/scielo.php?pid=S010209352004000300005&script=sci_arttext> Acesso em 10 jun. 2010. <http://br.answers.yahoo.com/question/index?qid=20100101164640AAyuKyj> Acesso em 10 jun. 2010. <http://www.uniblog.com.br/tabumga/185970/utilidades-do-veneno-de-cobra.html> Acesso em 10 jun. 2010. BALBINO C. A.; PEREIRA L. M.; CURI R. Mecanismos envolvidos na cicatrização: uma revisão. 2005. Disponível em: <http://portalsaudebrasil.com/artigospsb/medic002.pdf> Acesso em 15 jun. 2010. _________________________________________________________________________________ 24 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ APOPTOSE NO TRATAMENTO DO CÂNCER Denise C. Miranda e Silvana Melo Graduandas em Ciências Biológicas pelo Departamento de Ciências Biológicas, Universidade Federal de Ouro Preto RESUMO Apoptose é a morte celular não seguida de autólise, no qual a célula é eliminada sem comprometer células vizinhas. Processo de grande importante para a manutenção da homeostasia. É controlada principalmente por uma protease, a caspase. Algumas células tornam resistentes a apoptose, po-dendo se tornar um tumor. Para o tratamento dessas neoplasias terapias que utilizam drogas anti-tumorais convencionais parecem ser pouco efetivas, necessitando de terapias complementares. O glicocorticóide induz a apoptose em linfomas e leucemias, porém podem contribuir para o aumento da resistência em tumores sólidos. Palavras chave: Glicocorticóides. Apoptose. Caspase. Câncer. INTRODUÇÃO A apoptose é vital para a manutenção do equilíbrio do corpo humano, removendo células velhas ou danificadas do corpo humano sem acometer o tecido à sua volta. Esse fenômeno envolve várias mu-danças peculiares como: fragmentação do material genético, mudança na estrutura e formação de corpos apoptóticos, que são vesículas com o conteúdo interno da célula. A apoptose é ativada através de duas vias, a extrínseca, que corresponde a ativação de receptores de morte celular localizados na membrana plasmática (genes pró-apoptóticos, Fas), e a via intrínseca, que se dá por estresse celular interna ou externamente, por estímulos como indução de oncogene ou hipóxia. Ambos os mecanismos envolvem a atuação de caspases, proteases responsáveis pela parte sinalizadora e efetora do processo de apoptose, eficiente no tratamento de diversas patologias, como o câncer. Os medicamentos existentes no tratamento de câncer atualmente causam muitos efeitos colaterais como a perda de peso e queda capilar, na maioria das vezes não fornecendo resultados satisfatórios necessitando de co-tratamentos, como o uso de Glicocorticóides (LUCINDA, 2009). Os GC’s, também chamados de corticosteróides, são hormônios esteróides oriundos do colesterol, molécula de extensa cadeia carbônica precursora de várias substâncias vitais, como a vitamina D e hormônios sexuais (como testosterona e progesterona). Apesar de sua eficiência em tratamentos de linfomas, o GC atua negativamente em pacientes que possam altos níveis dessa, além disso, o GC causa um impacto negativo no tecido ósseo, provocando osteoporose por induzir a apoptose prematura de osteoblastos, células que ainda secretam matriz óssea, e osteócitos, célula óssea “madura”. _________________________________________________________________________________ 25 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Vias de ativação da cascata proteolítica. Mecanismo de ação do Glicocorticóide O receptor do GC pode atuar por transativação, ativando a transcrição gênica a partir da ligação com o GC ou transrepressão gênica, inativando-a. Dentro da célula, na via de transativação ele se liga a receptores específicos denominados Receptores de Glicocorticóides (CASTRO, 2005). O complexo glicocorticóide-receptor sofre transformação estrutural e se torna capaz de entrar no núcleo no qual se liga a regiões promotoras dos genes (transativação). Por meio da transrepressão, moléculas de GC se ligam a elementos responsivos negativos aos glicocorticóides (nERG), com isso há síntese de citocinas próinflamatórias como a IL-6 (Interleucina 6) (ANTI, GIORGI e CHAHADE, 2008). Atuação antitumoral do Glicocorticóide Os mecanismos de atuação do GC ainda são pouco esclarecidos (LUCINDA, 2009). Um dos mecanismos descritos na literatura é por meio do fator de transcrição forkhead, que inclui a FOXO3A, proteína que regula a expressão gênica. A FOXO3A medeia sinais pró-apoptóticos (GREER e BRUNET, 2005 citado por LUCINDA, 2009). A FOXO3A não-fosforilada (sua forma ativa) pode ser translocada para o núcleo e induzir a transcrição de genes pró-apoptoticos e anti-proliferativo, principalmente pela FasL - induzindo morte mediado por Fas. A FOXO3A fosforilada em múltiplos resíduos pela proteína quinase, sendo excluído do núcleo o que protege a célula de apoptose. Várias linhagens de cânceres apresentam-se resistentes a essa via devido à formação de fofoFOXO3A após tratamento com GC. Em câncer linfóide a dexametasona, um tipo de GC, induz resposta apoptótica rápida por meio da formação de IL-6. A dexametasona tem como principal efeito uma interação significativa com a resposta imune linfocitária, sendo assim, de extrema _________________________________________________________________________________ 26 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ importância para o controle de linfomas, cânceres em células responsáveis pela imunidade inata ou adaptativa. CONCLUSÃO Após a revisão bibliográfica realizada, conclui-se que glicocorticóides em geral são úteis para o co-tratamento de tumores, principalmente os linfomas, apesar de em alguns casos deixarem algumas células neoplásicas mais resistentes à apoptose (por manterem FOXO3A fosforilados dentro da célula, impedindo a cascata proteolítica), porém, dependendo da quantidade de GC no paciente o GC atua de forma negativa, sendo assim contra-indicado a pacientes que já a tem em quantidades satisfatórias. REFERÊNCIAS BIBLIOGRÁFICAS LUCINDA, F. M. L. - Mecanismos de Indução da Apoptose por Glicocorticóides e seus Efeitos no Câncer. Juiz de Fora, 2009 ANAZETTI, M. C.; MELO P. S. - Morte Celular por Apoptose: uma visão bioquímica e molecular. Metrocamp pesquisa, Campinas, vol.1, no. 1, 2007 BATISTA, J. J.; MARTINS A. S.; MORO L.; VASCONCELOS A. C. - Genic expression of caspases 3 and 8 in thymus and spleen of glicocorticoid-immunossupressed weaned rats. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, Belo Horizonte, vol. 57, no. 4, 2005 MAZZIOTTI G.; GIUSTINA A.; CANALIS E.; BILEZIKIAN J. P. - Glucocorticoid-Induced osteoporosis: clinical and therapeutic aspects. Arquivo Brasileiro de Endocrinologia & Metabologia, São Paulo, vol. 51, no. 8, 2007 CASTRO M. - Efeitos Antiinflamatórios e Antiproliferativos dos Glicocorticóides: Concordância ou Discordância? Arquivos Brasileiros de Endocrinologia & Metabologia, São Paulo, vol. 49, no. 3, 2005 _________________________________________________________________________________ 27 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ TRAPACEANDO O TRIPANOSOMA Lucas Á. Ferreira e Marcelo C. Mucci Daniel Graduandos em Ciências Biológicas pela Universidade Federal de Ouro Preto – UFOP RESUMO É evidente o avanço cada vez mais rápido da medicina, curando e buscando a cura para as diversas doenças existentes. O mais interessante é como doenças até certo momento fatais, passam a se tornar de simples cura. É o caso da doença conhecida como doença do sono africana ou tripanossomíase africana, que é bem comum na África e que já matou muitas pessoas, mas hoje é controlada pela simples inibição de uma enzima encontrada em seu metabolismo de síntese, por exemplo, de DNA, logo essencial para a vida. INTRODUÇÃO Cada doença causada por parasitas, no caso da tripanossomíase, e demais agentes infectantes como bactérias, vírus, fungos e outros, precisa de um estudo minucioso já que os remédios, vacinas e outros tratamentos agem de forma principalmente bioquímica, atuando em micromoléculas. O problema é que muitas vias metabólicas são comuns ou parecidas entre diversas espécies, e durante uma cura, o único afetado deve ser o agente patológico, daí vem à dificuldade em achar um ponto fraco que só o mesmo possui. No caso da tripanossomíase, que é causada por um protista chamado de Trypanosoma brucei sp, foi encontrado um ponto fraco que é uma enzima chamada de ornitina descarboxilase que não é sintetizada a uma velocidade considerável e que é essencial para a sobrevivência da espécie. A doença do sono africana: A doença é causada pelo protista Trypanosoma brucei, e possui dois tipos, a tripanossomíase africana do leste e a do oeste, onde no leste é causada pelo parasita chamado de Trypanosoma brucei rhodesiense e no oeste pelo T. brucei gambiense. O agente vetor da doença é uma mosca chamada de Tsé-tsé, que possui o parasita em sua saliva, que ao picar um ser humano transmite o mesmo que irá se desenvolver dentro do hospedeiro recém picado. A doença que é fatal possui como principais sintomas a febre, dores de cabeça e anemia, e num estágio mais avançado problemas cerebrais como convulsões, inchaço da meninge dura-máter, retardamento, podendo ainda chegar ao estágio de coma. O problema na cura da doença ocorria porque os tripanossomos possuem uma capacidade de recombinação genética de sua capa celular que pode ocorrer centenas de vezes. Nessa capa existe uma determinada proteína que serve como antígeno para nosso sistema imuno lógico, porém quando o parasita troca sua capa o sistema imunológico que estava preparado para destruir o grupo, se vê obrigado a montar novos anticorpos já que os anteriormente produzidos não reconhecem a nova capa celular. Com isso um ciclo se fecha, onde o sistema imunológico produz anticorpos e os tripanossomos recombinam seu envoltório, com isso a pessoa fica fraca até entrar em óbito. A trapaça, como os tripanossomos foram vencidos O ponto vulnerável no metabolismo desses organismos foi encontrado na via de biossíntese das poliaminas. As poliaminas espermina e espermidina são empregadas no empacotamento do DNA e são necessárias em grandes quantidades nas células em processo de multiplicação. O passo da reação normal é catalisado pela enzima ornitina descarboxilase, uma enzima que requer PLP. Uma vez liberado o CO 2, o movimento de elétrons é revertido e produzido a putrescina, uma poliamina que originará a espermina e a espermidina. Com base nesse mecanismo, foram projetados vários inibidores suicidas para essa enzima. Um desses é a difluormetilornitina (DFMO). A DFMO é relativamente inerte em solução, mas quando ela se liga à ornitina descarboxilase, a enzima é imediatamente inativada. _________________________________________________________________________________ 28 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Esse inibidor fornece um absorvedor de elétrons alternativo na forma de dois átomos de flúor estrategicamente colocados, e que são excelentes grupos de saída. Em vez de os elétrons se moverem para a estrutura em anel do PLP, a reação resulta no deslocamento de um átomo de flúor. O enxofre de um resíduo de cisteína no sítio ativo da enzima forma então um complexo covalente com o aduto inibidor-PLP, altamente reativo, em uma reação essencialmente irreversível. Dessa forma, o inibidor usa o mecanismo de reação da própria enzima para destruí-la. CONSIDERAÇÕES FINAIS A DFMO provou ser altamente efetiva contra a doença do sono africana em testes clínicos e agora é empregada no tratamento dessa doença provocada pelo Trypanosoma brucei sp. Abordagens como estas representam grandes promessas para o tratamento de um grande número de doenças com base na compreensão da enzimologia e do metabolismo. REFERÊNCIAS BIBLIOGRÁFICAS Lehninger, AL. Nelson, DL. & Cox, MM. Princípios de Bioquímica, 4ª edição, Sarvier Editora de Livros Médicos S.A., São Paulo, 2006. 1202 p. _________________________________________________________________________________ 29 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ OXIGÊNIO: TER OU NÃO TER, EIS A QUESTÃO! Hilda de Cássia Ferreira1 e Jaqueline Malta Rolim2 Graduandas em Ciências Biológicas pela Universidade Federal de Ouro Preto – UFOP RESUMO Em seu habitat natural os animais estão exportas a situações adversas que podem ser letal. Porém alguns animais apresentam mecanismos comportamentais como fisiológicos que os ajudam a manterem-se vivos diante de tais situações, podendo ser por baixa ou ausência de oxigênio, escassez de alimentos ou água e altas ou baixas temperaturas. Para então sobreviverem os organismos apresentam uma diminuição da taxa metabólica, também denominada depressão metabólica ou hipometabolismo animal, como um recurso para sobreviverem em menores taxas de oxigênio, ou como uma forma de poupar energia que poderia ser gasta em situações críticas como falta de alimento. Diante então dessas condições os animais apresentam comportamentos que os permitem sobreviverem a situações criticas em seu habitat natural. Palavra-chave: taxa de oxigênio; taxa metabólica; depressão metabólica; mecanismos de sobrevivência. INTRODUÇÃO Os animais em seu ambiente natural ficam expostos á situações ambientais em que estas podem prejudicar ou facilitar a manutenção da vida. Entre essas situações destacam-se a falta de oxigênio, ou baixa taxa do mesmo, escassez de alimentos e de água, altas e baixas temperaturas ambientais e mudanças sazonais, em que os organismos demonstram capacidades de poder passar vivos por estas situações. Estas capacidades podem ser tanto comportamentais ou mudanças fisiológicas. A obtenção de energia, através da oxidação de nutrientes, é um mecanismo importante para manutenção e desenvolvime nto dos organismos, já que produz grandes quantidades de ATP. Com isso o oxigênio é um importante indicador da taxa metabólica (Fig.1.1). Figura 1.1: Gráfico Taxa de Oxigênio X Taxa Metabólica Porém nem toda energia é convertida em ATP, estando uma parte perdida em forma de calor pelo organismo através da proteína transmembrana UCP (termogenina) que permite o movimento de prótons desacoplado da fosforilação do ADP, para dentro da matriz, em que este movimento gera calor. A atividade da UCP é importante na termogênese em animais endotérmicos, como aves e mamíferos, produzindo calor para que haja o controle da temperatura corpórea em relação ao do ambiente, exigindo grande quantidade de oxigênio. Já animais ectotérmicos, não possuem UCP’s, ficando estes dependentes da temperatura ambiente para termorregularem.(Fig.1.2) _________________________________________________________________________________ 30 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Figura 1.2: Gráfico relacionando a termogênese de animais endotérmicos e ectotérmicos de a acordo com a temperatura ambiente. Animais endotérmicos e ectotérmicos apresentam comportamentos e mudanças fisiológicas diferentes com relação a situações ambientais em que estão expostos, em que em condições de baixa taxa de oxigênio endotérmicos não conseguem sobreviver, já alguns animais ectotérmicos possuem a capacidade de sobreviverem em baixas e até ausência de oxigênio como no caso de “peixes Carassius sp, que em baixas temperaturas conseguem converter o lactato em etanol e este ser liberado para o meio externo através das brânquias”. (Simões apud JOHNSTON;BERNARD, 2008, p.13) Para então poderem sobreviver a condições adversas como essas, o metabolismo dos animais tendem a cair drasticamente, depressão metabólica, como um mecanismo de sobrevivência, em que esta pode ocorrer pela diminuição ou ausência de oxigênio, baixas e altas temperaturas e baixa oferta de água e de alimentos (Fig.1.3). Assim “a depressão metabólica é observada e vem sendo investigada durante condições/fenômenos como anóxia, hipóxia, diapausa, quiescência, torpor, hibernação estivação, desidratação, congelamento e superresfriamento” (WELKER apud STOREY; VAN GINNEKEN; CÁCERES; TESSIER; HAND; HERDWIG; GEISER; HERLDMAIER; MUIR; DINKELACKER, 2009) (Fig.1.4). ESTIVAÇÃO ESCASSEZ DE ÁGUA E ALIMENTOS BAIXA DISPONIBILIDADE OU AUSÊNCIA DE OXIGÊNIO DESIDRATAÇÃO ALTAS E BAIXAS TEMPERATURAS DEPRESSÃO METABÓLICA TORPOR DEPRESSÃO METABÓLICA CONGELAM ENT O E SUPERRESFRIA MENTO DORM ÊNCIA HIBERNAÇÃO HIPÓXIA E ANÓXIA Figura 1.3: Fluxograma da depressão metabólica Figura 1.4: Fluxograma condições ou fenômenos na depressão metabólica. Este trabalho então tem como objetivo abordar as condições de hipometabolismo nos animais causado por situações adversas que ocorrem em seu ambiente natural, bem como os mecanismos que são utilizados para sobreviverem. _________________________________________________________________________________ 31 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ DESENVOLVIMENTO A depressão metabólica ou hipometabolismo animal irá ocorrer em situações adversas como forma de sobrevivência dos animais. A seguir estão especificadas bem como exemplificadas as situações mais comuns de depressão metabólica. Hipóxia e Anóxia A hipóxia é a condição de baixa taxa de oxigênio e anóxia é a ausência de oxigênio presente no meio. São animais que resistem a estas condições. Muitos mamíferos, por exemplo, não resistem a hipóxia já que em baixas taxas de oxigênio o cérebro e o coração começam a sofrer mudanças degenerativas (WELKER apud JENNINGS; KARMAZYN, 2009). Animais que conseguem sobreviver a estas condições sofrem mudanças fisiológicas diante das menores taxas ou ausência de oxigênio. Entre essas mudanças têm-se o direcionamento do sangue para órgãos vitais; redução da taxa metabólica e maior capacidade das vias metabólicas anaeróbias. (WELKER apud JACKSON; DAVIES; HYLLAND; KOOYMAN; PONGANIS; ZENTENO –SAVÍN; STOREY; KEIVER; HOCHACHKA; ASKENASY, 2009) Entre os mamíferos que resistem a baixas concentrações de oxigênio são os mergulhadores e animais que habitam altitudes elevadas. Focas da espécie Cystophora cristata mantém sua atividade e seu balanço iônico, ao contrário de neurônios de ratos (WELKER apud FOLKOW, 2009). Já camelídeos da espécie Llama glama, apresentam menores valores de consumo de oxigênio, de atividade de Na+ /K+ -ATPase e de temperatura cerebral em resposta a hipóxia (WELKER apud Llanos, 2009). Estudos feitos com tartarugas,animais que resistem bem a anóxia, proporcionou importantes informações para compreender a fisiologia destes animais que conseguem viver sob estas condições. Entre os resultados obtidos têm-se a redução da síntese protéica, que demanda energia (WELKER apud LAND; HOCHCHKA, 2009) ; diminuição da atividade elétrica do cérebro relacionada a redução ATPase de sódio/potássio (WELKER apud FERNANDES; BUCK; HOCHCHKA, 2009); maior concentração e expressão de proteínas de choque térmico (WELKER apud CHANG;SCOTT;RAMAGLIA;BUCK,2009); maior expressão de genes mitocondriais envolvidos no metabolismo oxidativo, que poderiam otimizar a utilização do oxigênio residual na transição da hipóxia para anóxia (WELKER apud CAI;STOREY,2009); tolerância a altas concentrações de lactato com um ajustado sistema de tamponamento (WELKER apud JACKSON; CROCKER;REESE, 2009 ); manutenção da taxa de ligação de oxigênio –carreador (WELKER apud WANG, 2009) e diminuição da permeabilidade de íons e potássio através da membrana, mecanismo chamado de “channel arrest” ( WELKER apud PEK-SOTT;LUTZ; PRENTICE, 2009). Dormência A dormência é classificada em dois tipos: quiescência e diapausa, de acordo com os fatores que iniciam e mantêm o hipometablismo. A quiescência tem como fator as condições ambientais adversas e a diapausa mantida por uma resposta fisiológica interna. A diapausa é um processo que ocorre entre os artrópodos que podem parar o seu desenvolvimento em várias fases de sua vida, como ovos, lavas, pupas e adultos. Neste fenômeno ocorre uma queda do metabolismo aeróbio que se intensifica com o tempo, ocorrendo consequentemente redução da oxidação de nutrientes. ( WELKER apud CROZIER; ROMANO; ALEKSEEV; STAROBOGATOV; DENLINGER, 2009) Já a quiescência é bastante conhecida entre os poríferos, nematodos, artrópodos e embriões de vertebrados e invertebrados. Estudos em embriões de pequenos crustáceos como a espécie Artemia franciscana demonstraram que nesta condição de hipometabolismo elas possuem um menor grau de proteólise conferindo a eles uma alta tolerância a anóxia consequentemente. (WELKER apud ARCHORDOGUY;HAND;MENZE;CLEGG;JACKSON;COVI,2009) Os complexos mecanismos que aumentam o tempo de vida nos animais tem sido objeto de estudo, para compreensão do processo de envelhecimento (WELKER apud SIMPSON; FELL; LARSEN; CLARKE; STUART; BROWM;HONDA, 2009) Torpor Ao serem estudados animais que entram em torpor, constataram-se que os mesmos apresentavam intensa redução do metabolismo e da temperatura corporal. (WELKER apud GEISER;RUFE, 2009). Segundo Welker (2009, p.13), através do torpor animais, inclusive aves e mamíferos conseguem economizar suas reservas energéticas durante um período de inatividade. _________________________________________________________________________________ 32 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ O torpor é realizado durante o período noturno por animais de pequeno porte que precisam durante a noite manter temperaturas médias corporais acima da temperatura ambiente(Figura 2.1). Com isso o torpor faz com que as temperaturas corporais destes animais atinjam uma temperatura corporal quase que o equivalente a do ambiente economizando assim energia, que seria gasta para controlar a temperatura corpórea e consequentemente o metabolismo mantêm-se baixo. Entre os animais capazes de realizar torpor estão os beija –flores e os morcegos, por apresentarem baixa reserva energética e reduzida massa corporal. (WELKER apud Barcley, 2009). Figura 2.1: Mundanças na (a) temperatura corpórea e na (b) taxa metabólica durante o torpor. Fonte: POUGH, 2008. Hibernação Anima is que realizam hibernação, possuem uma depressão metabólica com maior duração. A hibernação ocorre em períodos em que se tem uma baixa temperatura e escassez de alimentos, como no inverno. Tanto animais ectotérmicos como endotérmicos apresentam depressão metabólica. Durante a hibernação, pequenos mamíferos podem poupar até 98% da energia em comparação ao estado eutérmico normal (WELKER apud HELDMAIER, 2009). A hibernação de pequenos mamíferos é composta por períodos de alguns dias de baixa taxa metabólica interrompidos por ciclos de despertar e eutermia de um a dois dias (WELKER apud CAREY, 2009) Estivação A estivação está relacionada a temperaturas elevadas, falta de água e alimento. Ocorre em diversos grupos como: anelídeos, moluscos, crustáceos, insetos, peixes, anfíbios, répteis, mamíferos e aves. (WELKER apud GUPPY; WHITHERS, 2009). Entre os animais estivantes estão os sapos Neobatrachus pelobatoides que consomem menos oxigênio por seus tecidos, os caramujos terrestres Helix lucorum que apresentam queda do consumo de oxigênio e da PO 2 de sua hemolinfa, menor + + atividade de Na /K -ATPase e menor síntese proteica que está relacionada com o grau de fosforilação de proteínas chaves e os peixes pulmonados que também entram em estivação e apresentam depressão metabólica (WELKER apud FLANIGAN; MICHAELIDIS; RAMNANAN; STOREY; PAKAY, 2009). Desidratação O fenômeno da desidratação pode ocorrer tanto em ambientes secos causando perda de água corporal que faz com que o volume de sangue diminua tornando-o viscoso como também em ambientes congelados. Animais com maior taxa de desidratação apresentam hipometabolismo ainda mais acentuado, como as rãs Rana syvatica que quando em estado de dormência submetidas a desidratação por 11 a 13 dias apresentam diminuição do consumo de oxigênio (WELKER, 2009). _________________________________________________________________________________ 33 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Algumas espécies de insetos diminuem o metabolismo oxidativo para se defenderem desidratação exagerada. (WELKER apud DANKS, 2009) de uma Congelamento ou superresfriamento Os efeitos da temperatura baixa causam tanta perplexibilidade quanto temperaturas elevadas, podendo ser letal para a maioria dos animais, inclusive aves e mamíferos, pois, o congelamento leva a desidratação celular, pertubação osmótica e iônica, retração celular, formação de cristais de gelo e consequentemente a destruição dos tecidos (WELKER apud DINKELACKER; COSTANZO, 2009). Entretanto alguns animais resistem a temperaturas abaixo de zero através de dois mecanismos: ou eles toleram o congelamento de seus fluidos extracelulares, que significam formação de gelo no seu corpo ou eles evitam esse congelamento através do super resfriamento, que é a manutenção dos fluidos na forma líquida abaixo do ponto de congelamento. (WELKER apoud DINKELACKER, 2009) O congelamento leva a isquemia e faz com que o metabolismo seja mantido de forma anaeróbica, uma vez que o oxigênio torna-se indisponível para os órgãos. Conseqüentemente espécies que são tolerantes ao congelamento também são tolerantes à anóxia, diferentemente do super resfriamento que mantém o metabolismo aeróbico. (WELKER apud VOITURON, 2009). A tartaruga é uma das espécies mais estudadas quanto à tolerância ao congelamento. Filhotes de tartaruga Chrysemys picta marginata toleram ao congelamento dos seus fluidos durante o inverno, dentre os fatores que contribuem para sua tolerância estão o aumento na concentração de glicerol e glicose que reduz o ponto de superresfriamento aumentando a probabilidade de formação de gelo. Adaptações animais Como já foi descrito, os animais que apresentam depressão metabólica sofrem flutuações no consumo de oxigênio e precisam se defender dos potenciais danos do retorno e do rápido aumento de sua taxa metabólica. Alguns animais apresentam como mecanismo de defesa a redução da produção de espécies reativas de oxigênio (ROS) que está relacionada com a maior taxa de desaclopamento (WELKER apud BRAND; RICQUIER; BOUILLAUD; SPEAKMAN; BROOKES; HARPER, 2009). Outro mecanismo de defesa é um sistema antioxidante eficiente, ou seja, alta concentração de moléculas antioxidantes como a glutationa e ascorbato, que evitam a formação de espécies reativas. E por fim muitos animais que resistem as flutuações no consumo de oxigênio apresentam um aumento de atividade de enzimas antioxidantes. REFERÊNCIAS BIBLIOGRÁFICAs WELKER, Alexis Fonseca. Efeito da flutuação da disponibilidade de oxigênio e da privação alimentar sobre o metabolismo de radicais livres. Instituto de Biociências da Universidade de São Paulo. Disponível em: <http://www.teses.usp>. Acesso em : 18/06/2010. POUGH, F.H , Janis, C.M & Heiser, J.B . 2008. A Vida dos Vertebrados. 4ª Edição. Atheneu Editora São Paulo LTDA. _________________________________________________________________________________ 34 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ ÁCIDOS GRAXOS ESSENCIAIS PARA A ALIMENTAÇÃO HUMANA Juliana F. V. Tófoli e Lorena A. F. Brito Graduandas dos cursos de Ciências Biológicas Bacharelado e Ciências Biológicas Licenciatura RESUMO Ácidos graxos são vitais para o equilíbrio orgânico, estando envolvidos nas funções do sistema nervoso, imunológico e cardiovascular. Os ácidos graxos essenciais entram na constituição das membranas celulares, além de serem necessários para a produção de energia, síntese de prostaglandinas, utilização do oxigênio, funcionamento do cérebro, transporte de colesterol e produção de Hemoglobina.São poliinsaturados não sintetizados pelas células do organismo, portanto, devem ser adquiridos através da alimentação. Palavras chaves: Ácidos Graxos Essências , Poliinsaturados , Araquidonato, Ômega 3, 6 e 7 PROPOSTA Demonstrar a partir de vias bioquímicas a importância da Síntese de Ácido Graxo Essencial para a coagulação, processos inflamatórios, desenvolvimento do Sistema Nervoso e memória. INTRODUÇÃO Há uma tendência nutric ional que preconiza uma alimentação saudável, com ingestão de fibras e redução de gordura e colesterol. Associando a mudança do estilo de vida a hábitos alimentares corretos, surgiram os alimentos funcionais. São compostos que, além de nutrir, apresentam propriedades fisiológicas específicas. O ser humano é capaz de sintetizar alguns ácidos graxos saturados e insaturados, porém essa capacidade é limitada quando se trata de ácidos graxos poliinsaturados, sem os quais nosso organismo não funciona adequadamente. Por essa razão, estes ácidos graxos são chamados de “essenciais” e devem necessariamente, ser incluídos na dieta alimentar. Os ácidos graxos essenciais para a alimentação humana são: Ácido Ácido Ácido Ácido Ácido Palmidoléico (Ômega 7) Linoléico (Ômega 6) Alfa linolênico (Ômega 3) Decosahexanóico (DHA) Eicosapentanóico (EPA) O ácido linolênico (ômega-6) está presente em grande quantidade nos óleos de milho e soja, enquanto o ácido linoleico (ômega-3)., em vegetais de folhas verdes, no óleo de linhaça e nos óleos de peixes marinhos. A importância destes ácidos graxos está na sua capacidade de se transformar em substâncias biologicamente mais ativas, com funções especiais no equilíbrio homeostático, e em componente estrutural das membranas celulares e do tecido cerebral e nervoso. Os óleos de muitas espécies de peixes marinhos são ricos em ácido graxo eicosapentaenóico (EPA) e ácido docosahexaenóico (DHA), que são as formas longas e insaturadas ativas da série ômega-3, e que podem ser absorvidas diretamente pelos ciclos metabólicos dos seres humanos. Estes ácidos graxos são produzidos pelas algas marinhas, e depois transferidos, através da cadeia alimentar, para os peixes. Dentre os peixes, aqueles que contêm maior quantidade de EPA e DHA são os que habitam águas frias, como salmão, truta e bacalhau. Estes apresentam, além dos ácidos graxos essenciais, proteína de alta qualidade, ótima digestibilidade e baixo teor calórico. Portanto, são recomendados para auxiliar na manutenção da sanidade _________________________________________________________________________________ 35 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ geral, e também para gestantes e lactentes, pois influem no desenvolvimento do cérebro e do sistema nervoso da criança. REFERENCIAL TEÓRICO Os produtos da ação das enzimas ciclooxigenase e lipoxigenase sobre o ácido araquidônico são prostaglandinas, tromboxanos e leucotrienos, também denominados eicosanóides. Tais compostos são agentes homeostáticos, envolvidos na manutenção da integridade dos sistemas inflamatório, cardiovascular e renal. Vários pesquisadores têm demonstrado que flavonóides apresentam inúmeras propriedades farmacológicas, entre elas atividade antiinflamatória e hipocolesterolêmica, reduzindo, assim, o risco de doenças cardiovasculares e um dos principais mecanismos de ação propostos é a inibição das enzimas, envolvidas no metabolismo final do araquidonato. A ingestão de ácidos graxos n-3 provoca alterações estruturais e funcionais na membrana celular fosfolipídica. A fluidez da membrana celular aumenta e permite maior mobilidade das proteínas de membrana e favorece maior troca de sinais de transdução, interação hormônio-receptor e transporte de substratos. Durante a suplementação dietética com óleo de peixe ocorre integração de ácidos graxos w-3 na membrana celular em 72 horas. A menor incorporação do ácido araquidônico na membrana celular ocorre provavelmente pela preferência da enzima - desaturase pelos ácidos graxos n-3. Ácidos graxos n-3, competem com o ácido araquidônico como substrato para síntese de prostaglandinas e leucotrienos. Com a maior disponibilidade de n-3 a síntese de prostaglandinas (PG) e tromboxanes (TX) da série 2 e leucotrienos (LT) da série 4 diminui, sendo substituída pela síntese de prostaglandinas e leucotrienos das séries 3 e 5 respectivamente. As PG, TX e LT das séries 3 e 5 são mediadores inflamatórios menos potentes, podendo modular a resposta inflamatória exacerbada. O Ácido Linoléico é um ácido graxo duplamente insaturado, ocorrendo principalmente em glicosídeos vegetais. É um ácido graxo essencial na nutrição de mamíferos e é usado na biossíntese de prostaglandinas e membranas celulares. Os flavonóides são compostos, contendo unidades C6C3C6, e fazem parte do metabolismo secundário de plantas. São encontrados em leguminosas, frutas, flores, folhas. Flavonóides afetam urna grande variedade de enzimas, possuem atividade antioxidante, quelam alguns cátions metálicos, afetam a fosforilação de proteínas celulares, apresentam efeito inibitório na agregação plaquetária e nas funções dos leucócitos e possuem efeito protetor sobre as células endoteliais, o que sugere que são substâncias de grande interesse no desenvolvimento de inibidores, nas interações entre o sangue e as paredes dos vasos, que estão intimamente relacionadas com o processo de trombose. Os ácidos graxos essenciais são poliinsaturados não sintetizados pelas células do organismo, portanto, devem ser adquiridos através da alimentação. Modelo esquemático: Palmitato Linoleato EPA DHA Araquidonato REFERÊNCIAS BIBLIOGRÁFICAS _________________________________________________________________________________ 36 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Lehninger, AL. Nelson, DL. & Cox, MM. Princípios de Bioquímica, 4ª edição, Sarvier Editora de Livros Médicos S.A., São Paulo, 2006. 1202 p. http://www.fmrp.usp.br/revista/2002/vol35n2/efeito_flavonoides.pdf http://bases.bireme.br/cgibin/wxislind.exe/iah/online/?IsisScript=iah/iah.xis&src=google&base=LILACS&lang=p&nextAct ion=lnk&exprSearch=355705&indexSearch=ID http://quimica10.com.br/10/wp-content/uploads/2009/01/metabolismo-dos-acidos-graxos-etriacilglicerois.pdf http://www.nutricaoclinica.com.br/2005080368/nutricao-clinica/acidos-graxos-omega-3-naimunonutricao http://www.enq.ufsc.br/labs/probio/disc_eng_bioq/trabalhos_pos2003/const_microorg/lipideos.htm http://www.scribd.com/doc/14180350/Bioquimica-lipideos http://www.fcfar.unesp.br/alimentos/bioquimica/introducao_lipidios/introducao_lipidios.htm http://bases.bireme.br/cgibin/wxislind.exe/iah/online/?IsisScript=iah/iah.xis&src=google&base=LILACS &lang=p&nextAction=lnk&exprSearch=311260&indexSearch=ID http://www.uff.br/mfl/outras_disciplinas/med_integral_infancia_adolescente/cox2.htm http://www.rbdm.com.br/a5.1.htm http://www.fmrp.usp.br/revista/2002/vol35n2/efeito_flavonoides.pdf http://www.cbiot.ufrgs.br/bioinfo/Aula_08-AINES_1.pdf http://quimica10.com.br/10/wp-content/uploads/2009/01/metabolismo-dos-acidos-graxos-etriacilglicerois.pdf http://www.nutricaoclinica.com.br/2005080368/nutricao-clinica/acidos-graxos-omega-3-naimunonutricao http://www.enq.ufsc.br/labs/probio/disc_eng_bioq/trabalhos_pos2003/const_microorg/lipideos.htm http://www.scribd.com/doc/14180350/Bioquimica-lipideos _________________________________________________________________________________ 37 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ BACTÉRIAS FAMINTAS POR PETRÓLEO: MICRORGANISMOS ANAERÓBIOS NA BIORREMEDIAÇÃO DE HIDROCARBONETOS Leonardo R Santos1 e Sarah F Guimarães1 1 Licenciatura em Ciências Biológicas, Universidade Federal de Ouro Preto, Minas Gerais, Brasil. RESUMO Durante muito tempo, a mineralização de hidrocarbonetos aromáticos e alifáticos foi considerada viável apenas em condições aeróbias. A bioquímica por trás deste dogma baseou-se principalmente na noção que em bactérias aeróbias degradantes de hidrocarbonetos, o oxigênio molecular era obrigatoriamente exigido como co-substrato na ativação enzimática inicial (Spormann e Widdel, 2000). Assim, a estratégia bioquímica para a ativação de hidrocarbonetos em condições aeróbias, é a introdução de um grupo hidroxila na molécula apolar, por meio de oxigênio ativado como agente oxidante. Desta forma, a degradação de hidrocarbonetos em condições anaeróbias possui mecanismos bioquímicos diferenciados (Spormann e Widdel, 2000). A utilização de bactérias anaeróbias na biorremediação é viável devido ao baixo gasto financeiro com manutenção, dispensam equipamentos de aeração, taxa de bioincrustração baixa e, apesar de mais lenta, a produção de metabólitos secundários é menor o que permite maior controle do processo e maior eficiência da biorremediação em longo prazo. Palavras chave: degradação, hidrocarbonetos, biorremediação, bactérias, anaeróbias, petróleo. INTRODUÇÃO Durante as duas ultimas décadas a biodegradação anaeróbica de xenobióticos vem atraindo cada vez mais a atenção da comunidade científica. Avanços significativos foram feitos para o isolamento de culturas bacterianas, elucidando de mecanismos bioquímicos de degradação de xenobióticos (hidrocarbonetos). Para os hidrocarbonetos derivados de petróleo, embora os processos aeróbios sejam geralmente usados, a biodegradação anaeróbia é significativa em determinadas circunstâncias (por exemplo, aquíferos esgotados de oxigênio, derramamento de óleo em pântanos). Para compostos persistentes, incluindo bifenilas policloradas, dioxinas, e DDT, os processos anaeróbios são lentos para recuperação ambiental, mas podem ser um caminho significativo em longo prazo para atenuação natural. (Zhang, C; Bennett, G. N, 2005) Hidrocarbonetos são compostos largamente disseminados no ambiente. Vários hidrocarbonetos são metabólitos naturais e parte da fração lipofílica em microrganismos, plantas e animais. O principal reservatório e fonte de hidrocarbonetos é o petróleo. Hidrocarbonetos aromáticos e alifáticos são os principais constituintes do petróleo e seus derivados. (Spormann, A. M; Widdel, F. 2000). Enquanto que degradação de hidrocarbonetos por microorganismos aeróbicos foi conhecida há cerca de um século, a degradação de hidrocarbonetos em condições anaeróbias foi investigada apenas na última década. (Zhang, C; Bennett, G. N, 2005). Hidrocarbonetos provenientes do petróleo são introduzidos no meio ambiente devido a sua ampla utilização como combustíveis e químicos pelo homem. Mas mesmo antes da sua utilização industrial, já haviam acumulações significativas de hidrocarbonetos na biosfera via escoamento natural. Isto pode explicar porque muitos tipos de microorganismos evoluíram capacidades metabólicas, utilizando estes compostos como doadores de elétrons para a respiração aeróbia ou anaeróbia e como fonte de carbono para a síntese celular. (Spormann, A. M; Widdel, F. 2000). O presente trabalho enfoca a degradação de hidrocarbonetos por bactérias anaeróbias, devido as suas vantagens relativas à eficiência de processos e custos econômicos. _________________________________________________________________________________ 38 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Bioenergética do processo: A mineralização microbiana de hidrocarbonetos em condições de redução do nitrato, redução Fe (III), redução do sulfato e metanogênese, é um processo exergônico, assim sendo, ideal para a conservação de energia microbiana. Nas reações entre reagentes e produtos em pH 7, a energia livre disponível por mol de elétron/aceptor consumidos na mineralização de hidrocarbonetos sofre poucas variações. Variações estas ocorrem devido ao tipo de compostos (por exemplo: alifáticos, aromáticos), e do tamanho da molécula. No entanto, estas reações no ambiente natural, os valores energéticos podem ser diferentes, principalmente, devido a grandes diferenças estequiométricas dos reagentes disponíveis e produtos. Vários fatores podem limitar as taxas de mineralização de hidrocarbonetos, estes fatores incluem a abundância dos microorganismos, a disponibilidade de hidrocarbonetos, a energética e a cinética da reação de ativação de hidrocarbonetos e eficiência das reações subseqüentes levando a CO 2. Dos hidrocarbonetos aromáticos e alifáticos, os compostos BTEX (benzeno, tolueno, etilbenzeno e xileno), naftaleno, bem como hexano, octano hexadecano, têm servido como representantes dos compostos (hidrocarbonetos) em estudos de laboratório para desvendar o metabolismo e mecanismos envolvidos na degradação anaeróbia de hidrocarbonetos. (Spormann e Widdel, 2000) Grupos de bactérias anaeróbias que promovem a degradação de xenobióticos: As bactérias anaeróbias capazes de degradar hidrocarbonetos são diversas, e estão presentes em diversos habitats, incluindo sedimentos, água subterrânea, conteúdo gastrointestinal, retículo-ruminal, aterros e resíduos de confinamento (Zhang, C; Bennett, G. N. 2005). Bioquímica da degradação de hidrocarbonetos derivados do petróleo: Alcanos saturados são mais suscetíveis a degradação de microrganismos, do que hidrocarbonetos alifáticos insaturados. É também bem estabelecido que alcanos com cadeias longas de estruturas retas são mais propensas a biodegradação aeróbia, o mesmo é provável que seja o caso de microrganismos anaeróbios. Este trabalho dá ênfase à degradação anaeróbia dos denominados compostos BTEX (Benzeno, etilbenzeno, tolueno e xileno). A mineralização é relatada em todos os compostos BTEX, exceto o p-xileno. As enzimas envolvidas na via de degradação destes compostos estão elucidadas na figura A. Figura A – Via anae róbia para degradação de hidrocarbonetos de petróleo. A: Fumarato; E1: benzil succinato sintase; E2: etilbenzenosuccinato sintase; E3: etilbenzeno desidrogenase; E4: etilbenzilsuccinato sintase; E5: benzoil-CoA redutase. Fonte: ZHANG, C; BENNETT, G. N. 2005. _________________________________________________________________________________ 39 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Após a formação de Benzilsuccinato, este é convertido em Benzilsuccinil-CoA por uma enzima Coatransferase, e em seguida oxidado a Benzoil-CoA e succinil-CoA, prosseguindo assim o metabolismo. A degradação destes hidrocarbonetos, em condições ideais, continua, através de mecanismos bioquímicos até a produção de CO 2. Assim, nestas condições ocorre a mineralização do hidrocarboneto. (ZHANG, C; BENNETT, G. N. 2005.) CONCLUSÕES E PROSPECTOS PARA O FUTURO A utilização de bactérias anaeróbias na biodegradação de compostos xenobióticos como o petróleo e seus derivados, provou ser eficiente em ambientes anóxidos ou hipóxidos como aquíferos, mangues, tratamento de esgotos e sistemas de biorreatores. O conhecimento das vias bioquímicas de degradação de compostos BTEX, dos genes responsáveis pela síntese enzimática que propicia a esses organismos a degradação desses compostos e a criação de uma bactéria “sintética”. Isto viabilizaria a produção de um único microrganismo que reúna todos os genes responsáveis pela produção de enzimática de degradação de todos os BTEX. Este, sendo ainda capaz de multiplicar-se, pode ser aplicado na biorremediação de xenobióticos. A figura B retrata a extração dos genes alvo e inserção na bactéria sintética. Figura B: Inserção de genes responsáveis pela degradação de compostos BTEX em um microrganismo sintético. REFERÊNCIAS BIBLIOGRÁFICAS GIBSON, Daniel G. et al. Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome. Sciencexpress Research Article. San Diego, USA. 2010 GRISHCHENKOV, V.G. et al. Degradation of petroleum hydrocarbons by facultative anaerobic bacteria under aerobic and anaerobic conditions. Process Biochemistry. Moscow, Russia. 1999. SPORMANN, A. M; WIDDEL, F. Metabolism of alkylbenzenes, alkanes, and other hydrocarbons in anaerobic bacteria. Kluwer Academic Publishers, Netherlands, 2001. ZHANG, C; BENNETT, G. N. Biodegradation of xenobiotics by anaerobic bacteria. Appl Microbiol Biotechnol. Springer-Verlag. 2005. _________________________________________________________________________________ 40 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ ESTRATÉGIAS DE PLANTAS CONTRA O ATAQUE DE AGENTES FITOPATOGÊNICOS Saulo Rodrigues Leles e Felipe Telles. Alunos do curso de Ciências Biológicas/Licenciatura e Ciências Biológicas/Bacharelado da Universidade Federal de Ouro Preto. RESUMO O presente trabalho propõe uma introdução sobre os mecanismos de defesa das plantas contra agentes fitopatogênicos, visando apresentar os principais aspectos envolvidos no mecanismo de defesa de plantas contra o ataque de patógenos. A proposta é evidenciar a atuação de cada componente, tendo como foco respostas químicas da planta resultando em produção de metabólitos secundários, podendo ser de três formas: compostos nitrogenados, terpenóides ou compostos fenólicos. Essas respostas químicas acontecem em conseqüência de ataques de agentes, desenvolvendo formas de respostas que podem ser alteradas de acordo com a eficácia dos produtos formados, fazendo com que a planta fique cada dia mais resistente a ataques fitopatógenos, e possa alcançar mais ambientes no mundo. Este trabalho teve como base estudos referente a planta Nicotiana attenuata que desenvolve uma séries de eventos e respostas a ataques de insetos herbívoros, liberando compostos químicos que são tóxicos, ou não digeríveis pelo inseto. Estudos envolvendo mecanismos de defesas de plantas são de suma importância para áreas de agropecuária, ecofisiologia, e evolução, podendo desenvolver novas estratégias para melhorar a adaptação das plantas, tanto a plantação de produtos de consumo humano, como para manutenção da biodiversidade. Palavras-chave: Fitopatogênicos,mecanismos,metabólitos,adaptação e biodiversidade. INTRODUÇÃO Embora aparentemente indefesas frente ao ataque de agressores ou até mesmo em condições adversas, as plantas apresentam estratégias de defesa que permitem o retardamento ou até mesmo impedem a penetração de agentes fitopatogênicos, tais como, fungos, bactérias, vírus, nematóides e insetos (Fernandes, 2004). As plantas reagem ainda sob estresse abiótico, como por exemplo, variações de temperatura, ausência de água ou tratamento com agentes químicos. Esta defesa é composta de resposta constitutiva, a qual já está presente nas plantas, e a resposta induzida, a qual ocorre após o ataque de fitopatógenos ou o início do estresse abiótico. As ativações dos mecanismos de defesa ocorrem por sucessivos sinais que iniciam o reconhecimento pela planta do agente agressor que ativa na planta, respostas físicas e químicas envolvidas no processo. Dentre as defesas utilizadas pelas plantas estão a resposta hipersensitiva (HR), resistência sistêmica adquirida (SAR), indução de proteínas relacionadas à patogênese (PR-Proteínas) e compostos sinalizadores, como por exemplo, ácido salicílico e peróxido de hidrogênio. A resposta hipersensitiva se caracteriza por ser a principal resposta das plantas contra o ataque de agentes patogênicos,por ser uma reação rápida e localizada. Dentre as principais características da resposta estão o rápido e localizado colapso do tecido vegetal ao redor do sítio de infecção, ocasionado pela liberação de compostos tóxicos, os quais também atuam, em alguns casos, diretamente sobre o patógeno, ocasionando sua morte (AGRIOS, 2004). A resistência sistêmica adquirida é uma resistência induzida que é inicialmente localizada na região de infecção, na tentativa de impedir e/ou retardar a penetração do patógeno, sendo conhecida como resistência adquirida. Posteriormente, esta resistência passa a ocorrer em locais da planta distantes do local da infecção pelo patógeno, ou do local de aplicação dos agentes eliciadores abióticos, caracterizando, assim, a resposta sistêmica adquirida (AGRIOS, 2004). Já as PR-proteínas são proteínas extracelulares acumuladas nas plantas, _________________________________________________________________________________ 41 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ que existem baixo nível, em estado normal, mas que os serem sinalizadas por fatores bióticos os abióticos são produzidas em grande escala, atuando diretamente no agente causador. As plantas ainda, podem desenvolver defesas físicas, como produção de espinhos, pêlos e cutícula, porém estas estratégias estão em baixos níveis na p lanta, e não são de grande eficácia contra todos os agentes fitopatogênicos. Defesas Químicas Diferentemente das barreiras físicas, a defesas químicas são grandes empecilhos contra os ataques de agente patogênicos( insetos, fungos e bactérias). Como defesas as plantas produzem metabólitos secundários, (conseqüentes de uma resposta hipersensitiva), que são compostos exclusivos do reino vegetal que não parecem possuir uma função direta no crescimento e desenvolvimento da planta (Taiz & Zeiger 1987). Porém essa definição tem sido repensada, pois a defesa da planta pode estar ligada indiretamente com o seu crescimento, afinal uma planta não cresce se estiver vulnerável a ataques. Os compostos secundários derivam de três vias metabólicas: Compostos nitrogenados(derivados de aminoácidos), terpenóides (acetil-CoA – ác. mevalônico), fenólicos (ác. malônico ou ác. chiquímico). Do ponto de vista bioquímico, a defesa para a planta é um grande dilema, pois ela fica entre crescer e defender-se. A planta primeiramente passa por todo o complexo de fotossíntese , com as fases químicas e fotoquímicas acontecendo normalmente, ocorrendo produção de NADPH e conseqüente produção de carboidratos. A partir daí a planta começa a ter decidir qual destino tomar, se entra na via glicolítica formando acetil-CoA de depois entrando na mitocôndria para o ciclo de Krebs, para formar agentes redutores para posterior produção de ATP,e formação dos tecidos para crescimento, ou se a partir do acetil-CoA, ou até mesmo antes da via glicolítica, ela segue o cominho das vias formadores de compostos secundários, que podem ser as vias do ácido chuiquímico, malônico ou mevalônico. CO2 Fotossíntese Carboidratos Via das pentoses fosfato Glicólise Eritrose 4-fosfato Via ác. chiquímico Aminoácidos alifáticos Aminoácidos aromáticos Comp. Sec. nitrogenados Fosfoenol piruvato Acetil-CoA Ciclo ác. tricarboxílico Via do ác. mevalônico Via do ác. malônico Terpenos Compostos fenólicos Esta realmente é uma decisão difícil para a planta, mas cabe a ela saber em qual ambiente ela se encontra, e se é mais compensativo o crescimento em busca de um lugar melhor no dossel , ou defender contra agentes que podem estar em grande número e prejudicar sua vida. Considerações ecofisiológicas Assim como crescer, defende-se também é muito importante, porém a produção dos compostos secundários, as vezes pode ser um processo caro e sem grandes retornos afinal a toxidez de um composto é relativa, depende da dose ingerida, da idade e do estado de saúde do animal, do mecanismo de absorção e do modo de ação e excreção.Compostos secundários desempenham, muitas vezes, o papel de repelente. As plantas se utilizam destes compostos para avisar aos potenciais herbívoros sobre o perigo de ingerí-las (sinais visuais também podem ocorrer). Assim a planta, não fica totalmente protegida, além de estar deixando de crescer. _________________________________________________________________________________ 42 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ O caso da Nicotiana attenuata As plantas conhecidas como tabaco selvagem (Nicotiana attenuata), da família das Solanaceas são originadas do sudoeste dos Estados Unidos até o norte do México. Essas plantas apresentam um curioso processo de defesa baseado nas características de seu predador. A N. attenuata possui em seus parênquimas de reserva, o alcalóide conhecido como nicotina, que é utilizado pela planta para processos de defesa contra possíveis ataques de parasitas exógenos. Quando a N. attenuata encontra-se em vias de predação, ou seja, quando o parasita está atacando suas folhas ou qualquer parte aérea, a N. attenuata utiliza desses alcalóides, principalmente da nicotina para a defesa. A nicotina é desviada para o local da infecção e o aumento da concentração desse composto diminui a palatabilidade das folhas do tabaco. Ora, sendo assim, o inseto herbívoro que predava a N. attenuata ira desistir da folha e a planta estará livre da destruição de seu bem mais precioso, a folha. Sendo assim, quando insetos que não são tolerantes à nicotina tendem a predar a N. attenuata, o simples fato da mobilização da nicotina para o local de predação se torna bastante eficaz para a defesa. Porém, se uma larva for tolerante à nicotina, o que irá ocorrer com a N. attenuata? Talvez por um processo intenso de co-evolução com as larvas de insetos herbívoros, a N. attenuata apresenta uma saída eficaz para resolver o caso das larvas tolerantes à altas concentrações de nicotina. A planta irá chamar o predador natural dessas larvas tolerantes para o local da herbívora por meio de liberação de compostos voláteis, mais precisamente, terpenos e jasmonatos (ácido jasmônico). Pois bem, agora sim a N. attenuata estará demonstrando toda a sua capacidade de se defender, seja por meio da mobilização da nicotina oupor meio da liberação de compostos voláteis, mas como essa planta sabe qual inseto está predando suas folhas? Baldwin et al (2001) interessou-se por tal fato e decidiu estudar o por que dessa distinção de defesa. Ele decidiu trabalhar com larvas do gênero Manduca, mas precisamente com as espécies M. sexta e M. quinquemaculata. Sabendo que tais espécies de larvas são tolerantes às altas concentrações de nicotina, Baldwin decidiu colocá-las para predar N.attenuata em seu laboratório no Max-PlanckInstitute, na Alemanha. O pesquisador alemão observou que na saliva das larvas de M. sexta e M. quinquemaculata havia concentrações diferentes de certos ácidos graxos e usando o HPLC, determinou as concentrações dos compostos formadores da saliva dessas larvas. O que Baldwin percebeu foi que a resposta das N. attenuata à predação pelas larvas de M.sexta e M.quinquemaculata produzia altos níveis de compostos voláteis (terpenos e jasmonatos), mas o que os ácidos graxos tinha a ver com a produção de tais compostos? Usando o HPLC, Baldwin observou que os ácidos graxos produzidos pelas larvas de M.sexta e M.quinquemaculata possuíam diferenças nas suas estruturas quando comparados com ácidos graxos produzidos por outras larvas predadoras de N.attenuata. Os ácidos graxos produzidos pelas larvas do gênero Manducam, tinha em sua composição ácidos graxos conjugados entre 16 e 18 carbonos com resíduos de glutamina (Gln), uma diferença quando comparado com os ácidos graxos conjugados de mesmo tamanho das espécies não tolerantes à nicotina, que possuíam resíduos de glutamato (Glu). Sendo assim, a equipe de Baldwin observou que quando se tem ácidos graxos conjugados com resíduos de Gln, a planta produz compostos voláteis. Esses ácidos graxos determinam a síntese de terpenos e jasmonatos. O caminho bioquímico para a síntese desses compostos ainda é pouco esclarecido, mas alguns pesquisadores acreditam que ao entrar em contato com esses ácidos graxos conjugados com resíduos de Gln, as folhas lesadas sintetizam prosistemina, que contem 200 a.a. Essa substância é processada proteoliticamente e produz um polipeptídeo de 18 a.a chamado de sistemina. A sistemina é liberada no apoplasto das células e via floema segue para as folhas danificadas. Sendo assim, alguns autores acreditam que a sistemina se ligue a um receptor de membrana que dará início à biossíntese do ácido jasmônico (jasmonato) que irá agir como defesa para a planta. CONCLUSÃO Algumas plantas apresentam para sua defesa modificações anatômicas como o aumento das inclusões celulares, a esclerificação das folhas, a produção de cutículas espessas, a produção de espinhos entre outros. E outras plantas para a sua defesa apresentam processos fisiológicos e bioquímicos. Um dos casos mais interessantes é o da nicotiana attenuata que apresenta saídas bioquímicas diferentes para diferentes tipos de predadores, dando a essa planta uma plasticidade muito pouco vista no reino vegetal. A co-evolução e a seleção positiva das espécies de N.attenuata _________________________________________________________________________________ 43 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ com seus predadores demonstra que essas plantas são sobreviventes intrínsecas e muito bem adaptadas às mudanças na pressão seletiva do ambiente, determinando assim o sucesso reprodutivo e vegetativo dessa planta frente a modificações ambientais. RELEVÂNCIA DO TRABALHO EM FACE AO DESENVOLVIMENTO CIENTÍFICO E TECNOLÓGICO O presente trabalho propõe uma revisão breve sobre a produção de metabólitos secundários, em resposta a ataque de agente fitopatogênicos, que podem causar danos e ate a morte das plantas. Esses mecanismos são estratégias de grande importância para as plantas visando sua defesa e/ou crescimento em diferentes habita, que podem garantir para os humanos, plantas mais sadias e com melhor aproveitamento na agropecuária e também na manutenção da biodiversidade e evolução. REFERÊNCIAS BIBLIOGRÁFICAS FERNANDES,C.F.; JÚNIOR,J.R.V; SILVA,D.S.G; REIS,N.D. Mecanismos de defesa de plantas contra atAque de agente fito patogênicos. Embrapa. Centro de pesquisa agroflorestal de Rondônia. Porto Velho, RO.2009. HALITSCHKE,R.; SCHITTKO,U.; POHNERT ,G.; BOLAND ,W.; BALDWIN,T. Molecular interactions between the specialist herbivore Manduca sexta (Lepidoptera, Sphingidae) and its natural host Nicotiana attenuata. III. Fatty acid-amino acid conjugates in herbivore oral secretions are necessary and sufficient for herbivore-specific plant responses 1. Department of Molecular Ecology, Max Planck Institut for Chemical Ecology, Carl Zeiss Promenade 10,D–07745 Jena, Germany.2001 GAQUEREL,E.; WEINHOLD,A.; BALDWIN,L.T. Molecular Interactions between the Specialist Herbivore Manduca sexta (Lepidoptera, Sphigidae) and Its Natural Host Nicotiana attenuata. VIII. An Unbiased GCxGC-ToFMS Analysis of the Plant’s Elicited Volatile Emissions. Department of Molecular Ecology, Max-Planck-Institute for Chemical Ecology, Jena 07745, Germany.2001 TAIZ, L.; ZEIGER, E. Plant Physiology. 2. ed. Sunderland Massachusetts: Sinaver Associates, 1998. 792p. AGRIOS, G. Plant Pathology. New York. Academic Press. 2004. _________________________________________________________________________________ 44 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ FIXAÇÃO BIOLÓGICA DE NITROGÊNIO E A DIVERSIDADE DE BACTÉRIAS DIAZOTRÓFICAS Giordano P. P. Freitas e Rafael C. Cardoso Graduandos do curso de bacharelado em Ciências Biológicas pela UFOP RESUMO O presente trabalho visa levantar a discussão sobre a fixação biológica do nitrogênio como alternativa ao uso de fertilizantes nitrogenados, visto que seu alto custo de produção e suas conseqüências ambientais podem inviabilizar a produção agrícola, econômica e ecologicamente. Palavras-chave Fixação biológica de nitrogênio - bactérias diazotróficas – fertilizantes nitrogenados – inoculação de bactérias – nódulos INTRODUÇÃO O Nitrogênio representa aproximadamente 80% da atmosfera, entretanto animais e plantas não conseguem utilizá-los em sua forma gasosa. Os seres capazes de fazer a fixação biológica de nitrogênio (FBN) são as bactérias denominadas diazotróficas, que são capazes de transformar N2 presente na atmosfera em NH3 ou aminoácidos que podem ser utilizados pelas plantas (Döbereiner – Embrapa). Há muito tempo este processo é conhecido em simbiose das bactérias do gênero Rhizobium ou Azorhizobium em raízes de leguminosas e em alguns casos nos colmos (Döbereiner – Embrapa). Essas bactérias formam nódulos em raízes de leguminosas onde há uma infecção controlada das células do vegetal e há troca de nutrientes entre os indivíduos (Heldt, 2005). Segundo Heldt as bactérias utilizam do complexo enzimático nitrogenase que transfere elétrons do NADH via ferrodoxina para produção de duas moléculas de NH3 a partir de N2 e 8H+. Atualmente tem-se estudado novas bactérias capazes de fazer a FBN em plantas não leguminosas, principalmente gramíneas de interesse econômico para a produção de biomassa e alimentação. Desde 1956 estudam-se no Brasil essas bactérias, mas somente em 1983 foi comprovado que algumas dessas gramíneas podem obter quantidades significativas de nitrogênio por meio da atividade dessas bactérias (Boddey & Döbereiner, 1988). Figura.1 Célula de Leguminosa infectada por Rhizobium (E. Mörschel and D. Werner, Marburg.) DISCUSSÃO Segundo Machado & Magnavaca (1991) a maior fonte de poluição dos sistemas agrícolas são os fertilizantes nitrogenados. O gasto energético para produção de fertilizantes nitrogenado é muito alto, _________________________________________________________________________________ 45 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ seis vezes maior que a produção de fósforo ou potássio (da Silva et al., 1978 apud Guimarães, 1999). Os fertilizantes nitrogenados representam aproximadamente 75% dos custos, correspondendo a aproximadamente 40% dos custos total da produção da cultura (Machado & Magnavaca, 1991). Na busca de energias alternativas através de biomassa vem sendo realizados no Brasil pesquisas com FBN em gramíneas buscando diminuir quantitativamente os de níveis de adubação nitrogenada, tornando a cultura energeticamente e ecologicamente mais indicada para alternativas bioenergéticas (Quesada et al., 2003). Pesquisas com enfoque em bactérias diazotróficas associadas a plantas não leguminosas, especialmente gramíneas de interesse econômico tem se tornado alvo de muitas pesquisas nos últimos anos, revelando novas descobertas importantes. Várias espécies de bactérias fixadoras de N2 foram isoladas do solo e da risosfera de cana-deaçúcar, milho, arroz, trigo, sorgo entre outras. Dentre essas bactérias destacam-se Beijerinckia, Bacillus, Azotobacter, Derxia, Enterobacter e Azospirillum (Quesada, 2003). Pesquisas com a soja associada às bactérias do gênero Bradyrhizobium no Brasil, demonstram que não há necessidade de nenhuma adubação nitrogenada, pois as bactérias suprem todas as necessidades de N da planta. Isto demonstra a viabilidade econômica do cultivo por meio da inoculação de melhores linhagens de bactérias diazotróficas (Hungria et al. , 2001). Figura 2. Convergência do nitrogênio fixado para as plantas CONCLUSÃO Com base nos altos custos de produção de fertilizantes nitrogenados e suas conseqüências ambientais, se faz necessário o uso de métodos alternativos visando à oferta de nitrogênio a ser utilizado pelas plantas em diversos cultivos. Um dos métodos alternativos a produção de Nfertilizantes é a inoculação de bactérias diazotróficas em leguminosas e gramíneas. Pesquisas com relação a este tipo de inoculação demonstraram a viabilidade deste processo, tanto econômico quanto ecológico. Na atualidade é possível encontrar vários estudos sobre inoculação de bactérias em leguminosas, mas ainda é escasso o número de pesquisa em gramíneas e no seu metabolismo de nitrogênio. Pesquisas com gramíneas ainda estão em desenvolvimento, mas demonstram serem promissoras estas abordagens na área. REFERÊNCIAS BIBLIOGRÁFICAS ROESCH, Luiz Fernando. Et al. Reinoculação de bactérias diazotróficas aumentando o crescimento de plantas de trigo. Santa Maria: Ciência Rural 2005. BRASIL, Marivaine da Silva. et al. Ocorrência de Bactérias do gênero Azospirillum spp. Associadas a gramíneas forrageiras do Pantanal da Nhecolândia. Seropédica: Embrapa, 2000. MACHADO, Altair Toledo. Et al. Efeito da Adubação Nitrogenada e da Inoculação com Bactérias Diazotróficas no Comportamento Bioquímico da Cultivar de Milho Nitroflint. HELDT, Hans-Walter. Plant Biochemistry Third Edition. Elsevier Inc. 2005. DÖBEREINER, J. A Importância da Fixação Biológica de Nitrogênio Para a Agricultura Sustentável. Seropédica: CNPAB/Embrapa. DE RESENDE, Alexander S. et al., Incorporação de Leguminosas para fins de Adubação Verde em Pré-Plantio de Cana-de-Açúcar. Embrapa: 2000. _________________________________________________________________________________ 46 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ BODDEY, Robert Michael et al. Fixação Biológica De Nitrogênio por bactérias associadas a cana-deaçucar. Embrapa 1992 MACHADO, A.T.; MAGNAVACA, R. Estresse Ambiental: o milho em perspectiva. Rio de Janeiro: AS-PTA, 1991. 47p. _________________________________________________________________________________ 47 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ MELATONINA: COMO ESTE HORMÔNIO ATUA NA DOENÇA DE PARKINSON Gabriela M. Z. da Silva e Lucas R. C. Aguiar Graduandos em Biologia pelo Departamento de Ciências Biológicas, Universidade Federal de Ouro Preto RESUMO A Glândula Pineal é um órgão fotossensível e de secreção endócrina conectado ao Sistema Nervoso Central. Este órgão produz a melatonina que age sobre as células do corpo indicando luminosidade (quanto à noite e dia) e mantém estas células viáveis atuando na regulação positiva e negativa de enzimas pró- e antioxidantes, contra agentes oxidantes e inflamatórios. No neurônio dopaminérgico, que mantém sinapse com o Corpo Estriado (controlador da função motora) através da Via Nigroestriada, este hormônio tem grande importância, atuando favoravelmente na integridade do neurônio, que lesado compromete as funções motoras do indivíduo, caracterizando a Doença de Parkinson. Nesta patologia, o indivíduo, dentre outros sintomas, apresenta tremores, rigidez muscular, instabilidade postural e dificuldade para realizar e iniciar movimentos. INTRODUÇÃO A glândula Pineal (GP), um órgão fotossensível e de secreção endócrina, mantém conexões, tanto aferentes quanto eferentes, com o sistema nervoso central (SNC) através do pedúnculo pineal. Nos mamíferos, a perda de suas conexões diretas com o SNC, faz com que a GP esteja sob comando do ciclo circardiano (= iluminação ambiental), de forma indireta, através de conexões com a retina mediadas por estruturas diencefálicas. Desta forma a produção e secreção de melatonina, o hormônio produzido pela GP, está ligado à variação de luminosidade ambiental, sinalizando para o meio interno se é noite ou dia no meio exterior, e pela duração do episódio secretório de melatonina qual é a estação do ano. Nas diferentes espécies, GP atua na organização temporal dos eventos fisiológicos e comportamentais, necessários à adaptação do indivíduo às flutuações temporais cíclicas do meio ambiente, além de ser um órgão importante na manutenção da integridade do SNC, a partir da secreção do hormônio melatonina de atividade antioxidante, antiinflamatória e estimuladora. Desta forma a ausência ou baixa produção deste hormônio acarreta a condições patológicas neurodegenerativas, como a Doença de Parkinson (DP), na qual os neurônios dopaminérgicos sofrem necrose por agentes oxidantes e enzimas proteolíticas e lipolíticas, comprometendo a síntese de dopamina. Características químicas da melatonina A melatonina ou N-acetil-5-metoxitriptamina (Fig.1), é uma molécula classificada como indolamina, um composto orgânico aromático heterocíclico, derivado do aminoácido triptofano e, portanto, não pertence às categorias clássicas de hormônios peptídicos ou esteróides. Os grupos acetil (hidrossolúveis) e metoxi (lipossolúveis) conferem anfifilicidade a melatonina permitindo que ela atinja todos os compartimentos do organismo interagindo com vários sistemas funcionais. Fig.1: Molécula de Melatonina _________________________________________________________________________________ 48 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Os carbonos 2 e 3 do grupo pirrólico (Fig. 2) do grupamento indólico (Fig. 3) conferem a molécula um alto poder redutor, e portanto, uma alta capacidade antioxidante. Fig. 2: Grupo Pirrol Fig. 3: Grupo Indol Papel fisiológico da noradrenalina como indutor da síntese de serotonina Na substância negra da área tegmentar ventral do cérebro, o aminoácido tirosina (Tyr) é hidroxilado a L-3,4-diidroxifenilalanina (L-DOPA) pela tirosina hidroxilase (TH) tendo como co-fator redutor a pteridina, que é regenerada pelo agente redutor NADH. A L-DOPA formada é convertida a dopamina por descarboxilação liberando CO 2 (Fig. 4). A dopamina, liberada pelos neurônios dopaminérgicos da área tegmentar, serve de substrato para a dopamina β-hidroxilase que sintetiza noradrenalina nos neurônios noradrenérgicos (Fig. 5). Esta é secretada pelos neurônios noradrenérgicos e na GP se liga a receptores β adrenérgicos dos pinealócitos, com afinidade e densidade aumentada no momento circadiano de transição dia-noite assim como a síntese de noradrenalina, que é ótima no período de transição dia-noite. Portanto, a neurotransmissão entre neurônios noradrenérgicos e os pinealócitos tem máxima eficiência neste momento do dia. Adrenorreceptores α, também presentes na membrana celular dos pinealócitos, sem variação dentro do ciclo circadiano, potencializam o acúmulo de adenosina monofosfato cíclica (cAMP) induzido pelos receptores β adrenérgicos. Este cAMP induz a atividade da serotonina acetiltransferase (NAT), enzima da via metabólica de síntese da melatonina (Fig. 7). Fig. 4: Síntese de dopamina no neurônio dopaminérgico. Fig. 5: Síntese de noradrenalina no neurônio noradrenérgico. Síntese de melatonina na via acelativa de degradação de serotonina No citossol do pinealócito, o aminoácido triptofano (Trp) inicia a cadeia de síntese de melatonina, sendo hidroxilado em 5-hidroxitriptofano (5-HTP) pela triptofano hidroxilase, dependente de oxigênio (O 2) e de co-fator pteridínico reduzido. 5-HTP é prontamente descarboxilado pela 5-hidroxitriptofano descarboxilase (5-HTPD), reação dependente do co-fator piridoxal fosfato, que remove o grupo αcarboxil terminal do 5-HTP e o transforma em seretonina (5-hidroxitriptamina). A aril-alquilamina N-acetiltransferase (NAT) ou serotonina acetiltransferase, que tem sua expressão gênica e atividade enzimática estimulada pelo acúmulo de cAMP e pelo íon cálcio (Ca 2+ ), catalisa a _________________________________________________________________________________ 49 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ transferência do grupo acetil do acetil-CoA para a serotonina, formando N-acetilserotonina (NAS). O Ca 2+ , que tem sua concentração aumentada pelos adrenorreceptores α, juntamente com diacilglicerol promove a ativação da quinase proteína C (PKC), que potencializa o acúmulo de cAMP pela fosforilação de proteínas G estimuladoras de adenilato ciclase que produzem cAMP. Ainda é possível que a estimulação da síntese de cAMP se dê pela fosforilação do sítio catalítico da adenilato ciclase pela PKC (Fig. 6). O Ca2+ ainda pode ter influência na ativação das enzimas triptofano hidroxilase e HIOMT. O NAS formado é O-metilado pela hidroxindol-O-metiltransferase (HIOMT) resultando na melatonina. Nesta via de metabolização da serotonina, a Via Acelativa, iniciada no início da noite pelo estimulo noradrenérgico, a melatonina sintetizada é secretada nos espaços perivasculares da GP difundindose para os capilares onde entra na circulação, sendo transportada pela albumina (Fig. 7). Fig. 6: Síntese de cAMP induzida pelo acúmulo de cálcio sinalizado pe lo adrenorreceptor α. fig. 7: síntese de melatonina na via acelativa de degradação da serotonina durante a noite. Degradação da melatonina Cerca de 90% da melatonina produzida é metabolizada no fígado, sendo hidroxilada a 6hidroximelatonina, seguida com uma conjugação com sulfato formando 6-sulfatoximelatonina que é excretada na urina. No SNC ou na própria GP, a melatonina pode ser convertida em N-acetil-N-formil5-metoxiquinuramina pela 2,3 indolamina dioxigenase (ou pela mieloperoxidase) que é descarboxilada a N-acetil-5-metoxiquinuramina (AMK) (Fig. 8). _________________________________________________________________________________ 50 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Fig. 8: Degradação da melatonina no fígado. No cérebro, a melatonina pode ainda formar outros produtos metabólicos, como o N-g-acetil-2formilmetoxiquinurenamina que sofre degradação imediata à N-g-acetil-5-metoxiurenamina. Outras vias metabólicas menos importantes são a formação de N-acetil serotonina, e de 2-hidroximelatonina cíclica, ocorrendo em várias células (Fig. 9). Fig. 9: Degradação da melatonina no cérebro. Via desaminativa-oxidativa de degradação da serotonina Durante o dia, ou na ausência de estimulação noradrenérgica, a serotonina dos pinealócitos é desviada, quase exclusivamente, para a Via Desaminativa-Oxidativa, onde sofre ação da monoamina O 2 oxidorredutase (MAO B) sendo transformada em ácido 5-hidroxiindolacetaldeído que sob a ação da aldeído desoxigenase forma ácido 5-hidroxiindolacético, ou sob a ação da álcool desidrogenase forma 5-hidroxitriptofol. Estes dois compostos formados, sob a catálise de HIOMT, formam respectivamente, o ácido 5-metoxiindolacético e 5-metoxitriptofol (Fig. 10). Segundo Millán Plano Sérgio, o 5-metoxitriptofol diminui a oxidação de lipídeos e proteínas de sinaptossomas. Fig. 10: Via desaminativa-oxidativa de degradação da serotonina. A deficiência neural causada pela neurodegeneração compromete as funções motoras do organismo Numa perspectiva patológica, como na DP, a melatonina atua como um importante agente antioxidante. Nesta doença, o envelhecimento, fatores ambientais, estresse oxidativo, inflamação, excitotoxicidade e fatores genéticos, podem estar envolvidos em sua ocorrência, quando os neurônios dopaminérgicos sofrem necrose pela reatividade de agentes oxidantes produzidos pelo metabolismo celular, induzidos por fatores ambientais (p.ex.: pesticidas) ou por patógenos e suas toxinas no processo de neuroinflamação mediado por citocinas. Nesses neurônios dopaminérgicos os agentes oxidantes, alteram a estrutura molecular de proteínas, lipídeos e carboidratos, através de ataque nucleofílico a estas moléculas, tornando-as não funcionais e, portanto levando a morte da célula que não consegue manter suas necessidades metabólicas. A morte dos neurônios dopaminérgicos (Fig. 13) desequilibra a transmissão de estímulo nervoso pela Via Nigroestriada para o Corpo Estriado, que atua no controle da atividade motora somática. Na DP a _________________________________________________________________________________ 51 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ atividade motora somática está comprometida e neste caso tremores surgem como sintoma inicial desta patologia, que também é caracterizada por dificuldades na programação e execução de movimentos, e em estágio mais avançado dificuldade em iniciar movimentos. Da mesma forma, o desempenho das pessoas acometidas por essa enfermidade em tarefas que requerem a realização de movimentos sequenciais e simultâneos é prejudicado. Rigidez muscular e instabilidade postural (incapacidade de manter o equilíbrio durante as tarefas diárias, tais como levantar, andar e curvar-se) também são observadas como sintomas desta patologia. Depressão, distúrbios do sono, fadiga, ansiedade, constipação, distúrbio olfatório e declínio cognitivo também são sintomas que acometem os portadores da DP. Fig. 11: Aspecto neuroanatômico da substância negra na porção ventral do mesencéfalo: A – substância negra normal; B – substância negra despigmentada; C – corte histológico normal; D – corte histológico evidenciando a redução no número de neurônios; E – eosinófilos intracitoplasmáticos. Ação da melatonina contra a necrose celular Para tanto, a melatonina e seus subprodutos metabólicos antioxidantes, são importantes agentes que combatem os radicais livres prejudiciais às células neuronais. Os agentes oxidantes podem atacar o ácido desoxirribonucleotídico mitocondrial (mtDNA) causando mutações que por vezes são vistas em complexos protéicos da cadeia transportadora de elétrons (CTE) e que portanto causa irregularidade na fosforilação oxidativa na membrana interna da mitocôndria. Uma das consequências desta má funcionalidade da CTE é evidente quando o O 2, um forte agente oxidante, não é reduzido no final da CTE pelo complexo IV (que transfere os elétrons no final do transporte para o O 2), estando disponível para outras reações químicas dentro da célula que produzem espécies reativas de oxigênio (ROS). Outro complexo da CTE que tem sua atividade reduzida na substância negra do cérebro observada na DP é o complexo I. Este pode ser estimulado pela melatonina através da regulação positiva de enzimas que produzem agente redutor nas reações que catalisam. A redução na síntese de adenosina trifosfato (ATP) também é outra conseqüência da má funcionalidade da CTE, acarretando na disfunção da atividade da ATPase transmembrana que bombeia Ca2+ para fora do neurônio dopaminérgico. Quanto a excitotoxicidade, a alta concentração de Ca2+ intracelular acarreta a ativação de proteases (destruidoras do citoesqueleto), fosfatases, fosfolipases (atacam membranas celulares), óxido nítrico sintase neural (produzem NRS) e produção de radicais livres. Este aumento na concentração de Ca2+ está relacionado também à liberação excessiva de glutamato, por neurônios glutamatérgicos em desordens neurodegenerativas, que se liga à receptores na membrana plasmática de neurônios 2+ dopaminérgicos e que por sua vez, respondem ao estimulo induzindo a captação de Ca extracelular via canais iônicos (Fig. 12). _________________________________________________________________________________ 52 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Fig. 12: Ação da melatonina na mitocôndria e na regulação de enzimas pró- e antioxidantes. Na neuroinflamação, onde anticorpos e células linfocíticas não participam, o próprio neurônio responde ao invasor, produzindo prostaglandinas e citocinas. As prostaglandinas promovem a quimiotaxia de células gliais liberadoras de agentes oxidantes, aumentam a permeabilidade capilar, ao passo que as citocinas estimulam na resposta inflamatória neural a produção de agentes oxidantes (ROS e espécies reativas de nitrogênio – RNS) que atacam o patógeno ou mesmo toxinas produzidas por ele. Contudo estes agentes oxidantes, por atuarem em componentes biológicos em geral, são neurotóxicos podendo atuar contra os próprios neurônios dopaminérgicos. Neste caso a AMK tem efeito importante como antiinflamatório inibindo a ação enzimática da cicloxigenase-2 (COX-2) que catalisa a oxidação e ciclização do ácido araquidônico até o hidroperóxido prostaglandina G 2 (PGG 2) e a peroxidação do PGG 2 até o hidroperóxido prostaglandina H2 (PGH2). Esta última é quimicamente instável e é rapidamente convertida por sintases específicas em uma série de prostaglandinas (principalmente PGE2). Além do ácido araquidônico, COX-2 pode usar outros ácidos graxos (p.ex.: anandamida) como substratos (Fig.13). Fig. 13: Ação do AMK no processo neuroinflamatório. A melatonina além de ser precursora de antiinflamatórios, estimuladora da CTE e agente antioxidante, ela também causa downregulation de enzimas pró-oxidantes (NO sintase e lipoxigenase) e upregulation de enzimas antioxidantes (glutationa peroxidase, glutationa redutase, glicose 6-fosfato desidrogenase, catalases e Cu-, Zn- e Mn-superóxido dismutases) (fig. 12). Decaimento da síntese de melatonina No decorrer da vida do indivíduo a secreção de melatonina decai com a calcificação da GP, e por isso com o envelhecimento, o organismo está mais vulnerável aos fatores citotóxicos combatidos pela melatonina e que necrosam, no caso da DP, os neurônios dopaminérgicos. _________________________________________________________________________________ 53 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Tratamento da doença de Parkinson com a administração de levodopa Há várias formas de tratamento para a doença de Parkinson, mas a medida mais eficaz consiste em restabelecer, ao menos parcialmente, a transmissão dopaminérgica. O uso de Levodopa é uma das formas de restaurar essa neurotransmissão e, no presente, ainda é a mais efetiva e viável de todas. A Levodopa penetra no sistema nervoso central e, por ação da enzima dopa descarboxilase cerebral, é convertida em dopamina. O surgimento da levodopa revolucionou o tratamento da DP no final da década de 60. A DP tornou-se a primeira doença degenerativa do sistema nervoso a ser tratada com a reposição de neurotransmissores. Apesar do impacto inicial positivo, alguns problemas surgiram com a Levedopa. A intolerância gastrointestinal foi um dos efeitos colaterais mais observados no início e, além disso, alterações psiquiátricas foram notadas em alguns pacientes. Essas complicações tornaram-se mais raras quando os inibitórios de dopa descarboxilase periférica foram incorporados aos comprimidos de levodopa (para impedir a conversão de dopamina na corrente sanguínea). Passado algum tempo, outros problemas surgiram com o tratamento prolongado. Apesar disso e do surgimento de novas alternativas terapêuticas, a levodopa permanece até hoje como a droga mais eficaz no tratamento da DP. REFERÊNCIAS BIBLIOGRÁFICAS CAPITELLI, C. S. Efeito da melatonina em modelo animal de parkinsonismo induzido pelo MPTP. Disponível em: http://dspace.c3sl.ufpr.br/dspace/bitstream/1884/11297/2/Parte%201.pdf. Acesso em: 15 de jun. 2010. CIPOLLA-NETO, J.; AFECHE, S. C. Glândula Pineal. Disponível em: http://www.dfs.uem.br/Joomla/index.php?option=com_phocadownload&view=category&id=4:& download=28:p&Itemid=39 grupo pirrólico. Acesso em: 15 de jun. 2010. FERRAZ, Henrique Ballalai. Tratamento da Doença de Parkinson. In: Revista Neurociências. http://www.unifesp.br/dneuro/neurociencias/Neurociencias%2007-1.pdf. Acesso em: 15 de jun. 2010. KANDEL, E. R.; JAMES, H. S.; JESSEL, T. M. Principles of neural Sciences. 4. ed. McGraw-Hill, 2000. p. 282 – 284. MACHADO, Angelo. Neuroanatomia Funcional. 2. ed. São Paulo: Atheneu, 2009. p. 203. MARKUS, R. P.; AFECHE, S. C.; BARBOSA JR, E. M.; LOTUFO, C. M. da C.; FERREIRA, Z. da S.; CIPOLLA-NETO, J. Glândula Pineal e Melatonina. Disponível em: http://www.crono.icb.usp.br/glandpineal.htm. Acesso em: 15 de jun. 2010. ROSSO, A. L. Z.; NICARETTA, D. H.; DE MATOS, J. P.Correlações Anatomoclínicas na Doença de Parkinson. Disponível em: http://lildbi.bireme.br/lildbi/docsonline/lilacs/20090300/217-LILACSUPLOAD.pdf. Acesso em: 15 de jun. 2010. SERGIO, M. P. Melatonina y otros compuestos pineales como antioxidantes y protectores del daño por radicales libres em sinaptosomas. Disponível em: http://www.cibernetia.com/tesis_es/CIENCIAS_DE_LA_VIDA/FISIOLOGIA_HUMANA/FISIOL OGIA_DEL_SISTEMA_NERVIOSO_CENTRAL/1. Acesso em: 15 de jun. 2010. WOLFRAMALPHA COMPUTATIONAL KNOWLEDGE ENGINE. Disponível em: http://www.wolframalpha.com/input/?i. Acesso em: 15 de jun. 2010. _________________________________________________________________________________ 54 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ BIOQUÍMICA DO MEL: PRODUÇÃO E QUALIFICAÇÃO Ana Laura de A. F. D. Pimentel 1 e Thiago C. Nepomucena1 1 Graduandos em Ciências Biológicas – Bacharelado, Universidade Federal de Ouro Preto. RESUMO Este trabalho teve como finalidade realizar uma revisão sobre a produção do mel, dando ênfase às enzimas relacionadas e a utilização destas na sua qualificação. Inicia-se com a manipulação do néctar pelas abelhas e a adição das enzimas produzidas por suas glândulas hipofaringeanas. Será destacado o metabolismo de três destas enzimas: Invertase, Diastase e Glicose-oxidase. Estas são as mais utilizadas na qualificação do mel comercializado. Palavras-chave: Mel, Invertase, Diastase, Glicose-oxidase, Controle de qualidade INTRODUÇÃO O mel é um produto viscoso, adocicado e de aroma agradável. (Dustmann, J. H.; Am. Bee J. 1993) Sua qualidade nutricional (vitaminas, minerais, valor energético elevado), suas propriedades medicinais (ação antioxidante e anti-séptica relacionada aos compostos fenólicos) e suas propriedades sensoriais têm atraído milhares de consumidores.( Zumlai, A.; Lulat, A.; J. Royal Soc. Med. 1989) O mel é constituído de diferentes açúcares, predominando os monossacarídeos glicose e frutose. Apresenta também quantidades variadas de proteínas, aminoácidos, enzimas, ácidos orgânicos, substâncias minerais, pólen e outras substâncias, sacarose, maltose, malesitose e outros oligossacarídeos (incluindo dextrinas). Além de pequenas concentrações de fungos, algas, leveduras e outras partículas sólidas resultantes do processo de obtenção do mel (CODEX STANDARD FOR HONEY, 2001). (Tabela 1) Tabela 01. Composição do mel Pode ser classificado quanto à sua origem em mel floral ou mel de melato (melato). O mel floral é obtido dos néctares das flores, e ainda pode ser classificado em: mel unifloral ou monofloral (quando o produto procede principalmente da origem de flores de uma mesma família, gênero ou espécie e possua características sensoriais, físico-químicas e microscópicas próprias) ou mel multifloral ou polifloral (obtido a partir de diferentes origens florais). O mel de melato é formado principalmente a partir de secreções de partes vivas das plantas ou de excreções de insetos sugadores de plantas que se encontram sobre elas.(BRASIL, 2000) _________________________________________________________________________________ 55 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Monofloral Mel Floral Mel Mel de Melato (mesma origem floral) Polifloral (diferentes origens florais) ( formado a partir de partes vivas das plantas ou de excreções de insetos) Figura 01. Fluxograma da origem do mel. Quando se trabalha com mel, é comum encontrar variações na sua composição física e química, tendo em vista que variados fatores interferem na sua qualidade, como condições climáticas, estágio de maturação, espécie de abelha, processamento e armazenamento, além do tipo de florada (SILVA et al., 2004). DISCUSSÃO PRODUÇÃO DO MEL A abelha coletora enche sua vesícula melífera de néctar coletado de flores e retorna à colméia. O néctar é diluído pelas secreções de várias glândulas durante o vôo, principalmente as hipofaringeanas, que secretam as enzimas utilizadas na elaboração do mel. (Figuras 2 e 3) Figura 02. Morfologia interna da abelha. _________________________________________________________________________________ 56 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Figura 03. Morfologia interna da abelha. Ao chegar à colméia, a abelha coletora já terá diluído o néctar com sua saliva, sendo que a mesma o retém até encontrar uma abelha caseira que queira aceitar seu alimento. Essas abelhas receptoras manipulam o néctar em suas peças bucais; estendem e retraem suas probóscides, expondo ao ar uma gota diluída de néctar e, em seguida, aspira a gota de volta pra a boca. Ao término do processo, as abelhas caseiras depositam sua carga em um alvéolo da colméia. (Figura 4) Figura 04. Célula ou Alvéolo de deposição do mel, na colméia Em seguida, o conteúdo de água do néctar é diminuído de 55 para 44%, no período de uma hora após sua chegada na colméia, quando então, terá recebido o complemento total de enzimas da abelha. Para que isso ocorra a abelha bate suas asas para aumentar a movimentação do ar e eliminar o excesso de umidade. Considerável parte da umidade do mel em elaboração continua sendo perdida até que seu conteúdo tenha atingido de 17 a 20%, de acordo com a umidade atmosférica e temperatura local. Quando isso ocorre, as abelhas operculam a célula, fechando-a hermeticamente com uma cobertura de cera, prevenindo desta forma, a absorção de água pelo mel, que tem acentuada característica higroscópica e, assim, o risco de fermentação. Durante esta redução no teor de umidade, a abelha introduz a enzima invertase, responsável por alterações químicas que levam a um conteúdo de açúcar mais alto do que poderia ser adquirido sem ação enzimática. _________________________________________________________________________________ 57 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ A diastase, outra enzima secretada pelas glândulas hipofaríngeanas das abelhas, quebram o amido. Contudo, não exerce papel de relevância na produção do mel. A terceira enzima, a glicose-oxidase, reage com a glicose formando gliconolactona e peróxido de hidrogênio, este, capaz de proteger a colméia contra a decomposição bacteriana, até que seu conteúdo de água esteja baixo o suficiente para fazê-lo. ENZIMAS Para a produção do mel algumas enzimas são utilizadas pelas abelhas, como catalase, diastase, invertase, alfa-glicosidase, peroxidase, lipase, fosfatase ácida, inulase e glicose-oxidase. Dentre as quais selecionamos três que são importantes para o controle de qualidade do mel. Invertase A invertase, produzida nas glândulas hipofarigenanas das abelhas, é a responsável pela conversão da sacarose, que é um dissacarídeo presente no néctar, em dois monossacarídeos, glicose e frutose. Nesse processo a invertase hidrolisa a sacarose, formando açúcares redutores, glicose e frutose. (Figura 5) Figura 05. Mecanismo de ação da Invertase Sua ação é contínua até que o amadurecimento total do mel ocorra. Assim pode-se definir o amadurecimento do mel como a inversão da sacarose do néctar pela enzima invertase e sua simultânea mudança de concentração. Glicose-oxidase A Glicose oxidase reage com a glicose e forma o ácido glucônico, que é um importante componente do mel. No processo o peróxido de hidrogênio é um subproduto, ele é responsável pela ação antibacteriana do mel, que é uma de suas propriedades. Na reação dois prótons e elétrons são transferidos de ß-D-glicose à enzima gerando gliconolactonaNa semi-reação oxidativa a enzima é oxidada pelo oxigênio molecular produzindo peróxido de hidrgênio. Por fim a gliconolactona pode ser hidrolisada não enzimaticamente em ácido glucônico. (Figura 6) Figura 06. Mecanismo de ação da Glicose-ox idase. _________________________________________________________________________________ 58 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Diastase A diastase é, na verdade, um grupo de enzimas que hidrolizam o amido conhecidas como amilases. As amilases produzidas pelas abelhas e responsáveis pela produção do mel são a α-amilase e a βamilase. O amido é constituído pelos polímeros de glicose, amilose e amilopectina. A α-amilase digere parcialmente o amido produzindo as dextrinas. Já a β-amilase cliva as extremidades do amido, produzindo a maltose. (Figura 7) Figura 07. Mecanismo de ação da Diastase A α-amilase é uma endoamilase, isto é, rompe as ligações (no caso, α1-4) no interior do substrato. (Figura 8) Possui uma ação aleatória, formando açúcares redutores e sua ação sobre a amilopectina leva à formação de dextrinas de baixa massa molar. Figura 08. Figura 09. Representação esquemática da atividade da alfa-amilose em amilopectina Representação esquemática da ação da beta-amilase em amilopectina A β-amilase hidrolisam unidades do final não redutor do substrato (exoamilases). A enzima hidrolisa as ligações glicosídicas -1,4 do amido a partir de extremidades não redutoras do polímero de glicose. Esta ação resulta na formação de mono e dissacarídeos, os quais aumentam a doçura dos produtos. (Figura 9) A amilose pode ser totalmente convertida em maltose, já na amilopectina, a atividade dessa enzima é interrompida perto dos pontos de ramificação devido à presença das ligações glicosídicas -1,6. A denominação da -amilase se refere ao fato de que existe uma inversão do enlace -1,4 à configuração beta sobre o carbono anomérico. O produto formado não é -maltose, mas sim maltose. QUALIFICAÇÃO DO MEL _________________________________________________________________________________ 59 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ A composição do mel depende, principalmente, das fontes vegetais das quais ele é derivado, mas também do tempo, solo, espécie da abelha, estado fisiológico da colônia, estado de maturação do mel, condições meteorológicas na época da colheita, dentre outros fatores. (Crane, 1983; Pamplona, 1994). Além dos açúcares em solução, o mel também contém ácidos orgânicos, enzimas, vitaminas, flavonóides, minerais e uma extensa variedade de compostos orgânicos, que contribuem para sua cor, odor e sabor. (Vilhena & Almeida-Muradian, 1999). As análises físico-químicas mais utilizadas para o controlo de qualidade do mel são quanto à maturidade (açúcares redutores, umidade, sacarose aparente), pureza (sólidos insolúveis em água, minerais ou cinzas, pólen), e deterioração (acidez livre, atividade diastásica e hidroximetilfurfural HMF). Inclusive são as indicadas pela legislação brasileira para o controle de qualidade do mel puro de Apis.(Tabela 2) Tabela 02. Parâmetros físico-químicos estabelecidos pela Legislação Brasileira e do Mercosul para controle de qualidade do mel de Apis mellifera. Açucares Redutores Os açúcares juntamente com a água são os principais componentes do mel, onde os monossacarídeos frutose e glicose representam 80% e os dissacarídeos sacarose e maltose apenas 10% da quantidade total (WHITE, 1975). Os teores desses diferentes tipos de açúcares podem provocar alterações físicas como viscosidade, densidade, higroscopicidade e cristalização no mel (CAMPOS, 1987). A glicose, por ter pouca solubilidade, determina a tendência da cristalização do mel. A frutose, que normalmente é predominante, é um dos fatores determinantes da doçura do mel e sua alta higroscopicidade. Méis com altas taxas de frutose podem permanecer líquidos por longos períodos ou nunca cristalizar (HORN, 1996). Umidade A umidade no mel é sem dúvida uma das características mais importantes, por influenciar na sua viscosidade, peso específico, maturidade, cristalização e sabor (Seemann & Neira, 1988). Normalmente, o mel maduro tem menos de 18,60% de umidade (Horn et al., 1996), tendo uma grande relação com deterioração, já que quando encontrada acima de um limite máximo (20%) o mel estará sujeito à fermentação (Frías & Hardisson, 1992). Normalmente, o mel maduro tem menos de 18,60% de umidade (Horn et al., 1996), tendo uma grande relação com deterioração, já que quando encontrada acima de um limite máximo (20%) o mel estará sujeito à fermentação (Frías & Hardisson, 1992). _________________________________________________________________________________ 60 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Sacarose A concentração de sacarose constitui um bom critério para diferenciar os méis monoflorais dos poliflorais (CARILLO MAGANA, 1998). O teor elevado deste açúcar significa na maioria das vezes uma colheita prematura do mel, isto é, um produto em que a sacarose ainda não foi totalmente transformada em glicose e frutose pela ação da invertase (AZEREDO et al., 1999). A enzima invertase irá permanecer no mel conservando sua atividade por algum tempo, a menos que seja inativada pelo aquecimento; mesmo assim, o conteúdo da sacarose do mel nunca chega à zero. Essa inversão de sacarose em glicose e frutose produz uma solução mais concentrada de açúcares, aumentando a resistência desse material à deterioração por fermentação e promovendo assim o armazenamento de um alimento altamente energético em um espaço mínimo. Diastase A diastase (α-amilase) é uma das enzimas presentes no mel, formada principalmente pelas glândulas hipofaringeanas das abelhas, sendo encontrada também, em baixa proporção, nos grãos de pólen (Pamplona, 1989). Tem a função de digerir a molécula de amido, sendo muito sensível ao calor, podendo assim indicar o grau de conservação e superaquecimento do produto (WHITE JUNIOR, 1992; WHITE JÚNIOR, 1994). A ausência da mesma reflete procedimentos e/ou adulterações realizadas no mel, tal como uso de temperatura acima de 60ºC durante o beneficiamento, adição de açúcar invertido, condições de armazenamento inadequadas (tempo acima de seis meses e temperaturas elevadas). A atividade diastásica diminui devido à desnaturação parcial ou total das amilases (AROUCHA ET al., 2008). Acidez Os ácidos orgânicos do mel representam menos que 0,5% dos sólidos, tendo um pronunciado efeito no flavor, podendo ser responsáveis, em parte, pela excelente estabilidade do mel em frente a microorganismos. Na literatura, pelo menos 18 ácidos orgânicos do mel já foram citados. Sabe-se que o ácido glucônico está presente em maior quantidade, cuja presença se da devido à atividade da enzima glicose-oxidase que ocorre durante o processo de amadurecimento. Já em menor quantidade, podem-se encontrar outros ácidos como: acético, butírico, lático, oxálico, fórmico, málico, succínico, pirúvico, glicólico, cítrico, butiricolático, tartárico, maléico, piroglutâmico, alfa-cetoglutárico, 2- ou 3fosfoglicérico, alfa- ou beta-glicerofosfato e vínico (Strison et al., 1960; White, 1975; Mendes & Coelho, 1983). Hidroximetilfurfural (HMF) O hidroximetilfurfural (HMF) é formado pela reação de certos açúcares com ácidos, principalmente pela decomposição da frutose. O seu conteúdo pode aumentar com a elevação da temperatura, armazenamento, adição de açúcar invertido, podendo também ser afetado pela acidez, pH, água e minerais no mel. É um indicador de qualidade no mel, visto que, quando em valores elevados representa uma queda no valor nutritivo pela destruição, por meio de aquecimento, de algumas vitaminas e enzimas que são termolábeis. (Figura 10) Figura 10. Estrutura do HMF. CONCLUSÃO A composição de açúcares, enzimas e ácidos do mel e a relação com suas propriedades físicoquimicas são essências para a formação de um produto final qualificado. O entendimento do processo bioquímico de formação do mel a partir do néctar é muito importante para que possamos conhecer os produtos das atividades enzimáticas e relacioná-los com a qualidade do mel. _________________________________________________________________________________ 61 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ REFERÊNCIAS BIBLIOGRÁFICAS AROUCHA E. M. M.; OLIVEIRA A. J. F.; NUNES, G. H. S.; MARACAJÁ P. B.; Qualidade do mel de abelha produzidos pelos Incubados da iagram e comercializado no Município de Mossoró/RN. Caatinga, Mossoró, v.21, n.1, p.211-217, janeiro/março de 2008. Disponível em: <http://caatinga.ufersa.edu.br/index.php/sistema/article/viewFile/629/286>. AZEREDO, M. A. A.; AZEREDO, L. da C.; DAMASCENO,J. G. Características físico-químicas dos méis do município de São Fidélis - RJ. Ciência e Tecnologia de Alimentos, v. 19, n. 1 , p. 3-7, 1999. BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Defesa Animal. Legislações. Legislação por Assunto. Legislação de Produtos Apícolas e Derivados. Instrução Normativa n. 11, de 20 de outubro de 2000. Regulamento técnico de identidade e qualidade do mel. Disponível em: <http://www.agricultura.gov.br/sda/dipoa/in_11_2000.htm> Campos, M.G.R. Contribuição para o estudo do mel, pólen, geleia real e própolis. Boletim da Faculdade de Farmácia de Coimbra, Coimbra, v.11, n.2, p.17-47, 1987. CARILLO MAGANA, F.A. Meliponicultura: el mundo de las abejas nativas de Yucatán. Mérida, México. 1998. Carvalho, C. A. L., Souza, B. A., Sodré, G. S., Marchini, L. C., Alves, R. M. O. Mel de abelhas sem ferrão: contribuição para a caracterização físico-química. Série Meliponicultura, nº4, 1ª Ed. 2005. Dustmann, J. H.; Am. Bee J. 1993, 133, 648. FRÍAS, I.; HARDISSON, A. Estudio de los parámetros analíticos de interés en la miel. II: Azúcares, cenizas y contenido mineral y color. Alimentaria, v.28, n.235, p.41-43. 1992. HORN, H.; alunos da disciplina análise de mel da Universidade de Hoheinheim, Alemanha. Méis brasileiros: resultados de análises físico-químicas e palinológicas. In: CONGRESSO BRASILEIRO DE APICULTURA, 11., Teresina, 1996. Anais. Teresina: Confederação Brasileira de Apicultura, 1996. p.403-429. HUIDOBRO, J. F., SANTANA, F. J., SANCHES, M. P., SANCHO, M. T., MUNIATEGUI, S. & SIMALLOZANO, J. Diastase, invertase and ß-glucosidase activities in fresh honey from north-west Spain. Journal of Apicultural Research, v. 34, n.1, p. 39-44, 1995. MENDES, B. A. & COELHO, E. M. Considerações sobre características de mel de abelhas – Análises e critérios de inspeção. Informe Agropecúario, v.9, n.106, p. 56-67, 1983. Mendes, C., Silva, J., Mesquita, L., & Maracaja, P. 2009 Jul 9. AS ANÁLISES DE MEL: REVISÃO. Revista Caatinga [Online] 22:2. Disponível: http://caatinga.ufersa.edu.br/index.php/sistema/article/view/789/633 Moreira, R. F. A., Maria, C. A. B. Revisão: Glicídios no Mel. Quím. Nova, vol.24, no.4. São Paulo July/Aug. 2001. Nunes, A. G., Faria, A. S., Steinmacher, J.R., Vieira, J. T., Processos enzimáticos e biológicos na panificação. Disponível em: http://www.enq.ufsc.br/labs/probio/disc_eng_bioq/trabalhos_grad/trabalhos_grad_20061/panificacao.doc PAMPLONA, B. C. Exame dos elementos químicos inorgânicos encontrados em méis brasileiros de Apis mellifera e suas relações físico-biológicas. São Paulo, 1989. 131p. Dissertação (Mestrado) - Instituto de Biociências, Universidade de São Paulo. PAMPLONA, B. Qualidade do mel. X Congresso Brasileiro de Apicultura, Rio Quente, GO, p.353-356. 1994. Pereira, F. M., Lopes, M. R., Camargo, R.C., Vilela, S. R. O. Produção do Mel. Embrapa Sistema de Produção, 3. ISSN 1678-8818 Versão Eletrônica. Julho, 2003. Disponível em: http://sistemasdeproducao.cnptia.embrapa.br/FontesHTML/Mel/SPMel _________________________________________________________________________________ 62 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Sánchez, M. P., Huid obro, J. F., Mato ,I., Muniategui, S., Sancho, M. T. Evolution of Invertase Activity in Honey over Two Years. J. Agric. Food Chem., 2001, 49 (1), pp 416–422. SEEMANN, P.; NEIRA, M. Tecnología de la producción apícola. Valdivia: Universidad Austral de Chile, Facultad de Ciencias Agrarias Empaste, 1988. 202p. SILVA, C. L.; QUEIROZ, A. J. M.; FIGUEIREDO, R. M. F. Caracterização físico-química de méis produzidos no Estado do Piauí para diferentes floradas. Rev. Bras. Eng. Agríc. Ambiental, v. 8, n. 2-3, p. 260-265, 2004. SILVA, R. A., MAIA, G. A., SOUSA, P. H. M., COSTA, J. M. C. Composição e Propriedades Terapêuticas do Mel de Abelha. Alim. Nutr., Araraquara, v.17, n.1, p.113-120, jan./mar. 2006. STINSON, E.E., SUBES, M.H., PETTY, J., WHITE, J.W., JR. The composition of honey. V. Separation and identification of the organic acids. Arch. Biochemestry Biophys, 89, 6-12, 1960. VILHENA, F.; ALMEIDA-MURADIAN, L. B. de. Análises físicoquímicas de méis de S.Paulo. Mensagem Doce, n.53, p.17-19. 1999. WHITE, J. W. & KUSHINIR, I. The enzimes of honey: examination by ion-exchange chromatography, gel filtration, and starch-gel electrophoresis. Journal of Apicultural Research, v.6, n.2: 69-89, 1967. WHITE, J.W. Physical characteristics of honey. In: CRANE, E. Honey a comprehensive survey. London: Heinemann, 1975. Cap.6, p.207-239. WHITE JÚNIOR, J. W. Quality evaluation of honey: role of HMF and diastase assays. Part II. American Bee Journal, v.132, n.12, p.792- 794. 1992. WHITE JÚNIOR, J. W. The role of HMF and diastase assays in honey quality evaluation. Bee World, v. 75, n.3, p. 104-107. 1994. WHITE, J.W. Physical characteristics of honey. In: CRANE, E. Honey a comprehensive survey. London: Heinemann, 1975. Cap.6, p.207-39. Zumla i, A.; Lulat, A.; J. Royal Soc. Med. 1989, 83, 384. _________________________________________________________________________________ 63 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ USO DE FEROMÔNIOS DE INSETOS SINTETIZADOS ARTIFICIALMENTE NO CONTROLE BIOLÓGICO DE PRAGAS DA AGRICULTURA Ana C.F. Magalhães¹ e Carlos R.A. Barreto¹ ¹ Bacharelado em Ciências Biológicas UFOP – 4°período RESUMO Este trabalho tem como objetivo demonstrar como feromônios de insetos podem ser sintetizados artificialmente e utilizados no controle de pragas da agricultura. Feromônios são substâncias químicas envolvidas na comunicação intra-específica, ocorrendo principalmente em insetos. Eles são importantes como alternativa para o controle de pragas quando as técnicas químicas e biológicas não são eficazes ou no intuito de reduzi-las. O isolamento de grandes quantidades de feromônios produzidos pelos insetos pode ser difícil e caro. Por isso são estudadas técnicas de síntese artificial dos mesmos. No presente estudo foram demonstradas a transformação de alcoóis em haletos de alquila, a esterificação de alcoóis, a obtenção de alquenos E, a síntese de feromônio da barata (Periplaneta americana) e a síntese do feromônio do besouro Gnathotrichus sulcatus - Sulcatol 7. Todos estes produtos são feromônios eficientes no controle de infestações em plantações. Palavras-chaves: Feromônios; Controle de pragas; Sulcatol 7; haletos de alquila; alquenos E. INTRODUÇÃO Ao longo da escala evolutiva, a transmissão de mensagens olfativas assume a maior importância entre os invertebrados, especialmente nos insetos, os quais dependem desse tipo de comunicação para a sobrevivência da espécie. No entanto, todos os animais e até alguns vegetais utilizam a linguagem química, adicionalmente a outros tipos de sinais, para se comunicarem (PAIVA, 1985). As substâncias envolvidas na linguagem química são chamadas semioquímicos, que significa “sinais químicos”. Os feromônios representam uma subclasse dos semioquímicos, pois são responsáveis somente pela comunicação intra-específica e são classificados conforme sua função; as principais são agregação, repulsão, alarme, sexual e trilha ou orientação. Já as substâncias pertencentes à subclasse dos aleloquímicos são responsáveis pela comunicação entre indivíduos de espécies diferentes e são classificados pelas vantagens e desvantagens que podem causar ao receptor e ou ao emissor (LAW & REGNIER, 1971). Os feromônios são isolados dos insetos em pequenas quantidades, o que torna extremamente laboriosa a determinação de suas estruturas. Daí a importância da síntese orgânica, permitindo a obtenção dos feromônios em quantidades suficientes para efetuar testes biológicos (FERREIRA, 1993) Os feromônios são de grande importância no combate a pragas agrícolas. FEROMÔNIOS Os feromônios fazem parte de um universo bastante amplo de comunicação química, efetuada por meio dos semioquímicos. Assim, os feromônios podem ser classificados de acordo com suas funções em: a) Feromônio de marcação de trilha: as formigas deixam um rastro químico que somente será detectado e entendido por outras formigas da mesma espécie. b) Feromônio de alarme: utilizado principalmente por insetos sociais, tais como formigas, abelhas, cupins, marimbondos etc., serve para avisar outros membros da colônia que um inimigo pode estar se aproximando. O odor característico emitido pelos insetos conhecidos por ‘maria-fedida’ ao serem tocados é um exemplo de feromônio de alarme. _________________________________________________________________________________ 64 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ c) Feromônio de ataque: utilizado normalmente por insetos sociais, serve para avisar os outros insetos de que devem atacar um intruso. d) Feromônio de agregação: empregado quando os insetos encontram uma fonte de comida ou um novo lugar para fazer sua moradia, e assim emitem o feromônio para atrair os demais membros da espécie. e) Feromônio sexual: utilizado para atrair o parceiro para a cópula e assim preservar a espécie, através da procriação. É interessante mencionar que inicialmente os estudos indicavam que apenas as fêmeas emitiam o feromônio, atraindo os machos. Hoje se sabe que em muitos casos é o macho que emite o feromônio, esperando que as fêmeas venham até ele (FERREIRA, ZARBIN, 1998). O primeiro feromônio de inseto foi isolado e identificado em 1959 por um pesquisador alemão chamado Butenandt, tendo sido o resultado de mais de 20 anos de pesquisas. O inseto empregado foi a mariposa do bicho-da-seda Bombyx mori (Figura 1) , e a estrutura química atribuída ao feromônio sexual dessa espécie, conhecida como bombicol (Figura 2). (FERREIRA, ZARBIN, 1998) Figura 1 Figura 2 Do ponto de vista químico, os feromônios são moléculas orgânicas, normalmente hidrofóbicas e voláteis (TEGONI et al., 2004). Estruturalmente, podem ser compostos relativamente simples, como os hidrocarbonetos, ou mais complexos e incluírem grupos funcionais como alcoóis, aldeídos, cetonas, ésteres, éteres, ácidos carboxílicos, aminas, entre outros. Uma vez que a variedade das estruturas químicas dos feromônios é grande, existem métodos variados para sua obtenção (FERREIRA, 1993). A síntese de feromônios ocorre de várias maneiras. Em suma, ocorrem reações em que a estrutura do esqueleto carbônico da molécula de partida permanece inalterada e reações em que o produto obtido tem o esqueleto carbônico diferentes do material de partida. (VILELA, DELLA LUCIA, 2001). SÍNTESES Transformações de alcoóis em haletos de alquila O método mais comum para efetuar tal transformação é o tratamento de alcoóis com os ácidos halogenídricos correspondentes ou a utilização de haletos derivados de fósforo, como tribrometo ou tricloreto de fósforo. Os haletos de alquilas são bons agentes alquilantes e são utilizados quando se deseja aumentar a cadeia carbônica da molécula. Esterificação de alcoóis _________________________________________________________________________________ 65 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Muitos feromônios possuem ésteres carboxílicos na sua composição. Estas substâncias podem ser facilmente preparadas a partir de uma reação de condensação entre o álcool e um ácido carboxílico (e seu derivado) apropriado. O método empregado com mais freqüência é a reação de cloretos de acila com alcoóis em presença de uma base (MARCH, 1985). Nos casos onde o álcool é impedido, ou se deseja diminuir o tempo racional, utiliza-se N,N-dimetilaminopiridina (DMAP) como catalisador. Obtenção de alquenos E Alguns feromônios, como o da Ostrinia nubilalis, são constituídos por uma mistura de substâncias contendo duplas ligações com configuração Z ou E. Existem ainda feromônios, tais como na lagartarosada-do-aldogodeiro, Pectinophora gossypiella, onde uma mesma molécula possui os dois tipos de ligações duplas, sendo a pureza estereoquímica fundamental para a ação biológica. Assim, é de extrema importância o desenvolvimento de métodos sintéticos para a obtenção estereosseletiva de olefinas com a configuração desejada. Os métodos apresentados anteriormente permitem a obtenção seletiva de olefina Z. Para a obtenção do estereoisômero E, utiliza-se a redução de acetilenos com metais alcalinos (principalmente sódio), dissolvidos em amônia liquida –NH3 (MORI, 1995). Síntese do acetato (3E, 5Z)-dodecadienila, um componente feromonal da lagarta-enroladeirada-maçã, Bonagota cranaodes. A lagarta-enroladeira-da-maçã é uma das mais importantes pragas de plantações de maçãs, trazendo sérios prejuízos a agricultores do sul do País. A descoberta deste feromônio foi efetuada em 1996, por meio de um projeto de colaboração cientifica entre brasileiros e suecos (UNELIUS et al. 1996). A síntese dessa substância é mostrada abaixo: a) Reação de olefinação de Horner entre o fosfato e octanaldeído _________________________________________________________________________________ 66 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ b) Desconjugação do dieno utilizando base forte c) Redução da carbonila de éster para álcool d) Acetilação do álcool, levando ao produto desejado. Feromônio da barata (Periplaneta americana) Na primeira tentativa de elucidar a estrutura deste feromônio, por volta de 1960, isolou 12.2mg de uma substância com propriedades de estimulante sexual altamente ativa. Após o estudo espectroscópio extensivo foi atribuída a essa substância uma estrutura derivada do ciclopropano: Um ano mais tarde ocorreu a síntese em laboratório (FERREIRA, 1993): Feromônio do besouro Gnathotrichus sulcatus - Sulcatol 7 Em 1990, o grupo de Ohta realizou a resolução do sulcatol em grande escala utilizando o microrganismo Pichia miso IAM 4682 na redução da sulcatona combinado a enzima PPL aplicada na transesterificação obtendo o (R)-sulcatol com 98% de e.e. Bastos e colaboradores realizaram a síntese do (S)-7 a partir da redução assimétrica da sulcatona, mediada por álcool de-hidrogenase de Thermoanaerobium brockii (TBADH), cuja reação necessita do cofator NADPH para iniciar, como este cofator é muito caro, foram desenvolvidos três metodologias para se regenerar tal cofator. Na primeira utilizou-se o próprio TBADH oxidando o 2-propanol para regenerar o NADH, os outros dois métodos utilizaram outras enzimas, a GDH oxidando a glicose e a G6PDH oxidando a glucose-6-fosfato. A melhor condição foi a que obteve 100% de conversão com 80h de reação. _________________________________________________________________________________ 67 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ IMPORTÂNCIA DOS FEROMÔNIOS O rápido crescimento populacional tornou a questão de suprimento alimentar um grande desafio para os líderes nacionais, especialmente nas regiões da Ásia, África e América do Sul (VILELA et al.2001, ZARBIN et al.1999, FERREIRA et al.2001). Os insetos são considerados nossos maiores competidores no que diz respeito à alimentação. Nesta disputa o homem tem recorrido, principalmente, ao uso de agrotóxicos tradicionais, como compostos organofosforados e clorados. Porém, o alto custo dos inseticidas, riscos de intoxicação durante a aplicação e a possibilidade de ocorrência de partículas residuais nos alimentos, desfavorecem o uso desta prática. A solução para o controle de insetos-pragas está vinculada ao uso de vários métodos compatíveis e racionais (FERNANDES, 2003). Dá-se o nome de Manejo Integrado de Pragas (MIP) à abordagem ampla de controle múltiplo de pragas, utilizando-se de forma simultânea diferentes técnicas de supressão populacional, com o objetivo de manter os insetos numa condição de não pragas, de forma econômica e harmoniosa com o ambiente e não pondo em risco a produção e o lucro do agricultor. Entre os métodos que podem ser usados de forma compatível e racional no MIP, destaca-se o controle comportamental (FERREIRA et al.2001). O controle é geralmente feito através do uso de feromônios, os quais são colocados em septos dentro de armadilhas de campo e podem atuar tanto na coleta massal e monitoramento de pragas, além de atuarem na manipulação de predadores e parasitóides relacionados a estes (VILELA et al.2001). Os feromônios são alternativas no controle de pragas das espécies agrícolas, quando a luta química e biológica se apresenta problemática ou ineficaz. Pode-se prevenir a comunicação entre os insetos e o reconhecimento do seu par sexual por pulverização da atmosfera com feromônios sintéticos. Esta técnica tem vindo a substituir os inseticidas convencionais para o controle de pragas de insetos, pois os feromônios induzem reações comportamentais com a vantagem de não serem toxicas (PHERONET, 2008). A utilização de feromônios sintéticos aplicada segundo o método da captura em massa ou da confusão sexual parece ser uma possibilidade para o controle de pragas. Uma vantagem do método de confusão sexual é a sua compatibilidade com os meios de luta biológicos num programa de Proteção Integrada ou mesmo de Agricultura Biológica (PATANITA, 2008). Um dos melhores exemplos da aplicação de feromônios no Brasil é o caso do besouro Migdolus fryanus, talvez a mais séria praga da cana-de-açúcar do país. As iscas utilizadas, minúsculos pellets contendo apenas um miligrama de feromônio sintético, começaram a ser colocadas nos carreadores dos canaviais de usinas paulistas e paranaenses no início de 1995. Instaladas em armadilhas de plástico (Figura 3), as iscas atraíam os besouros para uma cavidade ligada a um recipiente plástico do qual não conseguiam sair. A coleta de besouros atraídos pelas iscas contidas em quatro mil armadilhas chegou a seis milhões de machos. Figura 3 _________________________________________________________________________________ 68 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ O uso de feromônios para o manejo de pragas agrícolas é uma técnica inovadora que surge para aperfeiçoar de forma racional o controle de insetos em monoculturas. Esta técnica, no entanto, ainda carece de mais informações, principalmente relacionadas aos níveis de controle e dano econômico (FERREIRA et al. 2001). Esquema exemplificando a aplicação de feromônios no controle de pragas REFERÊNCIAS BIBLIOGRÁFICAS Bastos, F. D., Santos, A., G., Jones, J., JR., Oestreicher, E., G., Pinto, G., F., e Paiva, L., M., C. Three Different Coupled Enzymatic Systems For in Situ Regeneration of NADPH. Biotech. Tech., 1999, 13,661. Fernandes, L. Estudos Visando a Síntese de Feromônios de Formigas Através da Reação de Baylis-Hillman. Florianópolis, 2003. Ferreira, J. T. B. A contribuição fundamental da síntese orgânica no estudo de feromônios. 1993, São Carlos, SP. Ferreira, J. T. B.; Corrêa, A. G.; Vieira, P. C. Produtos Naturais no Controle de Insetos. São Carlos, EdUFSCar, 2001, 15-19 e 167-174. Ferreira, J. T. B. & Zarbin, P. H.G. A comunicação química entre os insetos. Amor ao primeiro odor – Química e Sociedade. 1998 Law J. H.,e Regnier F. E., Pheromones, Annual Review Of Biochemistry. 1971, March, J. Advanced Organic Chemistry. 3ed. New York Mori, K. 1995. Enantioselective synthesis in natural products chemistry – a personal account. J. Synth. Org. Chem. 53:952-962 Paiva, M. R.; Pedrosa-Macedo, J. N. Feromonas de insetos. Curitiba: FUFPR, 1985. 84p. Patanita, M. (2008). Métodos Sustentáveis no Combate as Principais Pragas da Nogueira. [Em linha]. Disponível em <http://www.esab.ipbeja.pt/sbpp/posters/ip_metodos_sustentaveis_combate_principais_praga s_nogueira.pdf> Acesso em 29-06-2010. Pheronet. [Em linha]. Disponível em <http://phero.net/> Acesso em 29-06-2010. Sugai, T., Ohta, H. Preparation of Chiral Compound Using Enzymes. Biochemical Preparation of (R)-sulcatol. Agric.Bio. Chem. 1990, 54, 1577. Tegoni, M., Campanacci, V. e Cambillau, C., (2004). Structural Aspects of Sexual Attraction, and Chemical Communication in Insects. Trends in Biochemical Sci., 5, May, pp. 257-264. Unelius, C. R.; A. Eiras. B. Witzgall; A. Kovaleski; E.F. Vilela & A.K. Borg-Karlson. Identification and synthesis of sex pheromone of Phtheocroa cranaodes (Lepidoptera. Tortricidae). Tetrahedron Lett, 37:1505. Vilela, E. F.; Della Lucia, T. M. C. Feromônios de Insetos, 2ª edição, Editora Holos, Ribeirão Preto, 2001, 1-206. Zarbin, P. H. G.; Ferreira, J. T. B.; Leal, W. S. Química Nova 1999, 22, 263-268. _________________________________________________________________________________ 69 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ PRODUÇÃO DE HERBICIDAS NATURAIS A PARTIR DE PLANTAS ALELOPÁTICAS Iuri S. Martins e Lorena M. Dias. Graduandos em Ciências Biológicas – Universidade Federal de Ouro Preto – UFOP RESUMO A alelopatia é definida como todo efeito, direto ou indireto, que uma planta exerce sobre outra, pela produção de compostos químicos liberados no ambiente, denominados de aleloquímicos. Esses aleloquímicos atuam de diferentes maneiras, mais em especial atuam na inibição da germinação e no crescimento de plantas seja essas da mesma ou de diferentes espécies. Aleloquímicos são compostos secundários produzidos nos tecidos vegetais de diferentes formas. Esses aleloquímicos estão contidos em todos os tecidos das plantas como: folhas, flores, frutos, raízes, rizomas, caules e sementes e variam em quantidade e qualidade dependendo da espécie de planta estudada. Hoje há poucos trabalhos acerca da atuação dessas substâncias e sua posterior ação como herbicida natural. O artigo tem como objetivo incentivar o estudo desses aleloquímicos para a produção de herbicidas naturais, uma vez que essas substâncias causam menor impacto no meio ambiente além de combater a resistência e a evolução de plantas daninhas. Com a produção de novas substâncias que atuam em sítios diferentes das plantas daninhas haverá uma maior eficiência para seu combate, já que os herbicidas sintéticos apresentam grande tempo de uso. Isso possibilitou a seleção de plantas daninhas com resistências a essas substâncias. A agricultura será uma das mais beneficiadas pela utilização desses compostos como herbicidas naturais, pois possibilitara uma maior eficiência do uso de herbicidas. Palavras- chaves: Aleloquímicos, herbicidas, compostos secundários, alelopatia, plantas daninhas. INTRODUÇÃO O termo alelopatia deriva do grego allelon, mútuo, e pathos, prejuízo. O termo alelopatia é definido como todo efeito, direto ou indireto, que uma planta exerce sobre outra, pela produção de compostos químicos liberados no ambiente, denominados de aleloquímicos (Rice, 1984). Muitos autores consideram alelopatia e competição o mesmo processo, porém segundo Ferreira et AL (2000) consideram que o efeito alelopático dependeria da liberação pela planta de um composto químico no ambiente, enquanto que a competição envolveria remoção ou redução de um fator ambiental, tal como água, minerais, luz, etc. . Os aleloquímicos são, em geral, ácidos graxos de cadeia curta, óleos essenciais, diterpenos, alcalóides, esteróides, compostos fenólicos: flavonóides, naftoquinonas, antraquinonas e derivados de cumarinas (Rodrigues, 2008). Aleloquímicos são compostos secundários produzidos nos tecidos vegetais, segundo Taiz e Zeiger (1991) os produtos secundários de plantas podem ser divididos dentro de três grupos de acordo com sua biossíntese: compostos terpenos, fenólicose compostos contendo nitrogênio. A figura abaixo mostra as principais rotas da biossíntese dos produtos secundários e sua relação com o metabolismo primário. Fonte: (Fidelis, 2003). _________________________________________________________________________________ 70 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Figura 1 - Mostra as principais rotas da biossíntese dos produtos secundários e sua relação com o metabolismo primário Os produtos secundários diferem dos metabólitos primários por terem distribuição restrita no reino vegetal, uma característica particular dos produtos secundários é que eles são tipicamente encontrados em apenas uma espécie de planta ou em grupo taxonomicamente, enquanto os metabólitos primários básicos são encontrados em todo o reino vegetal (Taiz e Zeiger, 1991). As plantas alelopaticas podem produzir substâncias químicas no ambiente que inibe a germinação e o crescimento de outras plantas da mesma espécie (Rodrigues, 2008). Esse tipo de alelopatia chamada de auto-alelopatia produz grandes prejuízos para a agricultura, uma vez que impende o crescimento de espécies utilizadas nas monoculturas. Estudos demonstram que diversas espécies, além das cultivadas presentes em agroecossistemas, podem exercer influência alelopáticas sobre culturas, consequentemente afetando sua germinação e crescimento. Algumas espécies cultivadas foram observadas que seus resíduos podem controlar ou até mesmo suprimir a emergência e crescimento vegetativo de algumas espécies de plantas daninhas (Rodrigues, 2008). A maioria dos aleloquímicos age produzindo mudanças nas funções fisiológicas das plantas como respiração, fotossíntese e absorção de íons resultando em alterações visíveis na germinação e no desenvolvimento das plantas (Rodrigues, 2008). Os aleloquímicos podem agir de diversas maneiras, como sobre algumas espécies vegetais que suprimem o alongamento da radícula pelo dano oxidativo causado pelas espécies reativas de oxigênio. Outros atuam no crescimento e na germinação como agente citostático, retardando a germinação e que pode induzir estresse oxidativo nas raízes das plântulas (Rodrigues, 2008). Os aleloquímicos estão presentes em todos os tecidos da plantas incluindo folhas, flores, frutos, raízes, rizomas, caules e sementes e variam em quantidade e qualidade (Silva, 2009). Esses compostos podem ser liberados por lixiviação a partir dos tecidos, volatilização, exsudação pelas raízes e decomposição de resíduos da planta (Silva, 2009). Uma das principais vantagens das substâncias alelopáticas é que elas são parcial ou totalmente solúveis em água e ativas em baixas concentrações. Os efeitos de promoção e germinação e do crescimento vegetal também são de grande interesse para a agricultura (Silva, 2009). Os aleloquímicos podem ser utilizados como ferramentas para a produção agrícola, já que são comuns nos vegetais, tóxicos para as plantas, potencialmente efetivos, seletivos e muitas vezes, ambientalmente seguros. Com isso pode-se produzir herbicidas com vantagens ecológicas conhecendo-se a estrutura química dos componentes ativos envolvidos. Algumas práticas agrícolas e rotação de culturas podem ser manejadas para minimizar perdas na produtividade provocadas por alelopatia e para o controle de plantas daninhas (Rodrigues, 2008). Atualmente, o potencial alelopático de várias plantas é considerado importante componente na estratégia de controle alternativo para reduzir o intensivo uso de herbicidas sintéticos em culturas, que pode acarretar problemas ambientais e de saúde (Rodrigues, 2008). As milhares de substâncias do metabolismo secundário de plantas fornecem uma diversidade de estruturas químicas que podem ser usadas tanto no estado natural como na forma modificada como herbicidas (Silva, 2009). O uso de produtos naturais de plantas como herbicidas é grande seja pelo _________________________________________________________________________________ 71 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ uso direto ou como base para a síntese de novas moléculas herbicidas, uma vez que, embora o método de controle químico seja prático, possui uma serie de limitações. O uso de herbicidas sintéticos, algumas vezes, leva a poluição ambiental além de causar efeitos inerentes, como resistência, entre outros (Rodrigues, 2008). A produção de novos herbicidas naturais são altamente desejáveis para combater a evolução de resistência em plantas daninhas, já que os herbicidas sintéticos tem número limitado de sítios alvo (Silva, 2009). Esse artigo tem como objetivo incentivar o maior estudo desses metabólitos secundários, uma vez que o uso de herbicidas sintéticos tem-se tornado um problema tanto para o ambiente como na seleção de plantas daninhas mais resistentes. A seleção dessas plantas daninhas se dá pelo uso contínuo de herbicidas, a produção de herbicidas naturais com sítios de atuação diferentes eliminaria esse problema. A maioria dos herbicidas sintéticos também apresenta pequena eficiência, já que são utilizados há muitos anos. Por isso o melhor estudo desses compostos poderá levar a descobertas muito importantes para a agricultura e para o meio ambiente. Com isso propomos a produção de herbicidas naturais a partir de plantas alelópaticas, uma vez esses compostos permanecem em menor tempo no ambiente além de apresentarem novos sítios de atuação que terão maior sucesso no controle de plantas daninhas. Tecidos da planta: folhas, flores, frutos, raízes, rizomas, caules e sementes. Metabolismo secundário Aleloquímicos Aumento do vacúolo Inibição do crescimento e germinação Liberação do meio externo REFERÊNCIAS BIBLIOGRÁFICAS Andrade, A. de Bastos (2006); Inibição do crescimento de raízes de soja pela mimosina: lignificação e enzimas relacionadas. Dissertação de mestrado, Universidade Estadual de Maringá. Ferreira, A. G.; ÀQUILA, M.E.A. ALELOPATIA: UMA ÁREA EMERGENTE DA ECOFISIOLOGIA. R. BRAS. FIS.VEG.,V.12 (EDIÇÃO ESPECIAL) .p175-204;2000 Fidelis, I. (2003); Crescimento Armazenamento, Homeopatia, Produção de Metabólitos Secundários e Teste Biológico do Extrato de Sphagneticola trilobata (L.) Pruski em Coelhos Diabéticos. Tese de mestrado. Universidade Federal de Viçosa. Filho, A. P. da s. Souza; ALELOPATIA E AS PLANTAS DANINHAS DA AMAZÔNIA. Rice, E. L. ALLELOPATHY. Orlando:Academic Press, 1984.422p Rodrigues, I. M. da C. (2008); Histoquímica e Prospecção de Compostos Produzidos por Senna alata (L.) Roxb. Com Potencial Atividade Alelopática. Dissertação de mestrado. Universidade Federal de Viçosa. Silva, C. B. da (2009); AVALIAÇÃO DO POTENCIAL DE ATIVIDADE ALELOPÁTICA DA PARTE AÉREA E SUBTERRÂNEA DE Hydrocotyle bonariensis LAM. (ARALIACEAE). Dissertação de mestrado, Fundação Universidade Federal de Mato Grosso do Sul. Soares et al(2002); POTENCIAL ALELOPÁTICO DO EXTRATO AQUOSO DE FOLHAS DE ALGUMAS LEGUMINOSAS ARBÓREAS BRASILEIRAS. V. 9, n.1, p.119 - 126, jan./dez. Taiz, L. ; Zeiger, E. Plant Fhysiology. Califórnia: The Benjamin, Cumming Pub lishing Company.1991.565p. _________________________________________________________________________________ 72 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ ASPECTOS FARMACOLÓGICOS DA HIPERTENSÃO: Uso do Captopril Barbara S. Passos e Lorena R. Vieira Graduandas do curso de Ciências Biológicas da Universidade Federal de Ouro Preto RESUMO A prevalência estimada de hipertensão no Brasil atualmente é de 35% da população acima de 40 anos. Isso representa em números absolutos um total de 17 milhões de portadores da doença, segundo estimativa de 2004 do Instituto Brasileiro de Geografia Estatística (IBGE) (1). A Hipertensão é uma doença que não tem cura, mas com a descoberta da bradicinina e de peptídeos potenciadores de bradicinina provenientes do veneno de jararaca (Bothrops jararaca) foi possível o desenvolvimento de medicamentos, entre eles o captopril, que permitiu o controle de tensão arterial em pacientes hipertensos. Pesquisa esta desencadeada por pesquisadores brasileiros. Palavras- Chave: Hipertensão, bradicinina, captopril, angiotensina II, aldosterona, Enzima Conversora de Angiotensina (ECA) e Inibidor da Enzima Conversora de Angiotensina (ECA). INTRODUÇÃO A hipertensão arterial continua sendo um dos mais importantes fatores de risco para doença cardiovascular e pode ser entendida como uma síndrome multifatorial, na qual interações complexas entre fatores genéticos e ambientais causam elevação sustentada da pressão arterial. Em aproximadamente 90% a 95% dos casos não existe etiologia conhecida ou cura, sendo o controle da pressão arterial obtido por meio de mudanças do estilo de vida e tratamento farmacológico(2-3). Um dos mecanismos de controle da hipertensão é por meio de fármacos do tipo peptídeos potenciadores da bradicinina, o BPP9a, que são mais efetivo e tem efeito mais duradouro no controle da hipertensão humana, tanto para a potenciação da bradicinina como para a inibição da conversão da angiotensina I(4). A nomenclatura peptídeos potenciadores da bradicinina originários do veneno da Bothrops jararaca foi substituído por peptídeos inibidores da enzima conversora da angiotensina. O BPP9a é inviável do ponto de vista clínico, pois não é oralmente ativo e sua síntese, muito cara, o que motivou o desenvolvimento de um inibidor não-peptídico da enzima conversora da angiotensina I(5). O captopril foi sintetizado pela adição de uma prolina de um radical quelador de metais(6), e é tido como um fármaco do tipo Inibidor da Enzima Conversora da Angiotensina I (IECA I), e atua no Sistema renina-angiotensina–aldosterona, inibindo a conversão da angiotensina I(AI) em angiotensina II (AII). O sistema Renina-Angiotensina-Aldosterona (SRAA) desempenha importante função na regulação da pressão arterial e na manutenção do equilíbrio hidroeletrolítico. A AII atua como principal mediador do sistema e a hiperatividade do mesmo têm sido relacionadas com o desenvolvimento da hipertensão, além de outras formas de doenças cardiovasculares e renais(7). O SRAA funciona da seguinte forma: o fígado produz angiotensinogênio, uma glicoproteína, que é hidrolisada pela renina, uma aspartil protease que é secretada pelos rins quando há redução da carga de sódio na mácula densa, e produz a AI. O epitélio dos pulmões libera a Enzima Conversora de Angiotensina I (ECA I), que é responsável pela exclusão de dois aminoácidos da porção carboxi terminal da AI, e convertê-la AII. A AII por sua vez estimula a liberação de aldosterona pelo córtex da glândula adrenal (rim), que promove a reabsorção de sódio nos túbulos distais dos rins, resultando em secreção de potássio juntamente com retenção de sódio e água, controlando o volume de sangue circulante. Além disso, a AII é responsável pela vasoconstrição, influenciando o aumento da pressão sanguínea e a filtração glomerular, pois possui um feedback negativo com a renina(8).(Fig. 1) Pacientes hipertensivos exibem um defeito na qual a secreção de renina não diminui em resposta a retenção de água e sal. Os IECA I inibem a formação de AII, pois o grupamento sulfidrila (captopril) que se liga ao átomo de zinco da ECA I, desta forma, inativando-a por uma inibição enzimática reversível. _________________________________________________________________________________ 73 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Os IECAs também inibem a degradação da bradicinina, um mensageiro não peptídico produzido enzimaticamente no sangue a partir da calidina, e um potente agente de dilatação arteriolar e de aumento da permeabilidade capilar. Com isso, pacientes hipertensos têm a pressão arterial controlada pelo captopril, que é um IECA, pois ele além de inibir a formação de AII, potencializa a bradicinina que é responsável pela vasodilatação (Fig. 1). Figura 1 REFERÊNCIAS BIBLIOGRÁFICAS Site do Ministério da Saúde: http://portal.saude.gov.br/portal/saude/visualizar_texto.cfm?idtxt=23616&janela=1 Williams RR, Hunt SC, Hopkins PN, Hasstedt SJ, Wu LL, Lalouel JM. Tabulations and expectations regarding the genetics of human hypertension. Kidney Int 1994;44(suppl):S57-S64. Harrap SB, Clark SA, Fraser R, Towrie A, Brown AJ, Lever AF. Effects of sodium intake and aldosterone on the renal pressure natriuresis. Am J Physiol 1988;254:F697-F703. Greene LJ, Camargo ACM, Krieger EM, et al. Inhibition of the conversion of angiotensin I to II and potentiation of bradykinin by small peptides present in Bothrops jararaca venom. Circ Res 1972;30(suppl 2):62-71. Ferreira SH. et al. Aapectos Históricos da Hipertensão Do fator de potenciação da bradicinina (BPF) aos inibidores da ECA. 1998; 2 Cushman DW, Cheung HS, Sabo EF et al. Design of potent competitive inhibitors of angiotensinconverting enzyme carboxyalkanoyl and mercaptoalkanoyl amino acids. Biochemistry 1977;16:5484-91. Ribeiro JM, Florêncio LP, et al. Bloqueio farmacológico do sistema reninaangiotensina- aldosterona: inibição da enzima de conversão e antagonismo do receptor AT1. 2000;1 Laragh, J. H. e H. C. Stoerk. A study of the mechanism of secretion of the sodiumretaining hormone (aldosterone). J Clin Invest, v.36, n.3, Mar, p.383-92. 1957. http://www.portaleducacao.com.br/farmacia/artigos/72/inibidores-da-enzima-conversora-daangiotensina-ieca http://www.bv.fapesp.br/projetos-regulares/2984/enzima-conversora-angiotensina-fluidos-biologicostecidos/ _________________________________________________________________________________ 74 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ ALERTA: O QUE A CAFEÍNA TEM, JÁ QUE O MUNDO NÃO VIVE SEM! Carolina F. De Angelis1 e Geysa C. Mendes Silva2 Graduandas em licenciatura do curso de Ciências Biológicas da Universidade Federal de Ouro Preto, no ano de 2010. RESUMO A cafeína (1, 3, 7 trimetilxantina) é uma substância branca, cristalina, de sabor muito amargo, sendo considerada a mais popular dentre as substâncias viciantes que existem, é encontrado no café, chá preto, chá mate, bebidas a base de cola, guaraná, chocolate e alguns medicamentos. A cafeína, ao ser absorvida no intestino delgado cai na corrente sanguínea e é distribuída para os órgãos. Ela acelera os batimentos cardíacos, estimula o cérebro, aumenta o fluxo urinário, a produção de ácidos digestivos, relaxa os músculos lisos e os que controlam os vasos sanguíneos e as vias respiratórias. Ao atuar sobre os receptores do hormônio adenosina (sintetizada no sistema nervoso central e nervos periféricos), exerce uma ação inibidora deste, impedindo que ele haja como redutor da freqüência cardíaca, da pressão sangüínea e da temperatura corporal. Por outro lado, a cafeína exerce um efeito sobre a descarga das células nervosas com a liberação de neurotransmissores e de alguns hormônios tais como a adrenalina. Age sobre a enzima lipase, que catalisa a mobilização dos depósitos de gordura para utilizá-la como fonte de energia no lugar do glicogênio muscular. Esse efeito de poupar o glicogênio torna o corpo mais resistente à fadiga. Uma xícara de café pode produzir em poucos minutos, um aumento da acuidade mental e sensorial, além de elevar o nível de energia, tornando a pessoa mais alerta e proporcionando bem estar. A cafeína é metabolizada no fígado onde acontece a remoção dos grupos metila, o que leva a formação de três grupos metilxantina: paraxantina, treobonina e teofilina que vão originar como produtos finais os vários ácidos úricos. Uma pequena parcela da cafeína é eliminada na urina sem ser absorvida. Estudos com a cafeína revelam seus benefícios quando ingerida em concentrações moderadas e também seus efeitos tóxicos em concentrações excessivas. Palavras-chave: adenosina, cafeína, SNC, lipólise, metilxantina. INTRODUÇÃO A cafeína é uma substância presente em bebidas e alimentos e vem sendo consumida pelo homem há milhares de anos. O chá é cultivado e consumido na China desde 350 d.C. e o cultivo do café se alastrou da Etiópia para a Arábia no século XV, tornando-se popular nos países de cultura árabe a partir do século XVI. No século XVII o consumo de café se alastrou por toda Europa. Na Inglaterra, o consumo de chá foi trocado pelo café, se tornando uma bebida de preferência. Como a cafeína hoje está presente nas composições de várias bebidas energéticas e em alimentos, passou a ser considerada como a substância viciante mais consumida em todo o mundo. Cafeína: metabolismo A cafeína (1,3,7-trimetilxantina) é um alcalóide formado molecularmente por nitrogênio, carbono, oxigênio e hidrogênio, é um composto de ocorrência natural, uma xantina. Considerada hoje como a substância psicoativa mais consumida em todo o mundo, por pessoas de todas as idades, independente do sexo e da localização geográfica. O consumo mundial de cafeína é estimado em mais de 120.000 toneladas por ano, como mostra a pesquisa realizada pelo departamento de medicina da UFMG: “Cerca de 80% da população geral faz uso dessa substância diariamente, seja pelo consumo de café, chá, chocolates, refrigerantes ou medicamentos à base de cafeína. O café é a fonte mais rica em cafeína. Após a ingestão oral, a cafeína é rapidamente eliminada com meia-vida de quatro a seis horas”. _________________________________________________________________________________ 75 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ 1,3,7-trimetilxantina A quantidade de cafeína em café é dependente de uma série de fatores como a variedade da planta, método de cultivo, condições de crescimento, além de aspectos genéticos e sazonais. No caso da bebida, por exemplo, além da quantidade de pó, influenciam também o tipo do produto (torrado ou instantâneo, descafeínado ou regular) e o processo utilizado no seu preparo. Após a absorção no intestino delgado, a cafeína é metabolizada pelo fígado, onde acontece a remoção dos grupos metila, através da ação do citocromo P450 1A2, o que leva a formação de três grupos metilxantina: 84% paraxantina, 12% treobonina e 4% teofilina, todos metabolicamente ativos. O cérebro e os rins desempenham uma importante função ao sintetizarem o citocromo P450 1A2. Parte da cafeína é eliminada sem ser absorvida. O metabolismo da cafeína leva também à formação de vários intermediários do ácido úrico, alguns autores apontam que esses intermediários estão ligados com a formação do ácido e outros autores sugerem nenhuma formação, como citado na bibliografia de Goodman e Gilman: "... levando os principais metabólicos urinarios, 1-metilxantina, ácido 1-metilúrico e um derivado uracil acetilado. A principal via de metabolização da teofilina envolve oito hidroxilação, resultando na excreção de acido1, 3dimetilurico, não há evidencias que as metilxantinas sejam convertidas a acido úrico”. Efeitos no organismo A cafeína atua sobre os receptores de adenosina, situados nas células nervosas, exercendo uma ação inibidora, impedindo que este receptor haja como redutor da freqüência cardíaca, da pressão sangüínea e da temperatura corporal. A adenosina é um constituinte celular presente em todo o corpo, regulado principalmente pelo metabolismo da Adenosina Tri-fosfato (ATP) e outros nucleotídeos adenina. Os efeitos fisiológicos advindos do bloqueio destes receptores são: liberação de catecolaminas que influencia a taquicardia, aumento da lipólise, aumento da secreção gástrica, diurese e ativação do sistema nervoso com a liberação de adrenalina e neurotransmissores. A presença da cafeína nas fibras musculares estimula a liberação de cálcio pelo retículo sarcoplasmático, prolongando a duração do período ativo da contração muscular, além de inibir o mecanismo de recaptação, tornando o íon Ca+ mais disponível para a contração. A cafeína também aumenta a força de contração muscular, pois na presença da cafeína ocorre diminuição do limiar de excitabilidade das fibras musculares. “A nível metabólico, os investigadores acreditam que a cafeína é um antagonista da adenosina e, ao contrário do efeito sedante, provocam um efeito estimulador e, posteriormente podem reverter o efeito sedante provocado pela adenosina. Outra possibilidade relatada em estudos é a possibilidade de as metilxantinas (p.ex. cafeína) ativarem a libertação de dois aminoácidos excitatórios (glutamato e aspartato) que desempenham um papel fundamental como principais neurotransmissores estimuladores do cérebro”. (Michel Silva) A relação entre o consumo de cafeína e o possível desenvolvimento de algumas doenças como: osteoporose e problemas cardíacos devido ao aumento da pressão arterial, tem despertado há muito tempo o interesse de cientistas. Apesar de não existirem evidências de que a ingestão de cafeína em doses moderadas (~300 mg/dia) sejam prejudiciais à saúde de um indivíduo normal, esta substância vem sendo continuamente estudada. Segundo estudos da UFMG: "... a cafeína, em doses moderadas, produz ótimo rendimento físico e intelectual, aumento da capacidade de concentração e diminuição do tempo de reação aos estímulos sensoriais. Por outro lado, doses elevadas podem causar sinais perceptíveis de confusão mental e indução de erros em tarefas intelectuais, ansiedade, nervosismo, tremores musculares, taquicardia”. _________________________________________________________________________________ 76 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Terapia para a asma: A cafeína atua como vasodilatador e inibe a secreção de mastócitos causador da inflamação dos brônquios, alguns medicamentos para tratamento de asma são a base de cafeína, revelado na bibliografia de Goodman e Gilman: "... propriedades farmacológicas e os usos terapêuticos das metilxantinas como a gente útil na terapia contra a asma”. Essa substância pode ser encontrada em mais de sessenta espécies vegetais e, assim como para muitos alcalóides, seu papel fisiológico ainda é desconhecido. Como a cafeína age como pesticida, mas é um produto natural classificado como um potencial agente tóxico de característica ambientalmente aceitável, para controle de pragas em culturas alimentares, protegendo assim os vegetais. “Entre as várias propostas apresentadas, duas têm merecido maior atenção: que alcalóides têm efeito alelopático e que atuam como agentes protetores contra a predação por herbívoros”. (Robinson, 1968, 1974; Waller & Nowacki, 1978). CONCLUSÃO O consumo da cafeína já se faz presente há muitos anos no cotidiano das pessoas, dessa forma concluímos que o consumo não excessivo desta substância analisando fatores como a dieta, idade e outros esta não oferece riscos á saúde. REFERENCIAS BIBLIOGRÁFICAS Pesquisa realizada pelo Departamento de Medicina da UFMG. Avaliação do efeito da cafeína no teste vestibular Disponível em: http://www.scielo.br/pdf/%0D/rboto/v71n6/a12v71n6.pdf Revista brasileira de otorrinolaringologia 71 (6) Parte 1. Nov-Dez 2005. Por Lilian Felipe, Lilia Correia Simões, Denise Utsch Gonçalves, Patrícia Cotta Mancini. Michel Santos Silva. Os efeitos da cafeína relacionados à atividade física: uma revisão. Disponível em: http://www.efdeportes.com/efd66/cafeina.htm Marleny D. A. SALDAÑA, Paulo MAZZAFERA, Rahoma S. MOHAMED. Extração dos alcalóides: cafeína e trigomelina dos grãos de café com C supercrítico. Disponível em: http://www.scielo.br/scielo.php?pid=S0101-20611997000400005&script=sci_arttext&tlng=en Disponível em: Goodman & Gilman: As Bases Farmacológicas da Terapêutica. 8ª edição. Rio de Janeiro: Editora Guanabara e Koogan, 1991. Disponível em: http://www.lume.ufrgs.br/bitstream/handle/10183/16278/000699179.pdf?sequence=1 . Disponível em: http://www.cafeesaude.com.br/cafeesaude/obesidade.htm. _________________________________________________________________________________ 77 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ VÍCIO QUE GERA PRAZER? UMA RELAÇÃO ENTRE DOPAMINA E COCAÍNA Ana Cláudia A. Carneiro 1 e Márcia Regina F. Luzia 2 Graduandas do curso de Licenciatura em Ciências Biológicas pela Universidade Federal de Ouro Preto no ano de 2010. RESUMO A dopamina constitui 80% do conteúdo catecolaminérgico do cérebro e as projeções que partem das áreas cerebrais onde ela é sintetizada dão origem a quatro vias axonais distintas: nigroestriada, mesolímbica, mesocortical e tuberofundibular, sendo que a via nigroestriada está diretamente relacionada á doença de Parkinson. Quimicamente a estrutura da dopamina é caracterizada por um anel aromático ligada a duas hidroxilas e uma cadeia carbônica linear com um radical amina na ponta da cadeia. Esse neurotransmissor é sintetizado no cérebro através da ativação da enzima tirosina hidroxilase (TH) que converte o aminoácido tirosina em L-DOPA, que por sua vez, é descarboxilado para formar a dopamina. Assim, a taxa de síntese de dopamina é modulada pela atividade da TH e pode ser atenuada pela ativação dos auto-receptores, ou seja, dos receptores localizados na célula pré-sináptica, onde estão localizados os sítios transportadores de dopamina. Os pesquisadores descobriram que a cocaína ocupa ou bloqueia os "sítios transportadores de dopamina" nas células cerebrais. Os "sítios transportadores de dopamina" levam esse neurotransmissor de volta para dentro de certos neurônios, após ela ter dado uma "passeada" pelo cérebro promovendo seus efeitos. Se a cocaína ocupar o mecanismo de transporte da dopamina, esta substância fica "solta" no cérebro até que a cocaína saia, e é justamente a presença anormalmente longa dela no cérebro é que causa os efeitos eufóricos associados com o uso da cocaína. A dopamina possui várias funções terapêuticas no que diz respeito ao tratamento de insuficiência renal aguda, ao choque cardiogênico e a insuficiência renal aguda. Na periferia, a dopamina é sintetizada nas células epiteliais do túbulo proximal e acredita-se que exerça efeitos diuréticos e natriuréticos locais.A infusão de doses baixas de dopamina aumenta a taxa de filtração glomerular, o fluxo sanguíneo renal a excreção de sódio. A relação dopamina e cocaína levou a vários estudos principalmente estudos recentes que levam uma abordagem clinica e terapêutica de cunho cientifico,que vai nos ajudar a esclarecer se o vício gera prazer ou se o prazer que vicia. Palavras-chave: Dopamina; Cocaína; Sistema Nervoso Central; Receptor; Tirosina Hidroxilase. INTRODUÇÃO Na década de 1960 a dopamina foi estudada como potencial do sistema nervoso central, embora os estudos histoquímicos, bioquímicos e farmacológicos tenham produzidos resultados compatíveis com o papel dessa substância como neurotransmissor,pois nem todos os pré-requisitos foram preenchidos. Somente no início da década de 1970, a disponibilidade do antagonista seletivo e potente, ácido γ – aminobutírico (GABA), conhecido por suas concentrações altas no cérebro levou a sua aceitação geral como substância neurotransmissora (Goodman e Gilman, 2007 – pág. 291). Neste contexto,diferentes vias de investigação tem demonstrado que a dopamina atua em locais específicos dos cincos receptores dopaminérgicos existentes, cujas estruturas e funções só agora começam a ser caracterizadas e que constituem peça importante para a explicação da adição às drogas de uso ilícito. Exposição a drogas psicoactivas,designadamente a psicoestimulantes, provoca alteração em diferentes sistemas orgânicos,em particular no SNC,quer no homem, quer em modelos experimentais. (Revista Portuguesa de Psicossomática,junho vol.05, numero 001 pp.65-73). Muitas perspectivas sobre o estudo da dopamina em relação ao uso da cocaína envolvem um largo espectro de áres de investigação com importante impacto não só científico,como também social. _________________________________________________________________________________ 78 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ A dopamina (o que é a dopamina) Pertence a um grupo de neurotransmissores,as catecolaminas, que são caracterizadas estruturalmente por possuírem um grupo amina ligado a um anel benzênico com dois grupos hidroxil adjacentes.Tem se ainda uma cadeia lateral de etilamina ou um de seu derivado.O precursor para a síntese de dopamina é o aminoácido aromático tirosina. São duas as reações que transformam a tirosina em dopamina.A primeira é catalisada pela tirosina hidroxilase(TH) que converte a tirosina em L-DOPA(L-1,3-diidroxifenilala nina). A TH é considerada enzima reguladora nesta via de síntese.A segunda é a descarboxilação da DOPA, catalisada pela enzima descarboxilase de L-aminoácido aromáticos,dando origem a dopamina.Depois de sintetizada a dopamina é armazenada em vesículas. Função Normal da Dopamina no Cérebro Após sua síntese, a dopamina é armazenada em no interior de vesículas sinápticas, quando chega um impulso elétrico a dopamina é direcionada a um terminal nervoso.A chegada nesse terminal présináptico,determina a liberação do neurotransmissor na fenda sináptica.A dopamina então atravessa essa fenda e se liga aos seus receptores específicos(D1 Aa D5) na membrana do próximo neurônio(pós-sináptico). Após isso o mesmo vai se ligar a receptores proteínas especifica existentes na membrana pós-sináptica.Essa ligação irá deflagrar uma seqüência de eventos,mediados por varias substâncias (AMPc,cálcio,sódio,dentre outras),culminando com a transmissão do impulso nervoso ao neurônio seguinte. Quando liberada a dopamina vai se ligar ao receptores que fica do lado de fora da célula.Essa ligação faz com que alguns sejam abertos.Dai há a entrada de íons, gerando uma mudança de carga elétrica na parte de dentro da membrana do neurônio, fazendo com que dispare outro impulso nervoso. Após a dopamina ter se ligado ao receptor pós-sináptico ela é recaptada novamente por sítios transportadores de dopamina localizados no primeiro neurônio (neurônio pré-sináptico). A recaptura dos neurotransmissores é um mecanismo fundamental para manter a homeostase e capacitar os neurônios a reagir rapidamente a novas exigências, já que o trabalho do cérebro é constante. O prejuízo da transmissão neuronal ligado ao menor aporte de neurotransmissores e/ou a uma menor sensibilidade dos receptores a eles esteja associado a maior ocorrência de distúrbios emocionais,cognitivos e de comportamentos em dependentes químicos e em diversas doenças psiquiátricas. _________________________________________________________________________________ 79 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ O ser humano pode chegar ao êxtase por ações que o levem ao prazer. Cada uma dessas ações é capaz de gerar um pequeno boom de dopamina, mas se o organismo for “normal” logo depois ele voltaria a ter níveis de dopamina, viverá altos e baixos e alguém assim se torna mais propicio ao vicio. A entrada de Cocaína no Cérebro Quando a cocaína entra no sistema de recompensa do cérebro, ela bloqueia os sítios transportadores dos neurotransmissores (função de levar de volta estas substâncias que estavam agindo na sinapse). Desta maneira, ela possibilita a oferta de um excesso de neurotransmissores no espaço inter-sináptico, fato biológico cuja correlação psicológica é uma sensação de prazer. Uma vez bloqueados esses sítios, a dopamina e outros neurotransmissores específicos não são recaptados, ficando portanto “soltos” no cérebro até que a cocaína saia. Quando um novo impulso nervoso chega, mais neurotransmissor é liberado na sinapse, mas ele se acumula no cérebro por seus sítios recaptadores estarem bloqueados pela cocaína. O efeito de euforia associado ao prazer então é prolongado. Relações Clínicas As ações da dopamina a nível do SNC são as mais importantes dentre elas, está o controle do movimento. Esse controle é realizado pela via nigro-estriada, ou seja, neurônios dopaminérgicos que produzem dopamina estão na substância negra e comunicam o músculo estriado. Quando há desrregulação dessa via temos a doença de Parkinson. Para haver os sintomas da doença de Parkinson, é necessário mais que 80% dos neurônios da via nigro-estriada inoperantes. Ações Terapêuticas - Insuficiência Cardíaca Congestiva - Choque Cardiogênico - Tratamento da Insuficiência Renal Aguda A Dopamina estimula os receptores do Sistema Nervoso Simpático atuando sobre os receptores dopaminérgicos nos leitos vasculares renais, mesentéricos, coronários, e intercerebrais e resulta em vasodilatação, sendo que, dependendo da dose, o efeito é o oposto.A vasodilatação renal aumenta a taxa de filtração glomerular, da excreção de sódio e do volume de urina. Com doses mais elevadas estimula os receptores alfa-adrenérgicos, com o aumento da resistência periférica e vasoconstrição renal. A pressão sistólica aumenta como resultado do incremento do trabalho cardíaco e da resistência periférica.Esse neurotransmissor não atravessa a barreira hematoencefálica e ainda não se sabe se atravessa a placenta. Metaboliza-se no fígado, rins e plasma a compostos inativados por monoaciloxidase (MAO) e catecol-o-metiltransferase (COMT). _________________________________________________________________________________ 80 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Sua meia-vida no plasma é de aproximadamente 2 minutos e a ação dura menos de 10 minutos. É eliminada por via renal sendo que cerca de 80% da dose excretam-se na urina em 24 horas. Nas situações agudas de choque os receptores que interessam ativar são os receptores dopaminérgicos. Nessas situações, os vasos dos órgãos alvos encontram-se em vasoconstrição, importante inicialmente para manter um fluxo postural, mas essa vasoconstrição passa a ser excessiva, o que leva a lesões tecidulares por anóxia no SNC, no rim e no coração ( a maior complicação do choque é a insuficiência renal aguda). E então, se a dopamina, em concentrações baixas, leva a vasodilatação desses territórios.Portanto a ativação dos receptores leva a um relaxamento dessas áreas vasculares, e isto, por exemplo em relação ao rim leva a um aumento do fluxo renal. Se ocorrer um choque hipovolêmico, ou hemorrágico, a primeira coisa a se fazer não é dar Dopamina, é antes repor a volemia. As duas coisas juntas são fundamentais para o êxito da terapêutica do choque. Ainda a nível periférico, no aparelho digestivo a Dopamina reduz o tônus esofágico e reduz a motilidade intestinal, sendo essas ações mais exuberantes ao nível do aparelho intestinal proximal (esôfago, estômago e intestino proximal). Estudo concluído Estudos concluem que cocaína induz o aumento da atividade e da formação da caspase 3, uma enzima responsável por provocar a morte celular. Além disso, a morte celular foi agravada após o bloqueio de uma outra proteína da célula, o fator NF-kB (NF-kappaB), que poderia atuar protegendo a célula da morte. Ao contrário do que pode parecer, a morte celular programada, na qual as caspases são os principais atuantes, é essencial para a formação e manutenção do organismo. Na fase embrionária, a morte celular permite o ajuste do formato dos nossos órgãos ao eliminar as células que acabam se tornando redundantes. Por outro lado, de acordo com a pesquisa , a cocaína ativa indevidamente esse processo, um achado que, contribui para a compreensão dos mecanismos de morte celular regulados pela cocaína. Outro benefício da pesquisa está no desenvolvimento de novas terapias para dependentes, que possam ajudar a interromper o desencadeamento dos processos degenerativos. Para o estudo,utilizou células PC12 de rato, que representam para os cientistas modelos de células do cérebro. Elas liberam dopamina e têm as mesmas características das células cerebrais humanas que secretam esse transmissor - responsável pela sensação de bem-estar. No cérebro, a cocaína impede a remoção (recaptura) do excesso de dopamina, intensificando, dessa forma, sua quantidade e, portanto, seus efeitos. Como toda pesquisa nem sempre o resultado é o que se espera, ocorre que a euforia é logo seguida pela depressão - associada, no uso crônico, com a interrupção prolongada da recaptura de dopamina, que acarreta sua escassez. O cérebro, ávido pela dopamina que agora lhe falta, sensibiliza-se, o que estimula a repetição do uso da droga. Se esse processo é acompanhado, ainda, de efeitos degenerativos em função da morte das células que liberam dopamina, agravando a falta de suprimento cerebral do transmissor, pode-se esperar que o usuário, em busca do efeito que seu organismo não é mais capaz de prover, apele para doses cada vez mais altas de cocaína.(Pesquisa realizada por uma pesquisadora da USP). Estudos futuros Uma vez que o efeito mais pronunciado da cocaína é a sua capacidade de interferir na recaptação de alguns neurotransmissores monoaminérgicos e que sua ação parece refletir também no desenvolvimento cerebral,é possível que fetos de rato em exposição “in utero”,por aumentar a transmissão sináptica,possa influenciar a neurotransmissão na descendência. Ainda é desconhecido a suspeita de que a exposição pré-natal a cocaína causa teratogênese neurocomportamental e disfunção estrutural no padrão de desenvolvimento cerebral.O desenho de modelos clínicos convenientemente controlados revelou-se de extrema dificuldade devido a multiplicidade de fatores envolvidos.Sendo assim a maioria dos inconvenientes das avaliações clínicas pode ser minimizadas com o desenvolvimento em animais.Utilizado assim o macaco Rhesus, pelo fato desse animal ter o desenvolvimento fetal semelhante aos dos humanos.Verificou-se usando esse modelo, que a exposição in útero a cocaína diminuía imunorreatividade da TH e a respectiva expressão do ARNm estão diminuídas no mesencéfalo,substancia negra e área tegmental ventral fetal. Pelo contrario a expressão do ARMn dos receptores de dopamina, D1 e D2 _________________________________________________________________________________ 81 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Aumentam significativamente na região do prosencéfalo.Estes resultados que o neurocircuito dopaminérgico que controla a função motora e condiciona o comportamento já se encontra alterado precocemente na gestação dos fetos expostos a cocaína. Nesse contexto foram propostos dois possíveis mecanismos que ainda não foram estudados o bastante para maior clareza,são eles: - A cocaína produz isquemia placentária privando o feto de oxigênio e nutrientes,bem como a isquemia cerebral fetal o que tem impacto direto na sobrevivência e função das células celebrais; - Relativamente ao desenvolvimento cerebral propriamente dito,a cocaína inibe a mitose e retarda a diferenciação celular. CONCLUSÃO A dependência à cocaína depende de suas propriedades psicoestimulantes e a dopamina é considerada importante no sistema de recompensa do cérebro, e seu aumento pode ser responsável pelo grande potencial de dependência da cocaína.A cocaína pode ser benéfica aos humanos porém tem que ser administrada por um profissional(médico) e em doses certas. REFERÊNCIAS BIBLIOGRÁFICAS: www.icb.ufmg.br /lpf/revista1: Acesso 25/06/2010 – 15:00 www.cerebromente.org.br/n08/doencas/drugs/anim.1.htm: Acesso 25/06/2010 – 15:30 www.palavrademedico.kit.net/tema : Acesso 26/06/2010 - 12:00 Goodmam e Gilman: As Bases Farmacológica da Terapêutica. Rio de Janeiro: McGraw-Hill Inter Americana do Brasil,11ª ed -2006 LOPES, Isabel Alexandra.PINTO, J. Correia. FORTUNATO, J.M. Soares. Desenvolvimento dos mecanismos dopaminérgicos cerebrais: A Influência da Cocaína. Revista Portuguesa de Psicossomática,junho, 2003/vol.05, número 0001.Sociedade Portuguesa de Psicossomática. Porto,Portugal.pag 65-73 _________________________________________________________________________________ 82 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ DOCE VENENO Lucas de Almeida Barbosa e Samuel Ramos de Souza Graduandos do curso de Licenciatura em Ciências Biológicas da UFOP RESUMO Doce Veneno, um título sugestivo que retrata o perigo quando o níveo de glicose sanguínea não é controlada normalmente, devido ao diabetes melito, uma doença ainda desconhecida em muitos aspectos. Sem exagerar em informações desnecessárias ao público leigo e sem abordagens muito técnicas este artigo define os pormenores necessários a compreensão da doença em seus conceitos básicos. A doença não possui dois tipos apenas que PE a diabetes tipo I e tipo II, mas outras também que afetam o bem-estar do paciente. A diabetes melito com o uso da insulina deve ser encarada como fim da vida, pois desde que temos as medidas necessárias o portador diabético pode levar uma vida melhor. A doença tipo I envolve a perda total da produção de insulina no organismo devido a falhas no pâncreas que é atingido por células de defesa imunológica. O tipo II é a forma mais comum e são mais ou menos que o tipo I. O tipo I envolve o peso elevado concomitante com a resistência a insulina. As formas de tratamento proporcionam uma melhora no estado do paciente e métidos preventivos contribuem para uma vida melhor. O antigo descreve a ligação entre a poluição ambiental e o diabetes em seu surgimento. Em suma este artigo esclarece melhor atentos duvidas permanentes no assunto. INTRODUÇÃO Aspectos Gerais do Diabetes Melito O diabetes que por muitos não é conhecido em tua totalidade é caracterizado não como uma doença única mas é um grupo que não é homogêneo, onde há elevação do nível glicômico no jejum. A qual é causada por uma deficiência parcial ou absoluta de insulina que prejudica o metabolismo da glicose sanguínea e comprometendo seriamente o organismo. O diabetes melito é a principal causa de cegueira e também amputação em adultos. Causa falha renal, ataques cardíacos e acidentes vasculares cerebrais. Em sua maioria os casos referentes ao diabetes melito podem, ser divididos em dois grupos em sua maioria que são o tipo I (diabetes melito insulina-depentente) e tipo II (diabetes melito insulina independente). É necessário compreendermos essa doença em suas particularidades para sermos conscientes desse mal que isola muitos dessa forma estarmos melhor informados de tudo o que é pertinente ao assunto. DIABETES DO TIPO 1 A doença caracteriza-se por deficiência absoluta de insulina que é um hormônio secretado pelo pâncreas que tem a função de controlar o nível de açúcar no sangue. A deficiência é ocasionada por um ataque auto-imune as células ß (beta) pancreáticas. As ilhotas de Langerhans do pâncreas tornam-se infiltrados com linfócitos T que são células de defesa do sistema imuno lógico que visa destruir microorganismos intracelulares mas que quando existe falha na imunidade os linfócitos podem atacar células e tecidos no organismo causando lesão tecidual. No caso do pâncreas, ocasiona insulite. Com o decorrer do tempo o ataque auto-imune leva a destruição gradativa da população das células ß. Os sintomas surgem quando 80 a 90% das células foram destruídas. O pâncreas falha em responder de forma adequada ao consumo de glicose e há becessudade de tratar o paciente acometido de doença. Com tempo de glicose exóbena que é necessária para o controle metabólico e prevenir suas complicações. Diagnóstico de Diabetes tipo 1 O início do diabetes tipo I ocorre tipicamente durante a infância ou a puberdade, e os sintomas surgem rapidamente. _________________________________________________________________________________ 83 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Pessoas acometidas dessa enfermidade podem de forma geral pelo surgimento abrupto de micção freqüente, sede excessiva e fome também excessiva, que podem ser resultantes de estresse ou por doença. Há cansaço, o paciente emagrece apresentando fraqueza. Para análise do paciente o diabetes tipo 1 é confirmado por alto nível de açúcar no jejum ma ior do que 126mg/dl. Mudanças no metabolismo A falta de insulina e um relativo excesso do hormônio glucagon que é responsável por liberação de glicose afetam três tecidos: fígado, músculo, e o adiposo. 1. Hiperglicemia e letoacidose. Quando o paciente diabético não é tratado níveis altos glicêmicos e cetonas se concentram na circulação sanguínea. O fígado aumenta a produção de glicose e há diminuição no seu uso por outros órgãos, pois é devido a incapacidade das células musculares e do tecido adiposo de captarem-no. A letose é devida ao exagero de ácidos que são mobilizados a uma síntese hepática de forma rápida de 3 (que junto com cetona denomina-se corpos cetônicos que são liberados em situações de jejum prolongado podendo suprir o cérebro). 2. Hipertriacilglicerolemia Ela acontece porque parte dos ácidos graxos não podem ser oxidados e utilizados a síntese de corpos cetônicos. Seu excesso é transformado em (gorduras) que são mobilizados em compostos que tem a função de transportar os lipídeos ingeridos. O paciente diabético apresenta a degradação das lipoproteínas no tecido adiposo baixo pois a enzima lipose lipoproteica que realiza o processo baixo está diminuído, pois níveis de insulina são insuficientes em conseqüência os níveis de quilomicra e VLDL estão elevados resultando nessa doença. DIABETES TIPO 2 A diabetes tipo II é quase determinada por elementos genéticos. A doença não está envolvida por viroses e anticorpos auto-imunes. É o tipo mais comum da doença. Afeta principalmente pessoas adultas após os 35 anos. A doença acontece quando a insulina produzida não é bem utilizada pelo organismo ou sua produção é baixa. O início dos sinais é lento e por muito tempo podem passar despercebido o que dificulta seu diagnóstico e tratamento. Muitos indivíduos apresentam micção freqüente e sede excessiva. A fome excessiva pode estar presente, mas é menos comum. As alterações no metabolismo observadas no diabetes do tipo 2 são mais amenas do que as que ocorrem no tipo I, em parte por que a secreção da insulina do tipo II impede a cetoacidose diabética. A forma de diagnóstico baseia-se mais comumente em uma concentração glicêmica maior que 126 mg/dl. Resistência a insulina O que causa resistência a insulina que os tecidos alvo não respondem de forma adequada as concentrações normais de insulina, por exemplo, como no fígado, adiposo e músculo. Na resistência ao hormônio ocorre uma produção exagerada e sem controle de glicose do fígado e por uma diminuição da captação de glicose pelo tecido muscular e pelo adiposo. 1. Resistência à insulina e obesidade A causa mais comum de resistência a insulina é a obesidade, mas a maioria das pessoas acima do peso que são resistentes ao hormônio não se torna diabética. Quando há ausência de um defeito na função das células beta, indivíduos obesos não-diabéticos compensam a resistência à insulina com níveis aumentados desse hormônio. As pessoas obesas apresentam secreção de insulina maior do que em indivíduos magros. Essa maior concentração de insulina compensa o efeito diminuindo do hormônio (como resultado da resistência a insulina e os níveis glicêmicos são similares em relação aos magros). Resistência à insulina e diabetes tipo 2 A resistência à insulina, não levará ao diabetes tipo 2. Ele é desenvolvido em pessoas resistentes ao hormônio que também apresentam diminuição das células ß. _________________________________________________________________________________ 84 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Em idosos, obesos que são sedentários e em gestantes a resistência à insulina e o subseqüente do diabetes do tipo 2 são comumente observados. Essas pessoas apresentam a impossibilidade de compensar de forma adequada a resistência à insulina com a liberação adequada de insulina. A resistência à insulina aumenta quando há ganho de peso e ocorre a diminuição quando há emagrecimento. Isso sugere que a deposição de lipídeos é importante no desenvolvimento de resistência ao hormônio. Difusão pancreática das células ß No tipo 2 da diabetes os níveis de insulina variam desde cima do normal até abaixo da normalidade pois a capacidade das células ß é mantida, mas há uma difusão dessas células pois há falha na secreção de insulina para correção da hiperglicemia preponderante. A deterioração de função das células ß é muito desvantajosa pois pode ser acelerada, pois com hiperglicemia persistente e com a elevação de ácidos livre estes se tornam tóxicos. Alterações metabólicas no diabetes tipo 2 A resistência à insulina causa anormalidades metabólicas se expressando principalmente no fígado, no músculo e no tecido adiposo. A hiperglicemia tem sua causa por um aumento na produção da glicose no fígado atrelada pela taxa diminuída de sua utilização periférica. A letose é mínima ou ausente nos pacientes do tipo 2, pois a presença de insulina mesmo quando ocorre a resistência desse hormônio, diminuía a cetogênes e hepática. A degradação de lipoproteínas nos adipócitos catalisada pela enzima é baixa nos portadores de diabetes tipo 2, o que resulta na hipertriacilglicerolemia, pois os níveis plasmáticos de quilomicra e de VLDL ficam elevados. DIABETES GESTACIONAL De forma geral o surgimento em gestantes desse tipo de diabetes surge em mulheres que não eram portadoras da doença. Elas são acometidas por alteração da tolerância a glicose em graus diversos durante a gestação. De fora geral ocorre o desaparecimento da doença quando a gravidez termina. No futuro elas podem ser acometidas com o diabetes tipo 2. Outros tipos de diabetes Outros tipos específicos de diabetes podem vir a ocorrer, mas constituem situações raras de ocorrência e são desencadeadas por: doenças do pâncreas, endocrinopatias, induzidos por formulas e agentes químicos, infecções, etc. Tratamento do diabetes tipo 1 Existe o tratamento padrão versus tratamento intensivo. O tratamento padrão vise o bem estar clínico do paciente e ele se caracteriza com a aplicação da insulina obtida de forma exógena injetada de forma subcutânea. Já o tratamento intensivo visa a normalização glicose sanguínea por meio de monitoramento de formas mais freqüentes, e subseqüentes injeções de insulina. Tratamento do diabetes tipo 2 Objetiva-se no tratamento do diabetes desse tipo manter a glicemia no sangue dentro de limites da normalidade e prevenção do desenvolvimento das complicações de longo prazo. Redução do peso corporal, atividade física e modificações na alimentação freqüentemente corrigem a hiperglicemia do diabetes tipo 2. Podem ser necessários para atingir níveis satisfatórios de glicose sanguínea, agentes hipoglicemiantes ou terapia com insulina. Prevenção do diabetes e efeitos crônicos A elevação crônica da glicemia causa as complicações crônicas relacionadas ao diabetes tipo I: neuropatia, problemas renais, aterosclerose prematura e problemas na retina podendo até causar cegueira. Pessoas sem histórico da doença na família devem fazer exames periódicos. O risco para o diabetes tipo II pode ser diminuído por um regime em combinação de terapia nutricional, perda de peso e atividade física regular. FIQUE POR DENTRO Poluição aumenta risco de diabetes _________________________________________________________________________________ 85 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ “A poluição do ar provocada por veículos já é acusada de provocar doenças cardiovasculares e agora poderá também levar a culpa por causar o desenvolvimento do diabetes tipo 2. Estudo realizado na Alemanha e publicado no jornal Environmental Health Perpectives analisou dados de mais 1.700 mulheres não diabéticas que tinham 55 anos em 1985, quando a pesquisa foi iniciada. O estudo durou até 1994 e teve um seguimento em 2006. Nesse ano 187 participantes foram diagnosticadas diabéticas tipo 2. O estudo utilizou dados de estações de monitoramento de emissão de gases para avaliar o nível de exposição das mulheres. A exposição aos componentes da poluição veicular, particularmente dióxido de nitrogênio (NO2) e fuligem por partículas finas, foi significativamente associada ao maior risco de diabetes tipo 2. Esse risco variou de 15% a 42%, dependendo do nível de exposição aos poluentes, sendo maior quanto maior era a exposição. Morar num raio de 100 metros de estradas movimentadas mais do que dobrou o risco. Os pesquisadores perceberam também relação entre poluição e diabetes com graus leves de inflamação. Eles fizeram medição de C3c, uma proteína do sangue que é um marcador de inflamação. As mulheres que apresentavam os maiores níveis de C3c no início do estudo foram justamente as que tiveram o risco aumentado de desenvolver diabetes tipo 2 relacionado à poluição. Apesar de o estudo ter sido focado apenas em mulheres, os pesquisadores admitem não ter motivo para eliminar a possibilidade de que os resultados podem ser similares em homens.” CONCLUSÃO É sabido que apesar da ampla divulgação de informações sobre cuidados que devemos ter na saúde existem pessoas que ainda não adotaram bons hábitos de vida seja na alimentação, atividade física de forma regular, etc. É necessário que passemos a ser mais conscientes quanto aos maléficos da diabetes não tratada e esta obra visou esclarecer os detalhes pertinentes ao assunto sem exagero de informações de cunho técnico e cientifico. Quem tem históricos na família de doença e quem é acometido pelo deve se esforçar para ter bons hábitos de vida para prevenção do primeiro citado e complicações segundo mencionadas. Devemos estar atentos a divulgações sobre pesquisas dessa enfermidade e quem não tem a doença possa ajudar os outros a entender o que é necessário sobre seus detalhes básicos. REFERÊNCIAS BIBLIOGRÁFICAS PAMOLA, C. Champe, HARVEY, Richard A.Bioquímica Ilustrada 3ª edição, FERRIECL, Denise R. http://www.portaldiabetes.com.br _________________________________________________________________________________ 86 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ ÓPIO: A DROGA DO SONO Thiago C. Silva e Renata P. Fumes Graduandos do curso de Ciências Biológicas Licenciatura da Universidade Federal de Ouro Preto. RESUMO O ópio é um produto originado do metabolismo da papoula, planta nativa da Ásia Menor, do qual se extrai a morfina, um importante fármaco utilizado como poderoso analgésico. O tema proposto por este trabalho possui com objetivo demonstrar a atividade analgésica da morfina no sistema nervoso central, enfatizando sua ação bioquímica. INTRODUÇÃO A morfina é um fármaco que deprime o sistema nervoso central. Essa substância produzir efeitos euforizantes e analgésicos, possuindo atividade em receptores específicos que estão presentes na membrana de células nervosas. Ao se ligarem nesses receptores a morfina causa diminuição na transmissão dos neurotransmissores, que levaria a informação de dor a outras células nervosas, assim sendo um dos principais locais de ação dessa droga é na medula espinhal. Dessa forma a morfina inibindo a sensação de dor sem causar perda da consciência. A História do Ópio Tão antiga quanto o homem é a busca pela felicidade, talvez por isto, a primeira droga a ser descoberta tenha sido o ópio (do grego opion: sulco de papaver). O conhecimento do ópio remonta talvez à pré-história ou, pelo menos, aos períodos históricos muito distantes. Sementes e cápsulas de papoula foram encontradas em uma vila da era Neolítica, situada na Suíça. Há evidências de cultivo há mais de 5000 (mil) anos deixadas pelos suméricos (DUARTE, 2005). A planta era usada para alívio de dores e em cerimônias religiosas, por diversas civilizações egípcias, mesopotâmias, persas, gregos e romanos (SILVA E VELOZO). O ópio também era componente básico em mais de 700 remédios. Conhecida por grandes médicos Gregos como Hipócrates e Galeano que Fez vários estudos sobres os efeitos da droga. Hipócrates não atribuía ao ópio propriedades mágicas como parece ter ocorrido aos sacerdotes das Asclepíades. Considerado o pai da Medicina, ele prescrevia o “mecônio” (provavelmente Um suco de papoula) como purgativo, narcótico, para a cura da leucorréia (DUARTE, 2005). O ópio era recomendado para a cura da epilepsia, bronquite, asma, pedra nos rins, febre, melancolia, tétano, insanidade e até ninfomania. Também podia ser utilizada como arma de intoxicação e morte, caso ocorrido também com médicos que estudavam a planta e se intoxicaram (SILVA E VELOZO). O ópio teve grande importância na civilização romana, simbolizando o sono e a morte. Agripina, a última esposa do Imperador Cláudio, adicionou essa droga ao vinho que ofereceu a Britânico, seu enteado, para permitir que Nero, seu próprio filho, herdasse o trono. Galeno, no século II d.C., foi um entusiasta das virtudes do ópio, cujo uso se tornou muito popular em Roma. Nos últimos anos do império, a exemplo do que já havia acontecido na Grécia, à papoula foi cunhada em uma das faces das moedas em uso (DUARTE, 2005). Em 1803 o farmacêutico Alemão Friedrich Serturner, isolou o primeiro alcalóide do ópio: a Morfina, esse nome deriva do Deus Grego Morfeus- Deus do sonhos). Em seguida também foi descoberta da papoula a codeína, a tebaína e a papaverina (SILVA E VELOZO). Durante o século XIX, o uso do ópio era tão comum quanto o da aspirina. Na Grã-Bretanha, entre 1831 e 1859, o consumo aumentava em média 2,4% ao ano. No século XIX foi consolidada a administração de drogas por via subcutânea. No dia 4 de outubro de 1836 foi submetida à Academia de Medicina de Paris uma comunicação de G. V. Lafargue, médico de St. Emilion, na qual ele descreve a inoculação de uma pasta de morfina, sob a epiderme, utiliza ndo uma lanceta de vacinação. Observou uma auréola avermelhada no ponto da inoculação, que aumentou de tamanho, alcançando o diâmetro máximo em torno de uma hora. Dessa forma, Lafargue descreveu, então sem conhecimento da causa, uma reação estaminóide à morfina. No dia três de junho de 1845, o médico irlandês Fancis Rynd foi o primeiro a introduzir morfina por via subcutânea, em estado líquido (SILVA E VELOZO). _________________________________________________________________________________ 87 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ O uso como analgésico já podia ser um atrativo para o uso constante do ópio, como descrito no do ilustre escritor De Quincey, nascido em 1785, tomou ópio pela primeira vez em 1804, quando estudante do Worcester College, em Oxford, por recomendação de um colega, para a cura de uma dor de dente. Assim ele descreveu suas primeiras sensações: “Dentro de uma hora, oh céus! Que extraordinária mudança! Que ressurgimento das mais inatingíveis profundezas do espírito! Que revelação do meu mundo interior. O fato de as minhas dores terem desaparecido pareceu-me então uma ins ignificância esse efeito negativo foi consumido no abismo De um prazer divinal subitamente revelado. Entre os anos de 1830 e 1860, a droga havia se tornado problema social, devido ao aumento de mortes por envenenamento (SILVA E VELOZO). A droga se destacou de certa forma a ser motivo da uma guerra entre a Grã-Bretanha que exportava a droga para a China, após o imperador chinês Ch’ung Ch’en proibir a entrada da droga no país. Com a derrota da China houve a liberação a importação da droga além de ceder à cidade de Hong Kong. Em 1900 metade da população adulta masculina da China estava viciada em ópio (SILVA E VELOZO). No ano de 1874, o farmacêutico inglês Alder Wright, com a intenção de fazer um analgésico mais poderoso, aqueceu a morfina com anidrido acético até a ebulição criou a diacetilmorfina, mais conhecida como heroína. Nome devido ao seu heroísmo para combater a dor. No ano de 1898 a heroína passou a ser comercializada no mercado e cinco anos depois foi proibida. O consumo do ópio aumentou muito durante a primeira guerra mundia l, e devido ao grande aumento de farmacodependentes a droga passou a ser proibida em vários países. Depois da segunda guerra mundial o ópio voltou a expandir e a heroína passou a ser contrabandeada em diversos países, por volta de 1965 a droga virou uma epidemia nos estados unidos. Em 1970 o numero passou para 500.000 usuários no país (SILVA E VELOZO). Hoje muitos países tenta controlar o contrabando do ópio, que se difunde em grande parte da Ásia, Oriente Médio, Europa e Estados Unidos. No Brasil o consumo não chega a ser alarmante, porém o cuidado a essa droga deve ser tomado com muito vigor e restrição devido sua alta ação de causar dependência. A Planta do Ópio. Originam de uma família com 28 gêneros de papoula e 250 espécies, apenas duas delas contêm uma quantidade razoável de ópio, Papaver bracteatum e P. somniferum originadas da Ásia menor. O ópio é produzido a partir da resina extraída artesanalmente das cápsulas das sementes do fruto imaturo de papoula, que depois é fervida e transformada em ópio, a papoula contêm mais de 50 Alcalóides dos quais a morfina é o mais importante. Não se sabe ao certo o porquê a planta produz esses alcalóides, porém algumas destas substâncias podem inib ir ação de insetos herbívoros ou ter função no armazenamento de nitrogênio. Em resumo, o processo de extração é iniciado duas semanas após a queda das folhas, quando as cápsulas que contêm as sementes endurecem. Ao anoitecer, a cápsula é escarificada com incisões rasas permitindo fluir o látex. Deixa-se então que ele se adense, graças à evaporação, na própria superfície da cápsula, do que resulta uma goma marrom que é removida, na manhã seguinte, com um instrumento de ferro com a forma de uma pá de pedreiro pequena. Essa goma é então transformada em pó (DUARTE, 2005). A morfina, protótipo desse grupo, representa 10% dos alcalóides do ópio. A codeína (metil-morfina) foi isolada por Robiquet, no ano de 1832, e a tebaína (dimetil-morfina) foi isolada por Pelletier e Thibouméry, no ano de 1835. A codeína e a tebaína representam, respectivamente, 0,5% e 0,2% dos alcalóides ópio (DUARTE, 2005). _________________________________________________________________________________ 88 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Figura 1 síntese da morfina na planta da papoula. Ação da Morfina no Sistema Nervoso. Os agonistas opióides produzem analgesia, propriedades euforizantes, depressão respiratória e dependência física ao se ligarem a receptores específicos, que se localizam principalmente no cérebro e regiões da medula espinhal. Os ligantes específicos de opióides são de três classes µ (um) que é reconhecido preferencialmente pela morfina, δ (delta) e ҝ (kappa) outros opióides. A ação ocorre na transmissão neurológica das células nervosas, ocorrendo da seguinte maneira: os receptores opióides estão ligados a proteínas-G que são capazes de afetar a regulação iônica, o processamento do Ca2+( cálcio) e fosforilação de proteínas. Quando os opióides se ligam eles fecham o canal de passagem de cálcio regulado voltagem nas terminações nervosas pré-sinápticos, reduzindo a liberação de transmissores, ou hiperpolarizam através da abertura inibindo neurônios pós-sinápticos através da abertura dos canais de K+ (potássio). São encontrados receptores tanto em neurônios de transmissão da dor na medula espinhal, quanto nos aferentes que transmitem a mensagem da dor, os agonistas opióides inibem a liberação de transmissores excitatórios deses aferentes primários e inibem os neurônios transmissores de dor do corno dorsal, exercendo um poder analgésico na medula espinhal. Parte a ação de alivio da dor dos opióides exógenos exemplo a morfina envolve a liberação de peptídeos opióides endógenos como asmetionina-encefalina e leucina-encefalina que atuam nos receptores delta e kappa que pode iniciar uma complexa seqüência de eventos envolvendo múltiplas sinapses e transmissores Figura 2 reações de transmissão e bloqueio das sinapses por morfina. _________________________________________________________________________________ 89 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Causas da Dependência e Tolerância a Morfina. Com a administração freqüente de doses de morfina verifica-se uma perda gradual da eficácia e ocorre a tolerância, para reproduzir a dose original é necessário administrar uma dose mais alta, também verifica-se uma dependência física, causando a síndrome de abstinência caracterizada quando a droga é interrompida. Acredita-se que o mecanismo envolva uma resposta celular associada a alterações em sistema de segundos mensageiros, incluindo a inibição da adenilil ciclase e fosforilação das proteínas. A fosforilação dos receptores opióides , modifica a habilidade do receptor em interagir com seu ligantes ou com a proteína-G, um decréscimo desta proteína-G leva a uma queda na sensibilidade funcional dos receptores opióides, o que pode ser traduzido como causa da tolerância, pois necessita de maiores concentrações de morfina para atingir esses poucos receptores. Ocorre também um decréscimo de AMPc induzido pela proteína-G que abre o canal de cátions. Algumas regiões do cérebro mostram um aumento dos níveis de proteínas-G em resposta a exposição crônica aos apiáceos e a exposição prolongada revela aumento nos níveis de adenolinatociclase, proteino Kinase e Adenosina-3,5-monofosfato cíclico (AMPc) dependente entre outros. Assim quando a morfina é retirada abruptamente, o sistema AMPc aumentado, aumenta a atividade do neurônio e produz sinais característicos de abstinência. Figura 3 esquema ilustrativo sobre esposição aguda e prolongada a opióides. Metabolismo Os opióides são convertidos em grande parte pelos em metabólitos polares, que são então facilmente excretados pelos rins. Os compostos com grupos hidroxilas livres são rapidamente conjugados em com ácido glicurônico,como por exemplo a morfina. Compostos como a heroína sofrem hidrolise rápida por esterase tecidual comum, com isso a heroína (diacetilmorfina), é convertida em monoacetilmorfina e depois em morfina. Figura 4esquema de reações de metabolização da heroína no fígado. _________________________________________________________________________________ 90 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ CONCLUSÃO Os opiáceos ocupam espaço cada vez maior na anestesia, na dor e nos cuidados intensivos. O futuro aponta para o uso de opiáceos sem nenhum efeito cumulativo administrados continuamente através de dispositivos e técnicas computadorizados. O anestesiologista deve estar preparado para absorver os avanços nesta área e aplicá-los para o bem estar dos pacientes REFERÊNCIAS BIBLIOGRÁFICAS. Silva C. V. e Velozo E. S., Ópio- A Droga do Sonhos. Fonte:http://www.sbq.org.br/filiais/adm/Upload/subconteudo/pdf/Historias_Interessantes_de_Produtos_Naturais1 3.pdf acessado em: 28 de junho 2010. DUARTE, D. F., Uma Breve História do Ópio e dos Opióides, 2005. NOCITE J.R. ,Opiáceos: Benefícios Riscos na Anestesia, na Dor e nos Cuidados Intensivos,1993. Fonte: _________________________________________________________________________________ 91 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ LANTERNA VIVA Karoline Estefani Duarte* e Walles Henrique Vieira Souza* *Graduandos em Ciências Biológicas Licenciatura pela Universidade Federal de Ouro Preto. RESUMO Na luta conta sobrevivência cada organismo utiliza estratégias diferentes, tais estratégias tem como principio básico a permanência de espécie no ecossistema. A maioria dos animais marinhos e uma diversidade grande de terrestres utilizam sinais luminosos para afugentar seus predadores, estes sinais são produzidos através de um evento denominado bioluminescência que ocorre devido a oxidação da molécula de luciferina pela enzima luciferase, gerando fótons luz. Palavras chave: Luciferina, quimiluminescência. Luciferase, Fótons de luz, Bioluminescência, Vaga-lume, INTRODUÇÃO: A vida dos animais seria muito mais fácil se eles pudessem expressar com palavras o que eles transmitir, porém tal comunicação só possível em seres humanos a comunicação utilizada por animais é através de mugidos, coaxo, berro e enfim por sinais luminosos. Grande parte dos animais marinhos e terrestres utilizam sinais luminosos para se comunicarem, tais sinais ainda possuem outras funções como afugentar predadores, reprodução da espécie, atração de presas. O organismo terrestre mais estudado e aonde se conhece melhor o processo bioquímico São os vaga-lumes ou popularmente chamados de pirilampos, descreveremos como ocorre o processo de emissão de luz e qual a sua relação com nicho ecológico que ele exerce. Anima is que realizam bioluminescência. A produção de luz por seres vivos A quimiluminescência é um conjunto de reações que se caracterizam pela emissão de fótons de luz, foi descoberta por Wiedmann em 1888 que estabeleceu o conceito como “à emissão de luz que ocorre como resultado de um processo químico”. Uma seqüência de estudos foi realizada para aprimorar mais o conceito de quimiluminescência, e em 1988 Campbell estabeleceu quatro características fundamentais para as reações quimiluminescentes: 1- o espectro da emissão de luz, em particular, se é ou não visível; 2- o estado em que a reação quimiluminescente ocorre, num gás, num líqüido ou numa das interfaces; 3- se a reação quimiluminescente é orgânica ou inorgânica; 4- a existência ou a necessidade de um receptor da energia do produto excitado formado na reação quimilurninescente, constituindo-se na espécie emissiva final, isto é, a transferência de energia ou quimilurninescência sensibilizada _________________________________________________________________________________ 92 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Existe uma variedade muito grande de reações de quimiluminescência, dentre elas existe a classe da bioluminescência que são reações que possuem as mesmas características das reações quimioluminescentes, porém são biologicamente viáveis. Este tipo de reações é realizado por todas as células vivas, entretanto a maioria produz uma emissão de luz ultra-fraca que não consegue ser visível, as reações químicas envolvidas no processo são altamente exergônicas e promovem uma oxidação do substrato. O sinal verde dos vaga-lumes Embora o mecanismo básico de toda a bioluminescência envolva a oxigenação de uma luciferina gerando um intermediário peroxídico, a natureza química das luciferinas, luciferases e cofatores participantes difere consideravelmente de um grupo de seres vivos para outro, o que levou desde cedo à conclusão de que a bioluminescência possa ter se originado muitas vezes independentemente no decorrer da evolução. A reaçãode proução de luz é realizada pela enzima luciferase ,a reação se inicia com uma molécula de luciferina que na presença de ATP, Mg++ formando o complexo Luciferina Adenilato que reage com o oxigênio com atuação da enzima luciferase e produz oxiluciferina liberando CO2 , AMP e luz. A oxiluciferin produzida sofre reações de regeneração voltando ao seu estagio inicial ( figura 1). Figura 1: reação de oxidação da lucife rina. A varidade química de luciferinas( Figura 2) é grande, e por isso existem várias cores diferentes emitidas pelos organismos. O tipo de luciferina vai gerar comprimentos de onda diferentes e conseqüentemente emissão de cores diferentes.a maior parte dos vaga-lumes emitem luz na tonalidade de verde. Figura 2; Tipos de luciferina. Importância Ecológica os vaga-lumes são animais voadores e na época de acasalamento utilizam os sinais luminosos para atrair as fêmeas, existem dois tipos de comunicação entre os vaga-lumes: no tipo I a fêmea se encarrega de sinalizar para o macho sua posição; no tipo II a emissão de sinal inicial ocorre por parte do macho, com resposta da fêmea porém em ambos os casos a fêmea se mantêm estacionária na vegetação e é o macho quem voa. _________________________________________________________________________________ 93 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Os vaga-lumes estão ameaçados pela forte iluminação das cidades já que a sua bioluminescência é anulada interferindo fortemente na reprodução, ocorrendo um forte indicio de extinção. REFERÊNCIAS BIBLIOGRÁFICAS Hagen, O. AVALIAÇÃO DO EFEITO DA ILUMINAÇÃO ARTIFICIAL SOBRE AS POPULAÇÕES DE VAGA-LUMES (Coleoptera: Lampyridae, Elateridae) NO CAMPUS DA UFSCAR DE SOROCABA, 2009. Bechara, E. J. H. Vagalumes da química à biotecnologia, Revista Química nova ed. 17, 1994. Viviani, V. R. Luciferases de vagalumes estrutura, função e aplicação em bioanalise e bioimageamento. Revista Biotecnologia ciencia e desenvolvimento ed. 37. Ciarlini, Luciana Del Rio Pinoti; Ciarlin Paulo César; Feitosa, Francisco Leydson Fonniga.Quimiluminescência: princípios e aplicações. Revista educação continental. São Paulo. Volume 5. fascículo 2. p. 181 . 187. 2002. Imagem disponível em: http://ajorgelopesdirecto.blogspot.com/2007_06_01_archive.html Acesso em 30/06/2010 Imagem disponível em: http://fabulas1.blogspot.com/2007/05/pirilampos.html Acesso em 30/06/2010 Imagem disponível em: http://inema.com.br/mat/idmat003559.htm Acesso em 01/07/2010 Imagem disponível em: http://alexiaa.blogs.sapo.pt/31818.html Acesso em 01/07/2010 Imagem disponível em: http://www.globoamazonia.com/Amazonia/0,,MUL1041877-16052,00CIENTISTA+PROCURA+COGUMELOS+LUMINOSOS+NA+AMAZONIA.html Acesso em 01/07/2010 Imagem disponível em: http://1.bp.blogspot.com/_NW2P_JDmJV4/RzVVTb7IDiI/AAAAAAAAAOE/V4Ztsbahh9U/s1600h/watasenia.gif Imagem disponível em http://3.bp.blogspot.com/_NW2P_JDmJV4/RzjKjL7IDkI/AAAAAAAAAOU/_uDK1QJHuTU/s1600h/sem+t%C3%83%C2%ADtulo.bmp Acesso em 01/07/2010 _________________________________________________________________________________ 94 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ PEPTIDEOS ANTIMICROBIANOS DE ORIGEM CUTÂNEA Ester A. Mota e Fernanda Marcondes Graduandas do curso de Bacharelado em Ciências Biológicas da UFOP RESUMO Os peptídeos antimicrobianos (PAM’s) atuam principalmente como antibióticos, e antifúngicos, atualmente têm se mostrado como uma alternativa ou esperança para combater certos microorganismos indesejados. Muitas dessas moléculas podem ser encontradas na secreção cutânea de anfíbios, que são os PAMs. As PAM’s atuam destruindo ou desestabilizando a membrana dos patógenos, em ambientes hidrofóbicos, adotam estrutura da hélice de forma anfifílica possuindo a carga global da molécula positiva sendo péptidos catiônicos. PAMs podem agir em conjunto para eliminar determinado alvo microbiano. Em Phyllomedusas são encontrados muitos PAMs de interesse comprovado e outros ainda em estudo como dermaseptinas, filoseptinas, hiposinas, dermatoxinas e filotoxinas. Em Xenopus laevis (rã africana) é encontrada a magainina 2 que é amplamente estudada e com ação comprovada contra diversos patógenos, tanto agrícolas quanto humanos. O uso de PAMs como fármacos, como conservantes não é algo novo, embora ainda existam muitos com suas propriedades desconhecidas como é o caso das hiposinas. Palavras-chave: PAM’s, glândulas dérmicas, antibióticos, antifúngicos, peptídeos catiônicos. INTRODUÇÃO Os anfíbios por possuírem respiração cutânea sempre foram vulneráveis a agressões bióticas (microorganismos e predadores) e abióticas (temperatura e umidade). Isto fez com que eles desenvolvessem mecanismos de defesa como uma secreção cutânea mucosa lubrificante associada a uma rica em moléculas de defesa. Possuindo pelo menos dois tipos de glândulas dérmicas, sendo uma mucosa, promovendo umedecimento da pele, outra granular ou de veneno e a glândula parotóide, que juntas secretam substâncias bioativas formando seu sistema de defesa principalmente inato. Com o surgimento freqüente de resistência a antibióticos existe um interesse de buscar meios alternativos para produção de remédios viáveis. A pesquisa da funcionalidade dessas moléculas e modo de ação está proporcionando tecnologias até mesmo de produção de plantas transgênicas resistentes a bactérias e fungos que antes eram pragas. Características dos PAMs São moléculas bioativas, que atacam membranas celulares de bactérias, fungos, protozoários e vírus. Têm sido usados amplamente como antibióticos (pela ação que se estende a Gram+ e Gram-) e antifúngicos. Principalmente em forma de L-aminoácido, os PAMs podem se organizar em α-hélice ou folhas β e D-aminoácidos em β-hélices, carga global +, fazem parte do sistema imune inato, são anfifílicos, contém resíduos polares positivos. O peptídeo em solução aquosa tem uma forma linear, em contato com uma membrana adquire uma estrutura helicoidal onde aminoácidos hidrofóbicos são polarizados em catiônicos aminoácidos. A interação eletrostática entre os lipopolissacarídeo da membrana microbiana e peptídeos os faz tomar uma posição paralela à membrana. Ao aumentar a concentração do PAM, estas são inseridas perpendicularmente na membrana, resultando na formação de canais ou poros por onde escoa elementos celulares (et al Karla Montaño). Por terem a carga global positiva os PAMs se ligam preferencialmente a fosfolipídios com carga negativa como fosfatidilglicerol, fosfatidiletanolamina e cadiolipinas, e fazem interações fracas com os lipídeos zwitteriônicos ou neutros de mamíferos, que é uma das explicações que mostra que fármacos produzidos com essas moléculas não são prejudiciais ao ser humano, mas se ácido siálico ou lipopolissacarídeos aderirem na superfície das hemácias como pode ocorrer, então há risco de um ataque hemolítico. Formas de ataque de PAMs nas membranas _________________________________________________________________________________ 95 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Modelo toroidal – a agregação do peptídeo conduz a uma reorientação dos fosfolipídios que formam poros toroidais; Modelo carpet-like – as moléculas do peptídeo acumulam-se paralelamente à superfície da membrana e causam desagregação, como em detergentes; Modelo barrel-stave – as moléculas do peptídeo reorientam-se formando agregados cilíndricos que criam poros na membrana. Mecanismos de inativação de PAMs Quando há heparina no meio extracelular a atividade antimicrobiana pode ser inibida, pois ela permeabiliza a membrana celular, ocasionando uma resistência do microorganismo ao PAM. Baixos níveis de fosfolipídios aniônicos na membrana plasmática do patógeno podem diminuir ou anular ação dos PAMs, pois sendo eles catiônicos, a interação não ocorre. PAMs podem ser inativados por componentes do soro sanguíneo como a albumina; isso é também um dos motivos pelos quais muitos PAMs não atacam células humanas. PAMs podem sofrer degradação na matriz por proteólise. Como os PAMs agem principalmente sobre componentes negativos pode ocorrer amidação desses componentes como forma de defesa. Representação esquemática do ataque de peptídeos na membrana formando o barril peptídico. Mecanismo carpet-like de ataque a membrana, formação de mice las. Modelo toroidal de ataque a membrana, desagregação. (et al., Michelle da Silva Libério ) Alguns PAMs com propriedades importantes comprovadas. Magainina 2 : análogo sintético mostrou inibição de conídios fúngicos de Cryphonectria parasitica, Fusanum oxysporum. sp.lycopersici e Septoria musica. Além de eficaz contra as bactérias: Agrobacterium tumefaciens, Ewinia sp. e Pseudomonas syringae. A magainina é o princípio ativo de LOCILEX que é um remédio de uso tópico para infecções e úlceras diabéticas. Derivados têm sido _________________________________________________________________________________ 96 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ usados na terapia do câncer, tratamento de conjuntivites, de acne, DSTs, micoses e até gripe. WWW.magainin.com Plasticininas: cationicidade mínima se comparada aos outros PAMs, pode adquirir conformações α e β- hélice. São ativas contra Escherichia coli. Filoseptinas e dermaseptinas: são de natureza similar, porém alguns subtipos de filoseptinas mostraram atividade hemolítica humana enquanto dermaseptinas não. Dermaseptinas podem participar do sistema imune adaptativo, pois pode causar a degranulção de leucócitos polinucleados, crê- se que ela pode se ligar ao receptor do leucócito provocando a reação. Foi demonstrada ação inibitória de crescimento para cepas de HIV-1, no meio. O descobrimento da atividade espermicida e contra os causadores de gonorréia e candidíase por um subtipo de dermaseptina levou a produção de contraceptivos além da inibição de crescimento de E.coli, S.aureus (causa doenças de pele e infecções alimentares) e P. aeruginosa (infecção urinária e respiratória). Subtipos de filoseptinas combinados a dermaseptinas apresentaram inibição a X.citrii (bactéria causadora de cancro cítricogrande importância agrícola e econômica). Filotixinas e dermatoxinas: são parecidas entre si no aspecto físico-químico e funcional, ambas mostraram ação contra Corynebacterium glutamicum (causa lesões na pele humana). Xenopsina e ceruleína: respectivamente. têm efeito análogo a neurotensina e gastrina/colecistocinina Observação: o PAM hiposina encontrado em Phyllomedusas não tem suas propriedades comprovadas, apenas se sabe que ela não apresenta atividade hemolítica a hemácias humanas e é o menor peptídeo da classe. Phyllomedusa e de rme ao lado. A glândula escura produz PAMs Representação simplificada de como agem os peptídeos antimicrobianos _________________________________________________________________________________ 97 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ CONCLUSÃO Apesar de relativamente ter muito tempo da descoberta que PAMs apresentam atividade antibiótica e antifúngica, a diversidade de PAMs existentes é ampla, então se considera que pouco é conhecido das propriedades dos PAMs, até porque, eles podem ter ação por diversos tipos de patógenos (bactérias, fungos, vírus e etc.). É promissora a pesquisa das propriedades dos PAMs, pois muitos têm aplicação na área agrícola, pecuária e terapêutica humana, levando a um interesse econômico pelo investimento nessa pesquisa. O interesse na pesquisa de PAMs exclusivamente de anfíbios tem acarretado uma consciência de preservação desses animais pelo ganho econômico que produtos talvez possam trazer. REFERÊNCIAS BIBLIOGRÁFICAS MANDEL, S (2008) UnB Prospecção de peptídeos antimicrobianos da secreção cutânea de anfíbios do gênero Phyllomedusa; SEIXAS, R (2005) Universidade do Porto Síntese de péptidos antibióticos de origem natural; BLOCH, C (2000) Revista biotecnologia ciência & desenvolvimento ano 3 número 17 www.biotecnologia .com.br LIBERIO, M. (2008) Caracterização química e biológica da secreção cutânea do anuro Leptodactylus labyrinthicus: peptídeos antimicrobianos e anticarcinogênicos, fosfolipases e peptidases. (figuras ilustrativas). _________________________________________________________________________________ 98 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ FORMIGAS, FUNGOS, BACTÉRIAS E SEUS COMPOSTOS MISTERIOSOS Antoniazzi-Junior, R.L.1,2 e Leite, A.C.1,3 1 2 Graduando(a) em Ciências Biológicas, Universidade Federal de Ouro Preto – UFOP. E-mail: [email protected]. [email protected]. RESUMO As formigas cortadeiras são seres herbívoros de vasta importância ecológica e econômica, podendo causar prejuízos enormes na agricultura humana. Formigas cortadeiras coletam partes frescas dos vegetais e as utilizam como substrato para o cultivo de fungos em seus ninhos, estabelecendo relações mutualísticas. Mas as relações são muito mais intrincadas e complexas do que formigafungo. Envolvem diversas espécies de fungos e de formigas (Tribo: Attini), e de inúmeras bactérias. Alguns fungos são inclusive patogênicos, que contam com a ajuda de bactérias para a defesa das colônias das formigas (e da cultura de fungos), e até mesmo de outros fungos. Nesse contexto, são produzidas substâncias de várias naturezas, envolvidas na defesa, ataque ou mesmo digestão. Essas substâncias podem ser lipídicas, complexos de carboidratos ou ácidos, que são encontradas em vias metabólicas de vários animais e plantas e muitas delas com aplicabilidade nas indústrias químicas, farmacêuticas ou de cosméticos. The study of the Attini and other fungus-growing insects has only just begun, and further advance in this fascinating subject will be more difficult for the mycologist than for the entomologist. (William Morton Wheeler 1910, p. 338.) INTRODUÇÃO Os herbívoros dominantes do neotrópico são as formigas cortadeiras. Elas herbivoram cerca de 20% do crescimento vegetacional anual, mas interrompem a coleta em árvores individuais para permitir o restabelecimento desses vegetais antes de voltarem a atacá-las (Hölldobler e Wilson, 1990). Com a derrubada das florestas naturais para a prática de monoculturas, houve um desequilíbrio biológico (Cruz & Batista-Filho, 1993) e essas formigas tornaram-se muito prejudiciais à lavoura, especialmente de citros, cana-de-açúcar, café e cacau entre outras, atuando também tanto em áreas abertas quanto em florestas tropicais (Weber, 1972). As formigas cortadeiras causam prejuízos elevados aos setores florestal e agrícola, uma vez que utilizam fragmentos de vegetais frescos, destinando-os para o cultivo de culturas de fungos simbióticos em seus ninhos, do qual se alimentam (Marsaro Júnior et al, 2001). As formigas cortadeiras representam prejuízos para a agricultura humana desde os primórdios e, apesar de inúmeros estudos, o seu controle vem sendo conseguido apenas com o uso de produtos químicos, principalmente na forma de iscas contendo dodecacloro ou através da termonebulização (Couto et al, 1977; Santos et al, 1979). Com a proibição do dodecacloro para o controle de formigas cortadeiras, tornou-se necessária a busca de medidas alternativas que garantam a mesma eficiência, mas que sejam mais seguras para o meio ambiente e o homem (Laranjeiro et. al, 1995). A preocupação com o controle de formigas cortadeiras na agricultura é constante. Elas se destacam como principais pragas em florestas implantadas de Pinus e Eucalyptus e seu controle é oneroso ao cultivo (Boaretto, 1997). Por exemplo, em plantações de Pinus que tenham mais de 30 ninhos de Atta laevigata por hectare, o volume médio de árvores mais novas que 10 anos pode ser reduzida em até 50% por hectare em um ano (North et al. 1997). _________________________________________________________________________________ 99 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Figura 1: Atta Laevigata (nom. pop. Saúva). Fonte: http://www.blueboard.com/leafcutters/pics/myrmecos1_2.htm, acessado em 02/07/2010, às 11h32. Figura 2: Atta Laevigata (nom. pop. Saúva). Fonte: http://www.antweb.org/bigPicture.do?name=casent0173811&shot=p&number=1, acessado em 02/07/2010, às 11h47. Figura 3: Acromyrmex fracticornis (nom. pop. Quenquém). Fonte: http://www.myrmecos.net/myrmicinae/AcrLan1.JPG. Alex Wild. Acessado em 02/07/2010, às 11h53. Para se ter uma idéia, o professor da Faculdade de Ciências Agronômicas da Unesp-Botucatu, Luiz Carlos Forti, escreveu, no manual Formigas cortadeiras, biologia, ecologia, danos e controle que "os prejuízos atingem até 14% em florestas de eucalipto e pinus, quando ocorrem mais de quatro colônias/hectare." Segundo o professor, são necessárias 86 árvores de eucalipto e 161 de pinus para alimentar um sauveiro durante um ano. Já a quenquém, prossegue, causam prejuízo de até 30% em reflorestamento de eucaliptos quando há 200 colônias/hectare. Lavouras comercias também sofrem com o ataque. Forti afirma que a saúva mata-pasto (Atta bisphaerica) pode destruir até 3,2 toneladas de cana/hectare/formigueiro (http://www.agrobyte.com.br/formigas.htm). As formigas-cortadeiras dos gêneros Atta e Acromyrmex apresentam sistema de vida com organização social semelhante, vivem em ninhos subterrâneos e são as principais pragas florestais na América (Della Lucia, 1993). A cerca de 50 milhões de anos atrás, na América do Sul, algumas espécies de formigas abandonaram suas formas primitivas de buscar alimento e, em um evento filogenético único, adotaram a agricultura como estilo de vida. Para tanto, entraram em uma parceria com um fungo (simbiose), aprendendo a manejá-lo para produzir alimento a partir de substrato orgânico, notadamente vegetal. São formigas da tribo Attini, com 210 espécies conhecidas, concentradas, sobretudo, na América do Sul (Schultz, 1999). _________________________________________________________________________________ 100 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Os fungos permitem às formigas usarem indiretamente o vegetal como alimento, provendo enzimas que degradam os tecidos vegetais, além de os desintoxicar quanto aos metabólitos secundários que causam prejuízos às formigas (Dowd, 1992). Em troca, as formigas oferecem aos fungos condições ótimas de crescimento como umidade e substrato além de produzir uma série de compostos antibióticos e antifúngicos protegendo suas culturas de microorganismos oportunistas (Currie, 1999). Novas hipóteses em relação à teoria de simbiose fungos-formigas, sugerem que os fungos exercem um pequeno controle sobre as formigas. Evidências apontam que os fungos podem explorar as formigas para que elas possam prover substrato e defesas antimicrobiais. Além disso, evidências experimentais sugerem que os fungos conseguem selecionar seu substrato de preferência controlando o comportamento de forrageio das formigas através de um mecanismo engenhoso de feedback bioquímico (North, 1997) – semioquímica ou aleloquímica. Figura 4: Interações entre formigas cortadeiras e seus fungos mutualísticos Escovopsis Currie e colaboradores (1999) observaram que as culturas de fungos são hospedeiros ideais para um segundo tipo de fungo parasita específico, o Escovopsis (Ascomycotina), que põe em risco a sobrevivência dos organismos simbióticos. Além disso, descreveram que uma terceira relação mutua lística que envolve uma bactéria filamentosa do gênero Streptomyces produz um antibiótico específico que suprime o crescimento do fungo parasita Escovopsis. As formigas carregam essas bactérias em algumas regiões específicas da cutícula e as transmitem entre si verticalmente das mais velhas para as mais novas. Figura 5: (a) Ninho de Trachymrymex sp. com a sua cultura de fungos saudável. (b) Ninho de Trachymyrmex sp. completamente devastado pelo fungo Escovopsis. Fonte: http://www.pnas.org/content/96/14/7998/F2.expansion.html, acessado em 02/07/2010, às 12h33. _________________________________________________________________________________ 101 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Raulinoa echinata (Rutaceae) Biavatti e colaboradores (2002) realizaram a investigação fitoquímica dos extratos de caules e folhas da espécie endêmica Raulinoa echinata Cowan, Rutaceae, levando ao isolamento de alcalóides furoquino línicos (esquimianina, kokusaginina, maculina e flindersiamina) e quinolônicos (1-metil-2-nnonil-4-quinolona, 2-n-nonil-4-quinolona e 2-fenil-1-metil-4-quino lona). Os alcalóides isolados mostraram atividade antifúngica contra Leucoagaricus gongylophorus, o fungo simbionte de formigas cortadeiras (Atta spp). Figura 6: Raulinoa echinata. Fonte: http://dyckiabrazil.blogspot.com/2009/08/dyckia-brevifolia-itajai-rivervalley.html, acessado em 02/07/2010 às 13h56. Os compostos de 1 a 5 (Figura 7) tiveram resultados positivos com alta inibição no crescimento do fungo simbionte, sugerindo uma possibilidade viável no uso dessas substâncias para o controle do crescimento e/ou manutenção de colônias de formigas, visto que as relações de simbiose são obrigatórias. O que significa dizer que a morte do fungo simbionte obrigatório elimina a colônia de formigas por inanição. Figura 7: Furoquinolines: skimmianine (1), kokusaginine (2), maculine (3), flindersiamine (4) and also the quinolone derivatives: 2-n-nonyl-4-quinolone (5), 1-methyl-2-n-nonyl-4-quinolone (6) and 1-methyl2-phenyl-quino lone(7). Modificado de Biavatti et. al, 2002. Pilocarpus grandiflorus (Rutaceae) Godoy e colaboradores (2002) isolaram alguns compostos de Pilocarpus grandiflorus, dentre eles o diclorometano extraído do caule que, em concentrações de 1.000 µg.mL-1, inibiu totalmente o desenvolvimento do fungo. Figura 8: Diclorometano. _________________________________________________________________________________ 102 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Outras substâncias Dentre as inúmeras substâncias encontradas nesses seres (como produtos de excreção, defesa, ou mesmo derivados metabólicos), vale a pena citar algumas que tem uma importância no mercado. Ácido Hidroxidecanóico: Utilizado na indústria de cosméticos em cremes para peles acnéicas, possui ação bactericida. Também encontrado como metabólito secundário da síntese de ácidos graxos em Pseudomonas spp. Esquema 1: Síntese de compostos ramnosídicos. Ácido Fenilacético: Utilizado como precursor químico em laboratórios clandestinos para a fabricação de drogas ilícitas, derivadas de metanfetamina. Também faz parte da oxidação de ácidos graxos de cadeias pares (Figura 4), como composto intermediário, após a perda da cadeia carbônica. O experimento de Knoop, em cachorros, utilizando-se de carbonos marcados, revelou que eles excretavam na urina ácido fenilacetúrico, composto formado a partir do ácido fenilacético. Essa reação só foi possível ser explicada após o descobrimento da CoA, confirmando a hipótese de Knoop. Diclofenaco de sódio (Voltaren®, Biofenac®, Dorgen®) e de potássio (Cataflan®). Figura 4: Degradação de ácidos graxos de cadeia par, tendo como subproduto o ácido fenilacético (experimento de Knoop). _________________________________________________________________________________ 103 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ Ácido Indolacético: Também conhecido como auxina, é um importante hormônio vegetal de crescimento, relacionado tanto com a elongação celular, quanto com a divisão e diferenciação celular (processos conhecidos por respostas rápidas e lentas). Esse hormônio é produzido por vegetais superiores, algas, fungos (Souchie et al., 2007) e até mesmo bactérias (Assumpção et. al, 2009), proporcionando diversas possibilidades de uso na agricultura. Figura 5: Ácido indolacético. CONCLUSÕES E PERSPECTIVAS O profundo entendimento das complexas relações entre formigas, fungos e bactérias oferece excitantes possibilidades do controle e manejo de formigas na agricultura humana, otimizando a produção oferecendo menos riscos à saúde humana e ao meio ambiente. Alternativas direcionadas a qualquer um dos muitos seres, moléculas e substâncias envolvidas nesta complexa e intrincada relação podem revelar brechas para a atuação de compostos eficientes, não descartando a possibilidade de um controle biológico utiliza ndo-se de bactérias e/ou fungos, bem como suas associações. Além disso, uma relação simbiótica que remonta a mais de 50 milhões de anos, em que na coevolução entre esses organismos surgem mecanismos de defesa e, por outro lado, ataques eficientes, voltando a burlar esses ataques com novas eficientes defesas, ciclicamente (Rainha Vermelha). Podem, ainda, nos revelar surpresas na descrição de novas substâncias ou atribuição de novas aplicabilidades, ou até mesmo novas vias metabólicas de síntese ou degradação de compostos orgânicos. Extrapolando essas questões, isolar organismos dessas relações podem nos revelar cepas de fungos ou bactérias que tornem mais eficiente a produção de produtos da indústria farmacêutica, cosméticos, e química em geral, aumentando o pool gênico dos objetos de estudo da biotecnologia. REFERÊNCIAS BIBLIOGRÁFICAS ASSUMPÇÃO, L.C.; LACAVA, P.T.; DIAS, A.C.F.; AZEVEDO, J.L.; MENTEN, J.O.M. 2009. Diversidade e potencial biotecnológico da comunidade bacteriana endofítica de sementes de soja. BIAVATTI, M.W.; VIEIRA, P.C.; SILVA, M.F.G.F.; FERNANDES, J.B.; VICTOR, S.R.; PAGNOCCA, F.C.; ALBUQUERQUE, S.; CARACELLI, I. ZUKERMAN-SCHPECTOR, J. 2002. Biological Activity of Quinoline Alkaloids from Raulinoa echinata and X-ray Structure of Flindersiamine. Journal of the Brazilian chemical society, Vol. 13, n°1. COUTO, L. et alii. Avaliação da eficiência do controle de Atta sexdens rubropilosa através do sistema de termonebulização, na região de Aracruz, ES. Revista árvore, Viçosa 1(1): 9-16, 1977. CRUZ, B.P.B.; BATISTA FILHO. 1993. A manifestação da forma perfeita de Leucocoprinus gongylophorus (Moller) Heim em sauveiro artificial de Atta sexdens rubropilosa Forel. Arq. Inst. Biol., vol. 60, n° 1/2, p. 66-69. CURRIE, C.R.; SCOTT, J.A.; SUMMERBELL, R.C.; MALLOCH, D. 1999. Fungus-growing ants use antibiotic-producing bacteria to control garden parasites. Nature, vol. 398. DOWD, P.F. 1992. Insect fungal symbionts: A promising source of detoxifying enzymes. J. Ind. Microbiol. 9:149-161. GODOY, M.F.P.; SOUZA, R.C.; ZANCUL, M.S.; PANGNOCCA, F.C.; FERNANDES, J.B. 2002. Toxicidade de Pilocarpus grandiflorus para o fungo simbionte de Atta sexdens. Arq. Inst. Biol., São Paulo, vol. 69 (supl.), p.1-306. HÖLLDOBLER, B.; WILSON, O. 1990. The Ants. Harvard University Press. LARANJEIRO, A.J.; ZANÚNCIO, J.C. 1995. Avaliação da isca à base de sulfluramida no controle de atta sexdens rubropilosa pelo processo dosagem única de aplicação. _________________________________________________________________________________ 104 BIOQUÍMICA ALÉM DA BIOQUÍMICA _____________________________________________________________________________________________________ MARSARO JÚNIOR, A.L.; DELLA LUCIA, T.M.C.; BARBOSA, L.C.A.; MAFFIA, L.A.; MORANDI, M.A.B. 2001. Efeito de Secreções da Glândula Mandibular de Atta sexdens rubropilosa Forel (Hymenoptera: Formicidae) Sobre a Germinação de Conídios de Botrytis cinerea Pers. Fr. Neotropical Entomology 30(3): 403-406 (2001). NORTH, R.D.; JACKSON, C.W.; HOWSE, P.E. 1997. Evolutionary aspects of ant-fungus interactions in leaf-cutting ants. Tree, vol. 12, n.°10. SANTOS, et alii. Controle de saúvas pelo sistema de termonebulização na região de Timóteo, MG. Brasil florestal, 9(38): 18-20, 1979. SCHULTZ, T.R. 1999. Ants, plants and Antibiotics. Nature, vol. 398. SOUCHIE, E.L.; AZCÓN, R.; BAREA, J.M.; SAGGUIN-JUNIOR, O.J.; SILVA, E.M.R. 2007. Indolacetic acid production by P-solubilizing microorganisms and interaction with arbuscular mycorrhizal fungi = Produção de ácido indol acético por microorganismos solubilizadores de fosfato e sua interação com fungos micorrízicos arbusculares (2007) WEBER, N.A. 1972. Gardening ants. The Attines Memoirs of the American Philosophical Society, v. 17, n° 92, pag.146. WHEELER, W. M. 1910. Ants: their structure, development, and behavior. Colombia University Press, New York. http://www.agrobyte.com.br/formigas.htm, acessado dia 20/06/2010, às 10h32 A.M. _________________________________________________________________________________ 105
Baixar