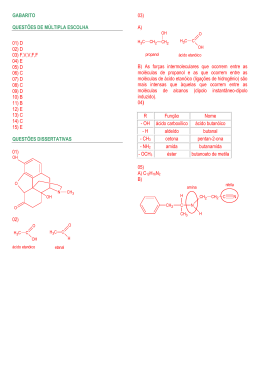
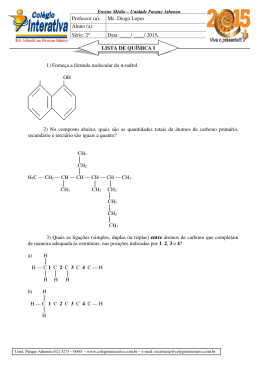
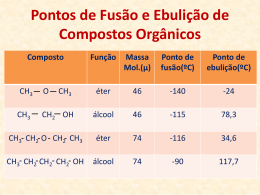
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO MARANHÃO Campus Bacabal Diretoria de Desenvolvimento de Ensino Departamento de Educação Superior de Tecnologia Curso de Licenciatura Plena em Química Disciplina: Química Geral I (60/10h) Ministrante: Prof. M.Sc. Maron Stanley Silva Oliveira Gomes 1. Considere as substâncias O2, HCl, H2O, NH3, H3CNH2, C2H5OH no estado sólido ou líquido. Indique o tipo de força intermolecular predominante em cada uma delas. 2. Os pontos de ebulição da água, amônia e metano seguem a ordem H2O>NH3>CH4. Explique essa seqüência, considerando os tipos de forças intermoleculares e suas intensidades. 3. A tensão superficial, que provém das forças de atração intermoleculares, é maior na água ou no éter etílico ? Por quê? 4. De um modo geral, o ponto de ebulição dos compostos orgânicos cresce com o aumento da massa molecular, o que não acontece com os compostos do quadro a seguir: Composto Massa molecular Ponto de ebulição (°C) HO – CH2 – CH2 – OH 62 198 HO – CH2 – CH2 – OCH3 76 125 H3CO – CH2 – CH2 – OCH3 90 83 Explique a diminuição do ponto de ebulição com o aumento da massa molecular nos compostos mencionados. 5. Como a eletronegatividade está relacionada com a polaridade? 6. Qual propriedade física é avaliada pelo momento de dipolo? Existem moléculas que possuem ligações polares mas o momento de dipolo das mesmas é nulo. Justifique esta afirmativa citando três exemplos. 7. Quais os três tipos de forças intermoleculares podem levar à interagir um conjunto de moléculas neutras? Em que circunstâncias cada uma destas forças predomina? Qual delas é a mais forte? 8. De que maneira, fatores como a massa da molécula, sua forma e tipos de interação, podem afetar as suas propriedades físicas, tais como: ponto de fusão, ponto de ebulição e solubilidade? 9. À uma mistura bifásica contendo HEXANO (CH3CH2CH2CH2CH2CH3) e METANOL (CH3OH), foram adicionados quatro compostos, cujas estruturas encontram-se dadas à seguir: CH3 CH3 H3C H3C C CH3 B HO OH HO CH2NH2 C CH3 A O C D Terminada a adição, cada um dos compostos se distribuiu preferencialmente em cada uma das fases. Baseado neste fato, responda: a) Quais os compostos estavam presentes em cada uma das fases. Justifique a sua resposta. b) Qual dentre estes compostos deve possuir o maior ponto de ebulição? E qual deve possuir o menor? Justifique a sua resposta. 10. Explique porque o CH3CH2OH é muito mais solúvel em água do que o CH3(CH3)2CH2OH 11. O ponto de ebulição da água é muito mais forte que o do HF, apesar de ambos fazerem o mesmo tipo de interação e terem pesos moleculares parecidos. Por que? 12. Responder todas as questões do capitulo 11 do livro: Química, a ciência central. Autor: BROWN
Baixar