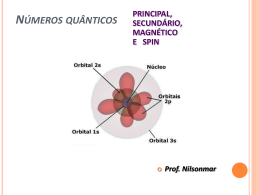
ÁTOMOS: ESTRUTURA ELETRÔNICA O que fazem os elétrons? Como eles se mantém em órbita? As leis da física eram insatisfatórias para descrever movimento de partículas tão pequenas quanto os átomos. Bohr propôs a elucidação da estrutura atômica pelo estudo da natureza da luz emitida pelas substâncias a temperatura alta ou sob influência de descarga elétrica Melhor maneira de investigar a estrutura atômica - estudo da interação dos átomos com a radiação eletromagnética Propriedades das Ondas •Todas as ondas têm um comprimento de onda característico, , e uma amplitude, A. •A frequência, , de uma onda é o número de ciclos que passam por um ponto em um segundo. •A velocidade de uma onda, v, é dada por sua frequência multiplicada pelo seu comprimento de onda. •Para a velocidade da luz = c = 2,99x108 m.s-1. λ é geralmente expresso em metros (m) ou nm (visível) ν é expressa em s-1 (hertz – Hz) Natureza Ondulatória Natureza Ondulatória •A radiação eletromagnética se movimenta através do vácuo com uma velocidade de 2,99 x 108 m/s. •As ondas eletromagnéticas têm características ondulatórias semelhantes às ondas que se movem na água. Natureza Ondulatória Energia e Fótons • Planck: a energia só pode ser liberada (ou absorvida) por átomos em pacotes, chamados quantum (mais tarde denomidos fótons). • A relação entre a energia de um fóton e a frequência é Eh onde h é a constante de Planck (6,626 10-34 J s). • O efeito fotoelétrico fornece evidências para a natureza de partícula da luz - “quantização”. Para entender a quantização, considere a subida em uma rampa versus a subida em uma escada: Para a rampa, há uma alteração constante na altura, enquanto na escada há uma alteração gradual e quantizada na altura. Energia Quantizada e Fótons Einstein supôs que a luz trafega em pacotes de energia denominados fótons. A energia de um fóton: E h hc À medida que frequência aumenta , energia aumenta À medida que comprimento de onda aumenta, energia diminui PROBLEMAS NUMÉRICO 1-Os aparelhos de CD (compact disc) operam com lasers que emitem luz vermelha com o de 685 nm. Qual é a energia de um fóton desta luz? h = 6,63x10-34 J.s (nm) ( m) 2- A luz violeta tem =410nm. Qual a sua frequência? Qual é a energia de um fóton de luz violeta? Qual a energia de 1,0 mol de fótons violeta? Compare a energia do fóton de luz violeta com a energia de um fóton de luz vermelha. Qual tem mais energia? Por qual fator? Modelo de Bohr Bohr propôs alguns postulados: • O elétron se move em torno de um núcleo em uma órbita fixa. • As órbitas do elétron são restritas, isto é, nem todas órbitas são permitidas em qualquer situação • Os elétrons em órbita NÃO emitem energia eletromagnética. Emissão de energia (ou absorção) ocorre somente na passagem de níveis. • Cada órbita tem uma energia associada, e a diferença de energia entre dois níveis é igual à energia emitida/absorvida na mudança. h E2 E1 O comportamento ondulatório da matéria • Sabendo-se que a luz tem uma natureza de partícula, parece razoável perguntar se a matéria tem natureza ondulatória. • Utilizando as equações de Einstein e de Planck, De Broglie propôs que todo tipo de matéria apresenta propriedades ondulatórias: h mv O momento, mv, é uma propriedade de partícula, enquanto λ é uma propriedade ondulatória. • De Broglie resumiu os conceitos de ondas e partículas, com efeitos notáveis se os objetos são pequenos. • Considere uma bola (0,150 Kg) se movendo a 41,6 m/s 6,626x1034 J / s (0,150Kg )(41,6m / s ) J Kgm2 s 2 6,626x1034 Kgm2 s 2 / s 1,06x1034 m Fora do espectro (0,150Kg )(41,6m / s ) eletromagnético • Um elétron na mesma velocidade: 6,626x1034 J / s (9,109x1031 Kg )(41,6m / s ) J Kgm2 s 2 6,626x1034 Kgm2 s 2 / s 5 1 , 75 x 10 m Região IV 31 (9,109x10 Kg )(41,6m / s ) O princípio da incerteza O princípio da incerteza de Heisenberg: na escala de massa de partículas atômicas, não podemos determinar exatamente a posição, a direção do movimento e a velocidade simultaneamente. •Para os elétrons: não podemos determinar seu momento e sua posição simultaneamente. Nova abordagem da estrutura atômica leva em conta natureza ondulatória do elétron, seu comportamento é descrito em termos apropriados para ondas. Modelo descreve precisamente a energia do elétron e define sua localização em termos de probabilidades. Mecânica quântica e orbitais atômicos • Schrödinger propôs uma equação que contém os termos onda e partícula. • A resolução da equação leva às funções de onda (ψ). • A função de onda fornece o contorno do orbital eletrônico. • O quadrado da função de onda fornece a probabilidade de se encontrar o elétron, isto é, dá a densidade eletrônica para o átomo. Mecânica quântica e orbitais atômicos Mecânica quântica e orbitais atômicos Orbitais e números quânticos • • • Se resolvermos a equação de Schrödinger, teremos as funções de onda e as energias para as funções de onda. Chamamos as funções de onda de orbitais. A equação de Schrödinger necessita de três números quânticos: 1. Número quântico principal, n. Informa a respeito da energia do orbital. À medida que n aumenta, o orbital torna-se maior e o elétron passa mais tempo mais distante do núcleo. n pode ser qualquer número inteiro de 1 a Mecânica quântica e orbitais atômicos Mecânica quântica e orbitais atômicos Orbitais e números quânticos • • • Os orbitais podem ser classificados em termos de energia para produzir um diagrama de Aufbau. Observe que o seguinte diagrama de Aufbau é para um sistema de um só elétron. À medida que n aumenta, o espaçamento entre os níveis de energia torna-se menor. Mecânica quântica e orbitais atômicos Orbitais e números quânticos Representações dos orbitais Orbitais s • • Todos os orbitais s são esféricos. À medida que n aumenta, os orbitais s ficam maiores. Representações dos orbitais Orbitais p • • • • • • Existem três orbitais p, px, py, e pz. Os três orbitais p localizam-se ao longo dos eixos x-, y- e z- de um sistema cartesiano. As letras correspondem aos valores permitidos de ml, -1, 0, e +1. Os orbitais têm a forma de halteres. À medida que n aumenta, os orbitais p ficam maiores. Todos os orbitais p têm um nó no núcleo. Representações dos orbitais Orbitais p Representações dos orbitais Orbitais d e f • • • • • Existem cinco orbitais d e sete orbitais f. Três dos orbitais d encontram-se em um plano bissecante aos eixos x-, y- e z. Dois dos orbitais d se encontram em um plano alinhado ao longo dos eixos x-, y- e z. Quatro dos orbitais d têm quatro lóbulos cada. Um orbital d tem dois lóbulos e um anel. Representações dos orbitais Representações dos orbitais • Elétron comporta-se como se tivesse uma rotação, como a Terra. • A descrição completa de um elétron em um átomo requer quatro números quânticos: n, l, ml, ms Atribuição dos elétrons Configuração eletrônica dos íons • Para formar um cátion a partir de um átomo neutro, um ou mais elétrons de valência são removidos: Na: 1s2 2s2 2p6 3s1 Na+: [1s2 2s2 2p6 ]+ eÁtomos e íons com elétrons desemparelhados são paramagnéticos (podem ser atraídos por um campo magnético). Do contrário são ditos diamagnéticos. • Exercícios 1- Dê a configuração eletrônica do enxofre, usando as notações spdf, do gás nobre e de orbitais em caixas. Z=16 2- Dê a configuração eletrônica do cobre, e dos seus íons +1 e +2. Algum desses é paramagnético? Quantos elétrons desemparelhados há em cada um deles? Z=29 3- Utilizando a configuração eletrônica condensada para elétrons mais internos e de quadrículas para elétrons de valência, determine o número de elétrons desemparelhados nos seguintes átomos: Ti - (Z=22) Ga - (Z=31) Rh - (Z=45) I - (Z=53) 4- Dê a configuração de orbitais em caixas para K+ e Cl-.
Download