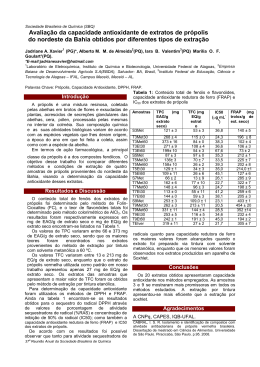
UNIVERSIDADE DE SÃO PAULO CENTRO DE ENERGIA NUCLEAR NA AGRICULTURA LUCIANA REGINA MANGETI BARRETO MOURÃO Estudo in vivo da atividade antioxidante da própolis vermelha brasileira Piracicaba 2013 LUCIANA REGINA MANGETI BARRETO MOURÃO Estudo in vivo da atividade antioxidante da própolis vermelha brasileira Versão revisada de acordo com a Resolução CoPGr 6018 de 2011 Tese apresentada ao Centro de Energia Nuclear na Agricultura da Universidade de São Paulo para a obtenção do título de Doutor em Ciências Área de Concentração: Energia Nuclear na Agricultura e no Ambiente Orientador: Prof. Dr. Severino Matias de Alencar Coorientador: Prof. Dr. Pedro Luiz Rosalen Piracicaba 2013 AUTORIZO A DIVULGAÇÃO TOTAL OU PARCIAL DESTE TRABALHO, POR QUALQUER MEIO CONVENCIONAL OU ELETRÔNICO, PARA FINS DE ESTUDO E PESQUISA, DESDE QUE CITADA A FONTE. Dados Internacionais de Catalogação na Publicação (CIP) Seção Técnica de Biblioteca - CENA/USP Mourão, Luciana Regina Mangeti Barreto Estudo in vivo da atividade antioxidante da própolis vermelha brasileira / Luciana Regina Mangeti Barreto Mourão; orientador Severino Matias de Alencar; coorientador Pedro Luiz Rosalen. - - Versão revisada de acordo com a Resolução CoPGr 6018 de 2011Piracicaba, 2013. 93 f.: il. Tese (Doutorado – Programa de Pós-Graduação em Ciências. Área de Concentração: Energia Nuclear na Agricultura e no Ambiente) – Centro de Energia Nuclear na Agricultura da Universidade de São Paulo. 1. Antiinflamatórios não-esteróides 2. Estresse oxidativo 3. Experimentos animais 4. Isoflavonas 5. Produtos naturais 6. Radicais livres 7. Ratos Wistar 8. Resinas vegetais I. Título CDU (635.077 + 66.094.3-097.8) : 636.028 Ao meu esposo Gerson e aos meus pequenos raios de luz Gabriel e Giovana, razões do meu viver e os pilares que sustentam meu castelo encantado. Ofereço Aos meus pais Jair e Toninha, meus exemplos maiores de amor, dedicação e moral. Dedico AGRADECIMENTOS Meu primeiro agradecimento vai a Ele, o Pai, aquele que não desampara nem abandona. Aquele que mesmo quando me esquecia de que Ele estava ali, bem do meu lado, me envolvia em seus braços e sussurrava em meus ouvidos sem que eu percebesse “Vá, continue, eu estou aqui”. Obrigada Deus, obrigada Jesus, meu Mestre. Agradeço eternamente aos meus pequenos “monstrinhos”, meus filhos Gabriel e Giovana por todo o apoio e paciência comigo em todos os momentos em que eles foram os alvos de minhas explosões de estresse. Um obrigada especial ao Gabriel que me dizia: “mãe, tá acabando, aguenta mais um pouco, você vai conseguir”. Te amo filho, e você tinha razão!!! Agradeço ao meu eterno amor Gerson, que sempre confiou mais em mim do que eu mesma, e que mesmo me puxando as orelhas às vezes, me mostrava o lado racional do trabalho e me dizia todas as vezes que não tinha nenhuma dúvida que eu conseguiria. Aos meus pais Jair e Toninha pela eterna ajuda com os pequenos, comigo, por sempre nos amar tanto... amor esse que nos impulsiona pra vida e nos faz seguir o caminho reto, aquele caminho que vocês sempre me mostraram e que agora mostro para os meu filhos. Amo vocês! Agradecimento muito especial ao meu orientador Professor Dr. Severino, meu professor, o cientista admirável que me mostrou que a simplicidade e a honestidade, acima de tudo, valem sempre a pena. Obrigada por todos os ensinamentos e toda compreensão. Ao Professor Dr. Pedro Rosalen, que além de ser meu co-orientador, foi muito mais do que isso. Obrigada pela ajuda em todas as dificuldades, os ensinamentos, a amizade e a possibilidade de realização de nossos experimentos, mesmo quando nem tudo corria bem como imaginávamos. À minha querida amiga e coorientadora Rosângela que me ensinou praticamente tudo que sei hoje sobre experimentação com animais de laboratório. Rô, sem você muita coisa não teria sido feita. Sou eternamente grata. Aos amigos queridos José Bento e Fernanda Rezende que sempre torceram tanto por mim e que se tornaram amigos e parceiros tão especiais. Amo vocês queridos! Às minhas queridas amigas e as técnicas mais competentes que conheço: Ivani e Adna. Muito obrigada por toda ajuda, pelas conversas, pela paciência comigo. Às minhas queridas amigas e companheiras de laboratório: Priscila, Patrícia, Juliana, Maria Augusta, Keityane, Valéria, Heloisa e até os que já se foram: Gilberto, Margarida e minha eterna “Tata” Tatiane Oldoni... você me faz muita falta. Todos moram no meu coração em um lugar especial que se manterá intacto para sempre. Um agradecimento especial à Lucimara (Lú), por tudo! Por toda ajuda técnica, por toda força moral, pelo companheirismo, pelas conversas, pelas noites no biotério, por ficar com meus filhos... nossa, tanta coisa!!! Você se tornou minha irmãzinha mais nova que amarei pra sempre. Outro agradecimento especial á minha amiga Ana Paula, por toda a dedicação em me ajudar nos momentos que tinha dúvida em desenvolver qualquer assunto que diz respeito à própolis. Ana você é demais! Super obrigada. Ao órgão de fomento e pesquisa CNPq pelo auxílio financeiro para a realização do trabalho. A todos os integrantes da seção de Pós Graduação do CENA/USP: Neuda, Cláudia, Fábio, Sônia e Daiane, por toda compreensão, ajuda e apoio em todas as horas solicitadas. À Professora Dra. Adriana Martinelli pela compreensão, amizade principalmente nos momentos em que precisava me ausentar das disciplinas para amamentar minha pequena Giovana. A todos que de uma forma ou de outra, sempre torceram por mim, me ajudaram e rezaram, para que essa etapa da minha vida fosse concluída. Obrigada! Término de uma etapa... início de outras que virão...vamos lá, a fila anda, e o tempo não para! O negócio é continuar! “Por vezes sentimos que aquilo que fazemos é senão uma gota de água no mar. Mas o mar seria menor se lhe faltasse uma gota.” Madre Teresa de Calcutá RESUMO MOURÃO, L. R. M. B. Estudo in vivo da atividade antioxidante da própolis vermelha brasileira. 2013. 90 f. Tese (Doutorado) - Centro de Energia Nuclear na Agricultura, Universidade de São Paulo, Piracicaba, 2013. Dentre os produtos naturais que contém compostos secundários com atividade biológica, está a própolis, uma resina coletada por abelhas Apis mellifera de diversas partes da planta com atividades biológicas tais como, antimicrobiana, antiinflamatória, cicatrizante, anestésica, antiviral e antioxidante. Um tipo diferente de própolis e com perfil químico peculiar, foi denominada de própolis vermelha, a qual possui alto teor de compostos fenólicos, principalmente da classe dos isoflavonoides. De acordo com a literatura, esta própolis possui alta atividade antioxidante in vitro, porém estudos sobre o efeito antioxidante in vivo ainda não são conhecidos. Portanto, o objetivo desse trabalho foi avaliar a atividade antioxidante in vivo do extrato etanólico da própolis vermelha brasileira (EEP) por modelo de experimentação animal, assim como comparar o desempenho in vivo do EEP com antioxidantes de alta atividade e efetividade em sistemas biológicos. Para certificação do alto potencial antioxidante da própolis vermelha utilizada, conforme relatado na literatura , o EEP foi caracterizado quanto ao seu potencial antioxidante por várias metodologias in vitro, além de análises da composição química das substâncias não voláteis e voláteis. A avaliação do perfil químico do EEP incluiu análises como espectrofotometria na região ultravioleta visível, teor de compostos fenólicos totais, cromatografia líquida de alta eficiência (CLAE), cromatografia gasosa acoplada com espectrometria de massas (CG-EM) e CG/EM-Headspace. Para as análises da atividade antioxidante in vitro foram utilizadas as metodologias de CLAE on-line, sequestro do radical ABTS•+; poder de redução do ferro (FRAP) e capacidade de absorbância de radicais de oxigênio (ORAC). No ensaio de avaliação da atividade antioxidante in vivo foi utilizado um delineamento experimental com 50 ratos Wistar machos, divididos em 7 tratamentos: Controle Normal (CTL/N), Controle estressado (CTL-J/APAP), Ácido Ascórbico (AA–J/APAP), Quercetina (Q-J/APAP), Própolis na dose de 150mg/kg (P150-J/APAP), 300mg/kg (P300-J/APAP) e 600mg/kg (P600-J/APAP). Todos os animais, com exceção do grupo CTL/N, foram tratados por 15 dias com os antioxidantes via intragástrica, e, ao 16º dia foram estressados com 800mg/kg de acetaminofen (APAP), via intragástrica, submetidos a 12 horas de jejum e então anestesiados e sacrificados para retirada de sangue e fígado para as análises de função hepática (enzimas ALT, AST e γGT), atividade de sequestro de radical superóxido no plasma pela enzima Superóxido Dismutase (SOD), Western Blot para as enzimas SOD e CAT, análise ORAC de plasma e fígado e histopatologia do tecido hepático. O EEP apresentou alto teor de compostos fenólicos (266,8 mg/g) e a presença de isoflavonoides e pterocarpanos, tais como liquiritigenina, isoliquiritigenina, vestitol, neovestitol, formononetina, biochanina, medicarpina, 3,4-diidroxi-9-metoxipterocaroano e 3,8-diidroxi-9-metoxipterocarpano, os quais são peculiares da própolis vermelha. Além disto, foram encontradas altas concentrações das substâncias voláteis -cubebeno e germacreno D, as quais não são as substâncias majoritárias da própolis vermelha de outras regiões. O EEP também apresentou elevado potencial antioxidante in vitro, tendo o valor de 4,26 mmol/g equivalente de Fe++ para o FRAP, 4,84 e 19.779,7 mmol de trolox para o ABTS e o ORAC, respectivamente. O APAP na dose e via de administração utilizada não gerou um estresse intenso para ser detectável por meio de alguns intermediários de vias e/ou rotas que respondem ao alto potencial oxidante. Porém, e de acordo com os resultados dos ensaios in vivo, a concentração para uso como antioxidante contra o estresse oxidativo se situa entre 150 a 300mg/kg. Portanto, a própolis vermelha brasileira além de alto potencial antioxidante in vitro também apresenta potencial antioxidante benéfico in vivo. Palavras chave: Própolis vermelha. Atividade antioxidante in vivo. Estresse oxidativo. Acetaminofen. ABSTRACT MOURÃO, L. R. M. B. In vivo antioxidant activity study of Brazilian Red Propolis. 2013. 90 f. Thesis (PhD). Center for Nuclear Energy in Agriculture, University of São Paulo. Piracicaba, 2013. Propolis is one of the natural products containing secondary compounds with biological activity. Propolis is a resin collected by honeybees from various plant parts and has several biological activities such as antimicrobial, anti-inflammatory, healing, anesthetic, antioxidant and antiviral. The Brazilian red propolis is a different type of propolis with a peculiar chemical profile compared to other types of Brazilian propolis, containing a high content of phenolic compounds, especially isoflavones. The literature reports that this propolis has high in vitro antioxidant activity, but studies on the in vivo antioxidant effects are still scarce. Therefore, this study investigated the in vivo antioxidant activity of the ethanol extract of Brazilian propolis (EEP) using animal experiments model. We also compared the in vivo EEP performance with high antioxidant activity and effectiveness in biological systems. To evaluate the high antioxidant propolis potential, as reported in the literature, the EEP was characterized for its in vitro antioxidant potential in various methodologies, as well as in analyses of the chemical composition of volatile and non-volatile substances. The evaluation of EEP chemical analyses included visible spectrophotometry in the ultraviolet region, total phenolic content, high performance liquid chromatography (HPLC), gas chromatography coupled with mass spectrometry (GC-MS) and GC/MS-Headspace. For in vitro analyses of antioxidant activity, we used the online HPLC methods, sequestration of ABTS•+ radicals, Ferric Reducing Antioxidant Power (FRAP) and Oxygen-Radical Absorbance Capacity (ORAC). To assess in vivo antioxidant activity, we used an experimental design with 50 male Wistar rats divided into 7 treatments: Normal Control (N/CTL), Stressed Control (CTL-J/APAP), Ascorbic Acid (AAJ/APAP), Quercetin (QJ/APAP), Propolis at 150mg/kg (P150-J/APAP), 300mg/kg (P300-J/APAP) and 600mg/kg (P600-J/APAP). All animals, except for the N/CTL group, were treated for 15 days with intragastric antioxidants, and on the 16th day, they were stressed with 800mg/kg of acetaminophen (APAP), intragastrically. Afterwards, they underwent a 12-hour fast, then, anesthetized and sacrificed to collect blood and liver for analyses of liver function (ALT, AST and GT enzymes), activity of superoxide radical sequestration in plasma by the enzyme Superoxide Dismutase (SOD), Western Blot for SOD and CAT enzymes, ORAC analysis of plasma and liver histopathology and liver tissue. The EEP showed high content of phenolic compounds (266.8 mg/g) and the presence of isoflavones and pterocarpans such as liquiritigenin, isoliquiritigenin, vestitol, neovestitol, formononetin, biochanin, medicarpin, 3,4-dihydroxy-9-methoxy pterocarn and 3,8-dihydroxy-9-methoxy pterocarpan, which are peculiar to the red propolis. Moreover, we found high concentrations of volatile -cubebeno and germacrene D, which are not the majority of substances in propolis from other regions. The EEP also showed high in vitro antioxidant activity, with 4.26 mmol/g equivalent of Fe++ for FRAP, 4.84 and 19779.7 mmol of trolox for ABTS and ORAC, respectively. The APAP in the dose and route of administration used did not generate intense stress detectable through some intermediate routes and/or routes that respond to the high oxidizing potential. However, according to the results of in vivo analysis, the concentration for use as an antioxidant against oxidative stress ranges from 150 to 300mg/kg. Therefore, the Brazilian red propolis has high in vitro antioxidant potential as well as beneficial in vivo antioxidant potential. Keywords: Propolis. In vivo antioxidant activity. Oxidative stress. Acetaminophen. LISTA DE FIGURAS Figura 1 - Fontes exógenas e endógenas de produção de ERO e ERN. Sistemas de defesa antioxidante enzimático e não enzimático, quando eficientes mantendo a homeostase e quando ineficientes, instalando estresse oxidativo causando danos às macromoléculas como DNA, proteínas, lipídios, que se expressam como envelhecimento ou doença (VASCONCELOS et al., 2007). ............................ 27 Figura 2 - Aspecto da exudação da resina vermelha pela leguminosa Dalbergia ecastophyllus (L) taub (a); Elaboração da própolis vermelha pelas abelhas Apis mellifera com a resina coletada (b e c); Aspecto do extrato etanólico da própolis vermelha (EEP) após extração e evaporação sob baixa pressão (d)............... 34 Figura 3 - Curva de decaimento de diferentes concentrações de Trolox. Pontos de concentração utilizados como curva de calibração para análise de ORAC (OU, HAMPSCH-WOODILL e PRIOR, 2001). .......................................................... 38 Figura 4 - Esquema da instrumentação para a análise CLAE-FR-DPPH on line45 Figura 5 - Esquema de cores do marcador de peso molecular Bio-Kaleidoscope Prestained Standards catalog #161-0324 para identificação e detecção de proteínas. ......................................................................................................................... 51 Figura 6 - Esquema representativo do funcionamento de um micrótomo tipo rotativo (ALBERTS et al., 2004). ................................................................................... 53 Figura 7 - Espectro de absorção UV-Visível do EEP da propolis vermelha brasileira ......................................................................................................................... 54 Figura 8 - Cromatograma obtido pela técnica de HPLC (CLAE) do EEP detectado a 280 nm; Compostos identificados para EEP: 1-ácido ferúlico; 2-liquiritigenina; 3quercetina; 4-vestitol; 5-neovestitol; 6-isoliquiritigenina; 7-formononetina; 8biochanina. ....................................................................................................... 56 Figura 9 - Cromatograma obtido por CG-EM do EEP da própolis vermelha. O nome do composto referente a cada pico está descrito na tabela 1. ......................... 58 Figura 10 - Cromatogramas obtidos pela técnica HPLC. A:Comatograma do EEP detectado a 280 nm; B: Cromatograma da atividade antioxidante on-line, após reação com DPPH. Compostos identificados para EEP: 1-ácido ferúlico; 2liquiritigenina; 3-quercetina; 4-vestitol; 5-neovestitol; 6-isoliquiritigenina; 7formononetina; 8-biochanina A. Para os picos da atividade antioxidante on-line, númERO iguais correspondem ao mesmo composto. ..................................... 63 Figura 11 - Tabela de contrastes ortogonais realizados para o modelo experimental apresentado, onde, cada cor representa as variáveis que foram contrastadas totalizando 6 contrastes possíveis com os sete tratamentos............................ 65 Figura 12 - A- Atividade da enzima ALT (U/L) e respectivos de desvios padrão; BTabela de contrastes ortogonais com valores de p. .........................................67 Figura 13 - A- Atividade da enzima ALT (U/L) e respectivos desvios padrão; BTabela de contrastes ortogonais com valores de p. .........................................68 Figura 14 - A- Valores médios de ORAC do plasma em equivalente de trolox e respectivos desvios padrão; B- Tabela de contrastes ortogonais com valores de p. ..........................................................................................................................71 Figura 15 - A- Média dos valores de ORAC do extrato de fígado em equivalente de trolox e desvio padrão; B- Tabela de contrastes ortogonais com valores de p. 72 Figura 16 - A- Valores médios de SOD em plasma, expresso como porcentagem de inibição de NBT e desvios padrão; B- Tabela de contrastes ortogonais com valores de p...................................................................................................................74 Figura 17 - Cromatogramas obtidos pela metodologia de atividade antioxidante online do plasma dos animais: A- Plasma de animal CTL-N; B- Plasma de animal CTLJ/APAP; C- Plasma de animal P300-J/APAP e D- Plasma de animal P600-J/APAP. ..........................................................................................................................76 Figura 18 - A: Western Blot da enzima Superóxido Dismutase I. Cada membrana possui 1 animal de cada tratamento. Detecção da enzima sem sinais visíveis de degradação. B: Western Blot da enzima Catalase. Cada membrana possui 1 animal de cada tratamento. As falhas visíveis não são resultado de degradação. Foram utilizadas amostras dos mesmos animais para ambos os filmes. 1-CTL/N; 2-CTLJ/APAP; 3-AA-J/APAP; 4-Q-J/APAP; 5-P150-J/APAP; 6-P300-J/APAP; 7-P600J/APAP; P-Padrão de SOD 800ng/ml...............................................................78 Figura 19 - Imagens de lâminas de histopatologia hepática, corada pelo processo Hematoxilina e Eosina. CTL/N (a); CTL-J/APAP (b); P150-J/APAP (c); P300-J/APAP (d); P600-J/APAP (e) ........................................................................................79 LISTA DE TABELAS Tabela 1 - Composição química do EEP da própolis vermelha analisada pela técnica de CG-EM Esquema da instrumentação para a análise CLAE-FR-DPPH on line . ......................................................................................................................... 57 Tabela 2 - Compostos voláteis (em porcentagem) identificados na própolis vermelha e seus respectivos índices e tempos de retenção............................................ 60 Tabela 3 - Valores de atividade antioxidante in vitro para as metodologias de FRAP e ABTS................................................................................................................ 64 Tabela 4 - Valores das enzimas de função hepática Alanina amino transferase (ALT), Aspartato amino Transferase (AST) e Gama Glutamil Transferase (γGT). Valores das médias de cada tratamento +/- o erro padrão. Para letras iguais, valores sem diferença significativa; para letras diferentes, valores com diferença significativa com nível de p individual para cada contraste. ........................................................ 66 SUMÁRIO 1. INTRODUÇÃO ................................................................................................. 21 1.1. Objetivos ...................................................................................................... 22 1.1.1. Objetivo Geral........................................................................................... 22 1.1.2.Objetivos Específicos ............................................................................... 22 2.REVISÃO DE LITERATURA ............................................................................ 24 2.1. Mecanismos antioxidantes de defesa ....................................................... 24 2.2. Antioxidantes naturais................................................................................ 25 2.3. Estresse oxidativo....................................................................................... 26 2.4. Acetaminofen X Estresse Oxidativo Hepático .......................................... 29 2.5. Enzimas de Função Hepática ..................................................................... 31 2.6. A Própolis .................................................................................................... 32 2.7. Compostos Bioativos Identificados e Isolados De Própolis ................... 35 2.8. Mensuração do Radical Peroxila em Sistemas......................................... 37 2.9. Enzima Superóxido Dismutase X Capacidade Sequestrante de Radical Superóxido.......................................................................................................... 39 2.10. Western Blotting de Enzimas ................................................................... 40 3. MATERIAL E MÉTODOS ................................................................................ 41 3.1. Ensaios In Vitro ........................................................................................... 41 3.1.1. Coleta de Material ...................................................................................... 41 3.1.2. Tratamento das amostras de própolis bruta ............................................... 41 3.1.3. Preparo do extrato etanólico da própolis (EEP) ......................................... 41 3.1.4. Caracterização química dos compostos não voláteis................................. 42 3.2. Atividade Antioxidante In Vitro .................................................................. 44 3.2.1. Atividade Antioxidante on-line por CLAE-FR.............................................. 44 3.2.2. Atividade antioxidante on-line por CLAE-FR modificada para amostras de plasma. .............................................................................................................................. Erro ! Indicador não definido. 3.2.3 Poder antioxidante de redução do ferro (Método FRAP) ............................. 45 3.2.4. Atividade antioxidante pelo método do ABTS •+.......................................... 46 3.2.5. Capacidade de absorbância de radicais de oxigênio (ORAC) .................... 46 3.3. Ensaios para Avaliação da Atividade Antioxidante In Vivo ..................... 47 3.3.1 Ensaios In Vivo ............................................................................................ 47 4. RESULTADOS E DISCUSSÃO ....................................................................... 54 4.1. Ensaios In Vitro............................................................................................ 54 4.1.1. Caracterização química da própolis vermelha ............................................ 54 4.2. Ensaios In Vivo e Ex Vivo ........................................................................... 65 4.2.1. Função hepática e instalação do estresse.................................................. 65 4.2.2. Atividade antioxidante X Estresse Oxidativo Induzido por APAP ............... 70 4.2.3. Atividade antioxidante on-line do plasma por HPLC ................................... 75 4.2.3. Análises qualitativas ................................................................................... 77 5. CONCLUSÕES ................................................................................................ 80 REFERÊNCIAS .................................................................................................... 1. INTRODUÇÃO A utilização de recursos naturais para uso terapêutico é muito antiga, e por muito tempo, os produtos naturais como minerais e vegetais constituíram o arsenal terapêutico de muitas civilizações. Muitas culturas utilizaram estes produtos por serem os principais, ou mesmo a única matéria prima para elaboração de medicamentos (PINTO et al., 2002). Atualmente, tanto no âmbito científico como no comercial, há uma procura cada vez mais crescente por produtos naturais, justamente pela grande diversidade de atividades biológicas que podem apresentar. Aliado a isto, a população também está mais atenta para os produtos naturais, principalmente os derivados de plantas que, sabidamente, vários não possuem efeito tóxico ou possuem menos efeitos colaterais do que as drogas sintéticas (MILNER, 1999; CHANDRASEKARAN et al., 2010). A abordagem terapêutica para utilização de produtos naturais na medicina convencional ainda é uma conduta alternativa, geralmente ignorada pela prática médica, devido à falta de informação científica adequada e evidência clínica (FONTANAROSA; LUNDBERG, 1988; YUAN; LIN, 2000). Assim, numerosos estudos in vitro têm sido realizados, porém não têm sido suficientes para o uso e/ou aplicação in vivo. Com isso, a utilização de modelos animais e humanos se torna essencial para validar cientificamente a eficácia e a segurança do uso terapêutico dos produtos naturais (PETRONILHO et al., 2012). Os produtos naturais possuem uma grande variedade de compostos secundários, os quais são responsáveis por várias atividades biológicas. Dentre esses compostos estão os flavonoides e os isoflavonoides, responsáveis principalmente pela atividade antioxidante, ou seja, do sequestro de radicais livres, por exemplo. Esses compostos são também importantes constituintes de vários vegetais consumidos pelo homem (KUHNAU, 1976; KEY et al., 1996). Os isoflavonoides possuem diversos efeitos biológicos e farmacológicos, como antioxidantes, antibacterianos, antivirais, anti-inflamatórios entre outros (COMWELL; COHICK, 2004; DASTIDAR et al., 2004). Entre os produtos naturais que contém esses compostos está a própolis, a qual é uma resina coletada por abelhas de diversas partes das plantas como brotos, botões florais e exudados resinosos, e tem sido utilizada há séculos na medicina popular. A própolis tem atraído a atenção de pesquisadores nas últimas décadas por apresentar várias atividades biológicas, como atividade antimicrobiana, antiinflamatória, cicatrizante, anestésica, antiviral e antioxidante (BURDOCK, 1998; CHEN et al., 2003; NAGAI et al., 2003, 2004; ISHIKAWA et al., 2004; KUMAZAWA et al., 2004; GHISALBERTI, 1979; BANKOVA et al., 1989; KHAYYAL et al., 1993; KUJUMGIEV et al., 1999; MARCUCCI et al., 2001; MONTPIED et al., 2003; CUNHA et al., 2004; ALENCAR et al., 2007; OLDONI et al., 2011), bem como aplicação nas indústrias farmacêutica e alimentícia (ACKERMANN, 1991) apesar de nem toda própolis possuir atividade biológica. Um tipo diferente de própolis e com perfil químico bastante peculiar, quando comparado aos outros tipos de própolis brasileiras, foi denominada de própolis vermelha (SILVA et al., 2007). Nessa própolis foi encontrada uma coloração vermelha intensa e um alto teor de compostos fenólicos, principalmente isoflavonoides. Estudos preliminares in vitro demonstraram que este tipo de própolis possui altas atividades antimicrobiana e principalmente antioxidante (OLDONI et al., 2011), sugerindo que ensaios in vivo devem ser realizados para avaliar essas propriedades em sistemas biológicos mais complexos, como por modelos de experimentação animal, e principalmente para a atividade antioxidante. 1.1. Objetivos 1.1.1. Objetivo Geral Avaliar a atividade antioxidante in vivo do extrato etanólico da própolis vermelha brasileira por modelo de experimentação animal bem como verificar todos os efeitos gerados pelas diferentes doses e pelo estresse gerado, já que não há relatos de testes in vivo para essa própolis. 1.1.2. Objetivos Específicos -Avaliar a composição química volátil e não volátil do extrato etanólico bruto da própolis vermelha brasileira (EEP); - Avaliar a atividade antioxidante in vitro do extrato etanólico da própolis vermelha brasileira; - Avaliar comparativamente o desempenho in vivo do EEP com antioxidantes de alta atividade e efetividade em sistemas biológicos (Vitamina E e Vitamina C); - Avaliar o perfil cromatográfico do plasma dos animais tratados com as doses de própolis e submetidos ao estresse por Acetaminofen por HPLC; - Avaliar o potencial antioxidante de extratos de fígado e plasma de ratos por ensaio de captura do radical peroxila (ORAC); - Avaliar a capacidade sequestrante da enzima Superóxido Dismutase no fígado e no plasma, dos animais tratados e não com própolis. - Avaliara instalação do estresse pelo Acetaminofen e o modo de ação da própolis no fígado através das enzimas de função hepática Gama Glutamil Transferase (γGT), Aspartato Amino Transferase (AST) e Alanina Amino Transferase (ALT) no plasma dos animais; - Avaliar por meio de exames histopatológicos se a própolis vermelha causa dano nos tecidos animais. 2. REVISÃO DA LITERATURA 2.1. Mecanismos antioxidantes de defesa Compostos com atividade antioxidante têm recebido atenção especial por apresentarem capacidade de sequestrarem e/ou reagirem quimicamente com radicais livres. A oxidação é parte fundamental da vida aeróbica e do nosso metabolismo e, assim, os radicais livres são produzidos naturalmente ou por alguma disfunção biológica. Esses radicais livres cujo elétron desemparelhado encontra-se centrado nos átomos de oxigênio ou nitrogênio são denominados Espécies Reativas de Oxigênio (ERO) ou Espécies Reativas de Nitrogênio (ERN). No organismo, encontram-se envolvidas na produção de energia, fagocitose, regulação do crescimento celular, sinalização intercelular e síntese de substâncias biológicas importantes. No entanto, seu excesso apresenta efeitos prejudiciais e causa diversos danos à célula, como câncer, doenças neurodegenerativas, anemia, isquemia, além da oxidação da LDL, o que pode levar a problemas cardiovasculares (RICE-EVANS, 2004; KOTSINAS et al., 2012). O excesso de radicais livres no organismo é combatido por antioxidantes produzidos pelo corpo, endógenos, ou absorvidos da dieta. A primeira linha endógena de defesa antioxidante são as enzimas antioxidantes. Sabe-se que no fígado é onde se encontra o maior arsenal dessas enzimas que combatem os radicais livres ou Espécies Reativas de Oxigênio (ERO). Por isso, para o estudo de compostos antioxidantes se faz importante avaliar a sua ação no órgão em questão. Cada enzima antioxidante é responsável por uma ação protetora específica contra as ERO ou ERN, conforme descrito a seguir: 1. Linha de proteção que atua como detoxificadora dos agentes antes de causar a lesão: enzimas superóxido dismutase (SOD), catalase (CAT), glutationa peroxidase (GPx), os metabólitos da glutationa reduzida (GSH) e Vitamina E; 2. Linha de defesa que tem a função de reparar a lesão ocorrida: enzimas glutationa redutase (GR), GPx, os metabólitos ácido ascórbico e GSH (KODYDKOVÁ et al., 2009) Em virtude de todos os danos trazidos pelo estresse oxidativo, há um grande interesse por antioxidantes exógenos que revertam ou protejam esse processo, principalmente se for componente de alimentos naturais como frutas e plantas (CHUN et al., 2005). Como exemplo de compostos antioxidantes naturais provenientes da dieta, podemos citar o -tocoferol (vitamina E), -caroteno (pro- vitamina A), ácido ascórbico (vitamina C) e os compostos fenólicos. Além disto, estudos epidemiológicos, clínicos e de intervenção, demonstram, cada vez mais, evidências de que os antioxidantes podem prevenir ou diminuir o desenvolvimento de muitas doenças (BARREIROS, 2007). 2.2. Antioxidantes naturais Os sistemas antioxidantes também estão presentes nas plantas que, por meio de metabolismo específico, produzem substâncias como taninos, fenóis, alcaloides, lignanas, cafeína e aminas (SOUSA et al., 2013; COTELLE, 2005; OKADA; OKADA; SAGESAKA, 2010). Assim, alguns desses compostos fenólicos de plantas, possuem como propriedade antioxidante, eliminar radicais livres e quelar metais reativos (CHUN et al., 2005). A própolis é um produto natural que contém em sua composição, compostos fenólicos e várias outras substâncias que conferem a esse produto atividade antioxidante, pois removem radicais livres em excesso (PARK et al., 2000; ALENCAR et al., 2007). Alguns pesquisadores atribuem ao CAPE (éster fenílico do ácido caféico), um composto fenólico da própolis europeia, grande potencial antioxidante. Porém, Russo, Longo e Vanella (2002) verificaram que mesmo com a remoção da CAPE, os extratos de própolis continuaram a apresentar atividade antioxidante, demonstrando que outros compostos, possivelmente flavonoides, também possuem atividade antioxidante. Os compostos fenólicos se encontram amplamente distribuídos no reino vegetal e em microrganismos, fazendo parte também do metabolismo animal. São multifuncionais como antioxidantes, pois atuam de várias formas: combatendo os radicais livres, doando um átomo de hidrogênio de um grupo hidroxila (OH) da sua estrutura aromática, quelando metais de transição, como o Fe2+ e o Cu+; interrompendo a reação de propagação dos radicais livres na oxidação lipídica; modificando o potencial redox do meio e reparando moléculas atacadas por radicais livres (PODSEKEK, 2007; MIN; EBELER, 2008). Também bloqueiam a ação de enzimas específicas que causam inflamação; modificam as rotas metabólicas das prostaglandinas (VALCO et al., 2006); protegem a aglomeração plaquetária e inibem a ativação de carcinógenos (LIU, 2005). Em outros estudos, também foi encontrado que atuam contra alergias, inflamações, hepatotoxinas, alguns vírus, úlceras e tumores; aumentam a resistência dos vasos sanguíneos e bloqueiam as enzimas que produzem estrógeno (MILES et al., 2005; PUKASKAS et al., 2005). Além da atividade antioxidante direta, vários estudos têm destacado as múltiplas funções e mecanismos importantes relacionados à habilidade dos compostos fenólicos de se ligarem a receptores celulares e a transportadores de membranas, influenciarem a expressão gênica, a sinalização e a adesão celular (MANACH et al., 2005; BEZERRA et al., 2012). A proteção do DNA é outro mecanismo antioxidante relevante para prevenção de mutações e da carcinogênese. Vários antioxidantes como o ascorbato, o tocoferol e os compostos fenólicos podem proteger o material genético dos efeitos deletérios provocados pelas ERO, ERN e metais (FERRARI, 2001). Um parâmetro bioquímico utilizado para se observar essa proteção é a fragmentação de DNA. Mishima et al. (2005), ao testarem o efeito citotóxico dos extratos aquoso (WEP) e etanólico (EEP) da própolis vermelha, em células de leucemia mielóide HL-60, observaram fragmentação de DNA dessas células, sugerindo a inibição do crescimento das mesmas. Concluíram assim, que essa inibição de crescimento se dá não só pela citotoxicidade direta, mas também por mediação de apoptose. Esses mesmos autores também realizaram ensaios de expressão de genes das células HL-60 e constataram que as culturas tratadas com EEP e com WEP expressaram dois genes responsáveis pela diferenciação em células granulocíticas, inibindo a formação de células de leucemia mielóide. 2.3. Estresse oxidativo Constantemente, no organismo humano, são geradas ERO e ERN no próprio metabolismo fisiológico, na presença de algum processo inflamatório, disfunção biológica ou até mesmo provenientes de alimentos (BARREIROS et al., 2006) (Figura 1). Figura 1 - Fontes exógenas e endógenas de produção de ERO e ERN. Sistemas de defesa antioxidante enzimático e não enzimático, quando eficientes mantendo a homeostase e quando ineficientes, instalando estresse oxidativo causando danos às macromoléculas como DNA, proteínas, lipídios, que se expressam como envelhecimento ou doença (VASCONCELOS et al., 2007) Na figura acima, é possível observar as fontes e respostas celulares às ERO e ERN, derivados de enxofre (ERS), de Cloro (ERCl), de Carbono (ERC) e metais de transição [M n+) ]. Essas espécies são geradas no metabolismo normal em organelas como mitocôndrias, peroxissomas e em várias enzimas citosólicas assim como também existem fontes exógenas de produção dessa ER. Porém, os sistemas de defesa antioxidante enzimático e não enzimático, quando são eficientes, conseguem manter a homeostase fisiológica ou, se ineficientes, permitem a instalação do estresse oxidativo. Esse estresse é representado pelo dano celular em macrmoléculas como DNA, proteínas e lipídios, com expressão clínica no envelhecimento, ou vários tipos de doenças (VASCONCELOS et al., 2007) Nesse sentido, qualquer estímulo que leve a produção excessiva de espécies reativas e/ou à depleção de antioxidantes, conduz a uma alteração significativa do balanço entre a produção e a remoção de espécies reativas, como os radicais livres (DRÖGE, 2002; URSO; CLARKSON, 2003). Entre as ERO, o mais potente oxidante em sistemas biológicos é o radical hidroxil (OH•), com um tempo de vida extremamente curto (1x10-9 s) e alta reatividade a uma grande variedade de moléculas orgânicas, pois necessita somente de mais um elétron para se estabilizar (ROVER JÚNIOR; HÖ; VELLASCO 2001). Se o radical hidroxil for produzido próximo ao DNA, e a este DNA estiver fixado um metal, poderão ocorrer modificações de bases purínicas e pirimidínicas levando à inativação ou mutação desse DNA, pois esse radical se combina com extrema rapidez ao metal ou até mesmo a outros radicais. O radical hidroxil pode também iniciar a oxidação dos ácidos graxos poli-insaturados das membranas celulares (lipoperoxidação) (DIAS; MOURA; D´ANGELIS, 2011). Os metais de transição, como o ferro e o cobre, têm ação catalítica na formação de lesões oxidativas decorrentes da produção de radical hidroxil (GUTTERIDGE; HALLIWELL, 2000), sendo que o ferro é o metal mais abundante no organismo, por atuar como cofator importante para várias enzimas. As duas reações de oxirredução mais importantes, responsáveis pela formação de radical hidroxil, com efetiva participação de ferro ou cobre, são as reações de Fenton e a de Haber-Weiss (KEHRER, 2000; DUTTA et al., 2001): Reação de Fenton/Haber-Weiss: H2O2 + Fe2+(Cu+) 1) Fe3+(Cu2+) + O-.2 2) Fe2+(Cu+) + H2O2 HO• + HO- + Fe3+(Cu2+) Fe2+(Cu+) + O2 Fe3+(Cu2+) + HO• + HO SOMA: O2-. + H2O2 HO• + O2 + HO- Quando acontece o desbalanço da quantidade produzida de ERO e a remoção destas pelos sistemas antioxidantes, se tem então um estresse oxidativo, causador de danos moleculares às estruturas celulares com consequente alteração funcional e prejuízo das funções vitais (DRÖGE, 2002). Esses danos podem ser observados em diversos tecidos e órgãos, tais como fígado, músculo e tecido adiposo (RAMESH et al., 2012), vascular e cerebral (MARNETT et al., 2000; FENSTER et al., 2002; KEYNES; GARTHWAITE, 2004). Por um lado as ERO oxidam importantes estruturas celulares como as macromoléculas, por outro lado também participam do sistema de defesa contra uma infecção em que os fagócitos são estimulados a produzirem ERO com a finalidade de destruir microrganismos (POULSEN et al., 2000). De qualquer forma, sabe-se que as ERO estão envolvidas em vários processos fisiológicos assim como em vários eventos patológicos como a mutação de DNA, carcinogênese, envelhecimento, atEROclEROe, danos por radiação, inflamação, diabetes mellitus, doenças neurodegenerativas e injúrias tóxicas, incluindo toxicidade aguda e crônica por álcool (DAS VASUDEVAN, 2007). 2.4. Acetaminofen X Estresse Oxidativo Hepático Acetaminofen (APAP; N-acetil-p-aminofenol) é uma droga analgésica, antipirética, muito utilizada e eficiente em doses terapêuticas. Porém o uso excessivo de APAP pode causar uma superprodução de Espécies Reativas de Oxigênio (ERO), durante a formação de N-acetil-p-benzoquinonemina (NAPQI) pelo citocromo P450 (DAHLIN et al., 1984; YEN et al., 2007). Esse mecanismo foi sugerido por James et al. (2003) para explicar o desenvolvimento de estresse oxidativo e injúria de hepatotoxicidade induzida pelo APAP. Em doses suficientemente altas, o APAP causa depleção de GSH, deixando o NAPQI livre para ligar a proteínas hepáticas essenciais, como APAPcisteina, que por fim desenvolve a necrose hepática. Os hepatócitos necrosados liberam para a circulação as enzimas hepáticas resultando alterações na atividade de outras enzimas metabólicas e integridade celular. A toxicidade do APAP é, portanto, em função do montante de NAPQI formado e a capacidade de GSH hepático utilizada para a desintoxicação desse metabólito tóxico. Porém, a toxicidade de APAP pode ser reduzida pela prevenção da depleção da defesa de antioxidantes endógenos e pela utilização de antioxidantes exógenos (NIRALA; BHADAURIA, 2008; SLIKKER JUNIOR et al., 2004). Portanto, overdoses de APAP resultam na geração de radicais livres, seguido de depleção do tripeptídeo glutationa (JAESCHKE; BAJT, 2006), que participa ativamente do mecanismo antioxidante endógeno. Para os compostos que assumidamente possuem efeito hepatoprotetor, o modelo de overdose de APAP em roedores, especialmente ratos, é um modelo experimental muito popular em sistemas in vivo utilizados atualmente (CAMPOS et al., 1989; CHEN et al., 2009; GAO; ZHOU, 2005; HAU et al., 2009; HSU et al., 2008; KUPELI et al., 2006; WANG et al., 2010; WU et al., 2008, 2010, YUAN et al., 2010). Este modelo possui a vantagem de ter sua toxicidade associada à dose e, em geral tornam o experimento fácil de ser realizado. No entanto, após mesmos vários anos de pesquisa, ainda não há uma informação substancial na literatura sobre os mecanismos de instalação da hepatoxicidade do APAP (HINSON et al., 2004; JAESCHKE et al., 2003; JAESCHKE; BAJT, 2006, 2010; NELSON, 1990; NELSON; BRUSCHI, 2001). De todos os mecanismos conhecidos, alguns estão bem estabelecidos e outros não; alguns estão corretos e outros distorcidos por condições experimentais, tornando o processo um tanto quanto controverso. A hepatotoxicidade do APAP é então de certa forma complexa e a interpretação dos dados gerados in vivo, torna-se às vezes difícil (JAESCHKE et al., 2010). Para o mecanismo de injúria hepática causada por APAP, geralmente é utilizado o modelo in vivo para ratos ou hepatócitos primários de ratos. Dentro desse modelo, os animais são utilizados em jejum ou alimentados, com injeção intraperitoneal ou intragástrica, fatores que estão diretamente ligados à dose que será utilizada e à resposta a injúria. Ratos são menos sensíveis ao APAP, portanto, em administração intragástrica, a dose recomendada é de 1g/kg para gerar uma injúria moderada (JAESCHKE et al., 2011). Estudos prévios relataram a presença de 3-nitrotirosina em fígados de ratos tratados com APAP. Sua ocorrência coincide nos hepatócitos centrolobulares com aductos de APAP-proteína desenvolvendo necrose (HINSON et al., 1998). Foi postulado que a espécie reativa de nitrogênio peroxinitrito, formada pela rápida reação da superóxido com oxido nítrico, foi importante no que diz respeito à toxicidade gerada. Peroxinitrito é tanto um agente de nitração como também um agente oxidante e é detoxificado pela GSH, a qual está diminuída em intoxicação por APAP (AGARWAL et al., 2010; SIES et al., 1997; MITCHEL et al., 1973). Seo et al. (2003) investigaram o efeito protetor de extrato etanólico de própolis proveniente da Coréia em hepatotoxicidade induzida por APAP em hepatócitos de ratos ecamundongos. Foi explorado o potencial dessa própolis em inibir a fase I das enzimas envolvidas na ativação metabólica do APAP, e também de induzir a fase II de conjugação das enzimas que serviriam para desintoxicar o produto reativo formado. No que se diz respeito à solubilização do APAP em meio hidrofílico, testes pilotos prévios realizados por nosso grupo de pesquisa verificaram que há uma considerável dificuldade na solubilização do APAP em solução de propilenoglicol a 40%. Apesar disto, Yen et al. (2007) preconizam que doses de 835mg/kg são consideradas como ideais para instalação de um estresse oxidativo hepático. Em consulta na literatura, verificou-se que a melhor solubilidade para o acetaminofen é o propilenoglicol (100%), na concentração máxima de 0,962 mol/L-1, o que equivale a 145,42g mol/L-1 à temperatura de 40ºC (JIMENEZ E MARTÍN, 2006). Dessa forma, e também por não ser um agente carcinogênico, o APAP foi a droga escolhida para a indução do estresse oxidativo no modelo animal para a avaliação do potencial antioxidante in vivo da própolis vermelha brasileira. 2.5. Enzimas de função hepática Ao ocorrer alguma lesão hepática, principalmente se essa lesão se tratar de danos celulares, há a liberação de enzimas que, por esse motivo, aumentam seus níveis séricos e fornecem informações importantes em relação ao grau da lesão. As transaminases, como a Alanina amino transferase (ALT) e Aspartato amino transferase (AST), são duas enzimas que geralmente são mensuradas em casos de lesão hepática, sendo que a ALT possui uma especificidade maior que a AST. Essas enzimas catalisam a transferência reversível dos grupos amino de um aminoácido para o -cetoglutarato, e essas reações exercem papéis centrais tanto na síntese como na degradação de aminoácidos, além de atuarem como ponte entre metabolismo dos aminoácidos e carboidratos (BRUNS et al., 1981). 2.6. A própolis A própolis é uma mistura de substâncias resinosas de diversas fontes vegetais, recolhidas pelas abelhas (Apis mellifera) e utilizada para vedar os orifícios nos favos de mel e proteger a colmeia da entrada de predadores. A própolis tem sido usada popularmente na medicina tradicional desde cerca de 300 aC (BURDOCK, 1998; OLDONI et al., 2011). Além de sua atividade biológica, tem sido utilizada com frequência em fórmulas farmacêuticas (THOMSOM W.M., 1990). Recentemente a própolis tem ganhado popularidade como um suplemento alimentar saudável e por esse motivo, tem sido extensivamente utilizada em alimentos e bebidas em diferentes partes do mundo, com o apelo de melhorar a saúde e prevenir doenças como câncer, inflamação, doenças cardíacas e diabetes, por exemplo (BANSKOTA; TEZUKA; KADOTA, 2001; BEZERRA et al., 2012). A composição da própolis é muito variável, mas em geral é composta por 50% de resina e bálsamo vegetal, 30% de cera, 10% de óleos essenciais e aromáticos, 5% de pólen e 5% de outras substâncias variadas, incluindo resíduos orgânicos. Devido à grande complexidade química, é considerada uma das misturas mais heterogêneas encontradas em fontes naturais, e hoje mais de 300 constituintes já foram identificados e/ou caracterizados em diferentes amostras de própolis (BURDOCK, 1998). O maior grupo de compostos já identificados na própolis foram os flavonoides, largamente encontrados no reino vegetal, os quais junto com os ácidos fenólicos são os componentes responsáveis pela atividade contra vários micro-organismos patogênicos (ISLA et al., 2005). Os compostos fenólicos presentes na própolis pode expandir a capacidade das células de neutralizar o estresse oxidativo e prevenir a apoptose (NOEL et al., 2000). A própolis possui atividade antioxidante no fígado, rins e trato gastrointestinal, onde provavelmente seus compostos se acumulam, influenciando esses tecidos mesmo do lado de fora da célula (MORENO et al., 2000). As diferentes variedades de própolis brasileiras foram classificadas em 12 grupos e testadas quanto as suas atividades biológicas, sendo que as que apresentaram as melhores atividade foram as dos grupos 3, (proveniente do Rio Grande do Sul); 6 (proveniente da Bahia) e 12 (proveniente de Minas Gerais) (PARK et al., 2000). As própolis dos tipos 3 e 12 foram as que apresentaram as maiores atividades antioxidante (PARK et al., 2000; MENSOR et al., 2001; AHN et al., 2004). Em acréscimo, Park et al. (2000) demonstraram que a própolis brasileira tipo 6 é altamente citotóxica contra quatro diferentes células tumorais. A própolis brasileira tem a sua composição química bastante diversificada, devido principalmente ao fato da rica biodiversidade do país. Portanto é necessária a investigação deste produto natural como uma importante fonte de novas substâncias bioativas, tais como ácidos fenólicos e seus derivados (BANKOVA; POPOV; MAREKOV; 1989; KIMOTO et al., 1998), flavonoides (BANKOVA; POPOV; MAREKOV; 1982; OLDONI et al., 2011) e outros compostos com propriedades farmacológicos e funcionais. A cor da própolis é normalmente amarela escura ou marrom, porém um tipo peculiar de própolis, com uma composição química rica em isoflavonoides e uma coloração vermelha intensa, encontrada em Alagoas , foi denominada de própolis vermelha (ALENCAR et al., 2007) (Figura 2). Silva et al. (2008) verificaram que as abelhas recolhiam exudatos sobre a superfície da Dalbergia ecastophyllum (L) Taub para elaboração desta própolis (Figura 2a). Após estudos desses autores, sobre o perfil químico comparativo entre a própolis a resina vegetal, pela técnica de Espectrometria de Massas, concluíram que a origem botânica da própolis vermelha brasileira é a espécie D. ecastophyllum. Figura 2 - Aspecto da exudação da resina vermelha pela leguminosa Dalbergia ecastophyllus (L) taub (a); Elaboração da própolis vermelha pelas abelhas Apis mellifera com a resina coletada (b e c); Aspecto do extrato etanólico da própolis vermelha (EEP) após extração e evaporação sob baixa pressão (d) Para a maioria das própolis, flavonoides e compostos fenólicos são os principais constituintes (IVANOVSKA et al., 1995), os quais possuem efeitos benéficos como antioxidantes naturais (BASNET et al., 1997; OLDONI et al., 2011), prevenindo o dano oxidativo do DNA ocasionado por espécies reativas de oxigênio. Tais efeitos antioxidantes podem ser o resultado de uma combinação da inativação dos radicais juntamente com uma interação das funções enzimáticas (BENKOVIC et al., 2007). É suposto que alguns compostos presentes na própolis são absorvidos e entram na circulação sanguínea onde se comportam como antioxidantes hidrófilos, recuperando a vitamina C, por exemplo (SUN et al., 2000). Segundo Badhauria e Nirala (2009), o extrato etanólico bruto da própolis reverte a lesão hepática subcrônica induzida por tetracloreto de carbono, além da toxicidade aguda induzida por Acetaminofen (APAP) (NIRALA; BHADAURIA, 2008). Frente a esses resultados, e a outros estudos já realizados in vitro, verifica-se a necessidade de estudos mais aprofundados para as atividades biológicas das própolis brasileira em modelos de experimentação animal, com o objetivo de avaliar as potencialidades biológicas não mais in vitro, mas in vivo. 2.7. Compostos bioativos identificados e isolados de própolis Estudos já demonstraram a existência de pelo menos trezentas substâncias em amostras de própolis, com a predominância de flavonoides, aldeídos aromáticos, ácidos fenólicos e alguns oligoelementos (BURDOCK, 1998; BANKOVA et al., 2005; ALENCAR et al., 2007; SILVA et al., 2005; OLDONI et al., 2011). Em consequência disto, trabalhos sobre a utilização de própolis aumentaram substancialmente, e devido aos resultados altamente promissores, ocorreu uma maior procura pelo produto in natura, tornando-se um atrativo no incremento da exploração econômica do setor apícola (INOUE et al., 2007). Vários trabalhos de isolamento e identificação química têm demonstrado a diversidade de compostos biologicamente ativos nas própolis das mais diversas regiões do mundo. Dentre eles podemos citar, por exemplo, o estudo de Schneidweind et al. (1975) que isolaram e identificaram 14 flavonoides de própolis europeia: crisina, tectocrisina, 5-hidroxi-4',7-dimetoxiflavona, ramnocitrina, galangina, isalpinina, pinostrobina, 5-hidroxi-4',7-dimetoxiflavanona e pinocembrina. Os outros cinco flavonoides sacuranetina, isolados pinobanksina (pectolinarigenina, e quercetina-3,3'-dimetil pinobanksina-3-acetato), nunca foram éter, antes encontrados em amostras de própolis. Aga et al. (1994) isolaram três ácidos aromáticos com atividade antimicrobiana da própolis verde brasileira (tipo 12): ácido 3,5-diprenil-4hidroxicinâmico (artepilin C), ácido 3-prenil-4-dihidroxicinamoloxicinâmico e ácido 2,2-dimetil-6-carboxietenil-2H-1-benzopirano. Ácidos diterpênicos possuem atividade antimicrobiana (SALOMÃO et al., 2004), antitumor (ORSOLIC et al., 2006) e antioxidante (SIMÕES et al., 2004). Da mesma forma, os terpenoides, tais como os tri, sesqui, di e pentacíclicos são frequentemente encontrados em própolis brasileira (SALATINO et al., 2005). O éster feniletil do ácido caféico (CAPE), isolado de amostras de própolis de clima temperado, demonstrou possuir atividades biológicas importantes para o ser humano, incluindo o aumento na sensibilidade à radiação das células cancerosas (CHEN et al., 2005), atividade anti-inflamatória e diminuição da resistência a insulina (BEZERRA et al., 2012). Banskota et al. (1998) isolaram e identificaram 23 compostos em amostras de própolis brasileira. Destes, um novo composto foi identificado como um derivado do cromano prenilado (3-hidroxi-2,2 dimetil-8-fenilcromano-6-ácido propenóico) (1). Os outros compostos, já conhecidos, foram identificados como: 2,2-dimetil-8- fenilcromeno-6- ácido propenóico (2); 2,2-dimetilcromeno-6-ácido propenóico (3); 2,2-dimetilcromeno-6- ácido carboxílico (4); artepelin (5); 4-dihidrocinamoiloxi-3ácido fenilcinâmico (6); 4- hidroxi-3-ácido fenilcinâmico (7); vanilina (8); aldeído coniferil (9); ácido isocupréssico (10); 15-acetoxiisocupressico ácido (11); ácido agático (12); ácido agático 15-metil éster (13); ácido agatálico (14); ácido cupréssico (15); tremetona (16); viscidona (17); 12- acetoxiviscidona (18); betuletol (19); canferide (20); ermanina (21); 3,5,7-trihidroxi-4'- metoxiflavanol (22) e acetato coniferil dimérico (23). Os compostos 4, 7, 12-19 e 22 foram isolados pela primeira vez em própolis. As benzofenonas polipreniladas são outro grupo de compostos bioativos que tem sido encontrado em amostras de própolis da Venezuela e Cuba (HERNANDÉZ et al., 2005) e Brasil (CASTRO et al., 2009). Castro et al. (2009) isolaram da própolis brasileira do tipo 6 uma nova bezofenona prenilada com alta atividade antibacteriana, demonstrando assim que os ácidos graxos não são os compostos bioativos responsáveis pela atividade antimicrobiana desta própolis, conforme sugerido anteriormente por Duarte et al. (2006). Na própolis produzida no Nordeste brasileiro (Teresina – PI) foram encontrados seis triterpenoides inéditos derivados do cicloartano (ácido mangiferólico, ácido isomangiferólico, ácido mangiferônico, 24-metileno-cicloartano3 ,26-diol, ácido ambólico e ácido ambônico) (SILVA et al., 2005). Triterpenoides pentacíclicos também já foram identificados em extratos de própolis provenientes da região sudeste do Brasil (TEIXEIRA et al., 2006). Oldoni et al. (2011) isolaram duas isoflavonas bioativas (vestitol e neovestitol) juntamente com uma chalcona (isoliquiritigenina) da própolis vermelha brasileira. Os isoflavonoides, dentre eles as isoflavonas, apresentam diversas atividades biológicas, como atividade antimicrobiana (CUSHINE; LAMB, 2005; OLDONI et al., 2011), anticâncer (AWALE et al., 2008) e antioxidante (TRUSHEVA et al., 2006), além de estarem associados a diversos benefícios para a saúde, como prevenção de doenças cardiovasculares (PICCINELLI et al., 2005), redução do colesterol, prevenção da osteoporose e alívio dos sintomas da menopausa (LEE et al., 2006). Já a atividade antimicrobiana das chalconas parece está relacionada com a presença das hidroxilas nas posições C-2’, C-4 e C-4’. A presença desses compostos na própolis vermelha demonstra uma grande diversidade de compostos bioativos e, sendo assim, estudos para avaliação do efeito biológico in vivo deste tipo de própolis são extremamente necessários para uma futura aplicação terapêutica. 2.8. Mensuração do radical peroxila em sistemas Dentre as diversas técnicas utilizadas atualmente para a verificação de atividade antioxidante está a Capacidade de Absorção de radicais de Oxigênio (ORAC), principalmente para amostras de produtos naturais e alimentos, além de amostras biológicas, sendo considerada nesse caso, como uma metodologia ex vivo. O ORAC é um teste amplamente aplicado para se verificar o potencial antioxidante em humanos, animais, plasma proteínas DNA, extratos de plantas, produtos naturais e alimentos (DÁVALOS; GÓMEZ; BARTOLOMÉ, 2004). Originalmente Cao et al. (1993) propuseram o ensaio ORAC utilizando - ficoeritrina (B-PE) como molécula alvo. Neste ensaio é mensurado a atividade antioxidante sequestrante induzida perante o radical peroxil 2,2’-azobis(2-dicloridrato amidinopropano) (AAPH) a 37°C (CAO et al., 1995; CAO et al., 1996). Neste modelo a B-PE foi a sonda fluorescente escolhida, pois a perda da fluorescência da B-PE é o indicador da extensão do dano no radical peroxila, causado pela reação contendo o antioxidante a ser testado. Porém, esses mesmos autores constataram que a B-PE utilizada como sonda de fluorescência, tinha como característica uma variabilidade em sua emissão de fluorescência, provavelmente relacionada com o processo de isolamento dessa proteína de sua matriz Porphyridium cruentum, que apresentava mudança de lote para lote. Além disso, foi observado que havia uma B-PE com os flavonoides presentes majoritariamente na maioria dos antioxidantes testados, ocasionando uma falsa queda nos valores ORAC (TANAKA et al., 2001; KOJIMA et al., 1999) Por esse motivo, a fluoresceína e seus derivados começaram a ser eleitos como sondas fluorescentes para detecção de biomoléculas, por se contrastarem em suas características da B-PE. A fluoresceína (FL) é um composto sintético com elevado rendimento quântico de fluorescência a um pH>7,0 (φ=0,78) e longos comprimentos de onda (492/515 nm, de excitação/emissão), além do que a FL não apresenta interação com outros compostos. Possui alta estabilidade em leitora de placas de 96 poços, o que torna o método mais acessível (OU; HAMPSCHWOODILL; PRIOR, 2001). O efeito protetor do antioxidante contido na reação é medido pela avaliação da área sobre a curva (AUC) de decaimento da fluorescência em comparação a um controle ou branco, que não possui antioxidante presente no ensaio, como mostrado na Figura 3. A sensibilidades na utilização do método ORAC-FL é bastante alta, o que se faz necessário, muitas vezes, várias diluições para as amostras testadas (OU; HAMPSCH-WOODILL; PRIOR, 2001). Figura 3 - Curva de decaimento de diferentes concentrações de Trolox. Pontos de concentração utilizados como curva de calibração para análise de ORAC (OU; HAMPSCH-WOODILL; PRIOR, 2001) 2.9. Enzima superóxido dismutase x capacidade sequestrante de radical superóxido Perante o desafio de um estresse oxidativo, os sistemas biológicos laçam mão de alternativas endógenas para reverter esse processo. A primeira alternativa é a ativação de enzimas antioxidantes que sequestram os radicais gerados pelo estresse, na tentativa de recuperar os possíveis danos causados. A Superóxido Dismutase (SOD) faz parte dessa primeira linha de defesa endógena contra a toxicidade dos radicais superóxidos gerados no estresse, pois catalisa a decomposição desses radicais. O radical superóxido pode desencadear a geração de outros radicais como o hidroxil e o peroxil. O superóxido em meio ácido forma rapidamente peróxido de hidrogênio e, em meio neutro ou pH alto, a dismutação ocorre pela SOD. Alguns autores relatam que o radical superóxido possui baixa reatividade molecular, tornando duvidosa a sua capacidade de causar danos importantes nas estruturas celulares (ANDRADE JUNIOR et al., 2005) A SOD cataliza a conversão do radical superóxido (O2.-) em peróxido de hidrogênio e oxigênio molecular, atuando juntamente com outras enzimas como a catalase, glutationa peroxidase na prevenção dos danos causados pela ação de radicais como superóxido, hidroxil e peróxido de hidrogênio (EWING; JANERO, 1995). Sabe-se que existem 3 formas de SOD: SOD1, encontrada no citoplasma e que tem em seu centro reativo cobre e zinco; SOD2, encontrada nas mitocôndrias e tem em seu centro reativo manganês e SOD3, encontrada no líquido extracelular e que, assim como a SOD2, também possui cobre e zinco em seu centro (LI et al., 2005). A alteração da atividade dessa enzima pode ser associada ao aparecimento de várias patologias, por isso, tornou-se frequente a mensuração de sua atividade celular. A maioria dos ensaios usa um sistema de geração de radicais superóxido pelo fato do mesmo apresentar um decaimento espontâneo. Assim, no ensaio observa-se a capacidade da solução de inibir a reação do radical superóxido (PESKIN; WINTERBOURN, 1999). 2.10. Western blotting de enzimas Western Blott é uma técnica utilizada para visualização e identificação de proteínas onde as transferências de Western detectam proteínas em amostras biológicas com alta sensibilidade. Alguns procedimentos são mais comuns para Western como SDS-PAGE, onde a separação é realizada de acordo com o seu tamanho, transferindo para uma membrana de imobilização e utilizando dois anticorpos para a detecção propriamente dita (BERGENDAHL; GLASER; BURGESS, 2003). Por meio de um anticorpo primário, há o reconhecimento específico da proteína de interesse sobre a membrana onde é aplicado o blot após ter sido bloqueada com BSA (albumina bovina) ou leite desnatado seco, com o intuito de saturar a membrana com proteína prevenindo a ligação inespecífica do anticorpo com a membrana. Com o anticorpo secundário, faz-se o reconhecimento do primário de acordo com a origem (anticorpo de cabra anti-IgG de rato com o de origem mouse), já que se liga a todas as imunoglobulinas do organismo particular que o anticorpo primário foi isolado (DENNIS-SYKES et al., 1985). 3.MATERIAL E MÉTODOS 3.1. Ensaios in vitro Para verificação do alto potencial antioxidante in vitro da própolis vermelha utilizada neste estudo, conforme a literatura preconiza, após a obtenção do extrato etanólico bruto (EEP) foram realizados ensaios de caracterização química e atividade antioxidante. 3.1.1. Coleta de Material As amostras de própolis foram obtidas de coletores colocados nas caixas de abelhas Apis mellifera, em um apiário localizado na cidade de Marechal Deodoro, próximo à região de mangue, Estado de Alagoas (SL 09.40 e WL 35.41). 3.1.2. Tratamento das amostras de própolis bruta A amostra de própolis bruta, um total de 2Kg, foi limpa retirando-se a poeira, pedaços de madeira, abelhas mortas, traças e qualquer outro tipo de material estranho. Em seguida, foi triturada com auxílio de nitrogênio líquido, homogeneizada, pesada e armazenada a -18ºC. 3.1.3. Preparo do extrato etanólico da própolis (EEP) Para o preparo do extrato etanólico de própolis (EEP) foram pesados 100g de própolis triturada, obtidos conforme o item 3.1.2, e transferido para frasco de vidro contendo 450 mL de etanol Puro para Análise (P.A). A extração foi realizada a 70ºC em banho de água termostatizado, por 30 minutos, sob agitação constante. Os frascos foram acondicionados em freezer a - 4ºC overnight para a separação da cera. Em seguida foi realizada uma filtração e o filtrado, denominado Extrato Etanólico de Própolis (EEP), foi transferido para um frasco de vidro com tampa de rosca. Posteriormente, o EEP foi concentrado a baixa pressão. 3.1.4. Caracterização química dos compostos não voláteis 3.1.4.1. Espectrofotometria na região ultravioleta-visível A determinação do espectro de absorção foi realizada baseando-se no método descrito por Silva et al. (2007). Uma alíquota do EEP, na concentração de 90 ppm, foi utilizada para determinação do espectro na região UV-Visível, na faixa de comprimento de onda de 200 a 600 nm, em um espectrofotômetro UV Mini 1240 (Shimadzu Co.). 3.1.4.2 Teor de compostos fenólicos totais O teor de compostos fenólicos totais do EEP foi determinado pelo método colorimétrico de Folin-Ciocalteau (SINGLETON et al., 1999). Este método tem como princípio a oxidação de fenóis por um reagente amarelo heteropoliácido de fosfomolibdato e fosfotungstênio (reagente de Folin-Ciocalteau). A medida colorimétrica é realizada a partir de um complexo azul Mo-W que se forma na reação em meio alcalino (SINGLETON; ROSSI, 1965). Para a determinação de fenólicos totais, uma solução do EEP de 100ppm (0,5 mL) foi misturada com 2,5 mL do reagente Folin-Ciocalteau diluído 1:10 e 2,0 mL de Na2CO3 4%. A absorbância foi medida a 740 nm depois de duas horas de incubação no escuro a temperatura ambiente. Os resultados do teor de compostos fenólicos totais foram expressos como equivalentes de ácido gálico (mg AG/g). 3.1.4.3. Cromatografia Líquida de Alta Eficiência (CLAE) em fase reversa As análises por CLAE em fase reversa do EEP foram feitas de acordo com o método descrito por Alencar (2007). Quinze microlitros do extrato na concentração 1% foram injetados em um cromatógrafo líquido acoplado a um detector de arranjo de fotodiodos a 260 nm e detector de fluorescência em série com uma coluna de fase reversa C18 (250 x 4,6 mm) com tamanho de partícula de 5 m. A fase móvel utilizada foi água/ácido acético (19:1, v/v) (solvente A) e metanol (solvente B), com vazão constante de 1 mL/min. O gradiente iniciou com 40% do solvente B até 60% de B em 45 minutos, 90% em 60 minutos até 75 minutos, 40% de B em 85 minutos. A coluna foi mantida a uma temperatura constante de 30° C e os cromatogramas foram processados utilizando software Class Vp. Os compostos foram identificados pelo espectro de absorção na região ultravioleta, utilizando os recursos do detector de arranjo de fotodiodos, pela comparação do tempo de retenção e co-cromatografia de padrões. Neste trabalho, foram utilizados os seguintes padrões autênticos de flavonoides e ácidos fenólicos (Extrasynthese Co.): quercetina, canferol, apigenina, crisina, acacetina, galangina, kanferide, isosacuranetina, sacuranetina, ácido pcumárico, ácido cafeico, ácido gálico, ácido cinâmico, ácido ferrúlico, formononetina, isoliquiritigenina e liquiritigenina. 3.1.4.4. Caracterização química por Cromatografia Gasosa Espectrometria de Massas (CG-EM) dos compostos não voláteis acoplada com A analise por CG-EM do EEP foi realizada de acordo com o método modificado descrito por Proestos et al. (2006). Uma massa de 10mg foi adicionado de 100µL de N-metil-N-(trimetilsilil)-trifluoroacetamida (MSTFA) para derivatização. Em seguida, as amostras silanizadas foram analisadas em um cromatógrafo gasoso (Shimadzu GC 2010) acoplado a espectrômetro de massas (Shimadzu QP 2010 Plus) e equipado com uma coluna capilar (RTX5MS 30m x 0,25mm x 0,25µL). A programação de temperatura iniciou em 80ºC (1 minuto), a uma taxa de aquecimento de 20ºC/minuto alcançou 250ºC (1 minuto) passou a 300ºC (5 minutos) a uma taxa de 6ºC/minuto, a 310ºC (5 minutos) a uma taxa de 15ºC/minuto e a 320ºC (10 minutos) a uma taxa de 20ºC/minuto, totalizando 40 minutos de analise. Hélio foi utilizado como gás de arraste. A temperatura do injetor foi de 280ºC e o volume de injeção foi de 0,5µL no modo “splitless”. A interface foi mantida a 280ºC e o detector operou no modo “scanning” (m/z 40-800), com modificações. A integração foi feita por meio do software Lab Solutions-GCMS. Flavonoides, ácidos fenólicos e derivados foram identificados por comparação com os dados obtidos do CG-EM (tempo de retenção e fragmentação iônica) de padrões autênticos da Extrasynthese Co. silanizados (quercetina, kanferol, apigenina, crisina, acacetina, galangina, canferide, isosacuranetina, sacuranetina, acido p-cumárico, ácido cafeico, ácido gálico, ácido cinâmico, ácido ferrúlico, isoliquiritigenina e liquiritigenina) eluídos nas mesmas condições e com a biblioteca Wiley ®8. 3.1.4.5. Caracterização química dos compostos aromáticos por CG/EM-Headspace A extração em headspace foi realizada com 1g de própolis a 100°C por 15 minutos. A fase de vapor (1mL) foi injetada no cromatógrafo a gás acoplado a um espectrômetro de massas modelo Shimadzu QP 2010 plus. A injeção foi realizada em modo splitless e o hélio foi utilizado como gás de arraste a uma vazão de 1 mL/minuto. A temperatura do injetor foi de 220°C. Uma coluna capilar de sílica fundida (5% fenil-95% polidimetilsiloxano, 30m x 0,25mm x 0,25µm) foi utilizada na separação dos compostos. A temperatura da coluna foi programada de 40°C (2 minutos) a 200°C, a uma taxa de 4°C/minutos. O espectrômetro de massas foi operado em um modo de ionização por impacto de elétrons a 70 eV e massa de varredura 4-60 Da. As temperaturas da fonte de íons e da interface CG/EM foram de 200 e 230°C, respectivamente. Os compostos foram identificados por comparação de seus espectros de massas com as bibliotecas do equipamento (Wiley® 8 e 1,2 FFNSC). 3.2. Atividade antioxidante in vitro 3.2.1. Atividade Antioxidante on-line por CLAE-FR O método on-line para a análise de compostos que possuem a habilidade de sequestro de radicais livres foi primeiramente proposto por Koleva et al. (2000). Vinte microlitros do cada extrato, na concentração de 12,5%, foram injetados em um cromatógrafo líquido acoplado a um detector de arranjo de fotodiodos e uma coluna de fase reversa C18 (250x4,6 mm) com tamanho de partícula de 5 µm. A fase móvel utilizada foi água:ácido acético (99,5/0,5 v/v) (solvente A) e metanol (solvente B) com vazão constante de 0,8mL/min. O gradiente iniciou com 30% do solvente B até 40% de B em 15 minutos, 50% de B em 30 minutos, 60% de B em 45 minutos, 75% de B em 65 minutos, 75% de B em 85 minutos, 90% de B em 95 minutos e 30% de B em 105 minutos. A coluna foi mantida a temperatura constante de 30°C. A análise do sequestro do radical livre DPPH, pós-coluna, por CLAE-FR-DPPH on line foi realizada utilizando a solução metanólica do radical livre DPPH na concentração de 10-5M, como mostrado na Figura 4, que reagiu com os compostos separados da amostra num coil de 15m, por aproximadamente 1 min. A vazão do reagente do DPPH foi de 0,8 mL/min e a perda de cor foi detectada por meio de picos negativos à 517nm. Bomba CLAE Extratos Bomba CLAE Coluna FR-C18 Solução DPPH Detector PDA Misturador 280 nm Detector 517nm Cromatograma geral dos compostos presentes nos extratos Cromatograma dos compostos com atividade antioxidante presentes nos extratos Figura 4- Esquema da instrumentação para a análise CLAE-FR-DPPH on line 3.2.2 Poder Antioxidante de Redução do Ferro (Método FRAP) Por meio desta técnica foi avaliada a atividade antioxidante, por meio da redução do ferro frente ao extrato da própolis vermelha. Foi utilizada para o ensaio, uma diluição do extrato de 200ppm, determinada como ideal através de testes realizados com diferentes diluições utilizando uma curva de calibração de sulfato ferro (100-1000 µM). A técnica se baseia na redução do complexo Fe3+- 2,4,6-tris(2piridil)-s-triazina (TPTZ) sobre condições ácidas de reação. O Fe3+ reduzido a Fe2+ forma novamente um complexo com TPTZ e aumenta a absorbância da coloração azul proveniente desse complexo que deve ser medida a 593nm. O reagente de FRAP foi preparado no dia do ensaio misturando 25 ml de tampão acetato (300 mM, pH 3,6), 2,5 ml de solução de TPTZ (10 mM TPTZ em 40mM HCL) e 2,5 ml de FeCl3 (20 mM) em solução aquosa. Foi utilizado 100µL do extrato o qual foi adicionado a 4,5 ml do reagente de FRAP, agitado e incubado por 30 minutos. A absorbância foi medida em 593 nm, usando a solução FRAP de trabalho como branco. Os resultados foram expressos em µM Fe2+/mg de peso seco do extrato. A atividade relativa das amostras foi comparada ao ácido L-ascórbico (KALOGEROPOULOS et al., 2009). 3.2.3. Atividade antioxidante pelo método do ABTS •+ O primeiro a sugerir o método indireto do sequestro do radical ABTS 2,2´-azinobis (3-etilbenzotiazolina-6-ácido sulfônico) em testes de amostras biológicas foi Miller et al. (1993). O ABTS•+ apresenta alta estabilidade em condições de análise específicas. Este radical é gerado por reações químicas (como o perssulfato de potássio) ou enzimáticas, e, é solúvel tanto em água como em solventes orgânicos, permitindo a análise tanto de amostras hidrofílicas como lipofílicas (ARNAO, 2000). Por meio da adição do perssulfato de potássio, ocorre a formação do radical ABTS, que apresenta cor esverdeada. Na medida em que o antioxidante é misturado com esse radical, ocorre a redução do ABTS•+ a ABTS, fato que provoca a perda da coloração do meio reacional. Os resultados são expressos em função do padrão antioxidante Trolox, submetido às mesmas condições de análise. O ABTS•+ apresenta forte absorção no intervalo de 600-750nm e pode ser facilmente determinado espectrofotometricamente, sendo um radical estável na ausência de antioxidantes. Possui a vantagem de ser um método relativamente simples de ser realizado, sendo por isso aplicado em várias análises de laboratório, além de apresentar boa solubilidade (ROGINSKI; LISSI, 2005; KUSKOSKI et al., 2005). Foi utilizada uma diluição de 200ppm do extrato, determinada como ideal após testes utilizando uma curva de calibração. 3.2.4. Capacidade de absorbância de radicais de Oxigênio (ORAC) A metodologia utilizada neste trabalho foi baseada na metodologia proposta por Ou, Hmapsch-Woodill e Prior (2001), com algumas modificações. Nessa análise, a fluoresceína foi utilizada como uma sonda de detecção aos danos causados pelos radicais gerados pelo 2.2’-Azobis (2-amidinopropano) diidroclorírico (AAPH) no decorrer da reação. A queda da fluorescência gera uma curva de decaimento que é então analisada pela mensuração da área produzida em relação a curva de um controle que não possui agentes antioxidantes que possam impedir o processo. Todos os reagentes, diluições das amostras e curva de calibração, foram preparados com tampão fosfato de potássio, 75mM, pH 7,4. Foram utilizados Fluoresceína na concentração inicial de 4,066mM e concentração final de 508,25mM, e o AAPH na concentração final de 76mM. Utilizou-se uma curva de calibração com Tolox nas concentrações de 12,5, 25, 50, 100, 200 e 400µM/mL. As análises foram realizadas em placa de 96 poços onde cada poço possui um volume de 300µL. No ensaio em microplaca, em cada poço foi adicionado 30 µL da amostra, 60µL da solução de fluoresceína a 508,28 mM e 110 µL da solução de AAPH 76 mM. No poço que correspondente ao controle, foram colocados todos os reagentes e a amostra substiuída por tampão e o correspondente ao branco, somente 300 µL de tampão. As análises foram realizadas em triplicata, com metodologia em modo cinético, utilizando as absorbâncias de emissão 528nm e excitação 825nm com duração de 2 horas a 37ºC. As amostras de plasma foram submetidas ao mesmo tratamento já descrito acima para análises de atividade antioxidante on-line por CLAE-FR, porém com a diferença de que os resíduos foram reconstituídos com o tampão de análise de ORAC (fosfato de potássio 75mM pH7,4), para que não houvessem alterações casualmente causadas por solventes orgânicos nessa análise. Já para as amostras de fígado, foram utilizados os extratos do órgão diluídos 100 vezes com o tampão de análise do ORAC. 3.3. Ensaios para avaliação da atividade antioxidante in vivo 3.3.1 Ensaios in vivo 3.3.1.1 Delineamento experimental dos animais Foram utilizados para o experimento 50 ratos Wistar machos, com 35 dias de idade, pesando em média 100g, fornecidos pelo CEMIB/UNICAMP. Esses animais foram alocados no biotério da Faculdade de Odontologia da UNICAMP/Campus Piracicaba, em condições ideais de luz e temperatura seguindo as condutas de ética e biossegurança exigidas pela Comissãp de Ética no Uso de Animais CEUA/Unicamp de número 2304-1 em 12 de novembro de 2010. Os animais chegaram ao biotério com 21 dias, desmamados e permaneceram por duas semanas nesse local sem manejo experimental, para a adaptação dos mesmos ao novo ambiente. Após esse período, o experimento propriamente dito foi iniciado. Os animais foram numerados por caixa, separados em 7 caixas contendo 7 animais cada uma, sendo que uma caixa alocou 8 animais. Cada caixa correspondeu a um tratamento, sendo eles: Controle normal (CTL-N) onde os animais foram somente manipulados, mas não receberam nenhum tratamento e nem Acetaminofen (APAP) como indutor de estresse; Controle estressado (CTL-J/APAP) os quais foram submetidos a jejum e receberam o indutor de estresse (APAP); Ácido Ascórbico (AAJ/APAP) os quais foram tratados com ácido ascórbico na dose de 600mg/kg, e submetidos a jejum e APAP; Quercetina (Q-J/APAP) os quais foram tratados com Quercetina na dose de 20mg/kg e submetidos a jejum e APAP; Própolis 150 (P150J/APAP) os quais foram tratados com própolis vermelha na dose de 150mg/kg e submetidos a jejum e APAP; Própolis 300 (P300-J/APAP) os quais foram tratados com própolis vermelha na dose de 300mg/kg e submetidos a jejum e APAP; Própolis 600 (P600-J/APAP) os quais foram tratados com própolis vermelha na dose de 600mg/kg e submetidos a jejum e APAP. Todos os tratamentos foram administrados por via intragástrica, (gavagem), uma vez ao dia durante 15 dias consecutivos. Foi utilizado propilenoglicol como veículo para todos os tratamentos e também na forma pura para os animais do grupo controle normal (CTL-N). Durante todo o experimento, os animais tiveram alimentação e água ad libitum e somente foram submetidos a jejum de 12 horas (overnight) no 15º dia de experimento após administração da dose de 800 mg/kg de APAP, também por via intragástrica. Após as 12 horas de jejum, já no 16º dia de experimento, os animais foram anestesiados com uma mistura de Xilazina e Quetamina 1/1, variando de 0,2 a 0,8 ml por via intraperitoneal, e sacrificados extraindo-se o fígado e aproximadamente 2 mL de sangue, o qual foi coletado pela veia cava inferior. 3.3.1.2 Avaliação da função hepática: análise das enzimas ALT, AST e γGT As análises das enzimas de função hepática ALT, AST e γGT foram realizadas no laboratório de análises clínicas Previlab Laboratório, localizado na cidade de Piracicaba sob responsabilidade técnica de Maria Angélica B. Sanches. As amostras de sangue heparinizado, coletadas dos animais no momento do sacrifício, foram armazenadas em gelo e em seguida centrifugadas para a separação do plasma. O plasma foi acondicionado em tubo fornecido pelo laboratório. As amostras de plasma foram levadas para o laboratório e submetidas a um método automatizado. 3.3.1.3 Determinação da atividade de sequestro de radical superóxido (O2.) pela enzima Superóxido dismutase A determinação da atividade de sequestro de radical superóxido foi realizada baseando-se na metodologia de Chisté et al. (2011). Nessa análise, foi gerado o radical superóxido pelo sistema -nicotinamida adenina dinucleotídeo (NADH)/Fenazina metosulfato (PMS), sistema este que reduz o nitroblue tetrazolium (NBT) à um composto azul, o diformazan. A eliminação dos radicais gerados pela ação da enzima Superóxido Dismutase contida na amostra de plasma e fígado foi monitorada por meio da redução de NBT a 560nm, durante 10 minutos, a temperatura ambiente (GOMES et al., 2007). A metodologia foi realizada em microplaca de 96 poços, tendo cada poço uma capacidade de volume de 300µl. Cada poço continha os seguintes reagentes em concentrações finais: NADH (166µM), NBT (43µM) e PMS (2,7µM), todos dissolvidos em tampão Fosfato de Potássio 19mM e pH 7,4, assim como todas as amostras de plasma e fígado utilizadas no ensaio. Foi realizada uma curva de calibração com a enzima Superóxido Dismutase (SIGMA) nas concentrações de 1,25; 2,5; 5; 10; 20 e 40 ng/µL, que foram dissolvidas no mesmo tampão de trabalho. Os efeitos foram expressos como a inibição em porcentagem da redução do NBT para diformazan. 3.3.1.4 Atividade antioxidante on-line por CLAE-FR modificada para amostras de plasma As análises de CLAE-FR em modo analítico para as amostras de plasma foram baseadas na metodologia descrita por Talcott, Howard e Brenens (2000). Vinte microlitros de plasma foram injetados em um cromatógrafo líquido acoplado a um detector de arranjo de fotodiodos e uma coluna de fase reversa C18 (250 x 4,6 mm) com tamanho de partícula de 5 µm. A fase móvel utilizada foi água:ácido acético (98:2, v/v) (solvente A) e água:acetonitrila:ácido acético (68:30:2) (solvente B), com vazão constante de 0,8mL/min. O gradiente iniciou com 0% do solvente B até 30% de B em 20 minutos, 50% em 30 minutos, 70% em 50 minutos até 100% em 55 minutos permanecendo nessa proporção por 15 minutos, somando 70 minutos de programação e retornando para 0% em 80 minutos. A coluna foi mantida a uma temperatura constante de 30ºC e os cromatogramas foram processados utilizando o software Class Vp. Ainda foi realizado um preparo prévio do plasma, para a análise de atividade antioxidante on line. Para 100µL de plasma foram adicionados 300µL de metanol P.A. e misturados em vortex por 30s. A mistura foi centrifugada à 9659 x g por 15 minutos e em seguida foi coletado 300 µL do sobrenadante. O sobrenadante foi evaporado à 40ºC sobre leve corrente de gás nitrogênio. O resíduo foi reconstituído em 100 µL de metanol e água (80:20, v/v) e centrifugado à 9659 x g por 5 minutos. Foi utilizada uma alíquota de 20µL para injeção no sistema CLAE. 3.3.1.5 Western blot para as enzimas superóxido Dismutase e Catalase Para a análise de Western Blot do fígado dos animais foi realizada uma extração do tecido na proporção de 1mg de tecido para 1 ml de tampão fosfato de sódio 50mM pH 7,4 com EDTA 0,1 mM. Durante a extração, os tecidos foram mantidos em nitrogênio líquido e durante a trituração no Polytron, o tampão se mantinha gelado e o tubo colocado no gelo. Após a trituração, o volume foi centrifugado a 18.500 x g por 20 minutos, para retirada do sobrenadante. Para que as amostras fossem visualizadas no gel, as amostras foram misturadas com um tampão que contém Azul de Bromofenol 0,1% chamado de tampão LAEMMLI. Essa mistura foi feita com 400ul da amostra e 100 µL do tampão e colocada em água fervente por 5 minutos. Após esse tempo, centrifugou-se em eppeddorf por 1 minuto a 9659 x g e só após foi possível a aplicação no gel. Os géis foram preparados com uma solução de acrilamida a 40% e foram utilizados dois tampões: tampão para gel de resolução (Resolving) e tampão para gel de empilhamento (Stacking). O Resolving possui uma concentração maior de Trisma (750mM) e o Stacking uma concentração de 50mM de Trisma, o que faz com que as amostras possam primeiramente se empilhar e depois correr no gel lentamente de acordo com seu peso molecular. Com gel já pronto, as amostras foram aplicadas sempre tendo como primeira posição o marcador de peso molecular com suas cores específicas para cada peso (Bio-Kaleidoscope Prestained Standards) (Figura 5). -216 KDa -132 KDa -78 KDa -45,7 KDa -32,5 KDa -18,4 KDa -7,6 KDa Figura 5 - Esquema de cores do marcador de peso molecular Bio-Kaleidoscope Prestained Standards catalog #161-0324 para identificação e detecção de proteínas As amostras foram submetidas à dosagem de proteínas totais pelo método de Bradford (BRADFORD, 1976) para se padronizar a quantidade de 200µg de proteína nas alíquotas aplicadas no gel. Os géis foram preparados na concentração de 12% de Resolving, ideal para a corrida de proteínas com peso molecular de 20 a 70 KDa como Superóxido Dismutase I e II (23 e 25 KDa respectivamente) e Catalase (64 KDa). Após a aplicação das amostras nos géis, os mesmos foram colocados nas cubas para a corrida com tampão de corrida (aproximadamente 900 ml para cada cuba). Foi selecionado 80 volts até o front (azul) entrar no gel de separação e 100-120 volts para corrida das amostras. A corrida foi monitorada e teve seu final entre 1,5 a 2 horas. Após a corrida foi realizada a transferência para uma membrana de nitrocelulose com um tampão apropriado, chamado tampão de transferência. As membranas foram colocadas novamente na cuba e submetidas a uma nova corrida, observando-se o valor de 46W que foi aumentando e no momento em que se alcançou o dobro desse valor, a corrida foi interrompida. Esse processo teve duração de aproximadamente 1 hora. Terminada a transferência, as membranas foram retiradas e colocadas em solução para anticorpo, juntamente com 10 µL do anticorpo primário específico para cada membrana (SOD I, SOD II e CATALASE), sendo então acondicionadas em geladeira, sob agitação constante, overnight. No dia seguinte, o anticorpo foi retirado e as membranas foram lavadas com uma solução basal, uma vez por 15 minutos e duas vezes por 10 minutos, sob agitação constante. As membranas então foram bloqueadas com uma solução contendo leite em pó desnatando por uma hora e meia. Após esse tempo, foi retirada a solução bloqueadora e as membranas foram lavadas com solução basal no mesmo esquema descrito acima. Após as membranas serem bloqueadas e lavadas, foi adicionado o anticorpo secundário, sendo que, para cada membrana, foi adicionado 2 µL de anticorpo em 10ml de solução basal. As membranas foram mantidas nessa solução por 1 hora em agitação constante à temperatura ambiente. Após esse tempo, as membranas foram novamente lavadas, ligeiramente secas e submetidas à reação de quimiluminescência com kit apropriado para revelação em filme em câmara escura. O tempo de exposição adequado para a melhor visualização das bandas foi de 2 segundos. 3.3.1.6. Histopatologia O tecido utilizado para a confecção das lâminas de histopatologia foi o fígado extraído no momento do sacrifício dos animais. Aproximadamente um terço do órgão de 4 animais de cada tratamento, foi separado e acondicionado em solução de formaldeído 10%, para posterior confecção das lâminas. As amostras foram alocadas e identificadas em cassetes específicos e durante esse processo, foi realizada a análise macroscópica do tecido. Em seguida, as amostras foram submetidas ao processo de fixação e inclusão com parafina, formando então os blocos que foram cortados em micrótomo. Depois de endurecida a parafina, os blocos foram aparados o máximo possível e colocados no micrótomo que realizou cortes de 4 a 7 µm de espessura, como mostra a Figura 6. Os cortes finos foram lavados, colocados em lâminas desengorduradas e secos em estufa. Posteriormente foram desparafinados e reidratados para serem submetidos à coloração de Hematoxilina e Eosina. Figura 6 - Esquema representativo do funcionamento de um micrótomo tipo rotativo (ALBERTS et al., 2004) A hematoxilina é uma base que cora, preferencialmente, compostos ácidos das células em tom roxo/azulado, por isso o núcleo é o que se torna mais corado pela hematoxilina pela presença do DNA e RNA, pois são compostos basofílicos. A Eosina, ao contrário, é um ácido que cora estruturas acidófilas em tons de rosa, essas estruturas estão mais abundantes no citoplasma (GARTNER; HIATT, 1999). 4. RESULTADOS E DISCUSSÃO 4.1. Ensaios in vitro 4.1.1. Caracterização química da própolis vermelha 4.1.1.1. Espectro na região UV-Visível Na Figura 7, está ilustrado o espectro de absorção na região UV-visível do EEP vermelha brasileira utilizada nesse trabalho. Observa-se que a absorbância máxima se deu em 280 nm, resultado coerentes com a absorção absorção da maioria dos compostos fenólicos, os quais estão na faixa de 250 a 350 nm (MARKHAM; THOMAS, 1970). O resultado do comprimento de onda máxima encontrado para o EEP da própolis vermelha deste trabalho (280 nm) (Figura 7) está de acordo com o obtido por Oldoni et al. (2007), os quais também trabalharam com a própolis vermelha de Alagoas e encontraram valores de absorbâncias que variaram de 276 a 284 nm. Figura 7 - Espectro de absorção UV-Visível do EEP da propolis vermelha brasileira 4.1.1.2. Teor de compostos fenólicos totais A quantidade de compostos fenólicos encontrada para a amostra de própolis vermelha utilizada nesse trabalho foi de 266,8 mg/g de própolis, teor elevado em relação a outros tipos de própolis brasileiras. Oldoni et al. (2007) encontraram um teor de 231,4 mg/g para a própolis vermelha brasileira, uma das maiores concentrações já encontrados até então em própolis. Frozza et al. (2013) ao analisar amostras de própolis vermelha provenientes do Estado de Sergipe encontraram teores menores (151,55 mg/g). Estes autores justificam que esta baixa concentração pode ser devido ao método de extração utilizado, bem como a localização geográfica de coleta. Sarikaia et al. (2009), ao avaliar própolis com origem botânica na espécie Castania Sativa Mill. também encontraram valores inferiores ao da própolis vermelha brasileira. Isso corrobora com o fato de que a própolis utilizada nesse trabalho possui as características peculiares da própolis vermelha brasileira referenciada na literatura, como o alto teor de compostos fenólicos e alta atividade antioxidante in vitro. O teor de compostos fenólicos totais possui um significado diferente em relação às outras análises de atividade antioxidante in vitro, pois expressa de outra forma a capacidade redutora do extrato, porém não necessariamente relacionados com a atividade antioxidante contra as ERO e ERN. Para isso, soluções de etanol ou metanol são normalmente misturadas com água, haja vista serem mais eficientes nas extrações dos compostos fenólicos do que esses mesmos solventes puros (RICE-EVANS; MILLER; PAGANGA, 1997) 4.1.1.3. Composição química por Cromatografia líquida de Alta Eficiência (CLAE) O EEP quando analisado pela técnica de CLAE possibilitou a identificação de compostos inerentes a esse tipo de própolis, ou seja, flavonoides, isoflavonoides e chalconas, as quais também já foram identificadas por Oldoni et al. (2011) e Silva et al. (2007), como por exemplo, liquiritigenina, quercetina, vestitol, neovestitol, isoliquiritigenina, formononetina e biochanina (Figura 8). Portanto, pode-se constatar que a própolis utilizada nos ensaios in vivo foi a mesma descrita por Silva et al. (2007), a qual foi classificada como o 13º tipo de própolis brasileira, e que segundo Alencar et al. (2007) e Oldoni et al. (2011) possui elevada atividade antioxidante in 1500 1500 1000 1000 500 500 0 0 10 20 30 40 50 60 70 80 90 100 Volts 2000 Detector B-260 nm Propolis vermelha (20mg por ml - Luciana) 20uL - 0,8mL DPPH 10-5M (10-02-12) ac acetico 0,1M Propolis vermelha (20mg por ml - Luciana) 20uL - 0,8mL DPPH 10-5M (10-02-12) ac acetico 0,1M 0 Volts 2000 vitro. 110 Minutes Figura 8 - Cromatograma obtido pela técnica de HPLC (CLAE) do EEP detectado a 280 nm; Compostos identificados para EEP: 1-ácido ferúlico; 2-liquiritigenina; 3-quercetina; 4-vestitol; 5neovestitol; 6-isoliquiritigenina; 7-formononetina; 8-biochanina 4.1.1.4. Cromatografia Gasosa acoplada com Espectrometria de Massas (CG-EM) da composição não volátil Na análise do EEP por CG-EM foram identificados 19 compostos, incluindo os isoflavonoides e pterocarpnaos característicos desse tipo de própolis como medicarpina, vestitol, formononetina, 3,4-diidroxi-9-metoxipterocaroano 3,8-diidroxi-9-metoxipterocarpano (Tabela 1 e Figura 9). e Tabela 1 - Composição química do EEP da própolis vermelha analisada pela técnica de CG-EM Pico Compostos íon (m/z abundancia em parenteses) 1 4,4'BIS[(TRIMETHYLSILYL)ETHYNYL]-2,2'-BITHIOPHENE-5,5' DICARBALDEHYDE 414(100), 73(95), 399(66), 342(64), 238(60), 208(41), 265(33) 2 SILANE, TRIMETHYL[5-METHYL-2-(1-METHYLETHYL)PHENOXY]- 222(100), 209(88), 207(81), 358(64), 73(46), 210(40) 3 MEDICARPINA 342(100), 327(34), 73(29), 148(15), 341(38) 4 BENZENEPROPANOIC ACID, 3,4-BIS[(TRIMETHYLSILYL)OXY]-, TRIMETHYLSILYL ESTER 73(100), 400(95), 401(36), 385(24), 369(22), 204(22) 5 ISOFLAVONA DESCONHECIDA 267(100), 280(90), 265(60), 73(88), 416(51), 268(40) 6 VESTITOL 222(100), 207(57), 209(55), 416(51), 73(48) 7 4,4'-BIS[(TRIMETHYLSILYL)ETHYNYL]-2,2'-BITHIOPHENE-5,5'-DICARBALDEHYDE 414(100), 73(54), 413(54), 415(35), 341(8), 383(10), 219(7) 8 HYDROCINNAMIC ACID, P-(TRIMETHYLSILOXY)-, TRIMETHYLSILYL ESTER 179(100), 192(67), 399(44), 400(61), 73(60), 177(40) 9 3,4-DIHYDROXY-9-METHOXYPTEROCARPAN 73(100), 430(95), 399(46), 267(29), 415(23), 161(16) 10 3,8-DIHYDROXY-9-METHOXYPTEROCARPAN (3-HYDROXY-8,9-DIMETHOXYPTEROCARPAN) 372(100), 357(25), 371(12), 219(5), 206(13), 178(10), 73(43) 11 1,3,5-CYCLOHEPTATRIEN, 7-METHYL-7-PHENYL-2,4-BIS(TRIMETHYLSILYL)- 252(100), 73(57), 222(48), 237(40), 240(38), 446(45), 179(15) 12 FORMONONETIN 340(100), 325(38), 132(26), 73(18), 208(9) 13 SILANE, 9H-FLUOREN-9-YLIDENEBIS[TRIMETHYL- 222(100), 73(53), 369(52),296(38),207(34),413(29), 503(16) 14 BENZENEACETIC ACID, 2,4,5-TRIS[(TRIMETHYLSILYL)OXY]-, TRIMETHYLSILYL ESTER 473(100), 268(91), 296(34), 269(26),179(16), 73(78) 15 ISOLIQUIRITIGENIN 457(100), 73(52), 458(35), 472(9), 307(7) 16 2-PROPENOIC ACID, 3-(3,4,5-TRIMETHOXYPHENYL)-, METHYL ESTER 252(100), 73(51), 460(35), 237(25), 206(7) 17 BENZENEACETIC ACID, 4-[(TRIMETHYLSILYL)OXY]-, TRIMETHYLSILYL ESTER 556(100), 73(96), 296(62), 297(39), 281(19), 69(42) 18 PROPANEDIOIC ACID, BIS[(TRIMETHYLSILYL)OXY]-, BIS(TRIMETHYLSILYL) ESTER 307(100),73(59), 308(25), 696(9), 219(11) 19 SILANE, TRIMETHYL[[(3.BETA.)-OLEAN-12-EN-3-YL]OXY]- $$ 3-[(TRIMETHYLSILYL)OXY]OLEAN-12- 218(100), 203(45), 69(25), 73(24), 498(3) 22 LUP-20(29)-EN-3-YL ACETATE 43(100), 218(91), 95(61), 109(55), 189(75), 135(45) 5 6 (x10,000,000) 2.00 TIC 1.75 3 1.50 1.25 7 1.00 17 0.00 32.5 35 .0 37.5 40.0 42.5 45.0 18 16 10 1 9 0.25 13 4 14 8 0.50 12 2 15 11 0.75 47.5 50.0 52.5 5 5.0 Figura 9 - Cromatograma obtido por CG-EM do EEP da própolis vermelha. O nome do composto referente a cada pico está descrito na Tabela 1 De acordo com os dados da Tabela 1, os principais compostos do EEP são da classe dos fenólicos, subclasse das isoflavonas, como medicarpina (pico 3), Isoflavona desconhecida (pico 5) e vestitol (pico 6). Além desses, outros isoflavonoides como a formononetina e a chalcona isoliquiritigenina também apresentaram uma porcentagem relativa significativa. Os isoflavonoides medicarpina e homopterocarpina também já foram identificados em altas concentrações pela técnica de CG/MS na própolis vermelha de Alagoas (ALENCAR et al., 2007). Os isoflavonoides são uma subclasse dos flavonoides e que possuem uma distribuição limitada na natureza. São compostos intrínsecos das plantas, cuja quantidade depende de fatores como crescimento e base genética. Embora várias plantas sintetizem isoflavonoides, a forma bioativa para o consumo humano está presente em poucos vegetais, que são espécies tipicamente da família das leguminosas (DEWICK, 1996; PETERSON; DWYER, 1998). Desta forma, estes compostos podem ser úteis como marcadores químicos deste tipo de própolis brasileira. De acordo com estudos epidemiológicos recentes, isoflavonoides são mais benéficos para a saúde humana do que os flavonoides. Dietas contendo isoflavonoides têm sido associadas com diversos benefícios para a saúde humana, como doenças cardíacas, osteoporose, redução dos sintomas da menopausa e prevenção de vários tipos de cânceres, vários associados com radicais livres (KOBLOVSKÁ et al., 2008; LOF et al., 2006). 4.1.1.5. Cromatografia Gasosa acoplada com Espectrometria de Massas (CG-EM) da composição volátil De acordo com a Tabela 2, observa-se que a própolis vermelha de Alagoas apresentou um perfil bastante heterogêneo em relação aos voláteis. Um total de 43 compostos foram encontrados, sendo os mais representativos o (12,95%), germacreno D (10,04%), anetol (9,65%) -cubebeno -cariofileno (7,58%), metil eugenol (6,03%), alfa pineno (5,72%), delta cadineno (4,95%), -asarona (3,71%), biciclogermacreno (3,47%) e cariofileno <9-epi-(E)> (3,39%). Também foi possível notar que o aroma da própolis vermelha consiste numa mistura de odores característicos, dentre os quais se podem citar o de ervas, cera, madeira, especiarias, pinho, cravo-da-índia, frescor, anis, entre outros. Dentre os compostos encontrados estão presentes alcoóis, éteres, aldeídos, cetonas e fenilpropanóides em menor proporção. Os compostos voláteis predominantes na própolis vermelha foram os monoterpenos e sesquiterpenos. Terpenos são metabólitos secundários de plantas formados pela condensação de unidades de isopreno (C5) através da via do acetato-mevalonato e os mais comumente encontrados são os monoterpenos (10C), sesquiterpenos (15C) e diterpenos (20C). Esses compostos estão também associados com a defesa do vegetal (BAKKALI et al., 2008). Tabela 2 - Compostos voláteis (em porcentagem) identificados na própolis vermelha e seus respectivos índices e tempos de retenção Compostos voláteis TR (%) I K* IK** Metil-D3 1dideuterio-2propenil eter Crotonaldeído, 3metil Hexanal 5-metil-2-hexanol Alfa pineno Beta-pineno Sabineno Metilheptenona Beta mirceno 1-octanal Delta 3 careno 4-cimeno Alfa-limoneno 1,8-cineol Beta-cis-ocimeno Beta-transocimeno Beta linalool Nonanal Estragol Decanal Anetol (Z) Delta elemeno Alfa cubebeno Alfa amorfeno Beta elemeno Metil eugenol 4,337 2,17 787 - Fórmula molecul ar C4H3D5O 5,779 0,30 823 - C5H8O 6,123 9,450 10,670 12,189 12,338 12,654 12,753 13,226 13,464 14,016 14,172 14,291 14,531 14,921 1,35 0,25 5,72 1,57 0,22 0,09 0,14 0,30 0,18 0,24 0,34 0,11 0,06 1,00 831 913 943 981 985 993 995 1007 1014 1029 1032 1035 1042 819 911 939 981 976 986 994 1006 1013 1028 1031 1030 1043 1050 C6H12O C7H16O C9H12 C10H16 C10H16 C8H14O C10H16 C8H16O C10H16 C10H14 C10H16 C10H18O C10H16 C10H16 16,885 17,058 20,544 20,759 23,618 25,351 25,756 26,355 27,154 27,525 1,05 0,66 1,74 0,15 9,65 0,15 14,90 1,48 3,60 6,03 1107 1108 1196 1211 1283 1340 1351 1393 1401 C10H18O C9H18O C10H12O C10H20O C10H12O C15H24 C15H24 C15H24 C15H24 C11H14O2 27,768 27,879 0,69 2,90 1412 1431 C15H24 C15H24 28,092 28,384 28,710 29,030 29,163 29,406 9,09 1,42 0,30 0,48 0,99 3,39 1428 1461 1454 1476 C15H24 C15H24 C15H24 C15H24 C15H24 C15H24 29,843 30,018 30,191 30,494 31,000 31,257 32,172 32,332 32,936 1,23 10,04 0,88 3,47 0,73 4,95 3,71 0,74 1,09 1485 1499 1485 1517 1513 1530 1559 1560 1576 C15H24 C15H24 C15H24 C15H24 C15H24 C15H24 C12H16O3 C15H24 C15H24O Alfa gurjuneno Alfa-cisbergamoteno Beta cariofileno Beta cubebeno Alloaromadendren Beta maalieno Alfa-cariofileno Cariofileno <9-epi(E) Alfa amorfeno Germacreno D Beta selineno Biciclogermacreno Gama cadineno Delta cadineno Beta-asarona Germacreno B Espatulenol 1052 1106 1110 1204 1211 1294 1346 1358 1376 1399 1410 1419 1423 1430 1440 1451 1462 1465 1474 1488 1494 1500 1510 1527 1534 1566 1570 1590 TR: Tempo de retenção IK*: Índice de Kovats encontrado no voláteis da própolis vermelha de Alagoas IK**: Índice de Kovats encontrado na literatura - : Compostos cujos índices de Kovats não foram encontrados ou divergiram muito da literatura Ainda não existem estudos sobre a composição de voláteis da planta Dalbergia ecastophyllum (L) Taub., origem botânica da própolis vermelha de Alagoas. Alguns trabalhos já foram conduzidos em outras espécies de Dalbergia, como, por exemplo, nas folhas de Dalbergia frutescens coletadas em Santa Catarina. Comparando a folha com os resultados encontrados para a própolis vermelha, verificou-se que os compostos com maior concentração nas folhas foram os norisoprenóides (produzidos pela degradação de carotenoides), e os mais abundantes foram a -damascenona e -ionona (MENDES et al., 2012). Nunes et al. (2009) analisaram os compostos voláteis de uma própolis vermelha produzida em Pernambuco e observaram que grande parte dos compostos identificados foram sesquiterpenos, fato que também ocorreu com a própolis de Alagoas. Houve semelhança entre alguns compostos como o -cubebeno, -cariofileno e nonanal, porém o composto majoritário encontrado na própolis de Pernambuco foi o transanetol, que variou de 25,58% a 52,58%, dependendo do mês de coleta. O anetol apareceu na própolis vermelha de Alagoas também, porém em concentração bem inferior (9,65%). De acordo com esses dados, é possível supor que as própolis podem apresentar semelhança na aparência, porém podem ou não ser oriundas da mesma fonte. Além disso, existem outros fatores, como temperatura, nutrientes do solo, disponibilidade de água, tipo de vegetação, entre outros, que interferem na produção de compostos secundários pelas plantas. Ultimamente diversos estudos in vivo têm demonstrando as propriedades biológicas de compostos voláteis, inclusive de substâncias encontradas em quantidades consideráveis na própolis vermelha de Alagoas. Choi et al. (2009) encontraram atividade do sesquiterpeno -iso-cubebeno como agente anti- inflamatório, sendo considerado pelos autores como possível composto capaz de prevenir e tratar doenças artEROcleróticas em seres humanos. Os compostos voláteis também podem agir em sistemas tritróficos, atraindo inimigos de herbívoros, como vespas parasitas e moscas ou ácaros predadores, o que pode proteger a planta de novos danos. Há pesquisas demonstrando que o germacreno D funciona como sinalizador fundamental na relação entre plantas e insetos (ARIMURA et al., 2004; PETRAKIS et al., 2005). Em estudo realizado por Geng et al. (2010), foram encontradas evidências da ação da -asarona contra a doença de Alzheimer, uma vez que, quando administrado por via oral, pode tanto suprimir a apoptose celular neuronal quanto a disfunção do sistema de memória. Estudos conduzidos por Manikandan e Devi (2005) mostraram o efeito da -asarona na restauração da atividade antioxidante no cérebro de ratos, após a indução do estresse pelo ruído. Rather et al. (2012) analisaram as atividades antioxidante e antimicrobiana do óleo de Juglans regia L. e seus principais constituintes, dentre os quais estão e -pinenos, -cariofileno e germacreno D. Nas análises microbiológicas (concentração inibitória mínima), observou-se que o -cariofileno e germacreno D apresentaram melhores resultados contra alguns microrganismos como B. subtillis, S. aureus, S. typhi, e K. pneumonia em relação aos pinenos. Para a atividade antioxidante, expressa em termos de IC50 (método DPPH), foi encontrada a concentração de 34,5 µg/mL para o óleo de Juglans regia L. e 78,1 µg/mL, 73,2 µg/mL e 80 µg/mL para -pineno, -cariofileno e germacreno D, respectivamente. De acordo com Tamble et al. (1996), o sesquiterpeno antiinflamatório -cariofileno apresentou, ainda, efeito gastro citoprotetor por meio da ingestão oral, inibindo as injúrias induzidas por agentes que causam lesões necróticas no estômago, como o etanol e o ácido clorídrico. Para o composto anetol, componente encontrado na própolis vermelha e majoritário em óleo de anis, óleo de erva-doce e cânfora, foi comprovada ação antiinflamatória e anticâncer, por meio da resposta celular induzida por TNF (CHAINY et al., 2000). Visando a aplicabilidade, os compostos voláteis podem ser utilizados em diferentes contextos. O uso na indústria alimentícia propicia a caracterização, reconstituição e formulação de aroma com maior fidelidade ao aroma natural de um alimento. Há, ainda a possibilidade de utilização em perfumarias e na química de aromatizantes. Dezenas de milhares de compostos já foram identificados e estudos se estendem desde a olfatometria simples até avaliações de propriedades medicinais e efeitos fisiológicos e psicológicos (NOGUEIRA, 2002). 4.1.1.6. Atividade antioxidante on-line por CLAE-FR do EEP O método de atividade antioxidante on-line é um método que visa à separação de compostos e sua atividade antioxidante simultaneamente. Como o detector que analisa a atividade antioxidante on-line é zerado com a solução de DPPH, e, após a reação com os compostos fenólicos a absorbância do respectivo radical decresce, os picos obtidos são negativos. Assim, quanto mais negativo, maior é a atividade antioxidante do pico. Portanto, dentre os compostos identificados por esta técnica, a isoliquiritigenina foi claramente a que apresentou a maior contribuição para a atividade antioxidante no sistema EEP. Já a formononetina, apesar de também estar em alta concentração (Figura 10), não contribuiu significativamente com o sequestro do radical livre DPPH. Oldoni et al. (2007) analisando o potencial antioxidante da própolis vermelha brasileira, tanto do EEP quanto de suas frações clorofórmicas e hexânicas, também verificaram uma contribuição significativa da atividade antioxidante dos compostos isoliquiritigenina, vestitol e o neovestitol, sendo que alguns compostos quando isolados apresentaram 1500 1000 1500 6 7 1000 45 500 Volts 2000 Detector B-260 nm Propolis vermelha (20mg por ml - Luciana) 20uL - 0,8mL DPPH 10-5M (10-02-12) ac acetico 0,1M Propolis vermelha (20mg por ml - Luciana) 20uL - 0,8mL DPPH 10-5M (10-02-12) ac acetico 0,1M 2 1 3 Volts 2000 atividade maior do que o EEP. 500 8 0 0 0 10 20 30 40 50 60 70 80 90 100 110 Minutes 0.00 Detector A (517nm) Propolis vermelha (20mg por ml - Luciana) 20uL - 0,8mL DPPH 10-5M (10-02-12) ac acetico 0,1M Propolis vermelha (20mg por ml - Luciana) 20uL - 0,8mL DPPH 10-5M (10-02-12) ac acetico 0,1M 3 7 8 -0.01 -0.02 mAU 4 mAU -0.01 1 0. 00 -0.03 -0.02 6 0 10 20 30 40 -0.03 50 60 70 80 90 100 110 Minutes Figura 10 - Cromatogramas obtidos pela técnica HPLC. A:Comatograma do EEP detectado a 280 nm; B: Cromatograma da atividade antioxidante on-line, após reação com DPPH. Compostos identificados para EEP: 1-ácido ferúlico; 2-liquiritigenina; 3-quercetina; 4-vestitol; 5-neovestitol; 6isoliquiritigenina; 7-formononetina; 8-biochanina A. Para os picos da atividade antioxidante on-line, númERO iguais correspondem ao mesmo composto 5.1.1.7. Atividade antioxidante pelos métodos FRAP, ABTS e ORAC As análises de atividade antioxidante in vitro pelos métodos FRAP, ABTS e ORAC, estão apresentados na Tabela 3: Tabela 3 - Valores de atividade antioxidante in vitro para as metodologias de FRAP e ABTS Amostra FRAP (mmol/g)1,2 ABTS (mmol/g)1,3 ORAC (µmol/g)1,3 EEP 4,26±0,23 4,84±0,26 19.779±1,8 1-Valores são a média ± desvio pádrão 2-equivalentes de Sulfato ferroso 3-equilvalentes de Trolox O valor encontrado para o FRAP para a própolis vermelha utilizada nesse trabalho foi de 4,26 mmol/g em equivalente de sulfato ferroso. Valores inferiores já foram encontrados para outros tipos de própolis provenientes de 6 regiões da Colômbia, sendo a maior atividade de 0,50 mmol/g (PALOMINO et al., 2009). Mohammadzadeh et al. (2007) encontraram teores de FRAP maiores do que os encontrados para a própolis da Colômbia: 1,65 mmol/g para a própolis Iraniana, porém esse valor é ainda significativamente inferior aos encontrados para a própolis vermelha brasileira utilizada neste trabalho. Em relação ao valor encontrado para a atividade antioxidante frente ao radical ABTS, de 4,84 mmol/g, foi possível observar que essa própolis apresenta um potencial antioxidante importante ao ser comparada com outras. No trabalho realizado com amostras de própolis de 19 locais do país de Basque, no Nordeste da Espanha, Bonvehí e Gutiérrez (2011) encontraram valores de ABTS que variaram de 0,56 a 1,46 mmol/g de equivalente de Trolox, demonstrando assim que, das 19 amostras, nenhuma apresentou atividade próxima à própolis vermelha de Alagoas. Para a análise de ORAC foi encontrado um valor de 19.779,7 µmol/g em equivalente de Trolox. Ninfali et al. (2009), em estudo sobre atividade antioxidante de vários extratos liofilizados de plantas, inclusive extrato de multifrações de própolis, encontraram um valor de ORAC de 13.800±1339 µmol/g, sugerindo que a própolis vermelha brasileira demonstra uma atividade antioxidante ainda superior para o sequestro do radical peroxila que é gerado nessa análise. Outros autores (SHI et al., 2012), ao analisar 15 amostras de própolis de 15 locais da China, encontraram uma variação de 2560 a 7630 µmol/g nos valores ORAC, atividades estas muito aquém do que o encontrado para a própolis vermelha do presente trabalho. 4.2. Ensaios in vivo e ex vivo 4.2.1. Função hepática e instalação do estresse Foram realizadas as análises de função hepática por meio da mensuração quantitativa das enzimas Alanina Amino Trasnferase (ALT), Aspartato Amino Transferase (AST) e Gama Glutamil Transferase (γGT) no intuito de se verificar a instalação do estresse oxidativo hepático induzido pelo Acetaminofen (APAP), 800mg/kg, intragástrico. Na análise dos resultados foi utilizada a ferramenta estatística de Contrastes Ortogonais (Figura 11), onde a ortogonalidade indica que a variação de um contraste é inteiramente independente da variação de outro qualquer que lhe seja ortogonal. (GARCIA; GOMES, 2002). Assim pode-se detectar as diferenças significativas com maior eficiência em experimentos que possuem mais de 4 tratamentos. Cada contraste possui um grau de liberdade, o que assegura assim ao teste maior confiabilidade. 1 CTL /N 2 CTL – J/APAP 3 AAJ/APAP 4 Q-J/APAP 5 P150J/APAP 6 P300J/APAP 7 P600J/APAP 1 2 3 4 5 6 Figura 11 - Tabela de contrastes ortogonais realizados para o modelo experimental apresentado, onde, cada cor representa as variáveis que foram contrastadas totalizando 6 contrastes possíveis com os sete tratamentos De acordo com os dados mostrados na Tabela 4, observa-se que não houve diferença entre os tratamentos para a enzima γGT, o que leva a crer que não foi gerada uma lesão hepática importante pelo indutor de estresse (APAP), já que essa enzima se apresenta alterada em processos de injúria hepática severa, por ter especificidade com este órgão. Tabela 4 - Valores das enzimas de função hepática Alanina amino transferase (ALT), Aspartato amino Transferase (AST) e Gama Glutamil Transferase (γGT). Valores das médias de cada tratamento +/- o erro padrão. Para letras iguais, valores sem diferença significativa; para letras diferentes, valores com diferença significativa com nível de p individual para cada contraste Tratamentos γGT (U/L) ALT (U/L) AST (U/L) CTL -N 3,37±0,30a 38,5±1,75a 69,7±3,07a CTL-J/APAP 2,85±0,27a 33,7±1,64b 78,8±3,72b AA-J/APAP 3,28±0,31a 32,3±1,57a 84,4±3,98a Q-J/APAP 3,42±0,33a 29,3±1,42a 88,1±4,16a P150-J/APAP 2,80±0,32a 29,0±1,66a 78,0±4,35a P300-J/APAP 3,16±0,33a 31,8±1,67a 70,6±3,60a P600-J/APAP 2,85±0,27a 42,4±2,06b 88,4±4,17b CTL-N (Controle normal) os animais foram somente manipulados, mas não receberam nenhum tratamento e nem APAP; CTLJ/APAP (Controle estressado) os animais foram submetidos a jejum e receberam o indutor de estresse (APAP); AA-J/APAP (Ácido Ascórbico) os animais foram tratados com ácido ascórbico na dose de 600mg/kg e submetidos a jejum e APAP; QJ/APAP (Quercetina) os animais foram tratados com quercetina na dose de 20mg/kg e submetidos a jejum e APAP; P150J/APAP (Própolis 150) os animais foram tratados com própolis na dose de 150mg/kg e submetidos a jejum e APAP; P300J/APAP (Própolis 300) os animais foram tratados com própolis na dose de 300mg/kg e submetidos a jejum e APAP; P600J/APAP (Própolis 600) os animais tratados com própolis na dose de 600mg/kg e submetidos a jejum e APAP. Chaves e colchetes se referem aos contrates, conforme descritos na figura 11. Com relação à enzima ALT, com importante especificidade para fígado, houve diferença entre os dois grupos controles, normal e estressado, podendo então verificar que houve uma alteração na função hepática dos animais estressados com APAP (Tabela 4 e Figura 12 B). Observa-se também que a própolis na dose de 150mg/kg apresentou efeito estatisticamente diferente das demais doses (300 e 600 mg/kg) e um comportamento de proteção em relação aos animais estressados. A dose de 150 mg/kg ainda se igualou ao antioxidante quercetina utilizado como controle positivo e que sabidamente é considerado um potente antioxidante de origem natural (Tabela 4 e Figura 12 A). Merece ainda destacar que os antioxidantes utilizados como controle positivo (quercetina e ácido ascórbico) não apresentam diferença estatística (Tabela 4 e Figura 12A). Ainda para a enzima ALT, merece destacar que todos os antioxidantes utilizados, com exceção da própolis 600mg/kg, apresentaram um efeito positivo na redução da ALT. Portanto, fica evidente que a própolis em concentrações superiores a 300 mg/kg tendem a ter um comportamento pro-oxidante, deixando assim de ser benéfica neste aspecto e passando então a modificar a função hepática. Apesar do controle estressado ter apresentado uma pequena redução nos níveis da ALT, proporcionado pela ativação do sistema antioxidante endógeno, o efeito foi sinérgico quando um antioxidante esteve presente (Figura 12 A e B). ) 1 CTL /N 2 CTL – J/APAP 3 AAJ/APAP 4 5 P150Q-J/APAP J/APAP 6 P300J/APAP 7 P600J/APAP 1 2 3 4 5 6 ! "# $ %& ' %& ' %( ' %( ' Figura 12: A- Atividade da enzima ALT (U/L) e respectivos de desvios padrão; B- Tabela de contrastes ortogonais com valores de p. Para a enzima AST, por ser uma enzima que está também presente em outros órgãos (músculo e coração, por exemplo), demonstra lesão desses órgãos além do fígado. Porém, novamente há diferença entre os controles normal e estressado (p=0,06) (Figura 13B), além de uma evidente ação pro-oxidante da própolis 600mg/kg em relação às outras doses, mostrado por uma tendência ao aumento desta enzima em relação aos grupos controles, tanto normal como estressado (Figura 12A). Além disto, o efeito da dose 300 mg/kg foi estatisticamente diferente da dose 600 mg/kg, a nível de p<0,01 (Figura 12B). ) 1 CTL /N 2 CTL – J/APAP 3 AAJ/APAP 4 5 P150Q-J/APAP J/APAP 6 P300J/APAP 7 P600J/APAP 1 2 3 4 5 6 ! #$ %& ' %& ' %( ' Figura 13 - A- Atividade da enzima ALT (U/L) e respectivos desvios padrão; B- Tabela de contrastes ortogonais com valores de p. Lee et al. (2011), quando induziram estresse hepático com APAP na dose de 200mg/kg por via intraperitoneal em camundongos, obtiveram efeitos mais pronunciados aos apresentados nesse trabalho, pois foi encontrado um aumento significativo das enzimas ALT e AST nos animais induzidos com APAP em comparação aos animais sem indução. Isso pode ser explicado pela via de administração utilizada, pois a via intragástrica torna o processo de absorção mais lento. Já na via intraperitoneal o APAP é absorvido quase que imediatamente após a aplicação, pelo fato do peritônio se tratar de um local altamente vascularizado. Manimaran et al. (2010), utilizaram APAP na dose de 420mg/kg e 1000mg/kg em ratos machos, por via intragástrica e obtiveram diferença significativa em relação aos grupos controle sem APAP para as duas doses, porém foi utilizado como veículo, carboximetilcelulose sal de Sódio, diferentemente do trabalho aqui apresentado, onde foi utilizado Propilenoglicol P.A. como veículo, tanto para APAP quanto para os tratamentos com os antioxidantes. Nirala e Bhadauria (2008) também obtiveram diferentes resultados ao utilizar própolis para reverter danos hepáticos causados por APAP. Foi utilizada própolis nas doses de 100mg/kg e 200mg/kg, também por via oral após 24h da administração do APAP na dose de 2g/kg em uma única vez (gavagem). Foram observadas diferenças significativas para as enzimas ALT e AST, entre o grupo controle e o grupo induzido por APAP, porém somente na dose de 200mg/kg a própolis reverteu os valores dessas enzimas significativamente. Há que se considerar que foi utilizado outro tipo de própolis naquele estudo e usado o extrato aquoso da própolis e água quente como veículo para o APAP. No presente trabalho foi utilizado o extrato etanólico da própolis, pelo fato do etanol extrair com alta eficiência os compostos com propriedades antioxidantes da própolis vermelha bruta (EEP). Porém, após evaporação o EEP foi ressolubilizado no veículo propilenoglicol, tanto para as doses de própolis como para o APAP. Este procedimento foi realizado devido ao fato de ser encontrada dificuldade de solubilização, tanto da própolis quanto do APAP em solventes aquosos, o que seria adequado para a administração aos animais Por tudo isso, foi necessário escolher um veículo que pudesse manter solúvel todos os compostos da própolis e ainda assegurar a solubilização de toda a dose do APAP administrada aos animais, sendo eleito o propilenoglicol. O propilenoglicol (1,2 propanediol) possui característica de fluido viscoso, incolor, higroscópico e inodoro, e comumente utilizado em várias aplicações: 1) veiculo em medicamentos diversos; 2) solvente e emulsificante e 3) precursor químico de outras substâncias (WARSHAW et al., 2009) e ainda é considerada uma substância de baixa a média irritabilidade, sendo que em algumas concentrações, tem ação queratolítica e antimicrobiana (LESSMANN et al., 2005) 4.2.2. Atividade antioxidante X Estresse Oxidativo Induzido por APAP 4.2.2.1. Capacidade de Absorbância de Radicais de Oxigênio (ORAC) Para avaliar a capacidade antioxidante do plasma e extrato do fígado, dos animais tratados e não tratados com os antioxidantes acido ascórbico, quercetina e as 3 doses de Própolis (150, 300 e 600mg/kg), foi realizada a análise de ORAC. Essa análise foi feita com o intuito de se observar uma possível diferença no potencial antioxidante endógeno, tanto no órgão alvo quanto na circulação sanguínea. Foi observado então, como mostrado na Figura 14 B, que há uma diferença significativa entre o grupo dos animais controle normal em relação aos animais do grupo controle estressado, sugerindo que o indutor de estresse causou a mobilização do sistema antioxidante endógeno, e isso fez aumentar a capacidade de sequestro de radicais nos animais estressados, tanto no plasma como no fígado. Para o ORAC no plasma, foi possível observar que há diminuição da atividade antioxidante nos animais estressados e tratados com os antioxidantes em relação aos animais somente estressados (Figura 14 A e B). Isto demonstra que apesar de terem sido submetidos ao mesmo estresse, não foi necessário a mesma mobilização do sistema antioxidante endógeno que o grupo controle estressado com APAP, pois os antioxidantes atuaram inibindo os radicais gerados pelo estresse. É possível ainda observar que, entre as doses de própolis, a de 150mg/kg teve uma tendência a preservar mais o sistema antioxidante dos animais, de forma semelhante ao ácido ascórbico e a quercetina, que sabidamente são potentes antioxidantes de produtos naturais (Figura 14 A e B). Essa observação pode novamente sugerir que doses muito altas de própolis podem se tornar pró-oxidantes. ) 1 2 CTL – J/APAP CTL /N 3 AAJ/APAP 4 5 P150Q-J/APAP J/APAP 6 P300J/APAP 7 P600J/APAP 1 2 3 4 5 6 Contrastes ORAC Plas 1 2 3 4 5 6 p<0,01 p=0,06 ns ns ns ns Figura 14 - A- Valores médios de ORAC do plasma em equivalente de trolox e respectivos desvios padrão; B- Tabela de contrastes ortogonais com valores de p Leite et al. (2011) utilizaram porcentagens diferentes de casca de jabuticaba em pó (0%,1%, 2% e 4%), introduzidos na alimentação comercial para ratos Wistar machos, e constataram que a atividade antioxidante máxima no plasma pela análise de ORAC foi encontrada no grupo de animais que receberam a concentração de 2% de jabuticaba e que o grupo dos animais que receberam 4%, não apresentou qualquer efeito antioxidante, quando comparado ao grupo controle. Assim, concluíram que os compostos fenólicos podem inibir o processo de oxidação em determinados sistemas, mas a dosagem pode ter limites superiores e inferiores e que alguns compostos antioxidantes podem apresentar uma atividade pró-oxidante sob algumas condições e concentrações. Em relação às análises de ORAC para o fígado, foi possível observar que o APAP gerou um estresse pelo aumento da atividade antioxidante dos animais somente estressados em comparação com os animais controle normal (Figura 15 A e B). Houve novamente, assim com no plasma, uma mobilização do sistema antioxidante endógeno dos animais induzido pelo estresse causado pelo APAP. Porém desta vez a quercetina teve uma tendência a apresentar atividade antioxidante semelhante aos animais do grupo controle estressado (Figura 15 A), o qual estatisticamente difere do grupo controle normal, sugerindo assim pouca ou nenhuma proteção desse antioxidante para este órgão na dose utilizada. Com relação às doses de própolis, a de 150mg/kg continuou apresentar uma tendência de ser mais protetora em relação as doses mais altas quando comparada ao grupo controle estressado. Também o efeito do controle positivo (ácido ascórbico) não diferiu significativamente das doses própolis (Figura 15 A e B). ) 1 2 CTL – J/APAP CTL /N 3 AAJ/APAP 4 5 P150Q-J/APAP J/APAP 6 P300J/APAP 7 P600J/APAP 1 2 3 4 5 6 Contrastes 1 2 3 4 5 6 ORAC Fíg p<0,01 ns ns ns ns ns Figura 15 - A- Média dos valores de ORAC do extrato de fígado em equivalente de trolox e desvio padrão; B- Tabela de contrastes ortogonais com valores de p Behling et al. (2004) verificaram que a quercetina administrada por via intragástrica tem potencial hepatoprotetor em injúria por isquemia-reperfusão e antifibrinogênico. Miltersteiner et al. (2003) também relataram a ação hepatoprotetora da quercetina intraperitoneal em ratos cirróticos. Diferentemente do trabalho aqui apresentado, esses estudos demonstram a ação benéfica da quercetina no fígado, porém aqueles autores não verificaram outras injúrias mais graves e/ou lesões importantes. O estresse induzido no presente trabalho pela dose de APAP de 600mg/kg, por via intragástrica, produziu um estresse oxidativo, porém não uma lesão hepática de grande ordem. 4.2.2.2. Sequestro do radical Superóxido pela enzima Superóxido Dismutase As análises de sequestro de radical Superóxido pela enzima Superóxido Dismutase (SOD) foram também realizadas no extrato do fígado e plasma. Os resultados para o extrato de fígado, não apresentaram diferenças significativas para nenhum dos tratamentos, controles com ou sem estresse, o que pode sugerir que o estresse moderado gerado não foi suficiente para que houvesse uma indução da ação antioxidante por parte desta enzima. Porém, os antioxidantes utilizados, podem ter estimulado a liberação da enzima SOD. Esse fato pode ser observado nos resultados da análise no plasma dos animais, onde os animais tratados com os antioxidantes apresentaram uma porcentagem de inibição de redução de NBT maior do que os não tratados, apresentando este contraste diferença significativa do ponto de vista estatístico (Figura 16 B). Para esta análise, ao contrário das análises de ORAC, a maior dose de própolis (600mg/kg) mostrou uma tendência positiva em relação a dose 300 mg/kg, apesar de não apresentar nenhuma diferença significativa. Pode-se verificar ainda que a dose de 150 mg/kg foi a que apresentou o comportamento na atividade da SOD mais próximo dos controles positivos (ácido ascórbico e quercetina) (Figura 16 A e B). ) 1 2 CTL – J/APAP CTL /N 3 AAJ/APAP 4 5 P150Q-J/APAP J/APAP 6 P300J/APAP 7 P600J/APAP 1 2 3 4 5 6 Contrastes SOD Plasma 1 2 3 4 5 6 ns p<0,01 ns ns ns ns Figura 16 - A- Valores médios de SOD em plasma, expresso como porcentagem de inibição de NBT e desvios padrão; B- Tabela de contrastes ortogonais com valores de p Kanbul, Eraslan e Silici, (2009) ao avaliarem o efeito da propolis na reversão dos danos causados pelo pesticida propetamphos em ratas Wistar, por meio da expressão da atividade da enzima SOD no plasma dos animais, também obtiveram resultado semelhante ao encontrado nesse trabalho. Observaram o aumento da atividade dessa enzima nos grupos que receberam o pesticida juntamente com a dose de própolis, diferindo significativamente do grupo que recebeu somente o pesticida. Hosmuter et al. (2004) verificaram que o consumo da SOD ativada no plasma de ratos submetidos á queimadura de pele aumenta pela necessidade de sua utilização, na forma ativa, para regenerar a injúria tecidual. Porém, os autores também verificaram que animais submetidos à injúria térmica e tratados intraperitonealmente com CAPE, um composto antioxidante da própolis temperada, fez com que houvesse uma diminuição do consumo dessa enzima, já que o próprio CAPE pode atuar na regeneração do tecido atingido. 4.2.3 Atividade antioxidante on-line do plasma por HPLC O plasma dos animais dos grupos controle normal, controle estressado e tratados com própolis foram submetidos à análise da atividade antioxidante on-line por HPLC, no intuito de se verificar se o estresse aliado ao tratamento com os antioxidantes, apresenta alguma alteração nos compostos do plasma em relação à atividade antioxidante. Foi possível observar que alguns compostos que aparecem no início do cromatograma foram inerentes a todos os animais, tais como o pico 1, 2 e 3, como mostrado na Figura 17. Isso provavelmente se deve ao fato de que existem compostos com atividade antioxidante circulante no plasma mesmo em condições de homeostase. Em relação ao pico 4, não foi possível detectá-lo nos animais do grupo controle normal, o que sugere que pode estar relacionado com a defesa antioxidante endógena do animal que foi mobilizada pelo estresse, fato que corrobora com os resultados das análises de ORAC no plasma. Os picos 5, 6 e 7 somente foram detectados nos animais estressados com APAP e tratados com as doses de própolis 300mg/kg e 600mg/kg. Essas substâncias podem significar os compostos fenólicos ou derivados da própolis vermelha que conseguiram ser absorvidos pela microvilosidades intestinais. ) 3: 280 nm, 8 nm CTL sem jejum R5 - 30uL - DPPH 0,45M acetonitrila + água ac (19-07-12) CTL sem jejum R5 - 30uL - DPPH 0,45M acetonitrila + ág ua ac (19-07-12) 3: 280 nm, 8 nm CTL com jejum R6 - 30uL - DPPH 0,45M acetonitrila + ág ua ac (13-07-12) CTL com jejum R6 - 30uL - DPPH 0,45M acetonitrila + ág ua ac (13-07-12) 40 20 20 10 10 150 150 100 100 Volts 30 Volts 30 Volts Volts 40 50 50 0 0 0 0 0 10 20 30 Minutes 40 50 0 60 10 20 30 Minutes 40 50 60 Detector A (517nm) CTL com jejum R6 - 30uL - DPPH 0,45M acetonitrila + água ac (13-07-12) CTL com jejum R6 - 30uL - DPPH 0,45M acetonitrila + água ac (13-07-12) 0.04 0.04 Detector A (517nm) CTL sem jejum R5 - 30uL - DPPH 0,45M acetonitrila + água ac (19-07-12) CTL sem jejum R5 - 30uL - DPPH 0,45M acetonitrila + ág ua ac (19-07-12) 0.00 -0.02 -0.02 -0.04 -0.04 0.02 0.02 0.00 0.00 -0.02 -0.02 -0.04 -0.04 mAU 0.00 mAU 0.02 mAU mAU 0.02 -0.06 -0.06 -0.06 0 10 20 30 Minutes 40 50 -0.06 0 60 10 20 30 Minutes 40 50 60 * 40 20 20 40 30 30 20 20 10 10 Volts 60 40 Volts 60 0 0 -20 0 -20 0 10 20 30 Minutes 40 50 60 0 0 0.04 -0.04 -0.04 -0.04 50 60 -0.06 -0.06 mAU -0.02 mAU 40 0.04 -0.02 -0.04 30 Minutes 60 -0.02 -0.02 20 50 0.00 0.00 10 40 0.00 0.00 0 30 Minutes 0.02 0.02 -0.06 20 0.02 0.02 mAU Detector A (517nm) P300 R4 - 30uL - DPPH 0,45M acetonitrila + água ac (12-07-12) P300 R4 - 30uL - DPPH 0,45M acetonitrila + água ac (12-07-12) 10 Detector A (517nm) P 600 R5 - 30uL - DPPH 0,45M acetonitrila + água ac (17-07-12) P 600 R5 - 30uL - DPPH 0,45M acetonitrila + água ac (17-07-12) 0.04 0.04 mAU 3: 280 nm, 8 nm P 600 R5 - 30uL - DPPH 0,45M acetonitrila + água ac (17-07-12) P 600 R5 - 30uL - DPPH 0,45M acetonitrila + água ac (17-07-12) 80 Volts Volts 40 3: 280 nm, 8 nm P300 R4 - 30uL - DPPH 0,45M acetonitrila + água ac (12-07-12) P300 R4 - 30uL - DPPH 0,45M acetonitrila + água ac (12-07-12) 80 -0.06 0 10 20 30 Minutes 40 50 60 Figura 17 - Cromatogramas obtidos pela metodologia de atividade antioxidante on-line do plasma dos animais: A- Plasma de animal CTL-N; B- Plasma de animal CTL-J/APAP; C- Plasma de animal P300J/APAP e D- Plasma de animal P600-J/APAP 4.2.3. Análises qualitativas 4.2.3.1. Western Blot As imagens apresentadas na Figura 18 demonstram a presença das enzimas Superoxido Dismutase e Catalase sem nenhum sinal de degradação. Por se tratar de uma análise qualitativa, não é possível observar diferença na expressão das enzimas entre os tratamentos, somente a detecção e a identificação das enzimas, pois suas bandas se localizaram na altura compatível de seus pesos moleculares, comparados com o marcador molecular, e também pela utilização de anticorpos específicos que se ligam somente a essas enzimas. $ $ $ $ ) Figura 18 - A: Western Blot da enzima Superóxido Dismutase I. Cada membrana possui 1 animal de cada tratamento. Detecção da enzima sem sinais visíveis de degradação. B: Western Blot da enzima Catalase. Cada membrana possui 1 animal de cada tratamento. As falhas visíveis não são resultado de degradação. Foram utilizadas amostras dos mesmos animais para ambos os filmes. 1-CTL/N; 2CTL-J/APAP; 3-AA-J/APAP; 4-Q-J/APAP; 5-P150-J/APAP; 6-P300-J/APAP; 7-P600-J/APAP; PPadrão de SOD 800ng/ml 4.2.3.2 Histopatologia hepática Para todos os tratamentos, excluindo o grupo Controle Normal (CTL/N), ocorreu o seguinte: presença de fragmentos de parênquima hepático com arquitetura lobular preservada. Tríade portal presente e sem alterações dignas de nota. Os hepatócitos se distribuem em trabéculas radiadas e, em áreas, algumas destas células mostram-se com núcleos picnóticos e citoplasmas eosinofílicos (corpúsculos de Councilman). Para os grupos, controle com jejum e APAP (CTL-J/APAP) e própolis 600mg/kg (P600/APAP) aconteceu o mesmo que descrito acima, porém com uma informação a mais: na zona 3 acinar (peri-venular), foi observado hepatócitos balonizados (aumento do volume celular com citoplasma claro), para todos os animais avaliados. Também não foi observado depósitos no material examinado e não foi encontrado a dilatação e congestão dos sinusóides como foi encontrado em todos os outros grupos. Isso remete ao fato dessa dilatação e congestão serem consequência do estresse induzido por APAP (Figura 19 A, B, C, D e E). As alterações encontradas nos grupos CTL-J/APAP e P600/APAP (Figura 17B e E), sugerem que as doses mais baixas protegeram melhor o órgão da lesão causada pelo APAP em relação a dose de 600mg/kg, fato que também corrobora com outras análises realizadas nesse estudo. Figura 19 - Imagens de lâminas de histopatologia hepática, corada pelo processo Hematoxilina e Eosina. CTL/N (a); CTL-J/APAP (b); P150-J/APAP (c); P300-J/APAP (d); P600-J/APAP (e) 5. CONCLUSÕES Diante dos resultados obtidos, foi possível concluir: A própolis utilizada nesse trabalho apresentou uma grande diversidade de flavonoides, isoflavonoides e pterocarpanos, típicos da própolis vermelha brasileira. Além disto, foram encontradas altas concentrações das substâncias voláteis -cubebeno e germacreno D, as quais não são as substâncias majoritárias na própolis vermelha de outras regiões do Nordeste do Brasil. O indutor de estresse oxidativo hepático Acetaminofen (APAP), na dose de 800mg/kg em administração oral, não gerou um estresse oxidativo intenso. Porém houve alteração hepática importante, mas não o suficiente que pudesse detectar diferenças significativas em algumas variáveis de resposta ao estresse oxidante. Pode-se concluir também que a via de administração da droga e a espécie de animal utilizado contribuem para que o estresse excessivo seja gerado. Dentre as análises realizadas, a análise de ORAC foi eficiente e adequada parta a avaliação da atividade antioxidante, tanto em amostras biológicas (plasma e fígado) quanto no próprio EEP. Em relação às doses de própolis utilizadas, foi possível concluir que a concentração para uso como antioxidante contra o estresse oxidativo é de 150 a 300mg/kg. Acima desse limite, a própolis deixa de ser antioxidante e passa a ter uma ação de menor proteção. As doses mais baixas, de acordo com as análises histopatológicas, protegeram melhor o fígado da lesão causada pelo APAP em relação à dose de 600mg/kg. A própolis vermelha brasileira possui alto potencial antioxidante in vitro, e também potencial benéfico in vivo. REFERÊNCIAS AGARWAL, R.; MACMILLAN-CROW, L. A.; RAFFERTY, T. M.; SABA, H.; ROBERTS, D. W.; FIFER, E. K.; JAMES, L. P.; HINSON, J. A. Acetaminopheninduced hepatotoxicity in mice occurs with inhibition of activity and nitration of mitochondrial manganese superoxide dismutase. Journal of Pharmacology and Experimental Therapeutics, Baltimore, v. 337, n. 1, p. 110-116, 2011. DOI:10.1124/jpet.110.176321. AHN, M. R.; KUMAZAWA, S.; HAMASAKA, T.; BANG, K. S.; NAKAYAMA, T. Antioxidant activity and constituents of propolis collected in various areas of Korea. Journal of Agricultural and Food Chemistry, Washington, DC, v. 52, p. 72867292, 2004. ALBERTS, B.; JOHNSON, A.; LEWIS, J.; RAFF, M.; ROBERTS, K.; WALTER, P. Biologia molecular da célula. Porto Alegre: Artmed, 2004. 1463 p. ALENCAR, S. M.; OLDONI, T. L. C.; CASTRO, M. L.; CABRAL, I. S. R.; COSTANETO, C. M.; CURY, J. A.; ROSALEN, P. L.; IKEGAKI, M. Chemical composition and biological activity of a new type of Brazilian propolis: Red propolis. Journal of Ethnopharmacology, Lausanne, v. 113, p. 278-283, 2007. ANDRADE JÚNIOR, D. R.; SOUZA, R. B.; SANTOS, S. A.; ANDRADE, D. R. Os radicais livres de oxigênio e as doenças pulmonares. Oxygen free radicals and pulmonary disease. Jornal Brasileiro de Pneumologia, São Paulo, v. 31, n. 1, p. 60-68, 2005. ARIMURA, G.; HUBER, D. P. W.; BOHLMANN, J. Forest tent caterpillars (Malacosoma disstria) induce local and systemic diurnal emissions of terpenoid volatiles in hybrid poplar (Populus trichocarpa × deltoides): cDNA cloning, functional characterization, and pattERN of gene expression of (−)-germacrene D synthase, PtdTPS1. The Plant Journal, Oxford, v. 37, p. 603-616, 2004. ARNAO, M. B. Some methodological problems in determination of antioxidant activity using chromogen radicals: a practical case. Trends in Food Science and Technology, Cambridge, v. 11, n. 11, p. 419-421, 2000. BAKKALI, F.; AVERBECK, S.; AVERBECK, D.; IDAOMAR, M. Biological effects of essential oils- A review. Food and Chemical Toxicology, Oxford, v. 46, p. 446-475, 2008. BANERJEE, A.; LINSCHEER, W. G.; CHIJI, H.; MURTHY, U. K.; CHO, C.; NANDI, J.; CHAN, S. H. Induction of an ATPase inhibitor protein by propylthiouracil and protection against paracetamol (acetaminophen) hepatotoxicity in the rat. British Journal of Pharmacology, London, v. 124, p. 1041-1047, 1998. BANKOVA, V.; POPOV, S.; MAREKOV, N. L. High performance liquid chromatographic analysis of flavonoids from propolis. Journal of Chromatography A, Amsterdam, v. 242, p. 135-143, 1982. BANKOVA, V.; POPOV, S.; MAREKOV, N.L. Isopentenyl cinnamates from poplar buds and propolis. Phytochemistry, Oxford, v. 28, n. 3, p. 871-873, 1989. BANSKOTA, A. H.; TEZUKA, Y.; KADOTA, S. Recent progress in pharmacological research of propolis. Phytotherapy Research, London, v. 15, p. 561–571, 2001. BARREIROS, A. L. B. S.; DAVID, J. M. Estresse oxidativo: relação entre geração de espécies reativas e defesa do organismo. Química Nova, São Paulo, v. 29, n. 1, p. 113-123, 2006. BASNET, P.; MATSUNO, T.; NEIDLEIN, R. Potent free radical scavenging activity of propol isolated from Brazilian propolis. Zeitschrift fur Naturforschung, Tubingen, v. 52, n. 11-12, p. 828-833, 1997. BEHLING, E. B.; SENDÃO, M. C.; FRANCESCATO, H. D. C.; ANTUNES, L. M. G.; BIANCHI, M. L. P. Flavonóide quercetina: Aspectos gerais e ações biológicas. Alimentação e Nutrição, Araraquara, v. 15, n. 3, p. 285-292, 2004. BENKOVIC, V.; HORVAT KNEZEVIC, A.; BROZOVIC, G.; KNEZEVIC, F.; DIKIC, D.; BEVANDA, M.; BASIC, I.; ORSOLIC, N. Enhanced antitumor activity of irinotecan combined with propolis and its polyphenolic compounds on Ehrlich ascites tumor in mice. Biomedicine and Pharmacotherapy, New York, v. 61, p. 292-297, 2007. BHADAURIA, M.; NIRALA, S. K.; SHUKLA, S. Hepatoprotective efficacy of propolis extract: A biochemical and histopathological approach. Iranian Journal of Pharmacology, Theran. v. 6, n. 2, p. 145-154, 2007. BHADAURIA, M.; NIRALA, S. K.; SHUKLA, S. Multiple treatment of propolis extract ameliorates carbon tetrachloride induced liver injury in rats. Food and Chemical Toxicology, Oxford, v. 46, p. 2703–2712, 2008. BONVEHÍ, J. S.; GUTIÉRREZ, A. L. Antioxidant activity total phenolics of propolis from the Basque Country (Northeastern Spain). Journal of American Oil Chemists’ Society, Chicago, v. 88, p.1387-1395, 2011. BRADFORD, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochemistry, New York, v. 72, p. 248-254, 1976. BURDOCK, G. A. Review of the biological properties and toxicity of bee propolis. Food and Chemical Toxicology, Oxford, v. 36, n. 4, p. 347-363, 1998. CABRAL, I. S. R.; OLDONI, T. L. C.; PRADO, A.; IKEGAKI, M.; ROSALEN, P. L.; ALENCAR, S. M. Composição fenólica, atividade antibacteriana e antioxidante da própolis vermelha brasileira. Química Nova, São Paulo, v. 32, p. 1523–1527, 2009. CAO, G.; ALESSIO, H. M.; CULTER, R. Oxygen-radical absorbance capacity assay for antioxidants. Free Radical Biology & Medicine, New York, v. 14, p. 303-311, 1993. CAO, G.; VERDON, C. P.; WU, A. H. B.; WANG, H.; PRIOR, R. L. Automated assay of oxygen radical absorbance capacity with the COBAS FARA II. Clinical Chemistry, Washington, DC, v. 41, p. 1738-1744, 1995. CHAINY, G. B. N.; MANNA, S. K.; CHATURVEDI, M. M.; AGGARWAL, B. B. Anethole blocks both early and late cellular responses transducted by tumor necrosis factor: effect on NF-kB, AP-1, JNK, MAPKK and apoptosis. Oncogene, Basingstoke, GB, v. 19, p. 2943-2950, 2000. CHANDRASEKARAN, C. V.; SUNDARAJAN, K.; KRIPALINI, D.; AGARWAL, A. In vitro efficacy and safety of poly-herbal formulations. Toxicology In vitro, Oxford, v. 24, p. 885–897, 2010. CHOI, Y. W.; KIM, H. J.; PARK, S. S.; CHUNG, J. H.; LEE, H. W.; OH, S. O.; KIM, B. S.; KIM, J. B.; CHUNG, H. Y.; YU, B. P.; KIM, C. D.; YOON, S. Inhibition of endothelial cell adhesion by the new anti-inflammatory agent -iso-cubebene. Vascular Pharmacology, New York, v. 51, p. 215-224, 2009. CHUN, S. S.; VATTEM, D. A.; LIN, Y. T.; SHETTY, K. Phenolic antioxidants from clonal oregano (Origanum vulgare) with antimicrobial activity against Helicobacter pylori. Process Biochemistry, Oxford, v. 40, p. 809–816, 2005. COHEN, S. D., PUMFORD, N. R., KHAIRALLAH, E. A., BOEKELHEIDE, K., POHL, L. R., AMOUZADEH, H. R., AND HINSON, J. A., Selective protein covalent binding and target organ toxicity. Toxicology and Applied Pharmacology, New York, v. 143, p. 1-12, 1997. CORNWELL, T.; COHICK, W.; RASKIN, I. Dietary phytoestrogens and health, Phytochemistry, Oxford, v. 65, p. 995-1016, 2004. COTELLE, N.; HAPIOT, P.; PINSON, J.; ROLANDO, C.; VEZIN, H. Polyphenols deriving from chalcones: Investigations of redox activities. Journal of Physical Chemistry B, Washington, DC, v. 109, n. 49, p. 23720-23729, 2005. doi.10.1021/jp0550661. DAHLIN, D. C.; MIWA, G. T.; LU, A. Y. H.; NELSON, S. D. N-acetyl-pbenzoquinone imine: a cytochrome P-450 mediated oxidation product of acetaminophen. Proceedings of the National Academy of Science of the USA, Washington, DC, v. 81, n. 5, p. 1327–1331, 1984. DASTIDAR, S. G.; MANNA, A.; KUMAR, K. A.; MAZUMDAR, K.; DUTTA, N. K.; CHAKRABARTY, A. N.; MOTOHASHI, N.; SHIRATAKI, Y. Studies on the antibacterial potentiality of isoflavones. International Journal of Antimicrobial Agents, Amsterdam, v. 23, p. 99-102, 2004. DAUGSCH, A.; MORAES, C. S.; FORT, P.; PARK, Y. K.; Brazilian red propolis Chemical composition and botanical origin. Evidence-Based Complementary and Alternative Medicine, Bethesda, v. 5, n. 4, p. 435–441, 2008. DAVALOS, A.; GOMEZ-CORDOVES, C.; BARTOLOME, B. Extending applicability of the oxygen radical absorbance capacity (ORAC fluorescein) assay. Journal of Agricultural and Food Chemistry, Washington, DC, v. 52, p. 48-54, 2004. DIAS, C. A. R.; MOURA, P. M. S. S.; D´ANGELIS, C. E. M. A complexa interação entre radicais livres, suplementação e doenças. Nutrição em Foco, p. 34-43, 2011. DUTTA, K.; MUKHOPADHYAYA, S.; BHATTACHARJEE, S.; CHAUDHURI B.; MARNETT, L. J. Chemical oxidation of methylene blue using a Fenton-like reaction Oxyradicals and DNA damage. Journal of Hazardous Materials, Amsterdam, v. 84, p. 57-71, 2001. FERREIRA, A. L. A.; LIMA, L. M. A.; MATSUBARA, L. S. Glutationa: O antioxidante. Síntese, metabolismo e degradação. Jornal Brasileiro de Medicina, Rio de Janeiro, v. 73, p. 93-102, 1997. FONTANAROSA, P. B.; LUNDBERG, G. D. Alternative medicine meets science. Journal of the American Medical Association, Chicago, v. 280, p. 1618–1619, 1998. FROZZA, C. O. S.; GARCIA, C. S. C.; GAMBATO, M. D. O. S.; SALVADOR, M.; MOURA, S.; PADILHA, F. F.; SEIXAS, F. K.; COLLARES, T.; BORSUK, S.; DELLAGOSTIN, O. A.; HENRIQUES, J. A. P.; ROESC-ELY, M. Chemical Characterization, Antioxidant and Cytotoxic activities of Brazilian Red Propolis. Food and Chemical Toxicology, Rio Grande do Sul, v. 52, p. 137-142, 2013. GARCIA, C. S. C.; GAMBATO, G.; SOUZA, M. D. O.; SALVADOR, M.; MOURA, S.; PADILHA, F. F.; SEIXAS, F. K.; COLLARES, T.; BORSUK, S.; DELLAGOSTIN, O. A.; HENRIQUES, J. A. P.; ROESCH-ELY, M. Chemical characterization, antioxidant and cytotoxic activities of Brazilian red propolis. Food and Chemical Toxicology, Oxford, v. 52, p. 137-142, 2013. GARTNER, L. P.; HIATT, J. L. Tratado de histologia. Rio de Janeiro: Guanabara Koogan, 1999. GENG, Y.; LI, C.; LIU, J.; XING, G.; ZHOU, L.; DONG, M.; LI, X.; NIU, Y. Betaasarone improves cognitive function by suppressing neuronal apoptosis in betaamyloid hippocampus injection rats. Biological and Pharmaceutical Bulletin, Tokyo, v. 33, p. 836-843, 2010. GOMES, F. P.; GARCIA, C. H. Estatística aplicada a experimentos agronômicos e florestais. Piracicaba: FEALQ, 2002. 309 p. GUTTERIDGE, J. M.; HALLIWELL, B. Free radicals and antioxidants in the year 2000. A historical look to the future. Annals of the New York Academy of Sciences, New York, v. 899, n. 1, p. 136-147, 2000. HART, S. G.; CARTUN, R. W.; WYAND, D. S.; KHAIRALLAH, E. A.; COHEN, S. D. Immunohistochemical localization of acetaminophen in target tissues of the CD- 1mouse: Correspondence of covalent binding with toxicity. Fundamental and Applied Toxicology, Orlando, v. 24, p. 260-274, 1995. HINSON, J. A.; PIKE, S. L.; PUMFORD, N. R.; MAYEUX, P. R. Nitrotyrosine-protein adducts in hepatic centrilobular areas following toxic doses of acetaminophen in mice. Chemical Research in Toxicology, Washington, DC, v. 11, p. 604-607, 1998. ISLA, M. I.; PAREDES-GUZMAN, J. F.; NIEVA-MORENO, M. I.; KOO, H.; PARK, Y. K. Some chemical composition and biological activity of Northern Argentine propolis. Journal of Agricultural and Food Chemistry, Washington, DC, v. 53, p. 11661172, 2005. IVANOVSKA, N. D.; DIMOV, V. B.; BANKOVA, V. S.; POPOV, S. S. Immunomodulatory action of propolis. VI. Influence of a water soluble derivative on complement activity in vivo. Journal of Ethnopharmacology, Lausanne, v. 47, n. 3, p. 145-147, 1995. JAESCHKE, H., KNIGHT, T. R., AND BAJT, M. L., The role of oxidant stress and reactive nitrogen species in acetaminophen hepatotoxicity. Toxicology Letters, Amsterdam, v. 144, p. 279-288, 2003. JAMES, L. P.; LETZIG, L.; SIMPSON, P. M.; CAPPARELLI, E.; ROBERTS, D. W.; HINSON, J. A.; DAVERN, T. J.; LEE, W. M. Pharmacokinetics of acetaminophenprotein adducts in adults with acetaminophen overdose and acute liver failure. Drug Metabolism and Disposition, Bethesda, v. 37, p. 1779-1784, 2009. KAMBUR, M.; ERASLAN, G.; SILICI, S. Antioxidant effect of propolis against to propetamphos in rats. Journal of Nutritional Biochemistry, Stoneham, v. 20, p. 163-171. 2009. KEHRER, J. P. The Haber–Weiss reaction and mechanisms of toxicity. Toxicology, Amsterdam, v. 149, p. 43-50, 2000. KEY, T. J.; THOROGOOD, M.; APPLEBY, P. N.; BURR, M. L. Dietary habits and mortality in 11,000 vegetarians and health conscious people: results of a 17-year follow up. British Medical Journal, London, v. 313, p. 775-779, 1996. KIMOTO, T.; ARAI, S.; KOGUCHI, M.; AGA, M.; NOMURA, Y.; MICALLEF, M. J. Apoptosis and suppression of tumor growth by artepillin C extracted from Brazilian propolis. Cancer Detection and Prevention, New York, v. 22, p. 506-515, 1998. KODYDKOVÁ J, VÁVROVÁ L, ZEMAN M, KODYDKOVA, J.; VAVROVA, L.; ZEMAN, M.; JIRÁK, R.; MACÁSEK, J.; STANKOVÁ, B.; TVRZICKÁ, E.; ZÁK, A. Antioxidative enzymes and increased oxidative stress in depressive women. Clinical Biochemistry, Toronto, v. 42, n. 13-14, p. 1368-1374, 2009. KOJIMA, H.; URANO, Y.; KIKUCHI, K.; HIGUCHI, T.; HIRATA, Y.; NAGANO, T. Fluorescent indicators for imaging nitric oxide production. Angewandte Chemie. International Edition, Weinheim, v. 38, p. 3209-3212, 1999. KOLEVA, I. I.; NIEDERLANDER, H. A. G.; van BEEK, T. A. An on-line HPLC method for detection of radical scavenging compounds in complex mixtures. Analytical Chemistry, Washington, DC, v. 72, p. 2323-2328, 2000. KOTSINAS, A.; AGGARWAL, V.; TAN, E. J.; LEVY, B.; GORGOULIS, V. G. PIG3: A novel link between oxidative stress and DNA damage response in cancer. Cancer Letters, Amsterdam, v. 327, p. 97–102, 2012. KUHNAU, J. The flavonoids. A class of semi-essential food components: their role in human nutrition. World Review of Nutrition and Dietetics, London, v. 24, p. 117191, 1976. LARSON, R. A. The antioxidants of higher plants. Phytochemistry, Oxford, v. 27, p. 969-978, 1988. LEITE, A. V.; MALTA, L. G.; RICCIO, M. F.; EBERLIN, M. N.; PASTORE, G. M.; MAROSTICA JUNIOR, M. R. Antioxidant potential of rat plasma by administration of freeze-dried jaboticaba peel (Myrciaria jaboticaba Vell Berg). Journal of Agricultural and Food Chemistry, Washington, DC, v. 59, p. 2277-2283, 2011. dx.doi.org/10.1021/jf103181x. LESSMANN, H.; SCHNUCH, A.; GEIER, J.; UTER, W. Skin-sensitizing and irritant properties of propylene glycol. Contact Dermatitis, Copenhagen, v. 53, n. 5, p. 247259, 2005. LI, Y.; HUANG, T. T.; CARLSON, E. J.; MELOV, S.; URSELL, P. C.; OLSON, J. L.; NOBLE, L. J.; YOSHIMURA, M. P.; BERGER, C.; CHAN, P. H.; WALLACE, D. C.; EPSTEIN, C. J. Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nature Genetics, New York, v. 11, p. 376-381, 1995. LIU, F. Antioxidant activity of garlic acid from rose flowers in senescence accelerated mice. Life Sciences, Oxford, v. 77, p. 230-240, 2005. MANACH, C.; WILLIAMSON, G.; MORAND, C.; SCALBERT, A.; RÉMÉSY, C. Bioavailability and bioefficacy of polyphenols in humans. I. Review of 97 bioavailability studies1–3. American Journal of Clinical Nutrition, Bethesda, v. 81, p. 230S-42S, 2005. MANIKANDAN, S.; DEVI, R.S. Antioxidant property of -asarone against noisestress-induced changes in different regions of rat brain. Pharmacological Research, London, v. 52, p. 467-474, 2005. MARKHAM, R. K.; MITCHELL, K. A.; WILKINS, A. L.; DALDY, J. A.; LU, Y. HPLC and GC-MS identification of the major organic constituents in new Zealand propolis. Phytochemistry, Oxford, v. 42, n. 1, p. 205-211, 1996. MENDES, C.E.; CASARIN, F.; OHLAND, A.L.; FLACH, A.; COSTA, L.A.M.A.; DENARDIN, R.B.N.; MOURA, N.F. Efeitos das condições ambientais sobre o teor e variabilidade dos óleos voláteis de Dalbergia frutescens (Vell.) Britton (Fabaceae). Química Nova, São Paulo, v. 35, n. 9, p. 1787-1793, 2012. MENEZES, H. Própolis: Uma revisão: os recentes estudos de suas propriedades farmacológicas. Arquivos do Instituto Biológico, São Paulo, v. 72, p. 405-411, 2005. MENSOR, L. L.; MENEZES, F. S.; LEITÃO, G. G.; REIS, A. S.; SANTOS, T. C.; COUBE, C. S.; LEITÃO, S. G. Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method. Phytotherapy Research, London, v. 15, p. 127-130, 2001. MILES, E. A.; ZOOUBOULI, P.; CALDER, P. C.; PHIL, D. Differential antiinflammatory effects of phenolic compounds from extra virgin olive oil identified in human whole blood cultures. Nutrition, Burbank, California, v. 21, p. 389-394, 2005. MILLER, N.J.; RICE-EVANS, C.A.; DAVIES, M.J.; GOPINATHAN, V.; MILNER, A. A novel method for measuring antioxidant capacity and its application to monitoring antioxidant status in premature neonates. Clinical Science, Oxford, v. 84, n. 4, p. 407-412, 1993. MILNER, J. A. Functional foods and health promotion. Journal of Nutrition, Bethesda, v. 129, p. 1395S–1397S, 1999. MILTERSTEINER, A.; MILTERSTEINER, D.; PEREIRA FILHO, N.; FROTA, A. R.; ELY, P. B.; ZETTLER, C. G.; MARRONI, C. A.; MARRONI, N. P. Uso de quercetina a longo prazo em ratos cirróticos. Acta Cirúrgica Brasileira, São Paulo, v. 18, n. 3, p. 232-237, 2003. MIN, K.; EBELER, S. E. Flavonoid effects on DNA oxidation at lowconcentrations relevant to physiological levels. Food and Chemical Toxicology, Oxford, v. 46, n. 1, p. 96–104, 2008. MISHIMA, S.; NARITA, Y.; CHIKAMATSU, S.; INOH, Y.; OHTA, S.; YOSHIDA, C.; ARAKI, Y.; AKAO, Y.; SUZUKI, K.; NOZAWA, Y. Effects of propolis on cell growth and gene expression in HL-60 cells. Journal of Ethnopharmacology, Lausanne, v. 99, p. 5-11, 2005. MITCHELL, J. R.; JOLLOW, D. J.; POTTER, W. Z.; GILLETTE, J. R.; BRODIE, B. B. Acetaminophen-induced hepatic necrosis. IV. Protective role of glutathione. Journal of Pharmacology and Experimental Therapeutics, Baltimore, v. 187: p. 211-217, 1973. MOHAMMADZADEH, S.; SHARRIATPANAHI, M.; HAMEDI, M.; AMANZADEH, Y.; EBRAHIMI, S. E. S.; OSTAD, S. N. Antioxidant power of Iranian propolis extract. Food Chemistry, Amsterdam, v. 103, p. 729-733, 2007. LEE, N. H.; SEO, C. S.; LEE, H. Y.; JUNG, D. Y.; LEE, J. K.; LEE, J. A.; SONG, K. Y.; SHIN, H. K.; LEE, M. Y.; SEO, Y. B.; KIM, H.; HA, H. Hepatoprotective and antioxidative activities of cornus officinalis against acetaminophen-induced hepatotoxicity in mice. Evidence-Based Complementary and Alternative Medicine, Bethesda, 2012. doi:10.1155/2012/804924. NOGUEIRA, P. C. L. Contribuição à química dos compostos voláteis e interações com os organismos receptores. 2002. Tese (Doutorado em Ciências) – Instituto de Química, UNICAMP, Campinas, 2002. NUNES, L. C. C.; GALINDO, A. B.; OLIVEIRA DE DEUS, A. S.; RUFINO, D. A.; RANDAU, K. P.; XAVIER, H. S.; CITÓ, A. M. G. L.; ROLIM NETO, P. J. Variabilidade sazonal dos constituintes da própolis vermelha e bioatividade em Artermia salina. . Revista Brasileira de Farmacognosia, João Pessoa, v. 19, p. 524-529, 2009. OKADA, Y.; OKADA, M.; SAGESAKA, Y. Production Activity and Tumor Necrosis Factor-Alpha Inhibitory Activity on 3T3-L1 Adipocytes. Plant Foods and Human Nutrition, Dordrecht, v. 65, p. 225-232, 2010. OKADA, Y.; KANEKO, M.; OKAJIMA, H. Hydroxyl radical scavenging activity of naturally occurring furanfatty acids. Biological and Pharmaceutical Bulletin, Tokyo, v. 19, p. 1607-1610, 1996. OLDONI, T. L. C.; CABRAL, I. S. R.; D’ARCE, M. A. B. R.; ROSALEN, P. L.; IKEGAKI, M.; NASCIMENTO, A. M.; ALENCAR, S. M. Isolation and analysis of bioactive isoflavonoids and chalcone from a new type of Brazilian propolis. Separation and Purification Technology, Amsterdam, v. 77, p. 208-213, 2011. OU, B.; HAMPSCH-WOODILL, M.; PRIOR, R. L. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. Journal of Agricultural and Food Chemistry, Washington, DC, v. 49, n. 10, p. 4619-4626. 2001. PALOMINO, L. R.; GARCÍA, C. M.; GIL, J. H.; ROJANO, B. A.; DURANGO, D. L. Determination of phenolic content and evaluation of antioxidant activity of propolis from Antioquia (Colombia). Vitae - Revista de la Facultad de Química Farmacêutica, Medellin, Colombia, v. 16, n. 3, p. 399-395, 2009. PARK, Y. K.; ALENCAR, S. M.; AGUIAR, C. L. Botanical origin and chemical composition of Brazilian propolis. Journal of Agricultural and Food Chemistry, Washington, DC, v. 50, n. 9, p. 2502-2506, 2002. PETRAKIS, P., V.; ROUSSIS, V.; PAPADIMITRIOU, D.; VAGIAS, C.; TSITSIMPIKOU, C. The effect of terpenoid extracts from 15 pine species on the feeding behavioural sequence of the late instars of the pine processionary caterpillar Thaumetopoea pityocampa. Behavioural Processes, Amsterdam, v. 69, p. 303-322, 2005. PETRONILHO, S.; MARASCHIN, M.; COIMBRA, M. A.; ROCHA, S. M. In vitro and in vivo studies of natural products: A challenge for their valuation. The case study of chamomile (Matricaria recutita L.). Industrial Crops and Products, Amsterdam, v. 40, p. 1-12, 2012. PINO, E.; CAMPOS, A. M.; LÓPEZ-ALARCÓN, C.; ASPÉE, A.; LISSI, E. Free radical scavenging capacity of hydroxycinnamic acids and related compounds. Journal of Physical Organic Chemistry, New York, v. 19, n. 11, p. 759-764.2006. PINTO, A. C.; SILVA, D. H. S.; BOLZANI, D. S.; LOPES, N. P.; EPIFANIO, R. A. Produtos naturais: atualidades, desafios e perspectivas. Química Nova, São Paulo, v. 25, n. 1, p. 45-61, 2002. PODSEDEK, A. Natural antioxidants capacity of brassica vegetables: a review. LWT: Journal of Food Composition and Analysis, San Diego, v. 40, p.1-11, 2007. PRIOR, R. L.; HOANG, H.; GU, L.; WU, X.; BACCHIOCCA, M.; HOWARD, L.; HAMPSCH-WOODILL, M.; HUANG, D.; OU, B.; JACOB, R. Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity (ORACFL)) of plasma and other biological and food samples. Journal of Agricultural and Food Chemistry, Washington, DC, v. 51, p. 3273-3279, 2003. PUKASKAS, A.; VAN BEEK, T. A.; DE WAARD, P. Development of a triple hyphenated HPLC-radical scavenging detection-DAD-SPE_NMR system for the rapid identification of antioxidant in complex plant extracts. Journal of Chromatography, A, Amsterdam, v. 1074, p. 81-88, 2005. RATHER, M. A.; DAR, B. A.; DAR, M. Y.; WANI, B. A.; SHAH, W. A.; BHAT, B. A.; GANAI, B. A.; BHAT, K. A.; ANAND, R.; QURISHI, M. A. Chemical composition, antioxidant and antibacterial activities of the leaf essential oil of Juglans regia L. and its constituints. Phytomedicine, Jena, v. 19, p. 1185-1190, 2012. RICE-EVANS, C. Flavonoids and Isoflavones (Phytoestrogens): Absorption, Metabolism, and Bioactivity. Free Radical Biology & Medicine, New York, v. 36, n. 7, p. 827-828, 2004. RIGHI, A. A.; ALVES, T. R.; NEGRI, G.; MARQUES, L. M.; BREYER, H.; SALATINO, A. Brazilian red propolis: unreported substances, antioxidant and antimicrobial activities. Journal of the Science of Food and Agriculture, London, v. 91, n. 13, p. 2363-2370, 2011. doi 10.1002/jsfa.4468. ROGINSKI, V.; LISSI, E. A. Review of methods to determine chain-breaking antioxidant activity in food. Food Chemistry, Barking, v. 92, n. 2, p. 235-254, 2005. RUSSO, A.; LONGO, R.; VANELLA, A. The role of the phenethyl ester of cafeic acid (CAPE) in inhibition of rat lung cyclooxygenase activity by propolis. Fitoterapia. Milano, v. 73, p. S30-S37, 2002. SARIKAYA, A. O.; ULUSOY, E.; OZTURK, N.; TUNÇEL, M.; KOLAYLI, S. Antioxidant activity and phenolic acid constituints of Chestnut (Castania sativa mill.) honey and propolis. Journal of Food Biochemistry, Westport, v. 33, p. 470-481, 2009. SEO, K. W.; PARK, M.; SONG, Y. J.; KIM, S. J.; YOON, K. R. The protective effects of propolis on hepatic injury and its mechanism. Phytotherapy Research, London, v. 17, p. 250-253, 2003. SHI, H.; YANG, H.; ZHANG, X.; YU, L. Identification and quantification of phytochemical composition and anti-inflamatory and radical scavenging properties of methanolic extracts of Chinese propolis. Journal of Agricultural and Food Chemistry, Washington, DC, v. 60, p. 12403-12410, 2012. doi.org/10.1021/jf3042775. SIES, H.; SHAROV, V. S.; KLOTZ, L. O.; BRIVIBA, K. Glutathione peroxidase protects against peroxynitrite-mediated oxidations. A new function for selenoproteins as peroxynitrite reductase. Journal of Biological Chemistry, Baltimore, v. 272, p. 27812-27817, 1997. SILVA, B. B.; ROSALEN, P. L.; CURY, J. A.; IKEGAKI, M.; SOUZA, V. C.; ESTEVES, A.; ALENCAR, S. M. Chemical composition and botanical origin of res propolis, a new type of Brazilian propolis. Evidence-Based Complementary and Alternative Medicine, Bethesda, v. 5, n. 3, p. 313-316, 2007. SINGLETON, V. L.; ORTHOFER, R.; LAMUELA-RAVENTÓS, R. M. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteau reagent. Methods in Enzymology – Oxidants and Antioxidants. Part A, New York, v. 299, p. 152-178, 1999. SLIKKER JUNIOR, W.; ANDERSEN, M. E.; BOGDANFFY, M. S.; BUS, J. S.; COHENE, S. D.; CONOLLY, R. B.; DAVID, R. M.; DOERRER, N. G.; DORMAN, D. C.; GAYLOR, D. W.; HATTIS, D.; ROGERS, J. M.; SETZER, R. W.; SWENBERG, J. A.; WALLACE, K. Dose-dependent transitions in mechanisms of toxicity. Toxicology and Applied Pharmacology, New York, v. 201, n. 3, p. 203-225, 2004. SUN, F.; HAYAMI, S.; HARUNA, S.; OGIRI, Y.; TANAKA, K.; YAMADA, Y.; IKEDA, K.; YAMADA, H.; SUGIMOTO, H.; KAWAI, N.; KOJO, S. In vivo antioxidative activity of propolis evaluated by the interaction with vitamins C and E and the level of lipid hydroperoxides in rats. Journal of Agricultural and Food Chemistry, Washington, DC, v. 48, p. 1462-1465, 2000. TAMBLE, Y.; TSUJIUCHI, H.; HONDA, G.; IKESHIRO, Y.; TANAKA, S. Gastric cytoprotection of non-steroidal anti-inflammatory sesquiterpene, -caryophyllene. Planta Medica, Stuttgart, v. 62, p. 469-470, 1996. TANAKA, K.; MIURA, T.; UMEZAWA, N.; URANO, Y.; KIKUCHI, K.; HIGUCHI, T.; NAGANO, T. Rational design of fluoresceinbased fluorescence probes. Mechanismbased design of a maximum fluorescence probe for singlet oxygen. Journal of the American Chemical Society, Washington, DC, v. 123, p. 2530-2536, 2001. THOMSON, W.M. Própolis. Med J Aust. p. 153-654, 1990. TOMÁS-BARBERÁN, F. A.; GARCÍA-VIGUERA, C.; VIT-OLIVIER, P.; FERRERES, F.; TOMÁS-LORENTE, F. Phytochemical evidence for the botanical origin of tropical propolis from Venezuela. Phytochemistry, Oxford, v. 34, n. 1, p. 191-196, 1993. TRUSHEVA, B.; POPOVA, M.; VASSYA BANKOVA, V.; SIMOVA, S.; MARCUCCI, M. C.; MIORIN, P. L.; PASIN, F. R.; TSVETKOVA, I. Bioactive constituents of Brazilian red propolis. Evidence-Based Complementary and Alternative Medicine, Bethesda, v. 3, p. 249-254, 2006. VALKO, M.; LEIBFRITZ, D.; MONCOL, J.; CRONIC, M. T. D.; MILAN, M.; TELSER, J. Free radicals and antioxidants in normal physiological functions and human disease. International Journal of Biochemistry & Cell Biology, New York, v. 32, n. 3, p. 3-41, 2006. WARSHAW, E. M.; BOTTO, N. C.; MAIBACH, H. I.; FOWLER JUNIOR, J. F.; RIETSCHEL, R. L.; ZUG, K. A.; BELSITO, D. V.; TAYLOR, J. S.; DELEO, V. A.; PRATT, M. D.; SASSEVILLE, D.; STORRS, F. J.; MARKS JUNIOR, J. G.; MATHIAS, C. G. Positive patch-test reactions to propylene glycol: a retrospective cross-sectional analysis from the North American Contact Dermatitis Group, 1996 to 2006. Dermatitis, Hamilton, v. 20, p. 14-20, 2009. YEN, F. L.; WU, T. H.; LIN, L. T.; LIN, C. C. Hepatoprotective and antioxidant effects of Cuscuta chinensis against acetaminophen-induced hepatotoxicity in rats. Journal of Ethnopharmacology, Lausanne, v. 111, p. 123-128, 2007. DOI: 10.1016/j.jep.2006.11.003. YUAN, R.; LIN, Y. Traditional Chinese medicine: an approach to scientific proof and clinical validation. Pharmacology and Therapeutics, Oxford, v. 86, p. 191–198, 2000. ANEXO
Download