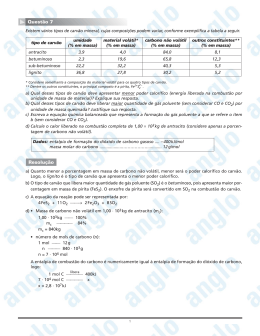
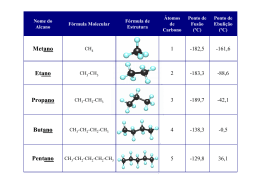
Leonnardo Cruvinel Furquim TERMOQUÍMICA 2 Calorimetria Os reagentes são colocados num recipiente de aço de paredes resistentes chamado bomba, o qual está imerso numa quantidade de água contida num recipiente isolado. Calorimetria Após terem sido medidas as Tinicial da H2O e do interior do calorímetro, a reação inicia-se pela passagem de uma corrente elétrica através de um fio para ignição. A Tfinal é determinada. Capacidade calorífica A capacidade calorífica de um sistema é a quantidade de calor necessária para elevar a temperatura de um sistema em 1 °C. As unidades SI para a capacidade calorífica molar (C) são joules por graus Celsius por mol (J °C-1 mol-1). A capacidade calorífica relaciona a quantidade de calor, q, absorvida por uma substância ao aumento de temperatura de um sistema. Se representarmos ∆T como a variação de temperatura (∆T = ∆Tfinal - ∆Tinicial), C, a capacidade calorífica molar, e n, o número de mols de substância, então: q = nC∆T Capacidade calorífica Uma amostra de 15,0 g de ouro (massa atômica de 197 g mol-1 e capacidade calorífica 25,4 J °C-1 mol-1) é aquecida de 16,1 °C para 49,3 °C. Na hipótese de que a capacidade calorífica do ouro seja constante neste intervalo, calcule a quantidade de calor absorvida pelo ouro. Capacidade calorífica Uma amostra de 15,0 g de ouro (massa atômica de 197 g mol-1 e capacidade calorífica 25,4 J °C-1 mol-1) é aquecida de 16,1 °C para 49,3 °C. Na hipótese de que a capacidade calorífica do ouro seja constante neste intervalo, calcule a quantidade de calor absorvida pelo ouro. n = 7,61 x 10-2 mol ∆T = 33,2 °C q = 64,2 J Capacidade calorífica Os calorímetros são projetados para manter a transferência de calor entre o interior e as vizinhanças a um mínimo valor absoluto. Numa bomba calorimétrica, assume-se que a quantidade de calor absorvido (ou liberado) pela combinação de água, o interior do calorímetro, a bomba e a mistura reagente seja igual à produzida (ou absorvida) pela reação que ocorre na bomba. Capacidade calorífica Uma amostra de 0,828 g de metanol é colocada numa bomba calorimétrica com uma quantidade de gás oxigênio (sob pressão) suficiente para assegurar a combustão completa. O calorímetro contém 1,35 Kg de água, e a capacidade calorífica do interior do calorímetro (sem água) é 1,06 KJ °C-1. Quando o metanol queima, a temperatura aumenta de 23,10 para 25,90 °C. Qual é o calor molar de combustão do metanol? (Quanto calor é liberado durante a combustão de 1 mol de metanol?) (Dados: CH2O = 75,3 J °C-1 mol-1). Capacidade calorífica Capacidade calorífica Equações termoquímicas Quando uma reação química se realiza à pressão constante, a quantidade de calor liberado ou absorvido é expressa pela variação de entalpia do sistema. Isto é chamado usualmente de calor de reação, ou entalpia de reação e é representado por ∆H ou ∆Hreação, e seu sinal algébrico indica se a reação é endotérmica ou exotérmica. Sinal de ∆H Reação + Endotérmica - Exotérmica Lei de Hess Quando 1 mol de carvão é queimado com um excesso de oxigênio à pressão constante, 1 mol de oxigênio é consumido, 1 mol de dióxido de carbono é formado e 383,5 KJ de calor é liberado. A equação termoquímica para esta reação é: C(s) + O2(g) CO2(g) ∆H = -393,5 KJ É preciso realizar este processo em duas etapas: Lei de Hess Lei de Hess Isto ilustra o fato de que, quando as equações químicas são adicionadas como se fossem equações algébricas, os valores de ∆H correspondentes podem também ser adicionados. Lei de Hess: a variação de entalpia para qualquer processo depende somente da natureza dos reagentes e produtos e independe do número de etapas do processo ou da maneira como é realizada a reação. Lei de Hess A figura abaixo ilustra esquematicamente a Lei de Hess para o processo C CO CO2. As reações de formação A Lei de Hess simplifica muito o trabalho de tabelar as variações de entalpia das reações, eliminando a necessidade de uma imensa lista de todas as possíveis reações e seus correspondentes valores de ∆H. Em vez disso, os valores de somente um tipo de reação, a reação de formação, são tabelados, e estes podem ser utilizados para calcular os valores de ∆H das outras reações. Os valores de ∆H das reações de formação são geralmente tabelados, no caso em que cada substância está no seu estado padrão, ou seja, na forma mais estável a 1 atm de pressão. As reações de formação Então, o valor de ∆H da reação de formação é chamado calor padrão de formação, ou entalpia-padrão de formação do produto: ∆H°f A variação de entalpia de uma reação química é o calor absorvido quando a reação se verifica sob condições de pressão constante. Quando todos os reagentes e produtos estão no estado padrão, ∆H°, dá-se o nome de calor padrão de reação, ou entalpia-padrão de reação. As reações de formação As reações de formação Se invertermos as primeiras duas equações anteriores mudando o sinal de cada valor de ∆H, e logo as adicionarmos à terceira equação, obteremos: As reações de formação As reações de formação Determine o calor padrão molar de combustão do metanol em oxigênio para formar dióxido de carbono e vapor de água: As reações de formação A combustão do carvão Quando a forma mais estável de carbono puro, o grafite, é queimado com um excesso de oxigênio, forma-se o dióxido de carbono. Quando ele é queimado por uma quantidade limitada de oxigênio, o monóxido de carbono é formado. As equações termoquímicas para estas duas reações são: C(s) + O2(g) CO2(g) ∆H° = -393,5 KJ mol-1 C(s) + ½O2(g) CO(g) ∆H° = -110,5 KJ mol-1 Os carvões são classificados tomando-se por base o seu conteúdo de carbono e o calor que produzem quando queimam. A combustão do carvão Na tabela abaixo são registrados quatro tipos de carvões, junto com seus calores de combustão aproximados, por grama. Além disso, o correspondente calor de combustão do carbono puro (grafite) é mostrado para efeito de comparação. Carvão %C aproximada ∆Hcomb, KJ g-1 aproximado Antracito 85 -30 Betuminoso 60 -28 Sub-etuminoso 40 -25 Linhito 30 -25 Carbono puro 100 -32,8 A combustão do carvão O carvão é muito usado como fonte de carbono para obter outros combustíveis. Um importante combustível, o gás de água, é uma mistura de gases hidrogênio e monóxido de carbono. Ele é obtido pela reação do vapor com o carbono do carvão, a T (°C) ↑. C(s) + H2O(g) CO(g) + H2(g) ∆H° = 131,3 KJ A mistura resultante é fácil de queimar em grandes fornos e queimadores do que o carvão, por ser um gás e não produzir cinzas. A mistura pode ser queimada diretamente e as duas reações de combustão são: CO(g) + ½O2(g) CO2 (g) ∆H°combustão = -282,0 KJ mol-1 H2(g) + ½O2(g) H2O (l) ∆H°combustão = -285,9 KJ mol-1 A combustão do carvão Ou pode ser tratado com mais vapor para converter CO em CO2: CO(g) + H2O (g) CO2(g) + H2(g) ∆H° = -41,2 KJ mol-1 O hidrogênio na mistura pode reagir com mais carbono do carvão para formar metano: C(s) + 2H2(g) CH4(g) ∆H° = -74,8 KJ mol-1 O processo global para converter carvão e água em metano (e o subproduto dióxido de carbono) é a soma das equações: C(s) + H2O(g) CO(g) + H2(g) ∆H° = 131,3 KJ CO(g) + H2O (g) CO2(g) + H2(g) ∆H° = -41,2 KJ mol-1 C(s) + 2H2(g) CH4(g) ∆H° = -74,8 KJ mol-1 2C(s) + 2H2O(g) CH4(g) + CO2(g) ∆H° = 15,3 KJ mol-1 A combustão do carvão 2C(s) + 2H2O(g) CH4(g) + CO2(g) ∆H° = 15,3 KJ Na mistura resultante dos gases, o dióxido de carbono não tem valor combustível, mas o calor molar de combustão do metano é alto: CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ∆H°combustão = -802 KJ mol-1 Por grama, o calor de combustão do metano é ainda mais alto do que o do carvão, e a mistura combustível é mais fácil de ser introduzida nos queimadores. Leonnardo Cruvinel Furquim [email protected]
Baixar