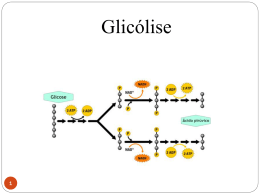
Streptococcus mutans Objetivo do Trabalho • Consiste na análise de bactérias Streptococcus mutans e em como conseguem sobreviver e produzir ácidos em pHs baixos. Pesquisas foram realizadas afim de estabelecer o desempenho desta em pHs baixos (normalmente a S. mutans encontra-se em pH por volta de 7.0 - em meio salivar - e no experimento foi testado um pH 5.0). Esta bactéria é vulgar na boca do homem e é o principal fator do desenvolvimento de cáries devido a sua capacidade acidogênica e acidúrica. Através de pesquisas, foi possível estreitar as adaptações bioquímicas e fisiológicas que permitem o S. mutans produzir ácidos e sobreviverem em pHs baixos. Essa bactéria gasta energia pra expulsar o excesso de H+ a partir da célula, minimizando os efeitos negativos ( efeitos esses que serão discutidos ao longo do estudo). A análise final demonstrou a capacidade de adaptação fenotípica durante a tolerância a ácidos e as mudanças no nível das proteínas, que parecem estar limitadas as principais vias metabólicas : a glicólise, a produção de ácidos graxos e a síntese de cadeias ramificadas de aminoácidos. Metodologia Empregada • PREPARAÇÃO DO MEIO DE CULTURA -Meio de cultura com saliva artificial, modificada,incluindo adenina,guanina e uracila a 20microgramas/mol,15 mM de KH2PO4 e 15 mM de K2HPO4. • a S.mutans é dependente de glicose a uma certa taxa de diluição,em pH 7.0 e pH 5.0,onde quase toda a glicose foi utilizada,e aminoácidos adicionados permaneceram em excesso. PREPARAÇÃO DE PROTEÍNAS CELULARES • Mutanolisina(enzima de extração). • -Proteínas são separadas em um meio onde há faixas ácidas de pH’s fixos (pH 4-6.7).Há a adição de substâncias que favorecem a difusão de mais alvos protéicos no gel.(Amidosulfatobetaína-14,e DTT) • Proteínas em faixas mais básicas de pH fixo(611):-Extração(mutanolisina) • -Centrifugação -Precipitação -Degradação do DNA(Exonuclease III) • -Eletroforese IDENTIFICAÇÃO DAS PROTEÍNAS • São identificadas por mapeamento de massa ANÁLISE DE AMINOÁCIDOS -Derivados de aminoácidos são separados e quantificados -Triptofano (raios UV) -Todos os outros(Técnica de fluorescência) ANÁLISE DE METABÓLITOS • Mede-se as concentrações de acetato,glicose,etanol,lactato presente no meio em estado de equilíbrio. • A quantidade de polissacarídeo intracelular acumulada é determinada por iodeto de potássio.(Método de DiPersio) Glicólise O principal sistema de transporte ativo de açúcar em importantes bactérias orais acidogênicas,tais como streptococus: fosfoenolpiruvato(PEP) Sistema de Fosfotransferase do açúcar. VIA GLICOLÍTICA Muitas bactérias orais, dentre elas os streptococos,degradarão a glicose 6-P formada após o transporte através da via glicolítica de Embden-Meyerhof,com o intuito de gerar energia e precursores para a síntese do material celular GLICOSE 6-FOSFATO ( S. mutans cultivada em cultura de pH 5) Metabólitos intermediários como a diidroxiacetona-fosfato e o gliceraldeído 3-fosfato mantém os seus níveis estáveis. Muitos microorganismos também possuem a via pentose-fosfato com o objetivo de produzir precursores celulares(ribose 5-P), bem como o poder redutor para as reações biossintéticas(NADPH). NADP – dependente gliceraldeído 3fosfato desidrogenase (em pH 5) Gliceraldeído 3-fosfato desidrogenase e Fosfoglicerato quinase Importantes na determinação do sentido do fluxo de carbono Conversão final do 3-fosfoglicerato em piruvato ENZIMAS DA VIA GLICOLÍTICA • 1a, 1b Mannose-specific phosphotransferase system component IIAB • 11aPhosphoglyceromutase 11b Phosphoglycerate mutase-like protein • • 2a ATP synthase alpha chain 2b ATP synthase epsilon chain • 12a, 12b, 12c, 12d, 12e, 12f, 12g, 12h, 12i Enolase • 3 Glucose kinase • 13a, 13b, 13c, 13d Piruvate kinase • 4 Glucose-6-phosphate isomerase • 5a, 5b Phosphofructokinase • 6a, 6b,6c Fructose-1,6-bisphosphate aldolase • 7a, 7b, 7c Triosephosphate isomerase • 8a, 8b, 8c, 8d, 8e, 8f, 8g, 8h Glyceraldehyde-3-phosphate dehydrogenase • 9a, 9b NADP-dependent glyceraldehyde-3-phosphate dehydrogenase • 10a, 10b, 10c, 10d, 10e, 10f, 10g, 10h, Phosphoglycerate kinase pH 5,0 X pH 7,0 Início da glicólise em Streptococcus mutans Ação da Hexoquinase na transformação de Glicose em Glicose 6 – fosfato (que é essencial para a ativação da Piruvato quinase mais tarde). ‘ A piruvato quinase é a principal limitante na regulação da glicólise em Streptococcus mutans, uma vez que é ativada pela glicose – 6 fosfato mas inibida por fosfato inorgânico. ATIVAÇÃO E INIBIÇÃO DA PIRUVATO QUINASE A ativação da piruvato quinase se faz pela presença de glicose 6 – fosfato. Quanto maior a concentração de glicose 6 - fosfato (consequente maior concentração de fosfoenolpiruvato) maior será a atividade da piruvato quinase. A inibição da mesma se faz pela concentração de fosfato inorgânico formado pelas reações de ATP ou ADP. Em altas concentrações de fosfato inorgânico a piruvato quinase é inibida. Gráfico de comparação da ação da Piruvato quinase em função da concentração de Fosfoenolpiruvato AÇÃO DA ENOLASE A enolase catalisa a eliminação de água do 2-fosfoglicerato para que ocorra a formação de fosfoenolpiruvato(PEP) – composto dotado de potencial energético elevado – que permitirá a formação de ATP na reação seguinte. INIBIÇÃO DA ENOLASE Fluoreto – Inibidor competitivo da enolase Bloqueia a glicólise Não há produção de lactato Nível de glicose inicial permanece igual Descobertas científicas e Sucesso do estudo se devem à Mudança na forma como o experimento é realizado Utilização da técnica de cultura contínua Como resultado desses experimentos, concluímos que: Os Streptococcus mutans toleram pH baixos através de .... Aumento de sua capacidade de extrusão de H+ Redução do nível de produção de H+ Redução da forma de NAD (P) H Produção de NH3 para neutralização do citoplasma UFRJ – Universidade Federal do Rio de Janeiro Odontologia – 1º período Bioquímica – Prof. Fabio Schneider GRUPO: JULIANA NOITE KARINA ANDRADE LORRANE MELLO MARIANA PEREIRA MILENA IUNG RAYAN FORTUNATO STEPHANIE MOURA TATHYANE CALDAS URSULA PUETTER
Baixar