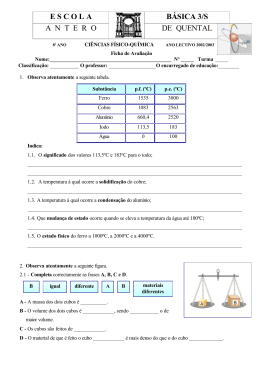
22-11-2009 MODELOS ATÓMICOS Inês Bruno e Marília Peres 2009 Fonte: http://ffden-2.phys.uaf.edu/212_fall2003.web.dir/erik_johnson/contents.html MODELOS DO ÁTOMO … John John Dalton (Inglês) Séc. Séc XVIII Esfera O O átomo de cada átomo de cada elemento é uma esfera indivisível 2 1 22-11-2009 MODELOS DO ÁTOMO … MODELO DE DALTON - 1803 Fonte: http://www.rsc.org/chemsoc/timeline/timeline.asp 3 MODELOS DO ÁTOMO … Descoberta do Electrão por J.J. TMOMSOM em 1897 Fonte: http://www.rsc.org/chemsoc/timeline/timeline.asp 2 22-11-2009 MODELOS DO ÁTOMO … Thomson 1897 Modelo do O átomo é uma esfera pudim de maciça carregada passas positivamente, onde os electrões se encontram encrostados. 5 MODELOS DO ÁTOMO … Rutherford 1911 Modelo planetário Rutherford observou grandes deflexões, sugerindo um núcleo duro e pequeno O átomo é constituído por um núcleo, de carga eléctrica positiva, onde está concentrada toda a massa do átomo, e por , p electrões que se moviam à volta do núcleo 6 3 22-11-2009 MODELOS DO ÁTOMO … Rutherford em1911 Fonte: http://www.rsc.org/chemsoc/timeline/timeline.asp MODELOS DO ÁTOMO … Bohr 1913 Modelo Os electrões só podem ocupar de Bohr níveis de energia bem definidos (quantização da energia) e giram em torno do núcleo em órbitas com d ú l ó bi energias diferentes; Modelo de Bohr para o átomo de Hidrogénio Estado o fundamen ntal Nível interno r Núcleo Electrão Menor energia n=1 n=2 n=3 n=4 n=5 n=6 Maior energia 8 4 22-11-2009 MODELOS DO ÁTOMO … Niels Bohr em1913 Fonte: http://www.rsc.org/chemsoc/timeline/timeline.asp MODELOS DO ÁTOMO … http://phet.colorado.edu/simulations/sims.php?sim=Models_of_the_Hydrogen_Atom 10 5 22-11-2009 - as órbitas interiores apresentam energia mais baixa e à medida que se encontram mais afastadas do núcleo o valor da sua energia é maior; - quando um electrão recebe energia suficiente passa a ocupar uma órbita mais externa (com maior energia) ficando o átomo num estado excitado; - se um electrão passar de uma órbita para uma outra mais interior liberta energia; - os electrões tendem a ter a menor energia possível estado fundamental do átomo. 11 Emissão e absorção de energia Nível Externo Nível interno Emissão de energia Electrão Absorção de energia Núcleo Eletrão Menor energia Maior energia 12 6 22-11-2009 Linhas de emissão no átomo de Hidrogénio n=∞ Contínuo n=6 n=5 n=4 n=3 n=2 Lγ Lβ Lδ Hγ Hδ Hβ Hα Pα Pβ Pγ Pδ Lα Bα B β Paschen Balmer Bγ Bδ Brackett n=1 Fα F Lyman β Pfund Núcleo Estado fundamental 1º estado 2º estado excitado excitado Fγ Fδ Nível limite externo 13 Bohr determinou matematicamente a relação existente entre a energia que o electrão poderia assumir e o nível em que se encontrava: En = −2,18 x10 −18 ( 1 ) 2 n 14 7 22-11-2009 Mas o modelo atómico de Bohr tem limitações… Falar em orbita implica conhecer SIMULTANEAMENTE e com EXACTIDÃO, EXACTIDÃO a POSIÇÃO e a ENERGIA DO ELECTRÃO num dado momento. No entanto Heisenberg demonstrou que é impossível determinar simultaneamente, com exactidão a posição e a energia de um electrão (Principio Principio da incerteza de Heisenberg) Heisenberg 15 MODELOS ACTUAL DO ÁTOMO Schrödinger e outros 1913 Modelo Os electrões movem‐se em Quântico torno dos respectivos núcleos sem trajectórias definidas. sem trajectórias definidas Apenas se conhece a PROBABILIDADE de um electrão com uma determinada energia se localizar num dado ponto do espaço. 16 8 22-11-2009 No Modelo Atómico de Bohr No Modelo Atómico Actual O electrão descreve órbitas O electrão ocupa uma orbital ÓRBITA:: Linha onde existe a ÓRBITA ORBITAL:: Região do espaço onde há ORBITAL certeza de encontrar o electrão probabilidade de encontrar um electrão com com uma dada energia uma dada energia. 17 Se fosse possível fotografar em instantes sucessivos o movimento do electrão em volta do núcleo, obteríamos uma imagens semelhante a esta. O electrão com uma dada energia, pode estar mais perto do núcleo ou mais afastado, ocupando mais vezes, determinadas posições no espaço à volta do núcleo do que outras. 18 9 22-11-2009 Uma orbital não se consegue visualizar, embora existam várias maneiras de a representar, uma delas é o Modelo da Nuvem Electrónica Menor probabilidade de se encontrar o electrão Maior probabilidade de se encontrar o electrão 19 Mais informação em TIMELINE - RSC Fonte: http://www.rsc.org/chemsoc/timeline/pages/timeline.html 10
Baixar