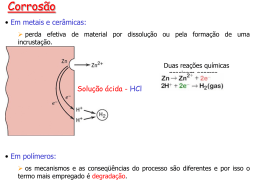
• A corrosão metálica é a transformação de um material metálico ou liga metálica pela sua interação química ou eletroquimica num determinado meio de exposição, processo que resulta na formação de produtos de corrosão e na liberação de energia. Quase sempre, a corrosão metálica (por mecanismo eletroquímico), está associada à exposição do metal num meio no qual existe a presença de moléculas de água, juntamente com o gás oxigenio ou íons de hidrogênio, num meio condutor. A adoção de uma ou mais formas de proteção contra a corrosão dos metais deve levar em conta aspectos técnicos e econômicos. Entre os aspectos técnicos, o meio de exposição é um parâmetro de grande importância. Quanto a este parâmetro, o uso de inibidores de corrosão ou o controle de agentes agressivos (SO², H+, Cl-) são impraticáveis nos casos em que se deseja proteger um determinado metal contra a corrosão atmosférica e o mesmo vale para a utilização da proteção catódica, restando nestes casos somente a modificação do metal ou a interposição de barreiras como uma alternativa para proteção contra a corrosão. • Em alguns casos, a modificação do metal é perfeitamente aplicável, citando como exemplo, a utilização do alumínio e suas ligas em componentes como esquadrias, portas e janelas ao invés do açocarbono. No entanto, para estruturas de grande porte, nas quais a resistência mecânica é um requisito importante, o alumínio e suas ligas nem sempre podem ser utilizados, sendo os aços inoxidáveis ou os aços aclimáveis, potenciais materiais alternativos. A utilização dos aços inoxidáveis nem sempre é economicamente viável, enquanto que a utilização dos aços aclimáveis esbarra na questão de condições de exposição, visto que estes só apresentam desempenho satisfatório em atmosferas moderadamente contaminadas com compostos de enxofre e em condições de molhamento e secagem, além da sua limitação de utilização em atmosferas com alta concentração de cloretos como, por exemplo, as marinhas severas. Outros tipos de ataque corrosivo onde há um uma maior heterogeneidade do ataque e consequente concentração em localizações específicas, resultando em perdas de volume localizada, são, por sua vez classificados dentro de uma denominação de corrosão localizada Tipos de corrosão • • • • • • • • • • • • • Corrosão uniforme Corrosão por pites Corrosão por concentração diferencial Corrosão por concentração iônica diferencial Corrosão por aeração diferencial Corrosão em frestas Corrosão filiforme Corrosão galvânica Corrosão sob tensão Corrosão seletiva Corrosão grafítica Corrosão por dezincificação Corrosão com cavitação Corrosão por pites • A chamada corrosão por pites (do inglês pit, orifício) é uma forma de corrosão localizada que consiste na formação de pequenas cavidades e profundidade considerável e o mais importante, significativa frente a espessura do material. Ocorre de maneira extremamente determinada, sendo portanto podendo ser chamada de puntiforme, não apresentando o material circundante ataque.Caracteríza-se por atacar materiais metálicos que apresentam formação de películas protetoras passiváveis e sendo resultado, geralmente, da atuação de "ilha" ativa-passiva nos locais de pequena área (disto pontos) onde há o rompimento de tal camada passiva.Sendo uma corrosão que não implica uma homogênea redução da espessura e ocorrendo no interior de equipamentos torna-se um tipo de corrosão de acompanhamento mais difícil. Corrosão por concentração diferencial • A variação de determinados componentes no meio no qual o material está permanentemente ou mesmo eventualmente imerso (em contato) provoca igualmente ação corrosiva, a qual é denominada corrosão por concentração diferencial. Seu mecanismo de ação é a formação de pilhas de concentração iônica diferencial e pilhas de aeração diferencial. Este tipo de corrosão pode ser dividido em corrosão por concentração iônica diferencial, associada com a variação de determinadas concentrações iônicas propriamente ditas do meio, a corrosão por aeração diferencial, variando a concentração de determinados gases da atmosfera gasosa em contato com o material, a corrosão em frestas, ocasionada por configuração geométrica do material corroível, que possibilita a formação de variações de concentração ou de aeração e pelo mesmo motivo, a corrosão filiforme, mas associada a configurações dos revestimentos aplicados, tais como a pintura Corrosão Seletiva • unidos de forma segura e sob condições de condensação ocasional ou umidade, com resultados não adversos principalmente quando a condutividade do eletrólito é baixa. A previsão desses efeitos é difícil porque a taxa de corrosão é determinada por um número de questões complexas. O uso de tabelas de potencial ignora a presença de filmes de oxido na superfície e os efeitos das proporções da área e diferentes soluções químicas (eletrólito). Entretanto, o uso inadequado destas tabelas pode produzir resultados incorretos. Elas devem ser utilizadas com cuidado e somente para avaliação inicial. Os aços inoxidáveis austeníticos normalmente formam o catodo num par bimetálico e então não sofrem corrosão. Uma exceção é o par com cobre que deveria ser normalmente evitado exceto em condições propícias. O contato entre aços inoxidáveis austeníticos e zinco ou alumínio pode resultar em alguma corrosão adicional dos dois últimos metais. Isso é pouco provável que seja significativo estruturalmente, mas o resultado em forma de pó branco/cinzento pode ser considerado de má aparência Corrosão sob tensão • O desenvolvimento da corrosão sob tensão exige a presença simultânea de tensões de tração e fatores ambientais específicos. Isso é incomum nas atmosferas internas de um edifício. As tensões não necessitam ser muito altas em relação ao limite de escoamento do material e pode ser devidas a carga e/ ou efeitos residuais dos processos de fabricação tais como soldagem ou dobramento. Devem ser tomados cuidados quando os componentes de aço inoxidável com tensões residuais elevadas (por ex. devido ao trabalho a frio) são usados em ambientes ricos em cloretos (por ex. piscinas cobertas, marinho, plataforma marítima Corrosão associada ao escoamento de fluidos • Quando no escoamento de líquidos os processos corrosivos podem sofrer aceleração pela associação da ação mecânica e seus efeitos com a formação de pilhas, a ruptura de passivações e proteções aplicadas e as consequentes formações de pilhas, oportunidades da ação química e sua consequente ação corrosiva.As corrosões ocasionadas por tais ações de fluidos sobre os materiais são classificadas principalmente em corrosão-erosão, a corrosão com cavitação e a corrosão por turbulência. Corrosão-erosão • Define-se erosão neste caso como o desgaste mecânico de uma substância sólida, no caso o material de componentes ou condutores de um sistema causado pela abrasão superficial de uma substância sólida, pura ou em suspensão num fluido, seja ele líquido ou gasoso.São casos comuns e frequentes deste tipo de ação: • no deslocamento de materiais sólidos, de qualquer granulometria, como rochas britadas, minérios ou produtos industriais diversos, como o cimento Corrosão com cavitação • Define-se cavitação como o processo de desgaste provocado em uma superfície, especialmente metálica, devido a ondas de choque no líquido, oriundas do colapso de bolhas gasosas nele temporariamente formadas por ebulição, normalmente a baixa pressão. Nas regiões de um sistema em movimento (como são os casos de pás de bombas centrífugas) ou em vibração (como são os casos das camisas de fluidos refrigerantes dos motores), onde ocorrem pelo menos momentos de baixas pressões, o suficiente para produzir bolhas de vapor ou mesmo de gases até então dissolvidos, e havendo a reversão para situações de pressão mais alta, causando o colapso de tais bolhas, que por redução praticamente instantânea de seu volume provocando ondas de choque e causando o impacto do fluido com as paredes, num efeito de "martelamento Corrosão por turbulência ou impingimento • A chamada corrosão por turbulência ou impingimento é um processo corrosivo associado aos fluxos turbulentos de um líquido, ocorrendo especialmente quando há a redução da área do fluxo, ou em outras palavras, quando seu caminho torna-se mais estreito ou apresentar mudança de direção, como em curvas ou como se usa dizer em tubulações, "cotovelos". De modo similar a cavitação, os fluxos turbulentos podem provocar regiões de baixa pressão e bolhas especialmente de gases dissolvidos (como por exemplo o ar) e vapor que podem colapsar, causando a ação de ondas de choque do fluido contra a parede metálica e o processo erosivo deste modo resultante é denominado de impingimento. O ataque é um tanto diferente da cavitação, propiciando alvéolos na forma de ferradura e pela ação dominante de bolhas de gases dissolvidos, enquanto na cavitação a fase gasosa dominante é o vapor do líquido Formas de Corrosão • A corrosão pode ser vista como nada mais que a tendência ao retorno para um composto estável. Assim, por exemplo, quando uma peça de aço enferruja, o ferro, principal componente, está retornando à forma de óxido, que é o composto original do minério. A corrosão pode manifestar-se de várias formas. Algumas são mais freqüentes que outras, e a ocorrência depende muito do ambiente e dos processos usados. Corrosão pelo ar • A maioria dos metais tende a se combinar com o oxigênio do ar, produzindo os respectivos óxidos. Não considerando a ação de vapores contidos no ar (de água, etc), esse processo se dá de forma lenta para o ferro em temperaturas usuais de ambientes. Entretanto, em alguns metais como o alumínio a corrosão é rápida mas acontece o fenômeno da apassivação: a camada de óxido formada na superfície isola o oxigênio e impede a continuação do processo. A presença de vapor d'água acelera a corrosão e ainda mais se tais vapores contém substâncias agressivas como sais ou ácidos. Ocorre em muitos ambientes industriais, locais próximos ao mar, etc. A prevenção e o combate dependem de cada caso. Métodos comuns são, por exemplo, uso de tintas protetoras, tratamentos superficiais como niquelagem, cromagem, fosfatização, etc. É evidente que em alguns casos pode ser viável o uso de materiais mais adequados. Exemplo: alumínio ou plástico no lugar do aço. • Corrosão, decorrente da exposição atmosférica, no gradil em monumento de ferro fundido situado na Praça Tiradentes Corrosão galvânica • É provavelmente o tipo mais comum, porque a corrosão em função da água quase sempre se deve ao processo galvânico. Alguns casos típicos são reservatórios, tubulações ou estruturas expostas ao tempo, submersas ou subterrâneas. Nessas condições, há a presença, constante ou não, de água, que favorece a formação de células galvânicas. • Dois eletrodos de materiais diferentes são imersos em um eletrólito e são eletricamente ligados entre si. Nessas condições, as reações eletroquímicas serão: No catodo: O2 + 4e− + 2H2O → 4OH− No anodo: 2Fe → 2Fe++ + 4e− Portanto, no anodo ocorre uma reação de oxidação (corrosão do material) e no catodo, uma reação de redução. Os íons OH− e Fe++ combinam-se para formar Fe(OH)2 (ferrugem). • A tabela acima dá os valores práticos de potenciais de vários metais, em solos e água, medidos em relação a um eletrodo de referência. Quanto mais negativo o potencial, mais anódico será a sua condição, ou seja, mais sujeito à corrosão. Corrosão por ação direta • Pode-se incluir neste item os casos em que o metal está diretamente em contato com substâncias que o atacam. É comum em processos industriais. Exemplos: soluções químicas, sais ou outros metais Portanto, no anodo ocorre uma reação de oxidação (corrosão do material) e no catodo, uma reação de redução. Proteção contra Corrosão • O aço em contato com o meio ambiente tende a se oxidar pela presença de O2 e H2O, começando pela superfície do metal até a sua total deterioração. Algumas soluções reduzem ou mesmo eliminam a velocidade da corrosão, entre elas podemos sugerir a utilização de aços resistentes à corrosão atmosférica, aplicação de zincagem e pintura. • Para tubulações subterrâneas, um método clássico e eficiente é a proteção catódica • Um ou mais eletrodos são introduzidos no solo e próximos da tubulação. A corrente elétrica de uma fonte externa é aplicada em ambos de forma a se opor à natureza anódica do tubo. Assim, ele passa operar como catodo, no qual não há oxidação. • Na engenharia hidráulica e na engenharia mecânica é grande a preocupação com a corrosão em bombas e em turbinas, sobretudo devido aos prejuízos que podem causar nas estações elevatórias e nas usinas hidrelétricas. Corrosão eletroquímica • A corrosão eletroquímica é um processo espontâneo, passível de ocorrer quando o metal está em contato com um eletrólito, onde acontecem,simultaneamente, reações anódicas e catódicas. Como exemplo, tem-se a formação da ferrugem Reação anódica (oxidação): Fe → Fe2+ + 2e– • Reação catódica (redução): 2H2O + 2e– → H2 + 2OH– Neste processo, os íons Fe2+ migram em direção à região catódica, enquanto os íons OH– direcionam-se para a anódica. Assim, em uma região intermediária, ocorre a formação do hidróxido ferroso: Fe2+ + 2OH– → Fe(OH)2 • Em meio com baixo teor de oxigênio, o hidróxido ferroso sofre a seguinte transformação 3Fe(OH)2 → Fe3O4 + 2H2O + H2 • Por sua vez, caso o teor de oxigênio seja elevado, tem-se: 2Fe(OH)2 + H2O + 1/2O2 →2Fe(OH)3 2Fe(OH)3 → Fe2O3.H2O + 2H2O • • • • • Assim, o produto final da corrosão, ou seja, a ferrugem, consiste nos compostos Fe3O4 (coloração preta) e Fe2O3.H2O (coloração alaranjada ou castanho-avermelhada). •Pilha galvânica,onde a área anódica (Fe) sofre o desgaste. Pilha de corrosão eletroquímica com dois eletrodos diferentes Corrosão química • A corrosão química decorre do ataque de um agente químico diretamente sobre o material, sem transferência de elétrons de uma área para outra. • Um exemplo desse processo é a corrosão de zinco metálico em presença de ácido sulfúrico: Zn + H2SO4 → ZnSO4 + H2 Corrosão eletrolítica • • • • • • • A corrosão eletrolítica se caracteriza por ser um processo eletroquímico, que se dá com a aplicação de corrente elétrica externa, ou seja, trata-se de uma corrosão não espontânea Componentes: • • • • • • • Andrea Ellen Ohana Jamile Lunna Milena Verenna Vivianne
Baixar